Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica
|
|
|
- Antonina Spina
- 6 anni fa
- Visualizzazioni
Transcript
1 Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica 2 H 2 (g) + 2 (g) 2 H 2 (g) 1 Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione
2 La cinetica chimica A differenza della termodinamica che si occupa della stabilità relativa tra reagenti e prodotti in una reazione chimica, la cinetica chimica si occupa dello studio della velocità con cui avviene una reazione chimica e della dipendenza di questa da vari fattori. ltre che della descrizione della dipendenza della velocità di reazione da fattori sperimentali, la cinetica si occupa anche di esaminare la sequenza dei processi chimici o fisici attraverso cui ha luogo la conversione tra reagenti e prodotti. In questa maniera lo studio della velocità di reazione mira ad ottenere informazioni dettagliate sull interazione tra le molecole nel corso della reazione. 2
3 La velocità di reazione Il concetto di velocità si incontra in molti contesti anche non chimici s t velocità spazio percorso tempo impiegato s t La velocità di una reazione si definisce in modo analogo: essa corrisponde alla variazione di concentrazione di una specie chimica nell unità di tempo velocità di reazione variazione di concentrazione intervallo di tempo 3
4 Si consideri la reazione di decomposizione del N 2 5 che ha luogo secondo la seguente reazione: 2 N 2 5 (g) 4 N 2 (g) + 2 (g) il progredire della reazione può essere seguito in diversi modi: attraverso l aumento della pressione parziale dell 2 o di N 2 o la diminuzione di N 2 5 La quantità di 2 che si è formata è legata alla quantità di N 2 5 inizialmente presente: per ogni mole di 2 formatasi, 2 moli di N 2 5 si sono decomposte La velocità della reazione può essere espressa, per un qualunque intervallo di tempo, come il rapporto tra la variazione di concentrazione di N 2 5 e l intervallo di tempo trascorso variazione di [N25] [N 25] velocità di reazione intervallo di tempo t Il segno è dovuto al fatto che la [N 2 5 ] diminuisce nel tempo. 4
5 Data la reazione: A k B la velocità di una reazione indica come cambia la concentrazione dei reagenti o dei prodotti nel tempo. velocità media v [A] t [A] t 2 2 [A] t 1 1 [B] t 2 2 [B] t 1 1 [B] t [B] [B] 2 [B] [B] 1 t t 1 t 2 t 5
6 [B] È possibile definire la velocità istantanea come la derivata rispetto al tempo della concentrazione di B (o A). Questa è la tangente alla curva nel punto considerato. k v [B] d[b] A B lim t 0 t dt [B] 2 [B] 1 t t 1 t 2 [B] unità di misura della velocità: concentrazione / tempo t 6
7 La velocità di reazione dipende da vari fattori: la natura dei reagenti la concentrazione dei reagenti la temperatura di reazione la presenza di catalizzatori la superificie dell interfaccia (se la reazione avviene tra reagenti in due fasi diverse) 7
8 Dipendenza della velocità di reazione dalla concentrazione Sperimentalmente si trova che la velocità di una reazione chimica dipende dalla concentrazione dei reagenti. L equazione che correla la velocità di una reazione alle concentrazioni dei reagenti è nota come equazione cinetica o legge della velocità ed ha la forma: a A + b B c C + d D v k [A] m [B] n cioè il prodotto delle concentrazioni dei reagenti elevate ad opportuni coefficienti (i.e. m, n, in genere diversi dai coefficienti stechiometrici) moltiplicati per una costante (k). Questi coefficienti sono in genere (ma non sempre) numeri interi e vanno determinati sperimentalmente. La costante k è chiamata costante di velocità specifica o costante cinetica e dipende solo dalla natura dei reagenti e dalla temperatura.
9 rdine di reazione Per una data reazione chimica di cui è nota l equazione cinetica, si definisce ordine di reazione rispetto ad un certo componente l esponente della concentrazione di quel componente nell equazione cinetica Si definisce invece ordine di reazione complessivo la somma degli esponenti di tutti i reagenti presenti nell equazione cinetica. Ad esempio la generica reazione: che ha equazione cinetica: v a A + b B c C + d D k [A] è di ordine m rispetto al reagente A e di ordine n rispetto al reagente B e di ordine m+n complessivo. Esempio, la reazione: 2 N (g) + 2 H 2 (g) N 2 (g) + 2 H 2 (g) con equazione cinetica v = k [N] 2 [H 2 ] m [B] n è del secondo ordine rispetto a N, primo ordine rispetto a H 2 e del terzo ordine complessivo. Se un reagente non compare nell equazione cinetica per una data reazione questa è di ordine zero rispetto a tale reagente. 9
10 Determinazione sperimentale dell ordine di reazione: metodo delle velocità iniziali La relazione tra velocità e concentrazione deve essere determinata sperimentalmente. Un modo per affrontare questo problema è quello basato sulla misura delle velocità iniziali (velocità misurata a t=0). Misurare le velocità iniziale è conveniente perché le concentrazioni iniziali dei reagenti è nota e in quanto evita possibili complicazioni derivanti da interferenze da parte dei prodotti di reazione o dal verificarsi di altre reazioni. CH 3 CCH 3 (aq) + H (aq) CH 3 C (aq) + CH 3 H (aq) acetato di metile ione ossidrile acetato metanolo v [CH CCH m n 3 3] [H ] La reazione è di ordine 1 rispetto all acetato di metile e di ordine 1 rispetto allo ione ossidrile. 10
11 CH 3 CCH 3 (aq) + H (aq) CH 3 C (aq) + CH 3 H (aq) [acetato di metile] 0 = M, T = 25 C 0.4 M 0.3 M 0.2 M 0.1 M pendenza = n = M [H ] 0 log v [CH CCH 0 [H ] m n ] log log v 0 m log[ch3cch3] 0 n log[h ] 0 11
12 La costante di velocità specifica k La costante di velocità specifica k è la costante di proporzionalità che mette in relazione velocità e concentrazione ad una data temperatura. È un parametro importante perché, una volta noto, permette di calcolare la velocità di reazione a qualunque valore di concentrazione. La unità di misura della costante di velocità specifica deve essere consistente con quelle degli altri termini contenuti nell equazione cinetica. k A B v = k [A] {k tempo 1 } k A + B C + D v = k [A] [B] {k concentrazione 1 tempo 1 } 12
13 Relazione tra concentrazione e tempo: leggi cinetiche integrate Talvolta è utile e importante sapere per quanto tempo una reazione deve aver luogo affinchè la concentrazione di un dato reagente raggiunga un dato valore oppure prevedere il valore della concentrazione di un reagente o di un prodotto dopo un certo tempo di reazione. A tal scopo si deriva una equazione che mette in relazione le concentrazioni ed il tempo: l equazione cinetica integrata. CH 3 CCH 3 (aq) + H (aq) CH 3 C (aq) + CH 3 H (aq) L equazione cinetica integrata descrive la tempo dipendenza di formazione dei prodotti o di scomparsa dei reagenti 13
14 Reazione del 1 ordine (monomolecolare) A k B v d[a] [A] d[a] dt k dt k[a] l equazione cinetica d[a] [A] k dt separazione delle variabili ln[ A] k t Q l equazione tempo integrata, dove Q = costante La costante d integrazione Q può essere calcolata imponendo la condizione che per t = 0, [A] = [A] 0 Q = ln[a] 0 : ln[ A] k t ln[a] 0 ln[ A] ln[a] 0 k t ln [A] [A] 0 k t [ A] [A] e k t 0 14
15 Reazione del 1 ordine (monomolecolare) A k B [A] [A] 0 e k t il decorso temporale è esponenziale k = 6.93 s 1 t ½ = 0.1 s [A] 0 = 1 mm dopo t ½ [A]= 0.5 mm il tempo di dimezzamento t ½ [A] 0 se [A] 2 2 t ½ [A]= 0.25 mm 3 t ½ [A]= mm 1 t 2 ln 2 k 15
16 Radioisotopi in biologia e medicina sono usati come traccianti o come fonti di energia distruttiva (radioterapia) devono avere semivita di giorni o mesi non devono accumularsi nell organismo si devono trasformare in isotopi stabili radionuclide emivita (t ½ ) tipo di radiazione 3 H 12 anni 14 C 5715 anni 24 Na 15 ore 32 P 14 giorni 35 S 87 giorni 40 K anni 45 Ca 163 giorni 125 I 59 giorni 131 I 8 giorni 16
17 Datazione al radiocarbonio Il carbonio possiede tre isotopi: due stabili ( 12 C e 13 C) e uno radioattivo ( 14 C). Quest'ultimo si trasforma per decadimento (elettroni) in azoto ( 14 N), con un tempo di dimezzamento medio (o emivita) di 5715 anni. 14 k 14 C N k ln 2 t anni 1 2 La produzione di nuovo 14 C avviene in natura negli strati alti della troposfera e nella stratosfera, per la cattura di neutroni termici da parte degli atomi di azoto. L'equilibrio dinamico che si instaura tra produzione e decadimento radioattivo mantiene quindi costante la concentrazione di 14 C nell'atmosfera (dove è presente principalmente legato all'ossigeno sotto forma di C 2 ). 17
18 Tutti gli organismi viventi che fanno parte del ciclo del C scambiano continuamente C con l'atmosfera attraverso processi di respirazione (animali) o fotosintesi (vegetali), oppure lo assimilano nutrendosi di altri esseri viventi o sostanze organiche. Di conseguenza finché un organismo è vivo, il rapporto tra la sua concentrazione di 14 C e quella degli altri due isotopi si mantiene costante e uguale a quella che si riscontra nell'atmosfera. Dopo la morte, però, questi processi terminano e l'organismo non scambia più C con l'esterno. Per effetto del decadimento, quindi, la concentrazione di 14 C diminuisce in modo regolare secondo la formula: k 14 6C 7N [ 14 C] [ 14 C] 0 e k t k ln t Quì, [ 14 C] 0 rappresenta la concentrazione di 14 C al momento della morte 18
19 L esame radiometrico del 14 C sulla Sindone nel 1988 la datò fra gli anni 1260 e 1390 (!?). Emivita del 14 C = 5715 anni La Sindone e [ 14 C] = [ 14 C] 0 e kt [ 14 C] [ 14 C] 0 e t MRTE 1 2 t ln 2 t MRTE 1 2 t ln 2 ln [ [ C] C] 0 19
20 Termodinamica e cinetica: le reazioni sono in genere reversibili A + B k 1 k 2 C velocità della reazione diretta (v D ) L equazione cinetica è: v k [A] [B] k 2 1 [C] velocità della reazione inversa (v I ) All equilibrio v D = v I e K EQ [C] [A] [B] k k 1 2
21 Le reazioni dal punto di vista microscopico Affinchè qualsiasi reazione chimica abbia luogo la teoria delle collisioni stabilisce che devono essere soddisfatte 3 condizioni: 1. le molecole reagenti devono collidere fra loro 2. le molecole reagenti devono collidere con energia sufficiente per rompere i legami coinvolti nella reazione 3. le molecole devono collidere secondo una orientazione che può consentire il riarrangiamento degli atomi e la formazione dei prodotti. 21
22 1. le molecole reagenti devono collidere fra loro 2. le molecole reagenti devono collidere con energia sufficiente per rompere i legami coinvolti nella reazione 3. le molecole devono collidere secondo una orientazione che può consentire il riarrangiamento degli atomi e la formazione dei prodotti. C (g) + N 2 (g) C 2 (g) + N (g) reagenti complesso collisionale prodotti avvicinamento dei reagenti riconoscimento separazione dei prodotti 22
23 1. le molecole reagenti devono collidere fra loro 2. le molecole reagenti devono collidere con energia sufficiente per rompere i legami coinvolti nella reazione 3. le molecole devono collidere secondo una orientazione che può consentire il riarrangiamento degli atomi e la formazione dei prodotti. distribuzione di Maxwell-Boltzmann 23
24 L energia cinetica minina richiesta per la reazione è detta energia di attivazione E a (l energia dello stato di transizione o complesso attivato) reazione esotermica A + B C + D reazione endotermica complesso attivato complesso attivato energia Energia avanzamento della reazione avanzamento della reazione avanzamento della reazione = coordianta di reazione 24
25 L'equazione di Arrhenius L'equazione di Arrhenius mette in relazione la temperatura con l'energia di attivazione E a (cioè la minima energia che le molecole debbono possedere perché la reazione proceda). k A e E a RT dove: ln k ln A E R a 1 T k rappresenta la costante di velocità specifica A il fattore di frequenza, che è correlato con la frequenza degli urti e con la probabilità che essi si verifichino con orientamento favorevole E a l'energia di attivazione R la costante universale dei gas T la temperatura assoluta 25
26 1. le molecole reagenti devono collidere fra loro 2. le molecole reagenti devono collidere con energia sufficiente per rompere i legami coinvolti nella reazione 3. le molecole devono collidere secondo una orientazione che può consentire il riarrangiamento degli atomi e la formazione dei prodotti. urto produttivo prima della collisione collisione dopo la collisione urto non produttivo 26
27 Gli Enzimi tripsina sito attivo 27
28 Proprietà generali degli enzimi (e differenze rispetto ai catalizzatori non biologici) Velocità di reazioni più elevate: le velocità delle reazioni catalizzate dagli enzimi sono normalmente da 10 6 a superiori rispetto a quelle delle corrispondenti trasformazioni chimiche non catalizzate e almeno di diversi ordini di grandezza superiori a quelle delle corrispondenti reazioni catalizzate per via chimica. Condizioni di reazione più blande: le reazioni catalizzate dagli enzimi avvengono in condizioni relativamente più moderate, a temperature inferiori a 100 C e pressione atmosferica e ph prossimo alla neutralità. Al contrario, la catalisi chimica richiede sovente temperature e pressioni elevate e valori di ph estremi. Maggiore specificità di reazione: gli enzimi esibiscono un grado specificità per substrati e prodotti straordinariamente superiore rispetto ai catalizzatori chimici. Possibilità di regolazione: le attività catalitiche di numerosi enzimi variano in risposta alle concentrazioni di sostanze diverse dai loro substrati. I meccanismi inerenti a tali processi regolatori comprendono il controllo allosterico, la modificazione covalente degli enzimi, nonché la variazione della concentrazione degli enzimi.
29 Velocità di reazioni più elevate: le velocità delle reazioni catalizzate dagli enzimi sono normalmente da 10 6 a superiori rispetto a quelle delle corrispondenti trasformazioni chimiche non catalizzate e almeno di diversi ordini di grandezza superiori a quelle delle corrispondenti reazioni catalizzate per via chimica. ln t 1 t 1 2 ln Tempo di dimezzamento: 7 s s reazione non enzimatica 0.7 s 1 t 2 reazione enzimatica ln 2 k
30 Condizioni di reazione più blande: le reazioni catalizzate dagli enzimi avvengono in condizioni relativamente più moderate, a temperature inferiori a 100 C e pressione atmosferica e ph prossimo alla neutralità. Al contrario, la catalisi chimica richiede sovente temperature e pressioni elevate e valori di ph estremi. N H 2 2 NH 3 In laboratorio: pressioni e temperature altissime Rhizobium trifolii: condizioni ambientali
31 N H e + 16 ATP 2 NH 3 + H ADP + 16 P i La nitrogenasi da Klebsiella pneumoniae Rhizobium trifolii
32 Maggiore specificità di reazione: gli enzimi esibiscono un grado specificità per substrati e prodotti straordinariamente superiore rispetto ai catalizzatori chimici. Un sito di legame per un substrato è costituito da una fessura posta sulla superficie dell enzima, la cui forma è complementare al substrato (complementarietà geometrica). I residui amminoacidici presenti nel sito attivo sono disposti in modo da attrarre il substrato mediante interazioni di van der Waals, elettrostatiche, idrofobiche e legami idrogeno (complementarietà elettronica). La complementarietà substrato/enzimi è il fondamento del modello chiave-serratura di Fischer Emil Fischer premio Nobel 1902
33 Sebbene i siti attivi della maggior parte degli enzimi siano in larga misura preformati, essi vanno incontro ad un certo grado di modificazione conformazionale indotto dal binding del substrato (adattamento indotto, induced fit)
34 La reazione esochinasica NH 2 ossidrile in 6 H H a-d-glucosio H H H - - Mg 2+ - N N N N - P P P + ATP H H esochinasi NH 2 H H P - H H P Mg 2+ - P N N N N ADP a-d-glucosio-6-fosfato H H
35 L adattamento indotto rende conto anche della regiospecificità della reazione esochinasica ossidrile in 6 del glucosio
36 Stereospecificità degli enzimi Gli enzimi sono altamente specifici sia nel legame di substrati chirali, sia nel catalizzare le loro reazioni. Esempi: la tripsina idrolizza proteine con L-amminoacidi ma non con D-amminoacidi gli enzimi coinvolti nel metabolismo del glucosio sono specifici solo per il D- glucosio.
37 La cinetica enzimatica Iniziò nel 1902 quando Adrian J. Brown studiò la reazione di idrolisi del saccarosio da parte di un enzima di lievito -fruttofuranosidasi (invertasi) purificato: H H H H H H H H H H H H H H H H + H 2 H H H saccarosio a-d-glucosio b-d-fruttosio Egli scoprì che quando la [saccarosio] >> [enzima], nell equazione cinetica la velocità di reazione era di ordine zero rispetto alla [saccarosio]. v k [saccarosio] Reazioni di ordine zero (i.e. indipendenti dalla concentrazione del reagente) sono dette anche cinetiche a saturazione. Brown propose che la reazione complessiva fosse composta da 2 reazioni elementari, in cui il substrato prima si lega all enzima ed in seguito è decomposto nei prodotti, rigenerando l enzima libero. 0 H H H H H H H H H H H H H H H k 1 k 2 E + S ES E + P k -1 37
38 Le due reazioni più comunemente trovate negli enzimi. k nella reazione A B l equazione cinetica è: v d[a] dt d[b] dt k [A] ed è del primo ordine rispetto ad A. Le dimensioni di k sono tempo 1 (es. s 1 ) k nella reazione A + B C l equazione cinetica è: v d[a] dt d[b] dt d[c] dt k [A] [B] il binding ed è del primo ordine rispetto ad A e B, complessivamente del secondo ordine. Le dimensioni di k sono M 1 tempo 1 (es. M 1 s 1 ) 38
39 L equazione di Michaelis-Menten (Henri) Leonor Michaelis ( ) Maud Menten ( ) Essa descrive la velocità di una reazione enzimatica in funzione della concentrazione del substrato. k 1 k 2 E + S ES E + P k 1 v 0 V K MAX M [S] [S] 39
40 k 1 k CAT E + S ES E + P k 1 Nel meccanismo E ed ES rappresentano l enzima libero ed il complesso enzima-substrato. gnuna delle reazioni elementari (qui 2) è descritta da una costante di velocità specifica: k 1 : costante di velocità per la formazione di ES (è una costante del secondo ordine con dimensioni M -1 s -1 ) k -1 : costante di velocità per la dissociazione di S da ES (è una costante del primo ordine con dimensioni s -1 ) k 2 : costante di velocità per la formazione di P da ES (è una costante del primo ordine con dimensioni s -1 ) Nota: per semplicità si assume che la reazione di formazione del prodotto P sia irreversibile. Ciò deve essere giustificato da esperimento ed in genere gli enzimi catalizzano reazioni reversibili.
41 v V K MAX M [S] [S] k K CAT M E0 [S] [S] v V K MAX M [S] v VMAX [S] = K M 41
42 Valori di K M, k CAT e k CAT /K M per alcuni enzimi e substrati v V K MAX M [S] [S] k K CAT M E0 [S] [S] H H 3 C NH C H 3 CH 3 HN CH 3 CH 3 NH CH 3 CH 3 N-acetilglicina etilestere N-acetilvalina etilestere N-acetiltirosina etilestere CH 3 42
43 Determinazione grafica dei parametri stazionari k CAT e K M grafico dei doppi reciproci o di Lineweaver- Burk grafico di Eadie-Hofstee 43
44 Grafico di Lineweaver-Burk 44
45 Concetto importante: gli enzimi abbassano l energia di attivazione della reazione reazione non catalizzata reazione catalizzata 45
46 L inibizione enzimatica proteasi a serina acetilcolinesterasi diisopropilfluorofosfato La maggior parte dei farmaci sono inibitori enzimatici Lo studio della cinetica enzimatica è utile per la progettazione di nuovi farmaci Gli studi cinetici permottono di stabilire l efficacia di un farmaco in vitro Le tossine naturali e molti agenti chimici bellici sono inibitori degli enzimi 46
47 L inibizione enzimatica Gli inibitori sono sostanze che legandosi all enzima ne riducono l attività, influenzandone il legame con il substrato (K M ) o il suo numero di turnover (k CAT ). Possono essere suddivisi in: inibitori irreversibili (o inattivatori): questi si legano così saldamente all enzima da bloccarne permanentemente l attività inibitori reversibili: riducono l attività legandosi reversibilmente all enzima. Sono suddivisi in: 1. inibitori competitivi 2. inibitori incompetitivi 3. inibitori non competitivi (inibizione mista) 47
48 Inibizione competitiva 48
49 Gli inibitori competitivi Si manifesta quando una sostanza strutturalmente simile al substrato si lega al sito attivo dell enzima. La sostanza compete con il substrato per occupare il sito attivo La triosofosfato isomerasi catalizza l isomerizzazione fra D-gliceraldeide-3-fosfato e diidrossiaceton fosfato. Il glicerolo-3-fosfato è un inibitore competitivo H H C substrato P - - H H H C H inibitore P - - pdb: 1m7p
50 Inibizione incompetitiva Per esempio il farmaco anti-hiv nevirapina può legarsi a ed inibire la DNA polimerasi virale soltanto dopo che questa si è legata al proprio substrato. Quando la polimerasi si lega al DNA cambia conformazione generando una tasca idrofobica (precedentemente non disponibile) a cui l'inibitore può legarsi 50
51 Inibizione mista (non competitiva) Alcuni inibitori si legano covalentemente a residui amminoacidici presenti sull'enzima. Il binding del Pb 2+ a residui di cisteina nell'enzima ferrochelatasi inibisce l'attività di inserzione del Fe 2+ nella protoporfirina IX. 51
Cinetica chimica. 2 H 2 (g) + O 2 (g) 2 H 2 O (g)
 Cinetica chimica 2 H 2 (g) + O 2 (g) 2 H 2 O (g) Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione La cinetica chimica A differenza della termodinamica
Cinetica chimica 2 H 2 (g) + O 2 (g) 2 H 2 O (g) Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione La cinetica chimica A differenza della termodinamica
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Cinetica Chimica. Cinetica chimica
 Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Esistono reazioni energeticamente favorite (ΔH<0) che non avvengono.es. C(diamante) à C(grafite)
 CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
La cinetica chimica. Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento)
 La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
CINETICA CHIMICA. Ogni reazione chimica però impiega un certo tempo per raggiungere le condizioni di equilibrio.
 Facendo reagire delle sostanze si arriva ad uno stato di equilibrio in cui le concentrazioni di reagenti e prodotto rispettano la legge di equilibrio chimico, definita da una costante di equilibrio. Ogni
Facendo reagire delle sostanze si arriva ad uno stato di equilibrio in cui le concentrazioni di reagenti e prodotto rispettano la legge di equilibrio chimico, definita da una costante di equilibrio. Ogni
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Cinetica chimica. Capitolo 13
 Cinetica chimica Capitolo 13 Cinetica chimica Termodinamica si verifica la reazione? Cinetica con che velocità si verifica la reazione? Velocità di reazione è la variazione di concentrazione di un reagente
Cinetica chimica Capitolo 13 Cinetica chimica Termodinamica si verifica la reazione? Cinetica con che velocità si verifica la reazione? Velocità di reazione è la variazione di concentrazione di un reagente
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
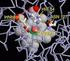 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
VELOCITA DI REAZIONE
 VELOCITA DI REAZIONE Analogamente alla velocità di un corpo (velocità = distanza percorsa / tempo impiegato) la velocità di reazione è definita come la variazione di concentrazione dei prodotti o dei reagenti
VELOCITA DI REAZIONE Analogamente alla velocità di un corpo (velocità = distanza percorsa / tempo impiegato) la velocità di reazione è definita come la variazione di concentrazione dei prodotti o dei reagenti
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA
 REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe. Substrato
 Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
In questo caso parliamo di un processo entalpico. Si tratta di un processo entalpico.
 LEZIONE DEL 10/04/2017 ENZIMOLOGIA - APPLICAZIONI DELLA CINETICA ENZIMATICA Essa trova applicazioni nel processamento dei rifiuti, nelle materie organiche. Si tratta dell'ingegnerizzazione dei processi
LEZIONE DEL 10/04/2017 ENZIMOLOGIA - APPLICAZIONI DELLA CINETICA ENZIMATICA Essa trova applicazioni nel processamento dei rifiuti, nelle materie organiche. Si tratta dell'ingegnerizzazione dei processi
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
Velocità di reazione Una trasformazione chimica modifica completamente la natura delle sostanze iniziali ( i reagenti), formando altre specie (i prodo
 Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Cinetica Chimica. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Cinetica Chimica Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Cinetica Chimica Termodinamica la reaction avrà luogo? Cinetica quanto sarà veloce la reazione?
Cinetica Chimica Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Cinetica Chimica Termodinamica la reaction avrà luogo? Cinetica quanto sarà veloce la reazione?
Velocità di reazione
 1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio
 Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Le reazioni chimiche
 Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A
 1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
Reazione di Briggs Rauscher
 Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. a.a
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia a.a. 2016-17 Cinetica Chimica studia i fenomeni connessi con la VELOCITA di una REAZIONE Reazioni
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia a.a. 2016-17 Cinetica Chimica studia i fenomeni connessi con la VELOCITA di una REAZIONE Reazioni
Catalisi. Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A Modulo di Biologia Strutturale
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Cine%ca enzima%ca. Copyright 2013 Zanichelli editore S.p.A.
 Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA
 TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
Termodinamica ENTALPIA...6
 Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Esistono reazioni energeticamente favorite ( H<0) che non avvengono.es. C(diamante) C(grafite)
 CINETICA CHIMICA Esistono reazioni energeticamente favorite ( H
CINETICA CHIMICA Esistono reazioni energeticamente favorite ( H
ESERCIZI ESERCIZI. 3) Data la reazione chimica: H 2
 ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
 Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Modellistica dei Sistemi Biologici. Lezione 1 Introduzione alla Cinetica Chimica Fabio Mavelli
 Modellistica dei Sistemi Biologici Lezione 1 Introduzione alla Cinetica Chimica Fabio Mavelli 14 marzo 2012 Cinetica Chimica Branca della Chimica-Fisica che studia l evoluzione temporale dei Sistemi Chimici
Modellistica dei Sistemi Biologici Lezione 1 Introduzione alla Cinetica Chimica Fabio Mavelli 14 marzo 2012 Cinetica Chimica Branca della Chimica-Fisica che studia l evoluzione temporale dei Sistemi Chimici
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Capitolo 18 L equilibrio chimico
 Capitolo 18 L equilibrio chimico 1. L equilibrio dinamico 2. L equilibrio chimico: anche i prodotti reagiscono 3. La costante di equilibrio 4. Il quoziente di reazione 5. La costante di equilibrio e la
Capitolo 18 L equilibrio chimico 1. L equilibrio dinamico 2. L equilibrio chimico: anche i prodotti reagiscono 3. La costante di equilibrio 4. Il quoziente di reazione 5. La costante di equilibrio e la
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
La cinetica chimica. Velocità media di reazione
 La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
1/v
 1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 21 L equilibrio chimico 3 Sommario 1. L equilibrio dinamico 2. L equilibrio chimico: anche i prodotti reagiscono 3. La costante
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 21 L equilibrio chimico 3 Sommario 1. L equilibrio dinamico 2. L equilibrio chimico: anche i prodotti reagiscono 3. La costante
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Legge dell azione di massa. Misura sperimentale della costante di equilibrio. Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
LA VELOCITA DELLE REAZIONI
 LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.V VERIFICA SE HAI CAPITO 10.B PRE-TEST ESERCIZI 10.
 VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.B PRE-TEST 10.C OBIETTIVI 10.3.2 CATALISI ETEROGENEA 10.3.3 CATALISI ENZIMATICA 10.V VERIFICA SE HAI CAPITO ESERCIZI 10.1 LA VELOCITA
VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.B PRE-TEST 10.C OBIETTIVI 10.3.2 CATALISI ETEROGENEA 10.3.3 CATALISI ENZIMATICA 10.V VERIFICA SE HAI CAPITO ESERCIZI 10.1 LA VELOCITA
Applicazioni biotecnologiche degli enzimi: le lipasi
 Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
CINETICA CHIMICA. ChimicaGenerale_lezione21 1
 CINETICA CHIMICA La cinetica chimica è lo studio della velocità delle reazioni chimiche, cioè della variazione delle concentrazione dei reagenti (o dei prodotti) in funzione del tempo. ChimicaGenerale_lezione21
CINETICA CHIMICA La cinetica chimica è lo studio della velocità delle reazioni chimiche, cioè della variazione delle concentrazione dei reagenti (o dei prodotti) in funzione del tempo. ChimicaGenerale_lezione21
Lo scopo della biochimica è la comprensione della vita in termini molecolari.
 Lo scopo della biochimica è la comprensione della vita in termini molecolari. Sebbene la biochimica venga spesso descritta come una scienza della vita e il suo sviluppo venga messo in relazione con la
Lo scopo della biochimica è la comprensione della vita in termini molecolari. Sebbene la biochimica venga spesso descritta come una scienza della vita e il suo sviluppo venga messo in relazione con la
2015 /2016. scaricato da
 Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Reazioni opposte. Reazioni opposte o reversibili A + B 2C (k 1 e k -1 )
 Reazioni complesse Reazioni opposte o reversibili A B ( e - ) Reazioni consecutive A B C ( e ) Reazioni competitive o parallele A B ( ) A C ( ) Reazioni opposte Reazioni opposte o reversibili A + B C (
Reazioni complesse Reazioni opposte o reversibili A B ( e - ) Reazioni consecutive A B C ( e ) Reazioni competitive o parallele A B ( ) A C ( ) Reazioni opposte Reazioni opposte o reversibili A + B C (
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA
 INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
Energia per la vita Bibliografia I colori della biologia Giusti- Gatti- Anelli Pearson Ed.
 Energia per la vita Bibliografia I colori della biologia Giusti- Gatti- Anelli Pearson Ed. Ogni alimento che ingeriamo viene scomposto attraverso i processi digestivi nelle sue molecole costituenti come
Energia per la vita Bibliografia I colori della biologia Giusti- Gatti- Anelli Pearson Ed. Ogni alimento che ingeriamo viene scomposto attraverso i processi digestivi nelle sue molecole costituenti come
Fondamenti di Chimica Farmaceutica. Recettori come bersagli dei farmaci
 Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
U.D. CHIMICA classe 2 a TECN. (CAT) CHIMICA TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO
 CHIMICA Classe 2 a TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D. Periodo Ore lezione 1. Nomenclatura molecole inorganiche (ripasso) settembre 6 2. Struttura atomica e tavola periodica
CHIMICA Classe 2 a TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D. Periodo Ore lezione 1. Nomenclatura molecole inorganiche (ripasso) settembre 6 2. Struttura atomica e tavola periodica
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
relazioni tra il calore e le altre forme di energia.
 Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Cinetica Chimica (cap. 15)
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 83424 - CCS CHI e MAT Cinetica Chimica (cap. 15) Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/general-chemistry-lessons/
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 83424 - CCS CHI e MAT Cinetica Chimica (cap. 15) Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/general-chemistry-lessons/
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
La termodinamica studia i flussi/trasformazioni di energia. Bioenergetica: termodinamica applicata ai sistemi biologici
 LA CAPACITÀ DI USARE ENERGIA È CARATTERISTICA DEI SISTEMI VIVENTI Bisogni degli esseri viventi: Energia (luce, molecole organiche) Catalizzatori biologici (enzimi) La termodinamica studia i flussi/trasformazioni
LA CAPACITÀ DI USARE ENERGIA È CARATTERISTICA DEI SISTEMI VIVENTI Bisogni degli esseri viventi: Energia (luce, molecole organiche) Catalizzatori biologici (enzimi) La termodinamica studia i flussi/trasformazioni
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe.
 INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
Introduzione alla cinetica chimica con esercizi
 Introduzione alla cinetica chimica con esercizi prerequisiti : conoscere la teoria particellare o cinetica della materia, sapere il significato di concentrazione, molarità, comprendere il concetto di equilibrio
Introduzione alla cinetica chimica con esercizi prerequisiti : conoscere la teoria particellare o cinetica della materia, sapere il significato di concentrazione, molarità, comprendere il concetto di equilibrio
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
La via per accelerare i processi biologici
 La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
Limiti del criterio della variazione entropia
 Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
Le proteine III. Corso di Biochimica 1. Prof. Giuseppina Pitari
 Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
PROGRAMMA DISCIPLINARE SVOLTO a. s / N.B. il programma è pubblico ad uso degli studenti e delle famiglie.
 Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Capitolo 16 L energia si trasferisce
 Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
Stampa Preventivo. A.S Pagina 1 di 11
 Stampa Preventivo A.S. 2009-2010 Pagina 1 di 11 Insegnante BADALINI RENZO Classe 2BT Materia elementi di chimica e fisica preventivo consuntivo 99 84 titolo modulo 1. STRUTTURA E TRASFORM. DELL 2. L'ATOMO
Stampa Preventivo A.S. 2009-2010 Pagina 1 di 11 Insegnante BADALINI RENZO Classe 2BT Materia elementi di chimica e fisica preventivo consuntivo 99 84 titolo modulo 1. STRUTTURA E TRASFORM. DELL 2. L'ATOMO
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
TECNICHE RADIOCHIMICHE
 TECNICHE RADIOCHIMICHE L ATOMO - Un atomo e costituito da un nucleo carico positivamente, circondato da una nuvola di elettroni carichi negativamente. - I nuclei atomici sono costituiti da due particelle:
TECNICHE RADIOCHIMICHE L ATOMO - Un atomo e costituito da un nucleo carico positivamente, circondato da una nuvola di elettroni carichi negativamente. - I nuclei atomici sono costituiti da due particelle:
EQUILIBRIO CHIMICO. Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2. C (g) + D (g)
 EQUILIBRIO CHIMICO Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2 C (g) + D (g) le velocità della reazione diretta e inversa sono esprimibili in funzione delle concentrazioni dei reagenti
EQUILIBRIO CHIMICO Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2 C (g) + D (g) le velocità della reazione diretta e inversa sono esprimibili in funzione delle concentrazioni dei reagenti
