Metodi basati sulla meccanica quantistica
|
|
|
- Matteo Magni
- 5 anni fa
- Visualizzazioni
Transcript
1 Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali teorie semplificate basate sulla meccanica quantistica e che differiscono per le approssimazioni usate: - teoria del legame di valenza (o VB) - teoria degli orbitali molecolari (o MO)
2 TEORIA DEL LEGAME DI VALENZA Permette di tradurre le formule di Lewis nello schema della meccanica quantistica. Nell'approccio di Lewis il legame covalente è dovuto alla condivisione di una coppia di elettroni da parte di due atomi. Anche nella teoria VB si considera la condivisione di una coppia di elettroni ma, facedo uso dei concetti della meccanica quantistica, si considera esplicitamente che questi elettroni sono descritti da funzioni d onda associate al legame. Secondo la teoria VB un legame tra due atomi si forma se sono verificate le seguenti condizioni: 1. Un orbitale di un atomo ed un orbitale dell altro atomo si sovrappongono cioè parte delle densità elettroniche dei due orbitali occupano la stessa regione dello spazio 2. Il numero complessivo di elettroni contenuti nei due orbitali sovrapposti non è maggiore di due La forza del legame dipende dal grado di sovrapposizione, maggiore è la sovrapposizione e più forte è il legame
3 La seconda condizione è una generalizzazione della più usuale condizione che i due orbitali che si sovrappongono contengano ciascuno un elettrone spaiato. Essa permette di includere il legame dativo, in cui un orbitale è occupato da due elettroni e uno da nessuno, ed il legame in H 2+, in cui un orbitale è occupato da un elettrone ed uno è vuoto. Essa è legata al principio di Pauli secondo cui in una data regione dello spazio possono coesistere al massimo due elettroni con spin opposto. Esempi: sovrapposizione + 1s H 1s H 1s H 2 1s
4 La teoria VB nasce dall esigenza di dare una interpretazione quantistica alla teoria del legame covalente di Lewis. L idea di base della teoria VB è quella di impiegare gli orbitali di valenza degli elementi per descrivere le coppie di elettroni che si trovano nelle formule di Lewis. Es. H 2 25% 50% 25% + 95% La probabilità di trovare la coppia di elettroni di legame (con spin opposto) è massima quando gli atomi si trovano alla distanza di legame. 15% 70% 15%
5 Energia potenziale La formazione del legame determina una diminuzione di energia potenziale (la molecola è più stabile degli atomi separati). 0 distanza
6 H 1s 1 Cl [Ne] 3s 2 3p 5 z
7 Nell'HCl la sovrapposizione avviene non in una direzione qualsiasi, ma lungo quella direzione che consente la massima sovrapposizione, cioè esattamente lungo l'asse dell'orbitale 3p z cioè l asse z sovrapposizione + z 1s 3p z HCl Si noti che nei due esempi considerati gli orbitali che si sovrappongono contengono entrambi un elettrone spaiato
8 Sulla base di questa osservazione sembrerebbe che un atomo possa formare un numero di legami pari al numero di elettroni spaiati che possiede. Nei due casi precedenti è questa la situazione: gli atomi H e Cl hanno un solo elettrone spaiato e formano un solo legame. Gli atomi O e N hanno due e tre elettroni spaiati e possono formare due e tre legami covalenti come in H 2 O e NH 3. 1s 2s 2p O due elettroni spaiati due legami 1s 2s 2p N tre elettroni spaiati tre legami
9 Passando a condiderare altri atomi ci si rende però subito conto che non sempre il numero di legami formati da un certo atomo corrisponde al numero di elettroni spaiati che esso possiede. Questo è dimostrato ad esempio dal carbonio che possiede due elettroni spaiati ma forma comunemente quattro legami covalenti, come nel metano CH 4 1s 2s 2p C Per spiegare questa, ed analoghe situazioni, dobbiamo tener conto che un atomo può utilizzare per formare legami configurazioni eccitate a bassa energia con un numero maggiore di elettroni spaiati.
10 Per esempio il carbonio può utilizzare la configurazione in cui un elettrone 2s viene eccitato e va ad occupare l'orbitale 2p vuoto E E 2p 2p 2s 2s 1s 1s Tale eccitazione richiede energia che però è più che compensata dall'energia che si guadagna in seguito alla formazione di due legami addizionali che il carbonio può ora formare (quattro invece di due)
11 L esempio del carbonio dimostra che quando due atomi si avvicinano per formare un legame covalente, è sempre possibile una spesa energetica iniziale per consentire la formazione di più legami. Energia C* + 4H C + 4H Spesa energetica iniziale CH 2 + 2H CH 4
12 In realtà la semplice eccitazione non riesce a spiegare completamente le proprietà dei quattro legami. Infatti nella configurazione eccitata del carbonio i quattro orbitali spaiati non sono equivalenti (un 2s e tre 2p) e i quattro legami deriverebbero dalla sovrapposizione degli orbitali 1s di tre idrogeni con i tre orbitali 2p x, 2p y e 2p z del carbonio e dell orbitale 1s del restante idrogeno con l orbitale 2s del carbonio: H y z H z y C x H H C Tre angoli HCH di 90 I restanti qualsiasi x
13 Queste previsioni sono però in contrasto con i dati sperimentali secondo cui i quattro legami C-H del CH 4 sono equivalenti. Il metano ha infatti una geometria tetraedrica con i quattro legami C-H tutti della stessa lunghezza e gli angoli HCH tutti uguali e pari a Nella teoria VB la si assume che i quattro orbitali di valenza del carbonio si combinino fra di loro per dare quattro nuovi orbitali equivalenti e isoenergetici detti orbitali ibridi. In generale un orbitale ibrido è una combinazione lineare di orbitali atomici di uno stesso atomo. Dal punto di vista della meccanica quantistica si ha: sp3 = c 1 2s + c 2 2px + c 3 2py + c 4 2pz Nel caso del carbonio in CH 4 si ottengono quattro orbitali ibridi, chiamati sp 3 perchè derivano dalla combinazione di un orbitale s e tre orbitali p.
14 I nuovi quattro orbitali ibridi sono isoenergetici e vanno riempiti in accordo con la regola di Hund: E + + sp s - Calcoli teorici mostrano che i quattro orbitali ibridi sono bilobati ma con un lobo molto maggiore dell'altro e sono diretti dal centro verso i quattro vertici del tetraedro.
15 Combinazione lineare Sullo stesso sistema cartesiano
16 Secondo la teoria VB i quattro legami C-H si formano in seguito alla sovrapposizione di ciascuno dei quattro orbitali ibridi sp 3 dell'atomo di carbonio con l'orbitale 1s di un atomo di idrogeno.
17 L'ibridazione degli orbitali del carbonio e la formazione dei legami C-H possono essere schematizzati come segue: Atomo C config. fondamentale Atomo C config. eccitata 1s 2s 2p 1s 2s 2p Atomo C ibridizzato 1s sp 3 La sovrapposizione con i 4 orbitali 1s dell idrogeno ognuno con un elettrone permette al carbonio di rispettare la regola dell ottetto dell idrogeno Atomo C in CH 4 1s sp 3 elettroni
18 Il numero di orbitali ibridi ottenuti è uguale al numero totale di orbitali atomici combinati e il simbolo per indicarli usa il numero dei vari orbitali combinati. Ad esempio i quattro orbitali ibridi sp 3 si chiamano così perchè derivano dalla combinazione di un orbitale s e tre orbitali p (in tutto si combinano 4 orbitali). L orbitale s può anche combinarsi con solo due o un orbitale p per dare orbitali ibridi di tipo: 1 orbitale s + 2 orbitali p 3 orbitali ibridi sp 2 1 orbitale s + 1 orbitale p 2 orbitali ibridi sp Lo schema di ibridazione dell elemento centrale andrà scelto di volta in volta in base alla geometria delle coppie elettroniche.
19 Orbitali ibridi sp 2 Consideriamo la molecola BF 3 in cui B ha tre coppie di elettroni disposte secondo l approccio VSEPR secondo una geometria trigonale planare. La configurazione elettronica del B non è adatta per formare una molecola di BF 3 con le caratteristiche attese. Atomo B config. fondamentale Atomo B config. eccitata 1s 2s 2p 1s 2s 2p Atomo B ibridizzato 1s sp 2 2p z Un orbitale 2s e due orbitali 2p = tre orbitali ibridi sp 2
20 sp2 = c 1 2s + c 2 2px + c 3 2py
21 I tre legami B-F si formano per sovrapposizione dei tre orbitali ibridi sp 2 del boro con ciascuno degli orbitali spaiati del fluoro F 1s 2s 2p Un orbitale 2p spaiato
22 Si noti che il boro conserva un orbitale 2p non ibridato, vuoto, perpendicolare al piano della molecola che ne determina importanti proprietà chimiche. Esso può formare ad esempio un legame dativo con una molecola che possiede una coppia solitaria.
23 Orbitali ibridi sp Consideriamo la molecola BeF 2 in cui Be ha due coppie di elettroni disposte secondo l approccio VSEPR secondo una geometria lineare. La configurazione elettronica del Be non è adatta per formare una molecola di BeF 2 con le caratteristiche attese. Atomo Be config. fondamentale 1s 2s 2p Atomo Be config. eccitata 1s 2s 2p Atomo Be ibridizzato 1s sp 2p Un orbitale 2s e un orbitale 2p = due orbitali ibridi sp
24 sp = c 1 2s + c 2 2px
25 I due legami Be-F si formano per sovrapposizione dei due orbitali ibridi sp del boro con ciascuno degli orbitali spaiati del fluoro F 1s 2s 2p Un orbitale 2p spaiato F Be F 2p Due ibridi sp su Be 2p
26 Si noti che il berillio conserva due orbitali 2p vuoti non ibridizzati
27 Va rimarcato che l'ibridizzazione è un modello, cioè non è un fenomeno fisico reale, ma una procedura matematica per ottenere funzioni d'onda, gli orbitali ibridi appunto, che spiegano la nuova conformazione e le proprietà della molecola (legami equivalenti in determinate direzioni dello spazio). Per questo si può affermare: Geometria molecolare Ibridazione Mentre non è corretto affermare: Ibridazione Geometria molecolare
28 Molecola di H 2 O Anche se l'ossigeno ha due elettroni spaiati è necessario ricorrere allo schema di ibridizzazione sp 3 per giustificare la sua geometria, piegata con angolo HOH=105 ^ In questo caso però non si ha bisogno di eccitazione Atomo O config. fondamentale Atomo O ibridizzato Formazione dei 2 legami O-H secondo la teoria VB per sovrapposizione dei due sp 3 spaiati con gli 1s dei due idrogeni Le due coppie solitarie occupano i due restanti orbitali sp 3 1s 2s 2p 1s sp 3 H h h h
29 Si noti che dei quattro orbitali sp 3 due sono doppiamente occupati e costituiscono le coppie solitarie mentre due sono spaiati e formano i due legami O-H per sovrapposizione con gli orbitali spaiati 1s dei due idrogeni. Se non si facesse uso degli ibridi sp 3 i legami i legami O-H sarebbero formati dalla sovrapposizione di due orbitali 2p con gli 1s degli H e l'angolo HOH dovrebbe essere di 90 (cioè quello tra due orbitali p) in disaccordo col valore sperimentale
30 Molecola di NH 3 Anche in questo caso l'azoto ha già tre elettroni spaiati ma è necessario ricorrere allo schema di ibridizzazione sp 3 per giustificare la sua geometria, piegata con angolo HNH=107 Atomo N config. fondamentale Atomo N ibridizzato 1s 2s 2p 1s sp 3 Formazione dei 3 legami N-H secondo la teoria VB per sovrapposizione dei tre sp 3 spaiati con gli 1s dei tre idrogeni La coppia solitaria occupa il restante orbitale sp 3
31 Uno dei quattro orbitali sp 3 è occupato dalla coppia solitaria mentre tre sono spaiati e formano i legami N-H per sovrapposizione con gli orbitali spaiati 1s dei due idrogeni. Anche qui se non si facesse uso degli ibridi sp 3 i legami i legami N-H sarebbero formati dalla sovrapposizione di due orbitali 2p con gli 1s degli H e l'angolo HNH dovrebbe essere di 90 in disaccordo con il valore sperimentale.
32 Teoria VB per 5 e 6 coppie di elettroni In questo caso è necessario ricorrere agli ibridi sp 3 d e sp 3 d 2 Molecola PF 5 Per formare 5 legami l atomo di fosforo deve passare ad una configurazione eccitata e poi dare ibridazione sp 3 d E E E 3d 3d 3d 3p 3p sp 3 d 3s Atomo P configuraz. fondamentale 3s Atomo P configuraz. eccitata Atomo P ibridizzato
33 Come visto per gli orbitali sp x questo processo è schematizzato su un unica linea come segue: Atomo P config. fondamentale 3s 3p 3d Atomo P config. eccitata 3s 3p 3d Atomo P ibridizzato sp 3 d 3d Essendo ottenuti dalla combinazione lineare di cinque orbitali, un s, tre p, e un d, gli orbitali ibridi sp 3 d sono cinque
34 Gli orbitali ibridi sp 3 d hanno la solita forma bilobata con uno dei due lobi molto piccolo e spesso non disegnato. Essi sono disposti attorno all atomo di fosforo nelle direzioni dei vertici di una bipiramide trigonale che è poi la geometria molecolare
35 I cinque legami P-F sono formati dalla sovrapposizione di ciascuno dei cinque orbitali sp 3 d con un orbitale spaiato 2p del fluoro
36 Molecola SF 6 Per formare 6 legami l atomo di zolfo deve passare ad una configurazione eccitata e poi dare ibridazione sp 3 d 2 E E E 3d 3d 3d 3p 3p sp 3 d 2 3s Atomo S configuraz. fondamentale 3s Atomo S configuraz. eccitata Atomo S ibridizzato
37 Questo processo è schematizzato su un unica linea come: Atomo S config. fondamentale 3s 3p 3d Atomo S config. eccitata 3s 3p 3d Atomo S ibridizzato sp 3 d 2 3d Essendo ottenuti dalla combinazione lineare di sei orbitali, un s, tre p, e due d, gli orbitali ibridi sp 3 d 2 sono sei
38 Gli orbitali ibridi sp 3 d 2 hanno la solita forma bilobata con uno dei due lobi molto piccolo e spesso non disegnato. Essi sono disposti attorno all atomo di zolfo nelle direzioni dei vertici di un ottaedro che è la geometria molecolare
39 I cinque legami S-F sono formati dalla sovrapposizione di ciascuno dei sei orbitali sp 3 d 2 con un orbitale spaiato 2p del fluoro
40 Orbitali ibridi e teoria VSEPR Esiste una corrispondenza diretta tra lo schema di ibridizzazione dell'atomo centrale e la teoria VSEPR. In particolare per ognuna delle geometrie previste dalla teoria VSEPR esiste uno schema di ibridizzazione tale che gli orbitali ibridi corrispondenti sono disposti nello spazio con la stessa geometria e, in seguito alla sovrapposizione con un orbitale spaiato degli atomi esterni, conducono esattamente alla stessa geometria molecolare. Orbitale ibrido n orbitali geometria VSEPR n coppie sp 2 lineare 2 sp 2 3 trigonale planare 3 sp 3 4 tetraedrica 4 sp 3 d 5 trigonale bipiramidale 5 sp 3 d 2 6 ottaedrica 6
41 Nel caso in cui ci siano coppie non leganti queste occupano alcuni degli orbitali ibridi e solo gli orbitali ibridi con l elettrone spaiato formano un legami per sovrapposizione con l orbitale spaiato dell atomo esterno. Ad esempio le seguenti molecole hanno tutte la stessa disposizione tetraedrica dei quattro ibridi sp 3 ma geometrie molecolari diverse D d CH 4 NH 3 H2 O sp 3 sp 3 sp 3 tetraedrica trigonale piramidale Piegata
42 Questa analogia suggerisce la seguente procedura per descrivere i legami di una molecola: 1. scrivere la formula di Lewis della molecola 2. dedurre da questa la geometria secondo cui sono disposte le coppie usando il modello VSEPR 3. dedurre il tipo di ibridizzazione dallo schema sopra 4. assegnare gli elettroni dell'atomo centrale agli orbitali ibridi secondo la regola di Hund 5. formare i legami facendo sovrapporre gli orbitali ibridi spaiati con gli orbitali spaiati degli atomi esterni Formula Lewis H-N-H H disposizione coppie tetraedrica 4 coppie VSEPR geometria trigonale piramidale 4 coppie ibridazione sp 3 Forma legami Hund
43 Legami multipli nella teoria VB Legami multipli (doppi e tripli) si possono formare quando si ha la sovrapposizione di più di due orbitali. Prima di vedere come si formano legami multipli consideriamo i modi in cui si possono sovrapporre i vari orbitali. Orbitali s - s Classificazione dei legami + 1s H 1s H 1s H 2 1s Simmetria cilindrica attorno all asse internucleare
44 Orbitali s - p H 1s 1 Cl [Ne] 3s 2 3p 5 + 1s 3p z HCl Simmetria cilindrica attorno all asse internucleare
45 Orbitali p - p Ci sono due modi in cui gli orbitali p si possono sovrapporre (es. F 2 ) F [He] 3s 2 3p 5 + 2p z 2p z F 2 Simmetria cilindrica attorno all asse internucleare
46 Quando si ha simmetria cilindrica attorno all asse internucleare il legame è di tipo. Gli orbitali si sovrappongono frontalmente I legami singoli sono tutti di tipo.
47 Orbitali ibridi L ibridazione viene introdotta nella teoria VB al fine di ottenere funzioni d onda orientate nella direzione di ogni legame. Di conseguenza le sovrapposizioni in cui sono coinvolti orbitali ibridi (di qualsiasi tipo) sono sempre frontali e i corrispondenti legami potranno essere solo di tipo σ. sp x - s sp x - p sp x - sp x
48 Orbitali p - p C è un altra maniera in cui gli orbitali p si possono sovrapporre Non c è simmetria cilindrica attorno all asse internucleare. Gli orbitali si sovrappongono lateralmente. C è un piano di densità elettronica nulla per l asse internucleare. Legame di tipo
49 Esempio. Molecola N 2 :N N: ogni atomo N ha configurazione elettronica 1s 2 2s 2 2p 3 x si formano un legame di tipo e due legami di tipo Legame triplo
50 I legami multipli sono costituiti sempre da un legame di tipo e da legami rimanenti di tipo π. Es. Legame doppio : 1σ + 1π Es. Legame triplo : 1σ + 2π
51 Formaldeide H :O: = C H Geometria planare
52 Etilene H H C=C H 120 H Geometria planare L angolo di 120 è compatibile con una ibridizzazione dei carboni di tipo sp 2
53 Atomo C config. fondamentale Atomo C config. eccitata 1s 2s 2p 1s 2s 2p Atomo C ibridizzato 1s sp 2 2p z Ogni carbonio ha tre orbitali sp 2 su un piano (es. xy) e un orbitale p perpendicolare (p z ) ognuno con con un elettrone spaiato z y x z z y x
54 I tre orbitali sp 2 si sovrappongono con un orbitale sp 2 dell altro carbonio e con gli orbitali 1s degli idrogeni per formare 5 legami Rimane un orbitale p z con un elettrone
55 Questi si sovrappongono per dare un legame con densità elettronica sopra e sotto il piano xy - la forma della molecola è determinata solo dagli orbitali che formano legami - la rotazione attorno al doppio legame è fortemente impedita (si romperebbe il legame ) - il legame ha una sovrapposizione più estesa del legame quindi è un legame leggermente più forte
56 Acetilene H C C - H Geometria lineare L angolo di 180 è compatibile con una ibridizzazione dei carboni di tipo sp
57 Atomo C config. fondamentale Atomo C config. eccitata 1s 2s 2p 1s 2s 2p Atomo C ibridizzato 1s sp 2p Ogni carbonio ha due orbitali sp su un asse (es. x) e due orbitale p perpendicolari (p y e p z ) ognuno con un elettrone spaiato z y x
58 I due orbitali sp si sovrappongono con un orbitale sp dell altro carbonio e con gli orbitali 1s degli idrogeni per formare 3 legami I due orbitali p con un elettrone spaiato si sovrappongono con quelli dell altro carbonio per dare due legami
VSEPR Polarità Ibridizzazione
 VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
La teoria del legame di valenza
 La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno
 Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Formule di Struttura delle Molecole Organiche
 Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
Serie completa di Modelli Molecolari per la Chimica Organica
 EdiSES Istruzioni per l utilizzo dei modelli molecolari Serie completa di Modelli Molecolari per la Chimica Organica allegati ai seguenti volumi: Chimica Organica - Paula Y. Bruice Elementi di Chimica
EdiSES Istruzioni per l utilizzo dei modelli molecolari Serie completa di Modelli Molecolari per la Chimica Organica allegati ai seguenti volumi: Chimica Organica - Paula Y. Bruice Elementi di Chimica
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Teoria del campo cristallino (CFT)
 Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
 LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
Dalla Chimica Generale
 RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
LA MOLE LA MOLE 2.A PRE-REQUISITI 2.3 FORMULE E COMPOSIZIONE 2.B PRE-TEST
 LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
Il Metodo Scientifico
 Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
I legami. 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1):
 Percorso 3 I legami E S E R C I Z I A Legame covalente omeopolare 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1): 2) Rappresenta la struttura della molecola di ossigeno
Percorso 3 I legami E S E R C I Z I A Legame covalente omeopolare 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1): 2) Rappresenta la struttura della molecola di ossigeno
Illustrazione 1: Telaio. Piantanida Simone 1 G Scopo dell'esperienza: Misura di grandezze vettoriali
 Piantanida Simone 1 G Scopo dell'esperienza: Misura di grandezze vettoriali Materiale utilizzato: Telaio (carrucole,supporto,filo), pesi, goniometro o foglio con goniometro stampato, righello Premessa
Piantanida Simone 1 G Scopo dell'esperienza: Misura di grandezze vettoriali Materiale utilizzato: Telaio (carrucole,supporto,filo), pesi, goniometro o foglio con goniometro stampato, righello Premessa
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
MEMBRANE. struttura: fosfolipidi e proteine
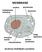 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
0.1 Esercizi calcolo combinatorio
 0.1 Esercizi calcolo combinatorio Esercizio 1. Sia T l insieme dei primi 100 numeri naturali. Calcolare: 1. Il numero di sottoinsiemi A di T che contengono esattamente 8 pari.. Il numero di coppie (A,
0.1 Esercizi calcolo combinatorio Esercizio 1. Sia T l insieme dei primi 100 numeri naturali. Calcolare: 1. Il numero di sottoinsiemi A di T che contengono esattamente 8 pari.. Il numero di coppie (A,
Struttura molecolare
 Struttura molecolare Molecole Gruppi discreti di atomi legati in modo stabile Caratterizzate da distanze, angoli e torsioni ben definite Esempio: Metano, CH 4 Distanze C-H 1.10 Å; Angoli H-C-H 109.5 Connettività:
Struttura molecolare Molecole Gruppi discreti di atomi legati in modo stabile Caratterizzate da distanze, angoli e torsioni ben definite Esempio: Metano, CH 4 Distanze C-H 1.10 Å; Angoli H-C-H 109.5 Connettività:
Organic Chemistry. 4 th Edition Paula Yurkanis Bruice. Delocalizzazione degli elettroni e risonanza
 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
COMPOSTI DI COORDINAZIONE (complessi)
 Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
Recenti Scoperte Scientifiche in Ottica
 Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
Energia elettrica. L atomo nel suo complesso è neutro perché ha l equilibrio tra protoni ed elettroni presenti nello stesso numero.
 Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
ESPERIENZE CON GLI SPECCHI PIANI
 1. Qual è la posizione dell immagine fornita da uno specchio piano? Di che tipo di immagine si tratta? Disponi il cilindro giallo dietro lo specchio, in modo che coincida con l immagine riflessa del cilindro
1. Qual è la posizione dell immagine fornita da uno specchio piano? Di che tipo di immagine si tratta? Disponi il cilindro giallo dietro lo specchio, in modo che coincida con l immagine riflessa del cilindro
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi.
 1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) 1 Atomi e Legami Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi. Il termine atomo significa indivisibile e
1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) 1 Atomi e Legami Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi. Il termine atomo significa indivisibile e
NUMERI DI OSSIDAZIONE
 NUMERI DI OSSIDAZIONE Numeri in caratteri romani dotati di segno Tengono conto di uno squilibrio di cariche nelle specie poliatomiche Si ottengono, formalmente, attribuendo tutti gli elettroni di valenza
NUMERI DI OSSIDAZIONE Numeri in caratteri romani dotati di segno Tengono conto di uno squilibrio di cariche nelle specie poliatomiche Si ottengono, formalmente, attribuendo tutti gli elettroni di valenza
ELASTOMERI ELASTOMERI
 ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
SOLUZIONE ESERCIZIO 1.1
 SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
I MINERALI DELLA CROSTA TERRESTRE
 I MINERALI DELLA CROSTA TERRESTRE Sono solidi cristallini, di origine inorganica, caratterizzati da una precisa formula chimica. Una sostanza è un minerale se: si presenta come solido cristallino, cioè
I MINERALI DELLA CROSTA TERRESTRE Sono solidi cristallini, di origine inorganica, caratterizzati da una precisa formula chimica. Una sostanza è un minerale se: si presenta come solido cristallino, cioè
Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Programmazione di Scienze A.S. 2013-2014
 Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Le trasformazioni fisiche della materia Gli stati fisici della materia I sistemi omogenei ed eterogenei Le sostanze pure ed i miscugli
Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Le trasformazioni fisiche della materia Gli stati fisici della materia I sistemi omogenei ed eterogenei Le sostanze pure ed i miscugli
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
Indice generale. Prefazione
 26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
Molecole singole come elementi attivi nei circuiti elettronici
 Molecole singole come elementi attivi nei circuiti elettronici La corrente che attraversa una singola molecola deve essere necessariamente misurabile. Il fatto che una corrente di 1 na potesse attraversare
Molecole singole come elementi attivi nei circuiti elettronici La corrente che attraversa una singola molecola deve essere necessariamente misurabile. Il fatto che una corrente di 1 na potesse attraversare
Modulo 1. Il legame chimico
 Modulo 1 Il legame chimico Caratteristiche di un legame Il legame covalente Il legame ionico Il legame metallico Strutture di Lewis Strutture di Lewis nei composti a carattere ionico La risonanza La geometria
Modulo 1 Il legame chimico Caratteristiche di un legame Il legame covalente Il legame ionico Il legame metallico Strutture di Lewis Strutture di Lewis nei composti a carattere ionico La risonanza La geometria
RIDUZIONE DELLE DISTANZE
 RIDUZIONE DELLE DISTANZE Il problema della riduzione delle distanze ad una determinata superficie di riferimento va analizzato nei suoi diversi aspetti in quanto, in relazione allo scopo della misura,
RIDUZIONE DELLE DISTANZE Il problema della riduzione delle distanze ad una determinata superficie di riferimento va analizzato nei suoi diversi aspetti in quanto, in relazione allo scopo della misura,
Gruppo 10 Nickel Ni (1751)
 Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI
 Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail danidvd@hotmail.it daniela.devita@uniroma1.it
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail danidvd@hotmail.it daniela.devita@uniroma1.it
Riconoscere e formalizzare le dipendenze funzionali
 Riconoscere e formalizzare le dipendenze funzionali Giorgio Ghelli 25 ottobre 2007 1 Riconoscere e formalizzare le dipendenze funzionali Non sempre è facile indiduare le dipendenze funzionali espresse
Riconoscere e formalizzare le dipendenze funzionali Giorgio Ghelli 25 ottobre 2007 1 Riconoscere e formalizzare le dipendenze funzionali Non sempre è facile indiduare le dipendenze funzionali espresse
LEGAME CHIMICO. H + H H 2 cioè H-H
 LEGAME CIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
INTERAZIONI DELLE RADIAZIONI CON LA MATERIA
 M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
isomeria di struttura isomeria di posizione isomeria di catena stereoisomeria isomeria di conformazione isomeria di configurazione 'isomeria ottica
 ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
Prova in itinere di Chimica Generale 1 Giugno 2011
 Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Gli Alcheni : struttura e nomenclatura
 Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
CAPITOLO V. DATABASE: Il modello relazionale
 CAPITOLO V DATABASE: Il modello relazionale Il modello relazionale offre una rappresentazione matematica dei dati basata sul concetto di relazione normalizzata. I principi del modello relazionale furono
CAPITOLO V DATABASE: Il modello relazionale Il modello relazionale offre una rappresentazione matematica dei dati basata sul concetto di relazione normalizzata. I principi del modello relazionale furono
Struttura elettronica delle molecole. Teoria quantistica del legame chimico
 Strttra elettronica delle molecole. Teoria qantistica del legame chimico Lo ione idrogeno molecolare H 2 + Eq. Schroedinger singolo elettrone La fnzione d onda φ b soddisfa na eqazione analoga. Gli atovalori
Strttra elettronica delle molecole. Teoria qantistica del legame chimico Lo ione idrogeno molecolare H 2 + Eq. Schroedinger singolo elettrone La fnzione d onda φ b soddisfa na eqazione analoga. Gli atovalori
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Chimica organica. Biomolecole. Tessuti biologici. Polimeri proprietà funzioni
 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni 1 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni C O N 1 Chimica organica Biomolecole Tessuti biologici
Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni 1 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni C O N 1 Chimica organica Biomolecole Tessuti biologici
Alimentazione ed efficienza dei sistemi alimentari
 Corso di laurea magistrale in Scienze e tecnologie animali Alimentazione ed efficienza dei sistemi alimentari Effetti delle tipologie dei consumi alimentari sui flussi della materia e dell energia, sulle
Corso di laurea magistrale in Scienze e tecnologie animali Alimentazione ed efficienza dei sistemi alimentari Effetti delle tipologie dei consumi alimentari sui flussi della materia e dell energia, sulle
TEORIA QUANTISTICA E STRUTTURA ATOMICA
 TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO: CHIMICA, MATERIALI E BIOTECNOLOGIE
 RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Degrado dei materiali non-metallici 1 materiali polimerici. Contenuto
 Contenuto o legame chimico C C - legame covalente, energia di legame - struttura tetragonale dei quattro legami del carbonio reazioni di polimerizzazione - poliaddizione, esempi - policondensazione, esempi
Contenuto o legame chimico C C - legame covalente, energia di legame - struttura tetragonale dei quattro legami del carbonio reazioni di polimerizzazione - poliaddizione, esempi - policondensazione, esempi
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA. L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
 COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Esistono alcune sostanze che manifestano la capacità di attirare la limatura di ferro, in particolare, la magnetite
 59 Esistono alcune sostanze che manifestano la capacità di attirare la limatura di ferro, in particolare, la magnetite Questa proprietà non è uniforme su tutto il materiale, ma si localizza prevelentemente
59 Esistono alcune sostanze che manifestano la capacità di attirare la limatura di ferro, in particolare, la magnetite Questa proprietà non è uniforme su tutto il materiale, ma si localizza prevelentemente
Giochi della Chimica 1996 Fase regionale Classi A e B
 Giochi della Chimica 1996 Fase regionale Classi A e B 1. Indicare le percentuali in massa degli elementi K, S e O presenti in K 2 SO 4 : A) 44,9% K; 18,4% S; 36,7% O B) 22,3% K; 52,6 % S; 25,1% O C) 56,1%
Giochi della Chimica 1996 Fase regionale Classi A e B 1. Indicare le percentuali in massa degli elementi K, S e O presenti in K 2 SO 4 : A) 44,9% K; 18,4% S; 36,7% O B) 22,3% K; 52,6 % S; 25,1% O C) 56,1%
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012)
 CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
Richiami sulle derivate parziali e definizione di gradiente di una funzione, sulle derivate direzionali. Regola della catena per funzioni composte.
 PROGRAMMA di Fondamenti di Analisi Matematica 2 (che sarà svolto fino al 7 gennaio 2013) A.A. 2012-2013, Paola Mannucci e Claudio Marchi, Canali 1 e 2 Ingegneria Gestionale, Meccanica-Meccatronica, Vicenza
PROGRAMMA di Fondamenti di Analisi Matematica 2 (che sarà svolto fino al 7 gennaio 2013) A.A. 2012-2013, Paola Mannucci e Claudio Marchi, Canali 1 e 2 Ingegneria Gestionale, Meccanica-Meccatronica, Vicenza
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
Programmazione individuale per competenze CLASSE 3^B LSA. Materia: CHIMICA
 Programmazione individuale per competenze CLASSE 3^B LSA Materia: CHIMICA Situazione della classe Accordi con la classe Accordi con le altre discipline Correlazione con i progetti proposti alla classe
Programmazione individuale per competenze CLASSE 3^B LSA Materia: CHIMICA Situazione della classe Accordi con la classe Accordi con le altre discipline Correlazione con i progetti proposti alla classe
Programma (piano di lavoro) preventivo
 I S T I T U T O T E C N I C O I N D U S T R I A L E S T A T A L E G u g l i e l m o M a r c o n i V e r o n a Programma (piano di lavoro) preventivo Anno Scolastico 2014/2015 Materia SCIENZE INTEGRATE:
I S T I T U T O T E C N I C O I N D U S T R I A L E S T A T A L E G u g l i e l m o M a r c o n i V e r o n a Programma (piano di lavoro) preventivo Anno Scolastico 2014/2015 Materia SCIENZE INTEGRATE:
Insegnare relatività. nel XXI secolo
 Insegnare relatività nel XXI secolo E s p a n s i o n e d e l l ' U n i v e r s o e l e g g e d i H u b b l e La legge di Hubble Studiando distanze e moto delle galassie si trova che quelle più vicine
Insegnare relatività nel XXI secolo E s p a n s i o n e d e l l ' U n i v e r s o e l e g g e d i H u b b l e La legge di Hubble Studiando distanze e moto delle galassie si trova che quelle più vicine
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
INDICAZIONI ED ESERCIZI PER LA PREPARAZIONE ALLA PROVA DI VERIFICA DI SETTEMBRE SCIENZE INTEGRATE (CHIMICA)
 ISTITUTO DI ISTRUZIONE SUPERIORE CHINO CHINI Via Pietro Caiani 68-50032 Borgo San Lorenzo (Fi) Tel. 055.8459.268 - Fax 055.8495.131 Sito Web: www.chinochini.it - E-mail: chinochini@tin.it - PEC FIIS02300N@PEC.ISTRUZIONE.IT
ISTITUTO DI ISTRUZIONE SUPERIORE CHINO CHINI Via Pietro Caiani 68-50032 Borgo San Lorenzo (Fi) Tel. 055.8459.268 - Fax 055.8495.131 Sito Web: www.chinochini.it - E-mail: chinochini@tin.it - PEC FIIS02300N@PEC.ISTRUZIONE.IT
CHIMICA ORGANICA. L isomeria
 1 B-ISOMERIA IMIA ORGANIA L isomeria Gli isomeri sono composti diversi (ciascuno con proprietà fisiche e chimiche proprie) che hanno tuttavia la stessa composizione chimica e quindi la stessa formula chimica
1 B-ISOMERIA IMIA ORGANIA L isomeria Gli isomeri sono composti diversi (ciascuno con proprietà fisiche e chimiche proprie) che hanno tuttavia la stessa composizione chimica e quindi la stessa formula chimica
I semiconduttori Semiconduttori intrinseci
 I semiconduttori Semiconduttori intrinseci I semiconduttori naturali usati per la produzione di dispositivi elettronici sono stati per molti anni il silicio e il germanio. Il germanio è andato, con il
I semiconduttori Semiconduttori intrinseci I semiconduttori naturali usati per la produzione di dispositivi elettronici sono stati per molti anni il silicio e il germanio. Il germanio è andato, con il
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
MICROSCOPIA A FORZA ATOMICA (AFM)
 MICROSCOPIA A FORZA ATOMICA (AFM) Binnig and Rohrer (1982, STM, Nobel prize in 1986) Binnig, Quate and Gerber (1986, AFM) Anno 2001-2002 1 Principio di funzionamento di un AFM A B C D Rivelatore Specchio
MICROSCOPIA A FORZA ATOMICA (AFM) Binnig and Rohrer (1982, STM, Nobel prize in 1986) Binnig, Quate and Gerber (1986, AFM) Anno 2001-2002 1 Principio di funzionamento di un AFM A B C D Rivelatore Specchio
Agostinetti Piero (425902/IM)
 UNIVERSITA DEGLI STUDI DI PADOVA FACOLTA DI INGEGNERIA Corso di Laurea in Ingegneria Meccanica LABORATORIO DI ANALISI STRUTTURALE CON ANSYS 5.6: VERIFICHE STRUTTURALI PER IL BILANCERE DELLA PIATTAFORMA
UNIVERSITA DEGLI STUDI DI PADOVA FACOLTA DI INGEGNERIA Corso di Laurea in Ingegneria Meccanica LABORATORIO DI ANALISI STRUTTURALE CON ANSYS 5.6: VERIFICHE STRUTTURALI PER IL BILANCERE DELLA PIATTAFORMA
Il comportamento del consumatore
 Il comportamento del consumatore Le preferenze del consumatore I vincoli di bilancio La scelta del consumatore Utilità marginale e scelta del consumatore 1 L obiettivo è quello di descrivere come i consumatori
Il comportamento del consumatore Le preferenze del consumatore I vincoli di bilancio La scelta del consumatore Utilità marginale e scelta del consumatore 1 L obiettivo è quello di descrivere come i consumatori
IDROCARBURI AROMATICI. Scaricato da Sunhope.it
 IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
Prova di ammissione al corso di laurea in Medicina e Chirurgia 2013
 Francesco Ranaldi Chimica organica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni
Francesco Ranaldi Chimica organica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni
REGOLE DELLA RISONANZA
 REGLE DELLA RISAZA 1 Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di con cinque valenze 2 La posizione dei nuclei DEVE essere
REGLE DELLA RISAZA 1 Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di con cinque valenze 2 La posizione dei nuclei DEVE essere
GEOMETRIA DELLE MASSE
 1 DISPENSA N 2 GEOMETRIA DELLE MASSE Si prende in considerazione un sistema piano, ossia giacente nel pian x-y. Un insieme di masse posizionato nel piano X-Y, rappresentato da punti individuati dalle loro
1 DISPENSA N 2 GEOMETRIA DELLE MASSE Si prende in considerazione un sistema piano, ossia giacente nel pian x-y. Un insieme di masse posizionato nel piano X-Y, rappresentato da punti individuati dalle loro
I differenti materiali differiscono per le caratteristiche meccaniche e fisiche.
 MATERIALI COMPOSITI I differenti materiali differiscono per le caratteristiche meccaniche e fisiche. I METALLI hanno forma cristallina e forti legami molecolari (legame metallico), che danno loro resistenza
MATERIALI COMPOSITI I differenti materiali differiscono per le caratteristiche meccaniche e fisiche. I METALLI hanno forma cristallina e forti legami molecolari (legame metallico), che danno loro resistenza
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
Abilità Informatiche. Lezione II. Creazione di modelli 3D. arch. Gabriella Rendina
 Abilità Informatiche Lezione II Creazione di modelli 3D arch. Gabriella Rendina Modellazione 3D La modellazione 3D consente di creare progetti utilizzando modelli di solidi, superfici e mesh. Un modello
Abilità Informatiche Lezione II Creazione di modelli 3D arch. Gabriella Rendina Modellazione 3D La modellazione 3D consente di creare progetti utilizzando modelli di solidi, superfici e mesh. Un modello
Classificazione della materia: Sostanze pure e miscugli
 Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
l = 0, 1, 2, 3,,, n-1n m = 0, ±1,
 NUMERI QUANTICI Le autofuzioi soo caratterizzate da tre parametri chiamati NUMERI QUANTICI e soo completamete defiite dai loro valori: : umero quatico pricipale l : umero quatico secodario m : umero quatico
NUMERI QUANTICI Le autofuzioi soo caratterizzate da tre parametri chiamati NUMERI QUANTICI e soo completamete defiite dai loro valori: : umero quatico pricipale l : umero quatico secodario m : umero quatico
Le trasformazioni geometriche
 Le trasformazioni geometriche Le trasformazioni geometriche Le trasformazioni affini del piano o affinità Le similitudini Le isometrie Le traslazioni Le rotazioni Le simmetrie assiale e centrale Le omotetie
Le trasformazioni geometriche Le trasformazioni geometriche Le trasformazioni affini del piano o affinità Le similitudini Le isometrie Le traslazioni Le rotazioni Le simmetrie assiale e centrale Le omotetie
APPUNTI DI MATEMATICA ALGEBRA \ INSIEMISTICA \ TEORIA DEGLI INSIEMI (1)
 ALGEBRA \ INSIEMISTICA \ TEORIA DEGLI INSIEMI (1) Un insieme è una collezione di oggetti. Il concetto di insieme è un concetto primitivo. Deve esistere un criterio chiaro, preciso, non ambiguo, inequivocabile,
ALGEBRA \ INSIEMISTICA \ TEORIA DEGLI INSIEMI (1) Un insieme è una collezione di oggetti. Il concetto di insieme è un concetto primitivo. Deve esistere un criterio chiaro, preciso, non ambiguo, inequivocabile,
Andrea Pagano, Laura Tedeschini Lalli
 3.5 Il toro 3.5.1 Modelli di toro Modelli di carta Esempio 3.5.1 Toro 1 Il modello di toro finito che ciascuno può costruire è ottenuto incollando a due a due i lati opposti di un foglio rettangolare.
3.5 Il toro 3.5.1 Modelli di toro Modelli di carta Esempio 3.5.1 Toro 1 Il modello di toro finito che ciascuno può costruire è ottenuto incollando a due a due i lati opposti di un foglio rettangolare.
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013
 LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016. CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO
 ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE Elaborata conformemente alle linee
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE Elaborata conformemente alle linee
La fisica e la misura
 La fisica e la misura La fisica è una scienza fondamentale che ha per oggetto la comprensione dei fenomeni naturali che accadono nel nostro universo. È basata su osservazioni sperimentali e misure quantitative
La fisica e la misura La fisica è una scienza fondamentale che ha per oggetto la comprensione dei fenomeni naturali che accadono nel nostro universo. È basata su osservazioni sperimentali e misure quantitative
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
