La struttura quaternaria della deossiemoglobina prende il nome di : forma T (tesa) mentre quella della ossiemoglobina viene chiamata forma R
|
|
|
- Martina Tarantino
- 4 anni fa
- Visualizzazioni
Transcript
1 La struttura quaternaria della deossiemoglobina prende il nome di : forma T (tesa) mentre quella della ossiemoglobina viene chiamata forma R (rilasciata); nello stato teso vi sono una serie di interazioni elettrostatiche piuttosto forti tra amminoacidi acidi e amminoacidi basici che portano ad una struttura rigida della deossiemoglobina (ecco il perché del "forma tesa"), mentre quando si lega l ossigeno, l entità di queste interazioni diminuisce (ecco il perché del "forma rilasciata")
2 Struttura quaternaria dell emoglobina emoglobina In seguito all ossigenazione i dimeri α 1 β 1 ed α 2 β 2 ruotano di circa 15 uno rispetto all altro. altro.
3
4 La struttura quaternaria della deossiemoglobina prende il nome di : forma T (tesa) mentre quella della ossiemoglobina viene chiamata forma R (rilasciata); nello stato teso vi sono una serie di interazioni elettrostatiche piuttosto forti tra amminoacidi acidi e amminoacidi basici che portano ad una struttura rigida della deossiemoglobina (ecco il perché del "forma tesa"), mentre quando si lega l ossigeno, l entità di queste interazioni diminuisce (ecco il perché del "forma rilasciata"). Inoltre, in assenza di ossigeno, la carica dell istidina viene stabilizzata dalla carica opposta dell acido aspartico mentre, in presenza di ossigeno, c è la tendenza da parte della proteina, a perdere un protone; tutto ciò comporta che l emoglobina ossigenata sia un acido più forte dell emoglobia deossigenata: effetto bohr
5
6 StatoT (deossi) Stato R (ossi) in assenza di ossigeno, la carica dell istidina viene stabilizzata dalla carica opposta dell acido aspartico in presenza di ossigeno, c è la tendenza da parte della proteina, a perdere un protone;
7
8 4 tra α1 e α2 1 tra α1 e β2 1 tra α2 e β1 1 intracatena per ogni β
9 Transizione T-R con cooperatività di legame
10 La molecola di deossiemoglobina è mantenuta nella forma T dalla presenza di sei ponti salini intersubunità, quattro tra le catene α, uno tra le catene α1 e β2 e uno tra le catene α2 e β1. Inoltre nelle catene β sono presenti anche due ponti salini intrasubunità. L'accesso dell'ossigeno agli eme α sembra favorito, da un minor ingombro sterico, rispetto agli eme β. Nella deossiemoglobina il ferro si trova fuori dal piano dell'eme verso l'istidina prossimale e l'eme assume una forma a cupola ("domed"). Il legame dell'ossigeno ad una subunità provoca delle variazioni conformazionali terziarie con la rottura dei ponti salini e rilascio di protoni. La rottura di quattro dei sei ponti salini intersubunità e le variazioni conformazionali terziarie a livello dell'interfaccia α1β2 modificano la costante dell'equilibrio conformazionale T R a favore della struttura quaternaria R (Figura 6). Il gruppo eme amplifica i piccoli cambiamenti del raggio atomico del ferro conseguenti alla transizione da alto a basso spin in un relativamente grande movimento dell'istidina F8. Tramite l'elica F il movimento è trasmesso all'interfaccia α1β2 causando la destabilizzazione della struttura T rispetto alla R. Una trattazione matematica di questo modello è stata sviluppata da Szabo e Karplus (Szabo & Karplus, 1972).
11
12
13
14
15
16 I componenti principali dell aria sono: Azoto: 78% (Percentuale molare) Ossigeno: 20,96% anidride carbonica: 0,03% Argon: 0,8% Altri gas : 0,21% Secondo la legge di Dalton, la somma delle corrispondenti pressioni parziali deve essere uguale alla pressione atmosferica (1 atm = 101,3 KPa) e infatti: azoto: 79,014 kpa ossigeno: 21,232 kpa anidride carbonica: 0,0304 kpa argon: 0,8104 kpa altri gas: 0,2127 kpa Totale (aria): 101,3 kpa La normale pressione atmosferica può sostenere circa 760 mm di mercurio; quindi 1/760 di una atmosfera, o 1 mm di mercurio (mmhg), è da lungo tempo una unità di misura molto diffusa. 1 Torr. La pressione esercitata da una colonnina di mercurio di 1 mm. in condizioni standard. 1 Torr = 133,322 Pa 1 atm = 760mm Hg = 101,3 KPa
17 Curva
18
19
20
21
22
23 Tasca idrofobica per l eme
24 CO2
25 Hb-nH+ +4O2 Hb-4O2 + nh+
26
27
28
29 TRASPORTO ANIDRIDE CARBONICA La CO2 è molto più solubile dell O2. Circa il 10% è disciolta nel plasma Circa il 30 % si lega alle proteine plasmatiche e all Hb Circa il 70% viene trasportato sotto forma di ioni bicarbonato (HCO 3- )
30
31 Sotto*) *
32
33
34
35
36 Vi sono altri fattori che possono influire sulla capacità dell emoglobina di legarsi all ossigeno, uno di questi è la concentrazione di 2,3 bisfosfoglicerato. Il 2,3 bisfosfoglicerato è un metabolita presente negli eritrociti in concentrazione 4-5 mm (in nessun altra parte dell organismo è presente in concentrazione così elevata). A ph fisiologico, il 2,3 bisfosfoglicerato è deprotonato ed ha su di sé cinque cariche negative; si va ad incuneare tra le due catene beta dell emoglobina perché tali catene presentano un elevata concentrazione di cariche positive. Le interazioni elettrostatiche tra le catene beta ed il 2,3 bisfosfoglicerato conferiscono una certa rigidità al sistema: si ottiene una struttura tesa che ha scarsa affinità per l ossigeno; durante l ossigenazione, poi, il 2,3 bisfosfoglicerato viene espulso. Negli eritrociti c è un apparato apposito che converte l 1,3 bisfosfoglicerato (prodotto dal metabolismo) in 2,3 bisfosfoglicerato in modo che esso raggiunga una concentrazione di 4-5 mm e che quindi l emoglobina sia in grado di scambiare l ossigeno nei tessuti.
37 H H
38 2,3-Bifosfoglicerato Effettore allosterico presente in concentrazioni variabili nella cellula (g. rosso) si lega con alta affinità in una nicchia prodotta da aa. con cariche +, il suo ruolo è quello di stabilizzare la forma deossi con conseguente maggior rilascio di ossigeno. Permette l adattamento immediato ad alte quote, e l utilizzo dell ossigeno materno dal feto Hb fetale due catene α e due catene γ al posto delle β. Le catene γ hanno Ser al posto His 143, questo elimina due cariche positivo dal sito per il BPG, riducendone l affinità, l assenza di BPG fa aumentare l affinità dell Hb fetale a scapito di quella materna
39
40
41
42 po 2 nei tessuti po 2 nei polm. (4500m slm) po 2 nei polm. a l. del mare variare fa 5mM a livello del mare 8mM in alta montagna.
43 5mM a livello del mare 8mM in alta montagna. 0mM l Hb lega l O con alta affinità A livello del mare l Hb è saturata nei polmoni(100mmhg), nei tessuti (20mmHg), quindi trasferisce il 70% di O 2. La saturazione dell Hb scende del 30% con l altitudine, con l aumento di BPG ritorna normale.
44
45
46 Nello sviluppo di un essere umano vi sono dei geni che vengono espressi solo per un determinato periodo di tempo; per tale motivo si hanno emoglobine diverse: fetali, embrionali, dell uomo adulto. Le catene che costituiscono queste diverse emoglobine, hanno delle strutture differenti, ma con delle similitudini, infatti la funzione che svolgono è più o meno la stessa.
47
48 La catena γ presenta una ser al posto di una his in posizione 143, l HbF ha quindi 2 cariche+ in meno nella sua cavità centrale, ha quindi bassa affinità per il 2,3BPG e una maggiore affinità per l ossigeno dell HbM
49
50
51
52
53
54 Struttura quaternaria dell Hb (4 eliche) determina il comportamento differente ad alta e bassa pp di O2; responsabile della curva sigmoidale (cooperatività)
55
56 CO2
57 Per variazioni di ph variazioni di affinità all O2; modifiche di struttura e della curva di azione di massa. A dx rilascia più O2 A sn più O2 legato.
58 po 2 nei tessuti po 2 nei polm. (4500m slm) po 2 nei polm. a l. del mare 5mM a livello del mare 8mM in alta montagna. Spostamento a destra della curva, aumento del rilascio di O2 quando il 2,3 DPG (o fa BPG) è legato all Hb. variare Permette regolazione dell O2 richiesto in base all entità di catabolismo in corso. Adattamento a quote diverse del livello del mare. Scambio O2 Placenta/embrione, feto
59 Hb embrionale e fetale, catene β sostituite da γ e ε, non legano il 2,3 BPG, maggiore affinità per O2 di Hb materna
60 15g/dl= 15g/100ml; 150g/1000ml= 150g/L 150g. : 1L= x : 5L x = 150*5/1 750g/5L
61 i i
62
63
64
65
66
67
68 Hb Hammersmith [Phe(42)βSer] La Ser permette all H2O di entrare nella sacca dell EME
69 Hb A con Gly Hb Savannah [Gly(24)βVal]
70 Hb Milwaukee [His Gly] Fe 3+ Stabilizzato dalla Gly
71 Hb Kansas[Asn(102) βthr]:si perde un legame ad H nell interfaccia α1/β2: Asn(102) β2/ Asp(94) α1; si stabilizza lo stato T, p50=70 mm Hg
72 Hb Yakima [Asp(99)βHis]: si è perso un legame ad H critico tra Β2-Asp(99) e α1-tyr(42) che stabilizza lo stato T; p50 = 12 mmhg
73
74
75
76
77
78 Gly 33%; Pro 13%; Hyp 9%; 45% tra leu, Ala etc.
79
80
81
82
83 Vit. C
84 a a a (vitc)
85 Idrossilazione di prolina
86
87
88
89
90
91
92
93 La biosintesi del collagene avviene ad opera di diversi tipi cellulari a seconda del tessuto (ad esempio fibroblasti nel tessuto connettivo, osteoblasti nell osso). Il processo inizia con la trascrizione del gene o dei geni e la maturazione dell mrna. Sono presenti sequenze che codificano per lunghi peptidi in eccesso rispetto alle molecole di collagene mature, quindi il collagene nasce come procollagene, prodotto che possiede rispetto al collagene due telomeri, uno N-Terminale e uno C- Terminale, che hanno struttura globulare. La traduzione avviene a livello dei ribosomi a ridosso della parete del RER (reticolo endoplasmatico rugoso) e la catena nascente di procollagene subisce rimozione del peptide segnale e idrossilazione di specifici residui di prolina e lisina ad idrossiprolina e idrossilisina (ad opera di idrossilasi, con cofattore essenziale la vitamina C), con la produzione di catene alfa di procollagene. Tre di queste catene si avvolgono a formare una tripla elica, stabilizzata da legame a idrogeno tra amminoacidi idrossilati (legami crociati). Questa elica passa nell apparato del Golgi dove viene completata la glicosilazione e da qui, attraverso vescicole di secrezione la molecola viene secreta all esterno. All esterno della cellula la molecola subisce l azione di alcune procollageno peptidasi, che rimuovono i residui N-terminali e C-terminali trasformando il procollagene in tropocollageno 2 telomeri, uno N-terminale e uno C-terminale
94 Le molecole di tropocollagene si dispongono in file parallele a formare fibrille. Le fibrille infine possono disporsi in fasci ondulati o paralleli per formare fibre e le fibre possono formare fasci di fibre.
95
96
97 Più di 1000 mutazioni nei 22 geni che cod. per il collageno e la sua sintesi, sono causa di molte patologie. La sindrome di Ehlers-Danlos (EDS) si origina da: Carenza di lisil/prolil idrossilasi o carenza di procoll. peptidasi, o da mutazioni puntiformi della sequenza aminoacidica. Mutazioni del collageno di tipo III, importante componente delle arterie, è causa di disturbi vascolari potenzialmente letali. Si associa anche a lassità della cute, oltre che lassità delle articolazioni.
98
99 Osteogenesi imperfetta (OI) o sindrome delle ossa di vetro, comprende un gruppo eterogeneo di patologie ereditarie. Tipo I, OI tardiva, si manifesta nella prima infanzia con fratture secondarie a traumi di minore entità, si può ipotizzare se l ecografia prenatale mostra incurvature o fratture nelle ossa lunghe. OI di tipo II o congenita, I pazienti muoiono prima della nascita o subito dopo il parto per insufficienza respiratoria
100
101 ELASTINA L'elastina è una proteina costituente il tessuto connettivo: è elastica e permette a molti tessuti di tornare alla loro forma originaria dopo forze di stiramento o di contrazione. L'elastina è un costituente fondamentale della pelle, cui si deve la caratteristica risposta elastica quando il tessuto è sottoposto a tensioni meccaniche. Il locus è Chr. 7 q ,
102 Localizzazione L'elastina svolge un ruolo importante nelle arterie ed è particolarmente abbondante nei grandi vasi sanguigni come l aorta. È anche un costituente strutturale molto importante dei polmoni, dei legamenti, della pelle, della vescica e della cartilagine.
103 Composizione glicina, valina, alanina e prolina, aa che compongono l elastina. è formata da molte molecole di tropoelastina (ad alfa-elica), idrosolubile e con massa molecolare di circa dalton, legate da legame covalente formatosi tra le lisine (lisil ossidasi). Il prodotto finale consiste in un voluminoso composto insolubile con resistenti legami crociati di lisina. Desmosina e isodesmosina sono proteine collegate all'elastina.
104 L Elastina è un polimero insolubile formato da tropoelastina, una proteina lineare di 700aa., prevalentemente piccoli e apolari (gly, ala, val). Inoltre presenta pro, e lys, ma solo tracce di HyPro e manca di HYLYs. La tropoelastina viene secreta dalle cellule nello spazio extracellulare dove interagisce con una glicoproteina, la fibrillina, che ha funzione di impalcatura. Le lys di tre catene di tropoelastina vengono deaminate (D. Ossidativa) e le allisine di 3 catene di tropoelastina contigue con una lys, non modificata formano un legame crociato di desmosina
105
106
107 Sindrome di Marfan dovuta ad un errore genetico: Le cause: è una malattia genetica. sul cromosoma 15 il difetto genetico che causa la MFS. alterazione (mutazione) del gene della fibrillina-1 (FBN1). La fibrillina-1 è una grossa glicoproteina, componente importante delle fibre elastiche presenti nel tessuto connettivo. la MFS, e dovuta,quindi, a una fibrillina-1 difettosa, a tutt oggi sono note circa 500 diverse mutazioni del gene FBN1; è particolarmente difficile effettuare diagnosi genetiche per identificare mutazioni. Mutazioni nel gene della fibrillina-1 sono responsabili anche di lussazione isolata familiare del cristallino e, in parte, dell aneurisma aortico-toracico familiare..
108 Patologie collegate Disturbi cardiovascolari. I disturbi più severi riguardano il sistema cardiovascolare. Il problema maggiore è costituito dalla dilatazione dell aorta Disturbi dell apparato scheletrico. Le persone affette da MFS hanno aspetto dinoccolato e longilineo, con arti e mani lunghe e sottili. Le articolazioni sono lasse, con lussazioni ricorrenti. Spesso è presente piede piatto. Si possono avere anche deformità della gabbia toracica come il petto carenato (sterno all infuori) e il petto escavato (sterno verso l interno), e problemi alla spina dorsale come scoliosi e lordosi di gravità variabile. Un altro difetto frequente è la miopia.
109 L antitripsina α (α1 ΑΤ), (prodotta dal fegato, e da monociti e macrofagi alveolari) impedisce la degradazione dell elastina nelle pareti alveolari. Una α 1-AT difettosa può causare enfisema. Dal 2 al 5% dei pazienti affetti da enfisema negli USA, c è una predisposizione genetica per difetto del gene per α1 antitripsina. α1
Scaricato da
 1 2 3 4 www.sunhope.it 1 Sinistrorsa destrorso 5 6 7 8 www.sunhope.it 2 9 10 11 12 www.sunhope.it 3 13 14 15 16 www.sunhope.it 4 17 18 19 20 www.sunhope.it 5 Idrossilazione della lisina 21 22 23 24 www.sunhope.it
1 2 3 4 www.sunhope.it 1 Sinistrorsa destrorso 5 6 7 8 www.sunhope.it 2 9 10 11 12 www.sunhope.it 3 13 14 15 16 www.sunhope.it 4 17 18 19 20 www.sunhope.it 5 Idrossilazione della lisina 21 22 23 24 www.sunhope.it
Collagene, Emoglobina e
 Collagene, Emoglobina e Mioglobina WWW.SUNHOPE.IT Vit. C WWW.SUNHOPE.IT a a a (vitc) WWW.SUNHOPE.IT Idrossilazione di prolina Per garantire la privacy, è stato impedito il download
Collagene, Emoglobina e Mioglobina WWW.SUNHOPE.IT Vit. C WWW.SUNHOPE.IT a a a (vitc) WWW.SUNHOPE.IT Idrossilazione di prolina Per garantire la privacy, è stato impedito il download
Riepilogo di Emoglobina, collagene, elastina e antitripsina
 Riepilogo di Emoglobina, collagene, elastina e antitripsina Vi sono altri fattori che possono influire sulla capacità dell emoglobina di legarsi all ossigeno, uno di questi è la concentrazione di
Riepilogo di Emoglobina, collagene, elastina e antitripsina Vi sono altri fattori che possono influire sulla capacità dell emoglobina di legarsi all ossigeno, uno di questi è la concentrazione di
Sinistrorsa. destrorso
 Sinistrorsa destrorso Collageno Glicoproteina insolubile del tessuto connettivo, tendini, denti, cartilagine, matrice organica, osso, cornea L unità strutturale del collageno è il TROPOCOLLAGENO costituito
Sinistrorsa destrorso Collageno Glicoproteina insolubile del tessuto connettivo, tendini, denti, cartilagine, matrice organica, osso, cornea L unità strutturale del collageno è il TROPOCOLLAGENO costituito
Sinistrorsa. destrorso
 Sinistrorsa destrorso P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006 Collageno Glicoproteina insolubile del tessuto connettivo, tendini, denti,
Sinistrorsa destrorso P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006 Collageno Glicoproteina insolubile del tessuto connettivo, tendini, denti,
Emoglobina e mioglobina
 Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
EME (Fe-PROTOPORFIRINA IX)
 EME (Fe-PROTOPORFIRINA IX) 1,3,5,8-tetrametil 2,4-divinil 6,7-dipropionil-porfirina 1 Il ferro può formare sei legami di coordinazione 4 con gli azoti dell anello tetrapirrolico 2 perpendicolari al piano
EME (Fe-PROTOPORFIRINA IX) 1,3,5,8-tetrametil 2,4-divinil 6,7-dipropionil-porfirina 1 Il ferro può formare sei legami di coordinazione 4 con gli azoti dell anello tetrapirrolico 2 perpendicolari al piano
IL COLLAGENO. E la specie proteica più abbondante nella maggior parte dei vertebrati, in tutti gli organi è presente la molecola di collageno.
 IL COLLAGENO E la specie proteica più abbondante nella maggior parte dei vertebrati, in tutti gli organi è presente la molecola di collageno. Fibre di collageno formano la matrice dell osso su cui precipitano
IL COLLAGENO E la specie proteica più abbondante nella maggior parte dei vertebrati, in tutti gli organi è presente la molecola di collageno. Fibre di collageno formano la matrice dell osso su cui precipitano
Polimorfismo genetico del collageno
 COLLAGENO È la proteina più abbondante del nostro corpo costituendo il 25% delle proteine totali. È la proteina principale dei tessuti connettivi, la cui matrice extracellulare contiene anche: -proteoglicani
COLLAGENO È la proteina più abbondante del nostro corpo costituendo il 25% delle proteine totali. È la proteina principale dei tessuti connettivi, la cui matrice extracellulare contiene anche: -proteoglicani
Ripiegamento e stabilità delle proteine
 Ripiegamento e stabilità delle proteine Ripiegamento e stabilità delle proteine La conformazione nativa di una proteina è quella a cui si associa la sua funzione biologica. Il termine stabilità può essere
Ripiegamento e stabilità delle proteine Ripiegamento e stabilità delle proteine La conformazione nativa di una proteina è quella a cui si associa la sua funzione biologica. Il termine stabilità può essere
Mioglobina Emoglobina
 Mioglobina Emoglobina RESPIRAZIONE : assunzione di O 2 dall ambiente e rilascio di CO 2 La RESPIRAZIONE CELLULARE è un processo redox attraverso il quale vengono trasferiti atomi di idrogeno da un composto
Mioglobina Emoglobina RESPIRAZIONE : assunzione di O 2 dall ambiente e rilascio di CO 2 La RESPIRAZIONE CELLULARE è un processo redox attraverso il quale vengono trasferiti atomi di idrogeno da un composto
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Le proteine che legano l ossigenol
 Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Trasporto di CO 2. ed effetto Bohr. . La CO 2. nei tessuti produce CO 2. Il consumo di O 2. deve essere rimossa e portata ai polmoni (o alle branchie)
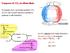 Trasporto di CO 2 ed effetto Bohr Il consumo di O 2 nei tessuti produce CO 2. La CO 2 deve essere rimossa e portata ai polmoni (o alle branchie) Anidrasi carbonica POLMONI La CO 2 abbassa il ph negli eritrociti
Trasporto di CO 2 ed effetto Bohr Il consumo di O 2 nei tessuti produce CO 2. La CO 2 deve essere rimossa e portata ai polmoni (o alle branchie) Anidrasi carbonica POLMONI La CO 2 abbassa il ph negli eritrociti
La demolizione delle proteine è fondamentale quanto la loro costruzione:
 La demolizione delle proteine è fondamentale quanto la loro costruzione: la pepsina, la tripsina, insieme ad altri enzimi proteolitici, spezzettano le proteine complesse del cibo in amminoacidi, passaggio
La demolizione delle proteine è fondamentale quanto la loro costruzione: la pepsina, la tripsina, insieme ad altri enzimi proteolitici, spezzettano le proteine complesse del cibo in amminoacidi, passaggio
RUOLI BIOLOGICI DELLE PROTEINE. Biochimica
 RUOLI BIOLOGICI DELLE PROTEINE Biochimica Il collagene una proteina strutturale Il collagene è un componente principale di tessuti quali la pelle, i capelli, i tendini, le ossa, il cartilagine, i vasi
RUOLI BIOLOGICI DELLE PROTEINE Biochimica Il collagene una proteina strutturale Il collagene è un componente principale di tessuti quali la pelle, i capelli, i tendini, le ossa, il cartilagine, i vasi
Le proteine che legano ossigeno:
 Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Mioglobina ed emoglobina
 Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Il metalloma Struttura e reattività di metalloproteine. Il trasporto dell O 2
 Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
L'importanza dei legami crociati dovuti alla lisil ossidasi. - è somministrato l'inibitore β-aminopropionitrile.
 L'importanza dei legami crociati dovuti alla lisil ossidasi è dimostrata da studi su animali a cui: - non è fornito con la dieta il Cu 2+ o - è somministrato l'inibitore β-aminopropionitrile. Le conseguenze
L'importanza dei legami crociati dovuti alla lisil ossidasi è dimostrata da studi su animali a cui: - non è fornito con la dieta il Cu 2+ o - è somministrato l'inibitore β-aminopropionitrile. Le conseguenze
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
Riabilitativa 2015/2016
 Emoglobina e collageno Spina Riabilitativa 2015/2016 WWW.SUNHOPE.IT Alla grande varietà di strutture tridimensionali corrisponde una grande varietà di funzioni Ogni proteina presenta diversi livelli di
Emoglobina e collageno Spina Riabilitativa 2015/2016 WWW.SUNHOPE.IT Alla grande varietà di strutture tridimensionali corrisponde una grande varietà di funzioni Ogni proteina presenta diversi livelli di
LE PROTEINE DEL CONNETTIVO: IL COLLAGENO, L ELASTINA.
 UNITÀ BIOTEC. DIDATTICA DI BIOCHIMICA GENERALE LE PROTEINE DEL CONNETTIVO: IL COLLAGENO, L ELASTINA. Roberto Giacominelli Stuffler IL COLLAGENO 2 IL COLLAGENO E una famiglia di proteine fibrose con ruolo
UNITÀ BIOTEC. DIDATTICA DI BIOCHIMICA GENERALE LE PROTEINE DEL CONNETTIVO: IL COLLAGENO, L ELASTINA. Roberto Giacominelli Stuffler IL COLLAGENO 2 IL COLLAGENO E una famiglia di proteine fibrose con ruolo
Modulo 4. Una proteina in azione
 Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
L organizzazione sfalsata dà origine alla tipica striatura di una fibrilla vista al ME in colorazione negativa.
 Le unità di tropocollageno si dispongono testa-coda su file parallele, sfalsandosi di circa 1/4 della loro lunghezza (60-70 nm). In ciascuna fila le unità sono separate da spazi di 35-40 nm, che nell osso
Le unità di tropocollageno si dispongono testa-coda su file parallele, sfalsandosi di circa 1/4 della loro lunghezza (60-70 nm). In ciascuna fila le unità sono separate da spazi di 35-40 nm, che nell osso
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme.
 1 Forma T Forma R Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme. 2 1 3 La forma sigmoide della curva indica che
1 Forma T Forma R Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme. 2 1 3 La forma sigmoide della curva indica che
Mioglobina Emoglobina
 Mioglobina Emoglobina Eventi successivi i alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione
Mioglobina Emoglobina Eventi successivi i alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione
CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ
EMOGLOBINA (Hb) nei globuli rossi e
 Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE
 FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
Emoglobina e mioglobina
 Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno
 Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno Eritrociti umani Ciascun eritrocita contiene circa 300 milioni di molecole di emoglobina Possiedono un motivo strutturale comune.
Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno Eritrociti umani Ciascun eritrocita contiene circa 300 milioni di molecole di emoglobina Possiedono un motivo strutturale comune.
STRUTTURA E FUNZIONE
 STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
 COMPOSIZIONE: - Semplici - Coniugate: Apolipoproteine Glicoproteine Nucleoproteine Metalloproteine Cromoproteine STRUTTURA: - Fibrose forma molecolare allungata struttura II - Globulari: forma molecolare
COMPOSIZIONE: - Semplici - Coniugate: Apolipoproteine Glicoproteine Nucleoproteine Metalloproteine Cromoproteine STRUTTURA: - Fibrose forma molecolare allungata struttura II - Globulari: forma molecolare
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine:
 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
Nel corso dell evoluzione, con il passaggio dalla. progressivamente differenziati due meccanismi. un sistema circolatorio adeguato;
 PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado
PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a:
 I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Legano reversibilmente l OSSIGENO. La mioglobina (monomerica) è presente nelle cellule muscolari. L emoglobina (tetramerica) è presente negli
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Legano reversibilmente l OSSIGENO. La mioglobina (monomerica) è presente nelle cellule muscolari. L emoglobina (tetramerica) è presente negli
- natura riduttiva - richiede energia
 - natura ossidativa - produce energia - natura riduttiva - richiede energia 1 L O 2 è poco solubile in acqua (10 ml/l a 20 C): se esso fosse semplicemente disciolto, potrebbe diffondere efficacemente solo
- natura ossidativa - produce energia - natura riduttiva - richiede energia 1 L O 2 è poco solubile in acqua (10 ml/l a 20 C): se esso fosse semplicemente disciolto, potrebbe diffondere efficacemente solo
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
COMPOSTI AZOTATI. derivanti dall ammoniaca AMMINE. desinenza -INA AMMIDE
 COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
Eventi successivi alla comparsa dell O 2
 Eventi successivi alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione dell ossigeno: infatti,
Eventi successivi alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione dell ossigeno: infatti,
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
Regolano il metabolismo, sia come enzimi, sia come ormoni (insulina, glucagone, ecc.)
 Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
Il BPG è un importante modulatore dell affinità di Hb per l O 2. - curva iperbolica. - P50 = 1 mm Hg
 L Hb è una proteina allosterica che presenta: - regolazione omotropica O 2 è sia il normale ligando sia il modulatore omotropico - regolazione eterotropica H +, CO 2 e BPG sono modulatori eterotropici
L Hb è una proteina allosterica che presenta: - regolazione omotropica O 2 è sia il normale ligando sia il modulatore omotropico - regolazione eterotropica H +, CO 2 e BPG sono modulatori eterotropici
EMOGLOBINA (Hb) nei globuli rossi e
 Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Trasporto gas nel sangue
 Trasporto gas nel sangue Trasporto O2 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 97% 3% O 2 disciolto nel plasma O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Trasporto gas nel sangue Trasporto O2 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 97% 3% O 2 disciolto nel plasma O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
La caratteristica fondamentale del tessuto connettivo è quella di essere costituito da cellule e sostanza intercellulare
 generalità La caratteristica fondamentale del tessuto connettivo è quella di essere costituito da cellule e sostanza intercellulare La sostanza intercellulare a sua volta è costituita da fibre e sostanza
generalità La caratteristica fondamentale del tessuto connettivo è quella di essere costituito da cellule e sostanza intercellulare La sostanza intercellulare a sua volta è costituita da fibre e sostanza
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Il Collageno tessuto connettivo
 Il Collageno Costituente del tessuto connettivo, insieme a elastina, fibrillina e proteoglicani, tutti prodotti da fibroblasti, condroblasti, osteoblasti La proteina + abbondante nei mammiferi (25% del
Il Collageno Costituente del tessuto connettivo, insieme a elastina, fibrillina e proteoglicani, tutti prodotti da fibroblasti, condroblasti, osteoblasti La proteina + abbondante nei mammiferi (25% del
moli OH - /mole amminoacido
 ) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
MIOGLOBINA ED EMOGLOBINA
 MIOGLOBINA ED EMOGLOBINA Il passaggio dalla vita anaerobia al metabolismo di tipo aerobico ha rappresentato un vantaggio energetico incredibile. L ossigeno è assolutamente indispensabile per il metabolismo,
MIOGLOBINA ED EMOGLOBINA Il passaggio dalla vita anaerobia al metabolismo di tipo aerobico ha rappresentato un vantaggio energetico incredibile. L ossigeno è assolutamente indispensabile per il metabolismo,
GLI ENZIMI ALLOSTERICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM)
 Effetti allosterici - Modelli d azione GLI ENZIMI ALLOSEICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM) Negli enzimi allosterici le
Effetti allosterici - Modelli d azione GLI ENZIMI ALLOSEICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM) Negli enzimi allosterici le
Scambi gassosi e regolazione del respiro
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ventilazione polmonare Ruolo del Sistema Respiratorio: 1 2 - fornire O 2 - rimuovere
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ventilazione polmonare Ruolo del Sistema Respiratorio: 1 2 - fornire O 2 - rimuovere
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
α-cheratine (α-elica) collageni e cheratine β-cheratine (conformazione β) M.N. Gadaleta
 Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Scambi gassosi e regolazione del respiro
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
θ = (siti occupati)/(siti disponibili totali) Al numeratore ritrovo solo la mioglobina che ha complessato l'ossigeno, solo l'ossigenata)
 LEZIONE DEL 03/04/2017 Emoglobina - complesso del metallo di transizione (ferro protoporfirina IX) complesso metallorganico. Derivazione della curva di legame iperbolica dell'ossigeno della mioglobina
LEZIONE DEL 03/04/2017 Emoglobina - complesso del metallo di transizione (ferro protoporfirina IX) complesso metallorganico. Derivazione della curva di legame iperbolica dell'ossigeno della mioglobina
degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l l anidride carbonica tra i polmoni e i tessuti
 l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
Trasporto dei gas. Pressioni Volumi
 Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
COMPOSIZIONE DELL ARIA ATMOSFERICA SECCA E PRESSIONI PARZIALI DEI GAS - (760 TORR, 15 C)
 COMPOSIZIONE DELL ARIA ATMOSFERICA SECCA E PRESSIONI PARZIALI DEI GAS - (760 TORR, 15 C) COMPOSIZIONE ARIA NELL ATMOSFERA = COSTANTE A PARTE LE VARIAZIONI DELLA QUANTITA DI VAPORE ACQUEO A 0 C 1 torr =
COMPOSIZIONE DELL ARIA ATMOSFERICA SECCA E PRESSIONI PARZIALI DEI GAS - (760 TORR, 15 C) COMPOSIZIONE ARIA NELL ATMOSFERA = COSTANTE A PARTE LE VARIAZIONI DELLA QUANTITA DI VAPORE ACQUEO A 0 C 1 torr =
Lo scambio gassoso negli animali
 Lo scambio gassoso negli animali Durante la RESPIRAZIONE CELLULARE (mitocondri) le cellule consumano O2 e producono CO2 L approvvigionamento di O2 e la rimozione della CO2 avvengono tramite SCAMBI GASSOSI
Lo scambio gassoso negli animali Durante la RESPIRAZIONE CELLULARE (mitocondri) le cellule consumano O2 e producono CO2 L approvvigionamento di O2 e la rimozione della CO2 avvengono tramite SCAMBI GASSOSI
 TESSUTO CONNETTIVO PROPRIAMENTE DETTO CELLULE + SOSTANZA INTERCELLULARE CELLULE Fibroblasti: secernono tutti i componenti dellasostanzaintercellulare. Fusati o stellati Cellule provenienti dal sangue:
TESSUTO CONNETTIVO PROPRIAMENTE DETTO CELLULE + SOSTANZA INTERCELLULARE CELLULE Fibroblasti: secernono tutti i componenti dellasostanzaintercellulare. Fusati o stellati Cellule provenienti dal sangue:
20/12/ tipi di amino acidi: parecchie combinazioni
 20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
Ogni globina ha una tasca in cui lega un gruppo EME, quindi l Hb può legare e trasportare 4 molecole di O 2
 Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
I TESSUTI CONNETTIVI. Tessuti connettivi propriamente detti; Tessuto adiposo; Sangue; Tessuto cartilagineo; Tessuto osseo. A cura di Tiziano Baroni
 I TESSUTI CONNETTIVI 1) 2) 3) 4) 5) Tessuti connettivi propriamente detti; Tessuto adiposo; Sangue; Tessuto cartilagineo; Tessuto osseo A cura di Tiziano Baroni TESSUTI CONNETTIVI Gruppo di tessuti con
I TESSUTI CONNETTIVI 1) 2) 3) 4) 5) Tessuti connettivi propriamente detti; Tessuto adiposo; Sangue; Tessuto cartilagineo; Tessuto osseo A cura di Tiziano Baroni TESSUTI CONNETTIVI Gruppo di tessuti con
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA
 PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
ECM matrice extra-cellulare
 ECM matrice extra-cellulare I tessuti biologici possono essere considerati come materiali compositi costituiti da un numero variabile di cellule legate ad una sostanza complessa denominata matrice extracellulare
ECM matrice extra-cellulare I tessuti biologici possono essere considerati come materiali compositi costituiti da un numero variabile di cellule legate ad una sostanza complessa denominata matrice extracellulare
Modificazioni delle proteine
 Modificazioni delle proteine POST-TRADUZIONALI = avvengono dopo la sintesi proteica CO-TRADUZIONALI = avvengono durante la sintesi proteica Sono modificazioni chimiche della catena polipeptidica ad opera,
Modificazioni delle proteine POST-TRADUZIONALI = avvengono dopo la sintesi proteica CO-TRADUZIONALI = avvengono durante la sintesi proteica Sono modificazioni chimiche della catena polipeptidica ad opera,
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
Foto funzioni apparato respiratorio
 RESPIRAZIONE ESTERNA Foto funzioni apparato respiratorio RESPIRAZIONE INTERNA GLI SCAMBI GASSOSI QUOZIENTE RESPIRATORIO = CO 2 PRODOTTA O 2 CONSUMATO A riposo: Epitelio alveolare 200 ml/min 250 ml/min
RESPIRAZIONE ESTERNA Foto funzioni apparato respiratorio RESPIRAZIONE INTERNA GLI SCAMBI GASSOSI QUOZIENTE RESPIRATORIO = CO 2 PRODOTTA O 2 CONSUMATO A riposo: Epitelio alveolare 200 ml/min 250 ml/min
LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOACIDI
 LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Il sistema respiratorio
 Il sistema respiratorio Utilizzo di ossigeno e produzione di anidride carbonica da parte delle cellule a livello mitocondriale con la produzione di ATP Zona di conduzione Zona respiratoria Funzioni non
Il sistema respiratorio Utilizzo di ossigeno e produzione di anidride carbonica da parte delle cellule a livello mitocondriale con la produzione di ATP Zona di conduzione Zona respiratoria Funzioni non
Schemi delle lezioni 1
 Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Apparato respiratorio
 Apparato respiratorio La respirazione esterna consiste nello scambio di gas (O 2 e CO 2 ) tra ambiente esterno e cellule. Comprende 4 processi: 1) Scambio di aria tra atmosfera e polmoni (ventilazione,
Apparato respiratorio La respirazione esterna consiste nello scambio di gas (O 2 e CO 2 ) tra ambiente esterno e cellule. Comprende 4 processi: 1) Scambio di aria tra atmosfera e polmoni (ventilazione,
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Sintesi e maturazione del collageno
 Sintesi e maturazione del collageno Modifiche intracellulari - idrossilazione (RE) - glicosilazione (RE) - formazione dei ponti S-S (Golgi) - formazione della tripla elica (Golgi) GLICOSILAZIONE I due
Sintesi e maturazione del collageno Modifiche intracellulari - idrossilazione (RE) - glicosilazione (RE) - formazione dei ponti S-S (Golgi) - formazione della tripla elica (Golgi) GLICOSILAZIONE I due
