LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOACIDI
|
|
|
- Raffaele Carlini
- 5 anni fa
- Visualizzazioni
Transcript
1 LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di amminoacidi presenta un buon grado di flessibilità GLI AMINOAIDI Parte comune a tutti gli aminoacidi arbonio α Gruppo aminico 2 N R α atena laterale OO Gruppo carbossilico Parte variabile 1
2 In relazione al p dell ambiente, il gruppo OO o il gruppo N 2 possono essere in forma dissociata o indissociata cedendo o accettando protoni + 3 N OO - 2 N R α OO GLIINA IL PIU SEMPLIE DEGLI AMINOAIDI R = 2 N α OO Gly G 2
3 UN AMINOAIDO: IL TRIPTOFANO R può essere un gruppo chimico complesso 2 N α OO Trp W 3
4 AMINOAIDI POLARI AMINOAIDO ATENA LATERALE (R) acido aspartico Asp negativa acido glutammico Glu negativa arginina Arg positiva lisina Lys positiva istidina is positiva Asparagina Asn non carica, polare Glutammina Gln non carica, polare serina Ser non carica, polare treonina Thr non carica, polare tirosina Tyr non carica, polare 4
5 AMINOAIDI NON POLARI AMINOAIDO ATENA LATERALE alanina Ala non polare glicina Gly non polare valina Val non polare leucina Leu non polare Isoleucina Ile non polare prolina Pro non polare Fenilalanina Phe non polare Metionina Met non polare Triptofano Trp non polare cisteina ys non polare 5
6 GLI AMINOAIDI ESSENZIALI ATTENZIONE, ESSENZIALE NON VUOL DIRE AMMINOAIDI PIÙ IMPORTANTI DI ALTRI SI DEFINISONO AMINOAIDI ESSENZIALI QUELLI E UN DATO ORGANISMO NON E IN GRADO DI SINTETIZZARE AUTONOMAMENTE MA E DEVE INTRODURRE ON LA ALIMENTAZIONE PER L UOMO GLI AMINOAIDI ESSENZIALI SONO: TREONINA METIONINA LISINA VALINA LEUINA ISOLEUINA ISTIDINA FENILALANINA TRIPTOFANO PER ALTRE SPEIE L ELENO POTRA ESSERE DIVERSO Gli aminoacidi si uniscono a formare una catena grazie al LEGAME PEPTIDIO N α O + N α O R O R O 2 O N α O N α O R R O 6
7 Struttura primaria di una proteina: è la sequenza degli aminoacidi che la compongono: quanti aminoacidi, quali e un quale ordine. Nota: in questa immagine, che descrive la struttura primaria di una proteina, la sequenza è stata disegnata ripiegata soltanto per motivi di spazio. La struttura primaria non descrive i ripiegamenti della catena polipeptidica. 7
8 Quanti tipi di proteine in un organismo? In un essere umano alcune decine di migliaia, ciascuna con una sua specifica sequenza di amminoacidi e una sua specifica funzione Nella stessa specie la maggior parte delle proteine può esistere in più di una variante, in genere con funzione identica o simile ma con piccole differenze nella sequenza di amminoacidi. Le differenze nella sequenza di amminoacidi sono conseguenza di mutazioni avvenute nel DNA In specie diverse possono esistere proteine con funzioni identiche o simili e con differenze nella sequenza di amminoacidi proporzionali alla distanza evolutiva Nella figura la lunghezza dei segmenti è proporzionale alle differenze 8
9 MetAspLeuTyrGlyGlyPheysProTrp.. SI DEFINISE STRUTTURA PRIMARIA DI UNA PROTEINA LA SUA SEQUENZA IN AMINOAIDI La catena polipeptidica si ripiega per assumere la sua conformazione tridimensionale grazie alla sua flessibilita e in seguito alle interazioni degli aminoacidi tra di loro e con l ambiente circostante Questi ripiegamenti vengono descritti da ciò che si definisce struttura secondaria e terziaria di una proteina (o eventualmente quaternaria per le proteine formate da più subunità) Il ripiegamento (FOLDING) delle proteine è dovuto alle interazioni degli aminoacidi tra di loro e con l ambiente 9
10 Piano β 10
11 Alcune proteine multimeriche possono essere costituite dai copie multiple di una stessa subunità o di subunità diverse NELLA SUA STRUTTURA TERZIARIA (O QUATERNARIA), UNA PROTEINA SI PRESENTA OME UN OGGETTO DI FORMA OMPLESSA, E POTRÀ PRESENTARE SOLI E AVITÀ ED E RIOPERTA DI GRUPPI IMII APAI DI FORMARE LEGAMI DEBOLI ON ALTRE MOLEOLE PERE UNA PROTEINA POSSA LEGARSI ON UN ALTRA MOLEOLA (LIGANDO), DOVRA ESISTERE UNA OMPLEMENTARIETA DI FORMA E DI APAITA DI FORMARE LEGAMI IL LEGAME SARA TANTO PIU STABILE QUANTO MAGGIORE E IL NUMERO DI INTERAZIONI SIMULTANEE 11
12 Pochi legami: la agitazione termica facilmente determina il distacco Molti legami: la agitazione termica difficilmente determina il distacco La precisione della complementarietà, e soprattutto il numero di legami non covalenti che si possono formare, determina la maggiore o minore affinità tra due molecole e la stabilità del legame, che è comunque sempre reversibile. Le stesse forze che determinano il ripiegamento delle proteine determinano anche le interazioni tra una proteina ed altre molecole, come ad esempio tra un enzima e il suo substrato o tra un recettore ed il suo ligando 12
13 MOLTE ARATTERISTIE FUNZIONALI DI UNA PROTEINA DIPENDONO DALLA SUA APAITA DI INTERAGIRE ON ALTRE MOLEOLE LEGANDOLE QUESTE INTERAZIONI RIIEDONO UN RIONOSIMENTO REIPROO, LEGATO ALLA FORMA DELLE MOLEOLE ED ALLE APAITA DI FORMARE LEGAMI LIGANDO Perchè una proteina possa interagire correttamente con il suo ligando è necessario che il suo ripiegamento sia avvenuto correttamente 13
14 LA STRUTTURA TRIDIMENSIONALE DI UNA PROTEINA NON E RIGIDA, MA DINAMIA IL AMBIAMENTO DELLE ONDIZIONI AMBIENTALI O L INTERAZIONE ON ALTRE MOLEOLE POTRA MODIFIARE REVERSIBILMENTE LA ONFORMAZIONE DELLA PROTEINA Ricordiamo infatti che quando una proteina si lega con un altra molecola (proteica o meno), viene a contatto con gruppi chimici che potranno essere carichi positivamente o negativamente, polari o non polari. Questa nuova situazione potrà modificare reversibilmente il ripiegamento della proteina 14
15 15
16 ome si ripiegano le proteine. Il ripiegamento delle proteine è dovuto alle proprietà dei suoi amminoacidi, quindi è una conseguenza della struttura primaria e delle sue interazioni con l ambiente. Alcune proteine, se artificialmente svolte (denaturate), si ripiegano correttamente in modo spontaneo Ripiegamenti non corretti contagiosi possono essere causa di malattie: il caso dei prioni (la mucca pazza ) 16
17 Una proteina prionica ripiegata in modo anomalo induce il ripiegamento anomalo di altri esemplari 17
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
AMINOACIDI Struttura. Funzione. Classificazione. Proprietà
 AMINOACIDI Struttura Funzione Classificazione Proprietà 1 STRUTTURA Composti caratterizzati dalla presenza di un gruppo aminico (NH 2 ) e di un gruppo acido (COOH) legati al medesimo carbonio (C). In soluzione
AMINOACIDI Struttura Funzione Classificazione Proprietà 1 STRUTTURA Composti caratterizzati dalla presenza di un gruppo aminico (NH 2 ) e di un gruppo acido (COOH) legati al medesimo carbonio (C). In soluzione
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
moli OH - /mole amminoacido
 ) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
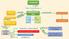 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
Amminoacidi e proteine Dagli amminoacidi come building-blocks alla struttura quaternaria
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Amminoacidi e proteine Dagli amminoacidi come building-blocks alla struttura quaternaria
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Amminoacidi e proteine Dagli amminoacidi come building-blocks alla struttura quaternaria
PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi
 POTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,, O, N) macromolecole organiche, molecole informazionali, polimeri
POTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (,, O, N) macromolecole organiche, molecole informazionali, polimeri
E. Giordano 16/09/2010
 GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Antimo Di Maro. Lezione 3. Corso di Laurea in Scienze Biologiche
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, Padova. Tel.
 Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: fulvio.ursini@unipd.it Funzioni delle
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: fulvio.ursini@unipd.it Funzioni delle
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
LE MACROMOLECOLE BIOLOGICHE Le cellule contengono 4 famiglie principali di molecole organiche:
 LEZIONE n 1 LE MACROMOLECOLE BIOLOGICHE Le cellule contengono 4 famiglie principali di molecole organiche: macromolecole Macromolecole macromolecole I componenti chimici di una cellula -Le macromolecole
LEZIONE n 1 LE MACROMOLECOLE BIOLOGICHE Le cellule contengono 4 famiglie principali di molecole organiche: macromolecole Macromolecole macromolecole I componenti chimici di una cellula -Le macromolecole
20/12/ tipi di amino acidi: parecchie combinazioni
 20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Schemi delle lezioni 1
 Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Sequenze nucleotidiche del DNA definite loci costituiscono i geni. Ogni gene codifica per una specifica proteina
 sintesi proteica La sintesi proteica è il processo che porta alla formazione delle proteine da sequenze del DN definite geni. Si tratta di un processo a più fasi Nelle sue linee fondamentali questo processo
sintesi proteica La sintesi proteica è il processo che porta alla formazione delle proteine da sequenze del DN definite geni. Si tratta di un processo a più fasi Nelle sue linee fondamentali questo processo
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
Struttura degli Amminoacidi
 Amminoacidi Struttura degli Amminoacidi Amminoacido (o α-amminoacido): molecola che possiede un gruppo amminico primario (-NH 2 ) come sostituente dell atomo di carbonio α, e un gruppo carbossilico acido
Amminoacidi Struttura degli Amminoacidi Amminoacido (o α-amminoacido): molecola che possiede un gruppo amminico primario (-NH 2 ) come sostituente dell atomo di carbonio α, e un gruppo carbossilico acido
Nome e cognome: [Totale: 80 punti]
![Nome e cognome: [Totale: 80 punti] Nome e cognome: [Totale: 80 punti]](/thumbs/74/70614081.jpg) Nome e cognome: ruppo / candidato No. SIENZE SPERIMENTLI: BIOLOI [Totale: 80 punti] Raccomandazioni: Rispondere direttamente sui fogli Non separare i fogli Rispondere in modo sintetico e chiaro, usando
Nome e cognome: ruppo / candidato No. SIENZE SPERIMENTLI: BIOLOI [Totale: 80 punti] Raccomandazioni: Rispondere direttamente sui fogli Non separare i fogli Rispondere in modo sintetico e chiaro, usando
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare quattro legami covalenti. Questi
apitolo 3 Le biomolecole I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare quattro legami covalenti. Questi
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Biochimica. studio della vita a livello molecolare
 Biochimica studio della vita a livello molecolare studio della composizione molecolare dei sistemi viventi studio delle reazioni chimiche cui vanno incontro i sistemi viventi ALCUNI QUESITI DELLA BIOCHIMICA
Biochimica studio della vita a livello molecolare studio della composizione molecolare dei sistemi viventi studio delle reazioni chimiche cui vanno incontro i sistemi viventi ALCUNI QUESITI DELLA BIOCHIMICA
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA
 PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
lezione Prof. Spina miliardi di anni fa l universo comparve sotto forma di eruzioni
 Biochimica Matricole dispari 1 1^ lezione Prof. Spina LA BIOCHIMICA 15 20 miliardi di anni fa l universo comparve sotto forma di eruzioni d l f d inimmaginabili di particele subatomiche ricche di energia
Biochimica Matricole dispari 1 1^ lezione Prof. Spina LA BIOCHIMICA 15 20 miliardi di anni fa l universo comparve sotto forma di eruzioni d l f d inimmaginabili di particele subatomiche ricche di energia
Nome e cognome: [Totale: 80 punti]
![Nome e cognome: [Totale: 80 punti] Nome e cognome: [Totale: 80 punti]](/thumbs/61/45962295.jpg) Nome e cognome: ruppo / candidato No. SIENZE SPERIMENTLI: BIOLOI [Totale: 80 punti] Raccomandazioni: Rispondere direttamente sui fogli Non separare i fogli Rispondere in modo sintetico e chiaro, usando
Nome e cognome: ruppo / candidato No. SIENZE SPERIMENTLI: BIOLOI [Totale: 80 punti] Raccomandazioni: Rispondere direttamente sui fogli Non separare i fogli Rispondere in modo sintetico e chiaro, usando
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
3.3.2. ALIMENTI DI ORIGINE VEGETALE. 3.3.2.1. Verdure
 3.3.2. ALIMENTI DI ORIGINE VEGETALE 3.3.2.1. Verdure Nella Tabella 9 sono riportati i valori degli aminoacidi liberi presenti in alcune fra le più diffuse verdure in commercio. In un passato recente era
3.3.2. ALIMENTI DI ORIGINE VEGETALE 3.3.2.1. Verdure Nella Tabella 9 sono riportati i valori degli aminoacidi liberi presenti in alcune fra le più diffuse verdure in commercio. In un passato recente era
Biochimica. studio della vita a livello molecolare
 Biochimica studio della vita a livello molecolare studio della composizione molecolare dei sistemi viventi studio delle reazioni chimiche cui vanno incontro i sistemi viventi ALCUNI QUESITI DELLA BIOCHIMICA
Biochimica studio della vita a livello molecolare studio della composizione molecolare dei sistemi viventi studio delle reazioni chimiche cui vanno incontro i sistemi viventi ALCUNI QUESITI DELLA BIOCHIMICA
ammoniaca ammina primaria ammina terziaria ammina secondaria R N H 2
 gruppo funzionale amminico N ammoniaca R N R N R R N R R ammina primaria ammina secondaria ammina terziaria R N 2 Le ammine, come l ammoniaca, hanno carattere basico ed in soluzione acquosa accettano un
gruppo funzionale amminico N ammoniaca R N R N R R N R R ammina primaria ammina secondaria ammina terziaria R N 2 Le ammine, come l ammoniaca, hanno carattere basico ed in soluzione acquosa accettano un
Università Telematica Pegaso. Indice
 LE PROTEINE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 TRASCRIZIONE--------------------------------------------------------------------------------------------------------------
LE PROTEINE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 TRASCRIZIONE--------------------------------------------------------------------------------------------------------------
LEZIONE 2 COMPOSTI DEL CARBONIO: MACROMOLECOLE:
 LEZIONE 2 COMPONENTI CHIMICI DELLA CELLULA ACQUA COMPOSTI DEL CARBONIO: MACROMOLECOLE: ZUCCHERI ACIDI GRASSI PROTEINE NUCLEOTIDI percentuale di abbondanza relativa I componenti chimici di una cellula organismi
LEZIONE 2 COMPONENTI CHIMICI DELLA CELLULA ACQUA COMPOSTI DEL CARBONIO: MACROMOLECOLE: ZUCCHERI ACIDI GRASSI PROTEINE NUCLEOTIDI percentuale di abbondanza relativa I componenti chimici di una cellula organismi
Compartime nto aminoacidi. 0,08 g (0,06 g) 0,36 g (0,32 g)
 G10% SENZA POTASSIO soluzione per infusione Principi attivi Compartime nto Compartime nto pronta all uso 125 ml 125 ml 250 ml 1000 ml Alanina 0,36 g 0,36 g 1,44 g Arginina 0,24 g 0,24 g 0,96 g Acido aspartico
G10% SENZA POTASSIO soluzione per infusione Principi attivi Compartime nto Compartime nto pronta all uso 125 ml 125 ml 250 ml 1000 ml Alanina 0,36 g 0,36 g 1,44 g Arginina 0,24 g 0,24 g 0,96 g Acido aspartico
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Nutrizione umana. Prof. Edgardo Canducci aa 2017/18
 Nutrizione umana Prof. Edgardo Canducci aa 2017/18 1 Le proteine aa 2017/18 2 Proteine. Generalità Le proteine (dal greco protos) sono i costituenti principali della materia vivente. Le proteine sono molecole
Nutrizione umana Prof. Edgardo Canducci aa 2017/18 1 Le proteine aa 2017/18 2 Proteine. Generalità Le proteine (dal greco protos) sono i costituenti principali della materia vivente. Le proteine sono molecole
Visualizzazioni 3D. Informatica. Matrice di voxel. Tipi di dato. Dati vettoriali. Tecniche di rappresentazione
 Informatica Lezione VIII Visualizzazione 3D di proteine Visualizzazioni 3D Rappresentazione di strutture/oggetti tridimensionali Risultato di un esperimento modello teorico dati fisici astrazione 1 Lezione
Informatica Lezione VIII Visualizzazione 3D di proteine Visualizzazioni 3D Rappresentazione di strutture/oggetti tridimensionali Risultato di un esperimento modello teorico dati fisici astrazione 1 Lezione
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
3.3. UMAMI NEGLI ALIMENTI
 3.3. UMAMI NEGLI ALIMENTI In questo capitolo saranno esaminati i vari cibi, ad esclusione di quelli ittici che verranno presi in considerazione successivamente, allo scopo di scoprire se in essi è presente,
3.3. UMAMI NEGLI ALIMENTI In questo capitolo saranno esaminati i vari cibi, ad esclusione di quelli ittici che verranno presi in considerazione successivamente, allo scopo di scoprire se in essi è presente,
Struttura delle proteine
 Struttura delle proteine I II III Copyright 2001-2018 by Giorgio Sartor. All rights reserved. Versione 1.3 24/09/2018 15:58 Proteine Biomolecole, macromolecole Più del 50% del peso secco di una cellula
Struttura delle proteine I II III Copyright 2001-2018 by Giorgio Sartor. All rights reserved. Versione 1.3 24/09/2018 15:58 Proteine Biomolecole, macromolecole Più del 50% del peso secco di una cellula
STRUTTURAZIONE DELLE PROTEINE
 STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
LA STRUTTURA DELLE PROTEINE È GERARCHICA
 LA STRUTTURA DELLE PROTEINE È GERARCHICA LA STRUTTURA DETERMINA LA FUNZIONE The Protein Folding Problem Cosa determina la struttura? Energia Cinetica Come si determina la struttura? Metodi Sperimentali
LA STRUTTURA DELLE PROTEINE È GERARCHICA LA STRUTTURA DETERMINA LA FUNZIONE The Protein Folding Problem Cosa determina la struttura? Energia Cinetica Come si determina la struttura? Metodi Sperimentali
COMPOSTI AZOTATI. derivanti dall ammoniaca AMMINE. desinenza -INA AMMIDE
 COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
Struttura secondaria
 Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine. Solo per uso didattico, vietata la riproduzione, la diffusione o la vendita
 MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
Aminoacidi. Struttura generale Sono 20 e formano le
 Aminoacidi Struttura generale Sono 20 e formano le proteine. Oltre a questi ne esistono altri meno comuni Alcuni subiscono modificazioni dopo essere stati inseriti nelle proteine Altri stanno nell organismo
Aminoacidi Struttura generale Sono 20 e formano le proteine. Oltre a questi ne esistono altri meno comuni Alcuni subiscono modificazioni dopo essere stati inseriti nelle proteine Altri stanno nell organismo
4.2. PRESENZA DI UMAMI NEGLI ALIMENTI ITTICI E DERIVATI
 4.2. PRESENZA DI UMAMI NEGLI ALIMENTI ITTICI E DERIVATI 4.2.1. PESCI, MOLLUSCHI E CROSTACEI Per la compilazione di questa parte, sono affiorati numerosi problemi di natura bibliografica che dimostrano
4.2. PRESENZA DI UMAMI NEGLI ALIMENTI ITTICI E DERIVATI 4.2.1. PESCI, MOLLUSCHI E CROSTACEI Per la compilazione di questa parte, sono affiorati numerosi problemi di natura bibliografica che dimostrano
Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa
 Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 5
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
DNA E PROTEINE IL DNA E RACCHIUSO NEL NUCLEO, MENTRE LA SINTESI PROTEICA SI SVOLGE NEL CITOPLASMA: COME VIENE TRASPORTATA L INFORMAZIONE?
 DNA E PROTEINE NUMEROSI DATI SUGGERISCONO CHE IL DNA SVOLGA IL SUO RUOLO GENETICO CONTROLLANDO LA SINTESI DELLE PROTEINE, IN PARTICOLARE DETERMINANDONE LA SEQUENZA IN AMINOACIDI E NECESSARIO RISPONDERE
DNA E PROTEINE NUMEROSI DATI SUGGERISCONO CHE IL DNA SVOLGA IL SUO RUOLO GENETICO CONTROLLANDO LA SINTESI DELLE PROTEINE, IN PARTICOLARE DETERMINANDONE LA SEQUENZA IN AMINOACIDI E NECESSARIO RISPONDERE
06_citologia_SER_golgi 1
 1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Parametri dell α-elica. residui/giro 3.6. passo dell elica
 GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE
 FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
Acqua: peso molecolare = 18 In un bicchiere circa ml, quindi 10 moli una mole 6x10 23 molecole, quindi in un bicchiere 6x10 24 molecole
 Acqua: peso molecolare = 18 In un bicchiere circa 180-200 ml, quindi 10 moli una mole 6x10 23 molecole, quindi in un bicchiere 6x10 24 molecole Volume degli oceani 1.3 miliardi di km 3 = 1.3 x 10 18 m
Acqua: peso molecolare = 18 In un bicchiere circa 180-200 ml, quindi 10 moli una mole 6x10 23 molecole, quindi in un bicchiere 6x10 24 molecole Volume degli oceani 1.3 miliardi di km 3 = 1.3 x 10 18 m
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
ARPAT Agenzia regionale per la protezione ambientale della Toscana
 ARPAT Agenzia regionale per la protezione ambientale della Toscana Dipartimento Provinciale di Livorno 114, Via Giovanni Marradi - 57126 LIVORNO Tel. 0586/263411 - Fax 0586/263477 E-mail: f.righini@arpat.toscana.it
ARPAT Agenzia regionale per la protezione ambientale della Toscana Dipartimento Provinciale di Livorno 114, Via Giovanni Marradi - 57126 LIVORNO Tel. 0586/263411 - Fax 0586/263477 E-mail: f.righini@arpat.toscana.it
Alimentazione. Ostetrica Paola Agnese Mauri
 Alimentazione materna Ostetrica Paola Agnese Mauri Per alimentarsi correttamente mettiamoci la testa! Dieta in allattamento dopo gravidanza fisiologica Gli attori della scena Il lattante Il fruitore Il
Alimentazione materna Ostetrica Paola Agnese Mauri Per alimentarsi correttamente mettiamoci la testa! Dieta in allattamento dopo gravidanza fisiologica Gli attori della scena Il lattante Il fruitore Il
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Carboidra8, lipidi, aminoacidi e nucleo8di.
 Elemen8 più abbondan8 nei organismi vivi: ossigeno (O), carbonio (C), idrogeno (H), azoto (N), zolfo (S), fosforo (P). Se l acqua è il medio per la vita, il carbonio è lo scheletro per la materia organica,
Elemen8 più abbondan8 nei organismi vivi: ossigeno (O), carbonio (C), idrogeno (H), azoto (N), zolfo (S), fosforo (P). Se l acqua è il medio per la vita, il carbonio è lo scheletro per la materia organica,
Macromolecole Biologiche. La struttura secondaria (I)
 La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
COOH. Sono tutti α-amminoacidi possiedono un gruppo amminico e un carbossilico entrambi legati allo stesso atomo di carbonio (il carbonio α)
 AMMINOACIDI Gi amminoacidi comuni o standard che tutti gi organismi viventi utiizzano per assembaggio dee PROTEINE sono 20 e sono codificati da codice genetico. Sono tutti α-amminoacidi possiedono un gruppo
AMMINOACIDI Gi amminoacidi comuni o standard che tutti gi organismi viventi utiizzano per assembaggio dee PROTEINE sono 20 e sono codificati da codice genetico. Sono tutti α-amminoacidi possiedono un gruppo
POLITECNICO DI BARI Corso di Laurea Magistrale in Ingegneria Elettronica BIOINFORMATICA DNA COMPUTING Docente Prof. Giuseppe Mastronardi
 POLITECNICO DI BARI Corso di Laurea Magistrale in Ingegneria Elettronica BIOINFORMATICA DNA COMPUTING Docente Prof. Giuseppe Mastronardi Sommario Introduzione Cenni di biologia Modello di Adleman Modello
POLITECNICO DI BARI Corso di Laurea Magistrale in Ingegneria Elettronica BIOINFORMATICA DNA COMPUTING Docente Prof. Giuseppe Mastronardi Sommario Introduzione Cenni di biologia Modello di Adleman Modello
4x4x4=4 3 =64 codoni. 20 aminoacidi
 4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
Cap. 1 Interazioni delle molecole con l acqua
 Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
