Smistamento e riconoscimento di una generica miscela inorganica
|
|
|
- Giacinta Ferri
- 8 anni fa
- Visualizzazioni
Transcript
1 Smistamento e riconoscimento di una generica miscela inorganica Soluzione acquosa HCl+BaCl 2 AgNO 3 Saggi Specifici Solfati Carbonati, Bicarbonati, Alogenuri, Fosfati, Borace, Nitriti, Tiosolfati, Idrossidi H 2 O Miscela Precipitato HCl Precipitato Soluzione Acida H 3 BO 3, Nitrati, KClO 3 As 2 O 3 ; (BiO) 2 CO 3 ; BiONO 3 ; Bi(NO 3 ) 3 H 2 S (TAA) NH 4 Cl+NH 4 OH NH 4 OH+(NH 4 ) 2 S (NH 4 ) 2 CO 3 CaHPO 4 ; Ca 3 (PO 4 ) 2 ZnO; ZnCO 3 CaCO 3 ; CaSO 4 ; CaO BaSO 4 ; Hg 2 Cl 2 Talco; Caolino; Bentonite NH 4 Cl+NH 4 OH +Na 2 HPO 4 KOH+NaHPO 4 LiCO 3 MgO; MgCO 3
2 Saggio alla Fiamma Il saggio alla fiamma ci permette di identificare la composizione della miscela in particolare i cationi che impartiscono colorazione caratteristica. Si prelevano con una spatola piccole quantità dei sali in analisi, disponendole su un vetrino da orologio. Si versano in una provetta alcuni ml di HCl dil. Si prende il filo di platino e si provvede alla pulizia inumidendolo con l HCl e portando alla fiamma ossidante (zona di fusione) di un becco di bunsen. Tale operazione è completata quando la fiamma appare incolore. Si inumidisce nuovamente il filo di Pt con l HCl, si raccolgono sulla punta alcuni cristalli del sale in analisi e si osservano il colore ed i caratteri della fiamma così si risale all elemento incognito aiutandosi con una tabella dei colori di riferimento. L HCl ha la funzione di permettere l adesione al filo dei cristalli del sale e di trasformare lo stesso in un cloruro, sale volatile. Si ripete l esperienza con tutti i sali disponibili, avendo cura di pulire il filo di Pt accuratamente. E bene porre il filo di Pt prima nella zona bassa a della fiamma (zona ossidante meno calda ~ 300 C) di un becco bunsen. Si ha la colorazione di sali alcalini (Li+, K+, Na+) molto volatili; poi si porta il filo di Pt nella zona più alta (~ 1500 C) di fusione b e si ottengono le colorazioni di sali meno volatili, ad es. alcalino terrosi.
3 Saggio alla Fiamma Elemento Li + Na + K + Ca 2+ Ba 2+ NH + 4 H 3 BO 3 Cu Pb Colore Rosso-carminio Giallo intenso persistente Violetto Rosso arancio a sprazzi dopo ogni immersione in HCl Verde pisello persistente Violetto tenue molto volatile Verde-canarino Verde-smeraldo Grigio-azzurro pallido
4 Comportamento alla calcinazione Di seguito sono riportate le osservazioni alla calcinazione di alcune sostanze: Sostanze inorganiche: non subiscono alterazioni (Ca 3 (PO 4 ) 2 ) si alterano cambiando colore, lasciando residuo ( (BiO) 2 CO 3 ; ZnCO 3 ). sublimano senza alterarsi (cloruro di ammonio, ammonio idrogeno carbonato). Sostanze organiche: carbonizza rapidamente e con emissione di vapori facilmente infiammabili con fiamma non fuligginosa o luminosa. Non lascia residuo (glucosio). carbonizza rapidamente e con emissione di vapori facilmente infiammabili con fiamma fuligginosa o fumosa tipica di composti organici. Non lascia residuo (acido benzoico, naftalene). Sostanze metallorganiche: carbonizza lentamente e in maniera incompleta, lascia residuo (Piombo acetato viraggio a caldo). Procedimento Porre una piccola quantità di ognuna delle sostanze riportate in parentesi in esame sulla spatola in dotazione ed eseguire la prova di calcinazione su bunsen. Per quelle che lasciano residui dopo la combustione verificare il comportamento delle ceneri in acqua (residuo organico galleggia, se vi sono carbonati si deposita) e in HCl dil. (carbonati danno effervescenza, sostanze organiche no).
5 Sostanze inorganiche: determinazioni qualitative Calcio fosfato dibasico anidro CaHPO 4 (F.U. X Edizione, European Pharmacopeia 4th Edition) Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità. Identificazione A. Disciogliere 0,1 g in una miscela di 5 ml di acqua R e 5 ml di acido nitrico diluito R. La soluzione dà la reazione caratteristica (b) dei fosfati. FOSFATI. Mescolare 2 ml di molibdovanadico reattivo R con 1 ml della soluzione prescritta. Si forma una colorazione gialla. Identificazione B. Disciogliere circa 5 mg in 5 ml di CH 3 COOH R. Aggiungere 0,5 ml di potassio ferrocianuro soluzione R. La soluzione rimane limpida. Aggiungere circa 50 mg di NH 4 Cl R e lasciare a riposo per 5 min. Si forma un precipitato cristallino bianco. Nitrato di Bismuto Bi(NO 3 ) 3 (F.U. X Edizione, European Pharmacopeia 4th Edition) Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità. Identificazione A. Sciogliere 5 g di sostanza in 10 ml di H 2 O a caldo aggiungere, quindi, 20 ml di acido nitrico. Raffreddare la soluzione e porta il volume fino a 100 ml con acqua. Prelevare un aliquota pari a 5 ml ed aggiungervi 0.3 ml di KI (soluzione). Il saggio sara positivo se si forma un precipitato nero che vira all arancione per aggiunta di ulteriori 2 ml di KI. (segue)
6 Sostanze inorganiche: determinazioni qualitative Identificazione B. (determinazione Bi) Aggiungere 10 ml di HNO3 dil. R a circa 45 mg della sostanza in esame o usare 10 ml della soluzione prescritta; bollire per 1 min, lasciar raffreddare e, se necessario, filtrare. Aggiungere 2 ml di una soluzione (100 g/l) di tiourea R a 5 ml della soluzione ottenuta. Si forma una colorazione arancione-giallastra o un precipitato arancione. Aggiungere 4 ml di una soluzione (25 g/l) di sodio fluoruro R. La soluzione non si decolora nei 30 minuti successivi. Identificazione C. (determinazione NO 3 ) Aggiungere alla sostanza in esame polverizzata, in quantità equivalente a circa 1 mg di nitrato (NO 3 -) o la quantità di sostanza prescritta, ad una miscela di 0.1 ml di nitrobenzene R e 0,2 ml di H 2 SO 4 R. Lasciare a riposo per 5 minuti, raffreddare in H 2 O ghiacciata, e aggiungere lentamente, agitando, 5 ml di H 2 O R e 5 ml di NaOH soluzione conc. R. Aggiungere 5 ml di acetone. Agitare e lasciare a riposo. Lo strato superiore si colora in violetto intenso Altro saggio per i Nitrati. La soluzione acquosa viene mescolata con cautela con H 2 SO 4 conc.. (acidificazione) poi viene lasciata raffreddare. Si aggiungono lentamente, (stratificazione) lungo la provetta 0,5 ml di una soluzione di solfato ferroso: si forma un anello bruno all interfaccia di due liquidi. Zinco ossido ZnO (F.U. X edizione, European Pharmacopeia 4th Edition) Disciogliere circa 0,1 g della sostanza in esame in 5 ml di acqua R. Aggiungere 0,2 ml di sodio idrossido soluzione concentrata R. Si forma un precipitato bianco che si scioglie per aggiunta di 2 ml di sodio idrossido soluzione concentrata R. Aggiungere 10 ml di ammonio cloruro soluzione R. La soluzione resta limpida. Aggiungere 0,1 ml di sodio solfuro soluzione R. Si forma un precipitato bianco fioccoso.
7 Sostanze inorganiche: determinazioni qualitative Solfato di Bario BaSO 4 (F.U. X Edizione, European Pharmacopeia 4th Edition) Identificazione A. Bollire 0,2 g con 5 ml di una soluzione (500g/l) di sodio carbonato R per 5 minuti, aggiungere 10 ml di acqua R, filtrare e acidificare una parte del filtrato con acido cloridrico diluito R. La soluzione dà le reazioni caratteristiche dei solfati. SOLFATI (F.E. IV edizione e F.U. X e XI edizione saggio a) Disciogliere circa 45 mg della sostanza in esame in 5 ml di acqua R o usare 5 ml della soluzione prescritta. Aggiungere 1 ml di acido cloridrico diluito R e 1 ml di bario cloruro soluzione R1. Si forma un precipitato bianco. Identificazione B. Lavare il residuo raccolto dal precedente saggio con tre successive piccole quantità di acqua R. Aggiungere 5 ml di HCl dil. R a questo residuo, filtrare e aggiungere al filtrato 0,3 ml di H2SO4 dil. R. Si forma un precipitato bianco che è insolubile in NaOH soluzione diluita R
Sostanze metallo organiche: determinazioni qualitative
 Tartrato acido di Potassio (European Pharmacopoeia IV th ) Identificazione A. GENERICA (Carattere acido). Disciogliere 15 mg di sostanza in 5 ml di acqua, scaldare se necessario. Aggiungere 0,1 ml di rosso
Tartrato acido di Potassio (European Pharmacopoeia IV th ) Identificazione A. GENERICA (Carattere acido). Disciogliere 15 mg di sostanza in 5 ml di acqua, scaldare se necessario. Aggiungere 0,1 ml di rosso
LA TERRA E LA CHIMICA: LA TAVOLA PERIODICA DEGLI ELEMENTI ELEMENTI E COMPOSTI
 I.I.S. A. PACINOTTI IST. TECNICO STATALE INDUSTRIALE Antonio PACINOTTI IST. TECNICO STATALE per GEOMETRI "Giorgio MASSARI" http://www.iispacinottive.it/ Via Caneve, n. 93 30173 - Mestre (VE) tel. 041 5350355
I.I.S. A. PACINOTTI IST. TECNICO STATALE INDUSTRIALE Antonio PACINOTTI IST. TECNICO STATALE per GEOMETRI "Giorgio MASSARI" http://www.iispacinottive.it/ Via Caneve, n. 93 30173 - Mestre (VE) tel. 041 5350355
Scritto Chimica generale 13.02.2012 Gruppo A
 Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
25/02/2015. ESERCITAZIONE n 9 PROVA INCOGNITA 1. SOSTANZA ORGANICA 2. SOSTANZA ORGANOMETALLICA 3. SOSTANZA ORGANICA
 ESERCITAZIONE n 9 PROVA INCOGNITA 1. SOSTANZA ORGANICA 2. SOSTANZA ORGANOMETALLICA 3. SOSTANZA ORGANICA 1 Il riconoscimento di una sostanza iscritta nella Ph. Eur. attraverso operazioni chimiche semplici,
ESERCITAZIONE n 9 PROVA INCOGNITA 1. SOSTANZA ORGANICA 2. SOSTANZA ORGANOMETALLICA 3. SOSTANZA ORGANICA 1 Il riconoscimento di una sostanza iscritta nella Ph. Eur. attraverso operazioni chimiche semplici,
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Chimica Analitica e Complementi di Chimica Modulo di Chimica Analitica 8 Novembre 2012
 Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
2) Calcolare la molarità di una soluzione di acido solforico al 17%,d = 1.12 g/ml
 Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Analisi della FU XII Ed. SAGGIO LIMITE PER I SOLFATI
 2.4.13. SOLFATI Analisi della FU XII Ed. SAGGIO LIMITE PER I SOLFATI Tutte le soluzioni usate in questo saggio devono essere preparate con acqua distillata R. Aggiungere 3 ml di una soluzione (250 g/l)
2.4.13. SOLFATI Analisi della FU XII Ed. SAGGIO LIMITE PER I SOLFATI Tutte le soluzioni usate in questo saggio devono essere preparate con acqua distillata R. Aggiungere 3 ml di una soluzione (250 g/l)
LA CHIMICA DEGLI ALIMENTI
 Sommario LA CHIMICA DEGLI ALIMENTI LA CHIMICA DEGLI ALIMENTI... 1 RICERCA DELLA VITAMINA C... 2 Metodo Qualitativo... 2 Metodo Quantitativo... 2 RICERCA DEGLI ZUCCHERI... 5 Metodo Qualitativo... 5 Metodo
Sommario LA CHIMICA DEGLI ALIMENTI LA CHIMICA DEGLI ALIMENTI... 1 RICERCA DELLA VITAMINA C... 2 Metodo Qualitativo... 2 Metodo Quantitativo... 2 RICERCA DEGLI ZUCCHERI... 5 Metodo Qualitativo... 5 Metodo
R i c o n o s c i m e n t o d e i g r u p p i f u n z i o n a l i attraverso r e a z i o n i s p e c i f i c h e
 R i c o n o s c i m e n t o d e i g r u p p i f u n z i o n a l i attraverso r e a z i o n i s p e c i f i c h e Considerazioni preliminari: 1) Sono saggi qualitativi in cui la positività del saggio viene
R i c o n o s c i m e n t o d e i g r u p p i f u n z i o n a l i attraverso r e a z i o n i s p e c i f i c h e Considerazioni preliminari: 1) Sono saggi qualitativi in cui la positività del saggio viene
DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Intervallo di viraggio ph
 CLASSE 2 A ocb 22/11/2009 1 DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Principi Teorici: gli indicatori acido-base sono sostanze organiche complesse, che si comportano
CLASSE 2 A ocb 22/11/2009 1 DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Principi Teorici: gli indicatori acido-base sono sostanze organiche complesse, che si comportano
Cod. EM6U4. Prove di stabilità dei Vini
 Cod. EM6U4 Prove di stabilità dei Vini Test di tenuta all aria Operazione: Prelevare 1 bicchiere di vino da testare; lasciare all aria per 12 24 ore; Vino limpido, quasi invariato, senza depositi; giudizio:
Cod. EM6U4 Prove di stabilità dei Vini Test di tenuta all aria Operazione: Prelevare 1 bicchiere di vino da testare; lasciare all aria per 12 24 ore; Vino limpido, quasi invariato, senza depositi; giudizio:
PRIMA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida e Via Secca) Ricerca dei Cationi Calcio, Magnesio,
PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida e Via Secca) Ricerca dei Cationi Calcio, Magnesio,
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni
 Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE
 DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE L esperienza consiste nel misurare il grado di acidità di un aceto, acquistando i concetti di titolazione acido-base, punto di equivalenza, indicatore
DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE L esperienza consiste nel misurare il grado di acidità di un aceto, acquistando i concetti di titolazione acido-base, punto di equivalenza, indicatore
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
REAZIONI ESOTERMICHE ED ENDOTERMICHE
 REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
ULTERIORI SAGGI PER VIA SECCA RICERCA FUNZIONE CARBOSSILICA RICERCA DEGLI AMMINOACIDI
 ULTERIORI SAGGI PER VIA SECCA RICERCA FUNZIONE CARBOSSILICA RICERCA DEGLI AMMINOACIDI IMPORTANTI ACIDI DI USO COMUNE ALCUNI IMPORTANTI ESTERI ALCUNI IMPORTANTI ESTERI Riconoscimento del Fosforo
ULTERIORI SAGGI PER VIA SECCA RICERCA FUNZIONE CARBOSSILICA RICERCA DEGLI AMMINOACIDI IMPORTANTI ACIDI DI USO COMUNE ALCUNI IMPORTANTI ESTERI ALCUNI IMPORTANTI ESTERI Riconoscimento del Fosforo
Sostanze inorganiche: determinazioni qualitative
 Carbonati e Bicarbonati Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità e il ph. Sodio carbonato anidro Na 2 CO 3 (F.U. X Edizione, European Pharmacopeia
Carbonati e Bicarbonati Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità e il ph. Sodio carbonato anidro Na 2 CO 3 (F.U. X Edizione, European Pharmacopeia
SOLUZIONI, DILUIZIONI, TITOLAZIONI
 SOLUZIONI, DILUIZIONI, TITOLAZIONI 1. Quanti ml di NaOH 1,25 N debbono essere aggiunti ad 1 litro di NaOH 0,63 N per ottenere una soluzione 0,85 N? [550 ml] 2. Quali volumi 0,55 N e 0,098 N debbono essere
SOLUZIONI, DILUIZIONI, TITOLAZIONI 1. Quanti ml di NaOH 1,25 N debbono essere aggiunti ad 1 litro di NaOH 0,63 N per ottenere una soluzione 0,85 N? [550 ml] 2. Quali volumi 0,55 N e 0,098 N debbono essere
Esercizi di Chimica (2 a prova in itinere)
 Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
LA CHIMICA IN LABORATORIO: PROPOSTA PER UNA ESERCITAZIONE
 LA CHIMICA IN LABORATORIO: PROPOSTA PER UNA ESERCITAZIONE G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 10/1994 L Autore illustra un metodo di analisi qualitativa sperimentato in un Istituto
LA CHIMICA IN LABORATORIO: PROPOSTA PER UNA ESERCITAZIONE G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 10/1994 L Autore illustra un metodo di analisi qualitativa sperimentato in un Istituto
Pb Pb 2+ + 2e 2Ag + + 2e 2Ag
 ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085]
![) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085] ) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085]](/thumbs/26/9134725.jpg) Chimica Analitica Prova scritta del 19 Gennaio 2004 1) 375 ml di soluzione acquosa contengono 21.2 µg di un principio attivo. Esprimere la concentrazione della soluzione in parti per milione (ppm) [0.056
Chimica Analitica Prova scritta del 19 Gennaio 2004 1) 375 ml di soluzione acquosa contengono 21.2 µg di un principio attivo. Esprimere la concentrazione della soluzione in parti per milione (ppm) [0.056
TECNOLOGIE CHIMICHE INDUSTRIALI, PRINCIPI DI AUTOMAZIONE E DI ORGANIZZAZIONE INDUSTRIALE
 PROGRAMMAZIONE DI LABORATORIO DI: TECNOLOGIE CHIMICHE INDUSTRIALI, PRINCIPI DI AUTOMAZIONE E DI ORGANIZZAZIONE INDUSTRIALE allegato 1 Prove meccaniche presso il laboratorio di edilizia Esperienza: Determinazione
PROGRAMMAZIONE DI LABORATORIO DI: TECNOLOGIE CHIMICHE INDUSTRIALI, PRINCIPI DI AUTOMAZIONE E DI ORGANIZZAZIONE INDUSTRIALE allegato 1 Prove meccaniche presso il laboratorio di edilizia Esperienza: Determinazione
DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE
 DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE L esperienza consiste nel misurare il grado di acidità di un aceto, acquistando i concetti di titolazione acido-base, punto di equivalenza, indicatore
DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE L esperienza consiste nel misurare il grado di acidità di un aceto, acquistando i concetti di titolazione acido-base, punto di equivalenza, indicatore
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
PRIMA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida) Ricerca dei Cationi Calcio, magnesio Ricerca degli
PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida) Ricerca dei Cationi Calcio, magnesio Ricerca degli
ISTITUTO TECNICO AGRARIO Carlo Gallini
 DETERMINAZIONE DEL FOSDORO ASSIMILABILE COME P2O5 METODO OLSEN PRINCIPIO Il fosforo viene estratto con una soluzione di NaHCO 3 0.5 N (ph 8.5). Sull estratto il fosforo viene dosato per via spettrofotometrica
DETERMINAZIONE DEL FOSDORO ASSIMILABILE COME P2O5 METODO OLSEN PRINCIPIO Il fosforo viene estratto con una soluzione di NaHCO 3 0.5 N (ph 8.5). Sull estratto il fosforo viene dosato per via spettrofotometrica
POLARITÀ DELLE SOSTANZE
 POLARITÀ DELLE SOSTANZE I liquidi si distinguono in polari e non polari. Obiettivo dell esperimento è controllare la polarità dei liquidi mediante bacchette caricate positivamente o negativamente. H2O
POLARITÀ DELLE SOSTANZE I liquidi si distinguono in polari e non polari. Obiettivo dell esperimento è controllare la polarità dei liquidi mediante bacchette caricate positivamente o negativamente. H2O
GAIALAB:INCONTRIAMO L AMBIENTE IN LABORATORIO
 LABORATORIO DI CHIMICA Le magie della chimica: l acqua scioglie e le sostanze reagiscono Il lavoro che vi proponiamo è una breve presentazione di alcune reazioni chimiche alcune di queste anche spettacolari
LABORATORIO DI CHIMICA Le magie della chimica: l acqua scioglie e le sostanze reagiscono Il lavoro che vi proponiamo è una breve presentazione di alcune reazioni chimiche alcune di queste anche spettacolari
Globeseren@: rete di scuole per un futuro sostenibile
 Globeseren@: rete di scuole per un futuro sostenibile 1 passo:inquadriamo l argomento: ma cos è la terra? Definizione e caratteristiche del suolo Il suolo è lo strato più superficiale della crosta terrestre
Globeseren@: rete di scuole per un futuro sostenibile 1 passo:inquadriamo l argomento: ma cos è la terra? Definizione e caratteristiche del suolo Il suolo è lo strato più superficiale della crosta terrestre
ANALISI CHIMICO FARMACEUTICA I
 Prof. Gianluca Sbardella : 089 962650 : gsbardella@unisa.it NORME GENERALI SUL COMPORTAMENTO IN LABORATORIO Ordine e concentrazione Conoscenza del procedimento analitico Uso corretto dell attrezzatura
Prof. Gianluca Sbardella : 089 962650 : gsbardella@unisa.it NORME GENERALI SUL COMPORTAMENTO IN LABORATORIO Ordine e concentrazione Conoscenza del procedimento analitico Uso corretto dell attrezzatura
RICERCA DEI CATIONI NELLE SOSTANZE INORGANICHE O ORGANO-METALLICHE RICERCA DEGLI ANIONI NEI SALI DI AMMINE O DI AMMONIO QUATERNARIO
 RICERCA DEI CATIONI NELLE SOSTANZE INORGANICHE O ORGANO-METALLICHE RICERCA DEGLI ANIONI NEI SALI DI AMMINE O DI AMMONIO QUATERNARIO Prof. Antonio Lavecchia Ricerca dei Cationi nelle Sostanze Inorganiche
RICERCA DEI CATIONI NELLE SOSTANZE INORGANICHE O ORGANO-METALLICHE RICERCA DEGLI ANIONI NEI SALI DI AMMINE O DI AMMONIO QUATERNARIO Prof. Antonio Lavecchia Ricerca dei Cationi nelle Sostanze Inorganiche
1 a e 2 esperienza di laboratorio: SEPARAZIONE DI UNA MISCELA A TRE COMPONENTI PER ESTRAZIONE
 1 a e 2 esperienza di laboratorio: SEPARAZIONE DI UNA MISCELA A TRE COMPONENTI PER ESTRAZIONE 2014/2015 1 Prima di iniziare ESTRAZIONE: Tecnica utilizzata per separare il prodotto organico desiderato da
1 a e 2 esperienza di laboratorio: SEPARAZIONE DI UNA MISCELA A TRE COMPONENTI PER ESTRAZIONE 2014/2015 1 Prima di iniziare ESTRAZIONE: Tecnica utilizzata per separare il prodotto organico desiderato da
ANALISI SISTEMATICA DEI CATIONI
 ANALISI SISTEMATICA DEI CATIONI Particolare procedura analitica attraverso la quale tutte le specie cationiche presenti in una ipotetica miscela vengono inizialmente separate in gruppi, mediante l uso
ANALISI SISTEMATICA DEI CATIONI Particolare procedura analitica attraverso la quale tutte le specie cationiche presenti in una ipotetica miscela vengono inizialmente separate in gruppi, mediante l uso
ESAME DI ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO + LABORATORIO DI ANALISI QUALITATIVA. Nome e cognome: Numero di matricola:..
 ESAME DI ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO + LABORATORIO DI ANALISI QUALITATIVA Nome e cognome: Numero di matricola:.. 1) Indicare, motivando la risposta, il ph di una soluzione
ESAME DI ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO + LABORATORIO DI ANALISI QUALITATIVA Nome e cognome: Numero di matricola:.. 1) Indicare, motivando la risposta, il ph di una soluzione
Esercizi sul calcolo del ph. Generalità introduttive. 2. Spiega il significato del termine «acido coniugato» e «base coniugata».
 Esercizi sul calcolo del ph Generalità introduttive 1. L'ammoniaca :NH 3 non possiede alcun ruppo ossidrilico. Come puoi spieare il suo comportamento basico? 2. Spiea il sinificato del termine «acido coniuato»
Esercizi sul calcolo del ph Generalità introduttive 1. L'ammoniaca :NH 3 non possiede alcun ruppo ossidrilico. Come puoi spieare il suo comportamento basico? 2. Spiea il sinificato del termine «acido coniuato»
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Prova in itinere di Chimica Generale 1 Giugno 2011
 Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
Metodo IV.1. Determinazione dell azoto ammoniacale
 METODI IV METODI DI DETERMINAZIONE DELL AZOTO Metodo IV.1 Determinazione dell azoto ammoniacale 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare l azoto ammoniacale. 2.
METODI IV METODI DI DETERMINAZIONE DELL AZOTO Metodo IV.1 Determinazione dell azoto ammoniacale 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare l azoto ammoniacale. 2.
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Esperienza A: idrofilicità e idrofobicità
 Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE
 SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE 1 STADIO Identificazione e definizione delle soluzioni Obiettivo : il bambino, attraverso un approccio fenomenologico, impara il concetto di SOLUZIONE
SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE 1 STADIO Identificazione e definizione delle soluzioni Obiettivo : il bambino, attraverso un approccio fenomenologico, impara il concetto di SOLUZIONE
Correttivi. 1.1. Classificazione granulometrica: per i correttivi calcio-solfo-magnesiaci è adottata la seguente classificazione granulometrica.
 ALLEGATO 3 (previsto dall articolo 1, comma 1, lettera b) Correttivi 1. PREMESSA 1.1. : per i correttivi calcio-solfo-magnesiaci è adottata la seguente classificazione. 1.1.1. Prodotto polverulento: almeno
ALLEGATO 3 (previsto dall articolo 1, comma 1, lettera b) Correttivi 1. PREMESSA 1.1. : per i correttivi calcio-solfo-magnesiaci è adottata la seguente classificazione. 1.1.1. Prodotto polverulento: almeno
Il sudore è un liquido che viene escreto dalle. Il processo di secrezione del sudore è chiamato sudorazione.
 UN DEODORANTE CORPOREO DR. ROBERTO FINESI IL SUDORE Il sudore è un liquido che viene escreto dalle ghiandole sudoripare della pelle. Il processo di secrezione del sudore è chiamato sudorazione. Le ghiandole
UN DEODORANTE CORPOREO DR. ROBERTO FINESI IL SUDORE Il sudore è un liquido che viene escreto dalle ghiandole sudoripare della pelle. Il processo di secrezione del sudore è chiamato sudorazione. Le ghiandole
Conducibilità (IRSA 2030)
 Conducibilità (IRSA 2030) Principio Si definisce conducibilità elettrica (o conduttanza) di un mezzo omogeneo il reciproco della sua resistenza (espressa in ohm). Per conducibilità elettrica specifica
Conducibilità (IRSA 2030) Principio Si definisce conducibilità elettrica (o conduttanza) di un mezzo omogeneo il reciproco della sua resistenza (espressa in ohm). Per conducibilità elettrica specifica
Metodo III.1. Determinazione dell umidità. 1. Determinazione dell umidità nei fertilizzanti che non contengono sostanze volatili diverse dall acqua
 METODI III METODI DI DETERMINAZIONE DELL UMIDITA, GRANULOMETRIA, ph e SALINITA Metodo III.1 Determinazione dell umidità 1. Determinazione dell umidità nei fertilizzanti che non contengono sostanze volatili
METODI III METODI DI DETERMINAZIONE DELL UMIDITA, GRANULOMETRIA, ph e SALINITA Metodo III.1 Determinazione dell umidità 1. Determinazione dell umidità nei fertilizzanti che non contengono sostanze volatili
ACIDI E BASI IN CASA. Scheda studente n.1
 Scheda studente n.1 Come interagisce ciascun liquido con la polvere di marmo? Seguite le istruzioni, osservate con attenzione ciò che accade e completate la tabella. polvere di marmo e le seguenti sostanze:
Scheda studente n.1 Come interagisce ciascun liquido con la polvere di marmo? Seguite le istruzioni, osservate con attenzione ciò che accade e completate la tabella. polvere di marmo e le seguenti sostanze:
CONCENTRAZIONE DELLE SOLUZIONI. Solvente: normalmente liquido in eccesso Soluto: gas, liquido o solido, normalmente in difetto
 CONCENTRAZIONE DELLE SOLUZIONI Solvente: normalmente liquido in eccesso Soluto: gas, liquido o solido, normalmente in difetto Percentuale in peso = g soluto / g soluzione x 100 H 2 O 2 al 3% Percentuale
CONCENTRAZIONE DELLE SOLUZIONI Solvente: normalmente liquido in eccesso Soluto: gas, liquido o solido, normalmente in difetto Percentuale in peso = g soluto / g soluzione x 100 H 2 O 2 al 3% Percentuale
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
A) Preparazione di una soluzione di NaOH 0.05 M
 UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Preparazione e standardizzazione di una soluzione di Esercitazione n
UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Preparazione e standardizzazione di una soluzione di Esercitazione n
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
DISTILLAZIONE e ANALISI MERCEOLOGICHE
 DISTILLAZIONE e ANALISI MERCEOLOGICHE ANNA M. DI MARIA Determinazione del grado alcolico del vino (distillazione semplice) pallone di ebollizione da 250 ml tubo adduttore con bolla di sicurezza refrigerante
DISTILLAZIONE e ANALISI MERCEOLOGICHE ANNA M. DI MARIA Determinazione del grado alcolico del vino (distillazione semplice) pallone di ebollizione da 250 ml tubo adduttore con bolla di sicurezza refrigerante
SOSTANZE INORGANICHE
 SOSTANZE INORGANICHE Na2B4O7 Na2HPO4 H3BO3 La soluzione acquosa, trattata con AgNO3 dà un precipitato solubile in HNO3 conc. Indicazioni Generali La sol. acq. si tratta a freddo con alcune gocce di AgNO3.
SOSTANZE INORGANICHE Na2B4O7 Na2HPO4 H3BO3 La soluzione acquosa, trattata con AgNO3 dà un precipitato solubile in HNO3 conc. Indicazioni Generali La sol. acq. si tratta a freddo con alcune gocce di AgNO3.
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari.
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
Fe(OH) 3. Mn(OH) 2. bianco. MnO 2 2H 2 O
 III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
Progetto lauree scientifiche 2015. da una tazzina di caffè. Pavia 1-11 settembre 2015. di Riccardo Scarabello e Damiano Duminuco
 Progetto lauree scientifiche 2015 da una tazzina di caffè di Riccardo Scarabello e Damiano Duminuco Pavia 1-11 settembre 2015 le nostre esperienze Estrazione della caffeina Estrazione dell olio dal caffè:
Progetto lauree scientifiche 2015 da una tazzina di caffè di Riccardo Scarabello e Damiano Duminuco Pavia 1-11 settembre 2015 le nostre esperienze Estrazione della caffeina Estrazione dell olio dal caffè:
primi passi nella chimica
 IS science centre immaginario scientifico Laboratorio dell'immaginario Scientifico - Trieste tel. 040224424 - fax 040224439 - e-mail: lis@lis.trieste.it - www.immaginarioscientifico.it indice Parole simpatiche
IS science centre immaginario scientifico Laboratorio dell'immaginario Scientifico - Trieste tel. 040224424 - fax 040224439 - e-mail: lis@lis.trieste.it - www.immaginarioscientifico.it indice Parole simpatiche
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z)
 Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
SEMPLICEMENTE ACQUA. Museo Scienze Naturali Bergamo
 SEMPLICEMENTE ACQUA Museo Scienze Naturali Bergamo L ACIDITA Prendete i contenitori riempiti con varie sostanze di uso comune e provate a metterli in fila a partire dalla sostanza secondo voi più acida
SEMPLICEMENTE ACQUA Museo Scienze Naturali Bergamo L ACIDITA Prendete i contenitori riempiti con varie sostanze di uso comune e provate a metterli in fila a partire dalla sostanza secondo voi più acida
Procedure di manutenzione
 Mercato: Oggetto: Mezzi di trasporto Procedure di manutenzione 1 Pavimenti in gomma ARTIGO Dopo la posa, proteggere sempre il pavimento con fogli di cartone o polietilene per evitare possibili danni dovuti
Mercato: Oggetto: Mezzi di trasporto Procedure di manutenzione 1 Pavimenti in gomma ARTIGO Dopo la posa, proteggere sempre il pavimento con fogli di cartone o polietilene per evitare possibili danni dovuti
PROVA STRUTTURATA DI CHIMICA ORGANICA
 1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
Esperimenti Informazioni per il PD
 Informazioni per il PD 1/7 Compito Gli alunni conducono degli esperimenti con il sale avendo così la possibilità di studiarlo in quanto composto chimico. Grazie ai vari esperimenti imparano anche quali
Informazioni per il PD 1/7 Compito Gli alunni conducono degli esperimenti con il sale avendo così la possibilità di studiarlo in quanto composto chimico. Grazie ai vari esperimenti imparano anche quali
LEZIONE 12. Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA. Scaricato da Sunhope.it
 LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
Progetto L età di Leonardo per i curricoli del biennio unitari finalizzati all innalzamento dell istruzione a 16 anni dall a.s.
 Progetto L età di Leonardo per i curricoli del biennio unitari finalizzati all innalzamento dell istruzione a 16 anni dall a.s. 2007/08 [Eleonora Aquilini] Le sostanze basiche Preparate una soluzione di
Progetto L età di Leonardo per i curricoli del biennio unitari finalizzati all innalzamento dell istruzione a 16 anni dall a.s. 2007/08 [Eleonora Aquilini] Le sostanze basiche Preparate una soluzione di
SAGGI PER VIA SECCA. Fiamma Ossidante. Fiamma Riducente C C
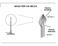 SAGGI PER VIA SECCA Fiamma Ossidante 1350-1500 C Fiamma Riducente 400-500 C Ricerca dei Cationi per Via Secca Gli elementi metallici presenti nei composti organometallici della F.U. sono: Sodio, Potassio,
SAGGI PER VIA SECCA Fiamma Ossidante 1350-1500 C Fiamma Riducente 400-500 C Ricerca dei Cationi per Via Secca Gli elementi metallici presenti nei composti organometallici della F.U. sono: Sodio, Potassio,
Sommario Processo negativo-positivo... 2 Processo diapositivo... 7 Trattamenti a colori - 1/13
 TRATTAMENTI A COLORI Sommario Processo negativo-positivo... 2 Processo diapositivo... 7 Trattamenti a colori - 1/13 Processo negativo-positivo Negativo (trattamento C-41) Originale: 1. Esposizione pellicola
TRATTAMENTI A COLORI Sommario Processo negativo-positivo... 2 Processo diapositivo... 7 Trattamenti a colori - 1/13 Processo negativo-positivo Negativo (trattamento C-41) Originale: 1. Esposizione pellicola
Piano Lauree Scientifiche 2010 2012 Area Chimica Università di Bologna Facoltà di Chimica Industriale. Laboratori didattici dei Corsi di Laurea
 Chimica Industriale Bologna Faenza Rimini BOLOGNA La Chimica nella vita di tutti i giorni è scienza per il futuro Dr. ELENA STROCCHI elena.strocchi@unibo.it Tel. 051 2093645 FAENZA La Chimica e i Materiali:
Chimica Industriale Bologna Faenza Rimini BOLOGNA La Chimica nella vita di tutti i giorni è scienza per il futuro Dr. ELENA STROCCHI elena.strocchi@unibo.it Tel. 051 2093645 FAENZA La Chimica e i Materiali:
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
UNIVERSITA' DEGLI STUDI DI ROMA "LA SAPIENZA"
 Separazione per estrazione semplice Una miscela di 3 composti (acido carbossilico, fenolo, sostanza neutra, 3-4 g), in 100 ml di etere etilico viene estratta (imbuto separatore da 250 ml) 3 volte con 50
Separazione per estrazione semplice Una miscela di 3 composti (acido carbossilico, fenolo, sostanza neutra, 3-4 g), in 100 ml di etere etilico viene estratta (imbuto separatore da 250 ml) 3 volte con 50
Analisi delle acque dell isola di Favignana
 Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
Esercitazione 8. Gli equilibri acido-base: Ka, Kb. L autoprotolisi dell acqua. Misura del ph Soluzioni tampone 1,0 10-14
 Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO
 IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 4/1995 Gli insegnanti di chimica, durante l esposizione dei concetti fondamentali di acidità
IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 4/1995 Gli insegnanti di chimica, durante l esposizione dei concetti fondamentali di acidità
LA FRAZIONE SOLIDA INORGANICA
 LA FRAZIONE SOLIDA INORGANICA ROCCE MINERALI Classe Alogenuri Solfati Solfuri Ossidi ed idrossidi (Al, Fe, Mn, Ti) Carbonati Nitrati Fosfati Silicati (fillosilicati) Minerale Cloruro di sodio Gesso Pirite
LA FRAZIONE SOLIDA INORGANICA ROCCE MINERALI Classe Alogenuri Solfati Solfuri Ossidi ed idrossidi (Al, Fe, Mn, Ti) Carbonati Nitrati Fosfati Silicati (fillosilicati) Minerale Cloruro di sodio Gesso Pirite
Fe(OH) 3. Mn(OH) 2 2H 2 O
 III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
Samuele Di Rita - Classe 2 B sa - 16/03/2015 - Gruppo 5: Di Rita, Dal Maso
 Samuele Di Rita - Classe 2 B sa - 16/03/2015 - Gruppo 5: Di Rita, Dal Maso SAGGI ANALITICI SU ALIMENTI CONTENENTI CARBOIDRATI OBIETTIVI Fase 1: Dimostrare, mediante l uso del distillato di Fehling, se
Samuele Di Rita - Classe 2 B sa - 16/03/2015 - Gruppo 5: Di Rita, Dal Maso SAGGI ANALITICI SU ALIMENTI CONTENENTI CARBOIDRATI OBIETTIVI Fase 1: Dimostrare, mediante l uso del distillato di Fehling, se
II Gruppo: CH 3 - C + H 2 O CH 3 - C + H 2 S CH 3 - C + NH 4 OH TAA
 II Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili nell intervallo di ph = 0 2 per HCl (esclusi quelli del I Gruppo). Il reattivo precipitante è la solfuro d ammonio
II Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili nell intervallo di ph = 0 2 per HCl (esclusi quelli del I Gruppo). Il reattivo precipitante è la solfuro d ammonio
MICROELEMENTI CON TITOLO INFERIORE OD UGUALE AL 10% Metodo IX.1. Estrazione dei microelementi totali
 METODI IX METODI DI DETERMINAZIONE DEI MICROELEMENTI E DEI METALLI PESANTI MICROELEMENTI CON TITOLO INFERIORE OD UGUALE AL 10% Metodo IX.1 Estrazione dei microelementi totali 1. Oggetto Il presente documento
METODI IX METODI DI DETERMINAZIONE DEI MICROELEMENTI E DEI METALLI PESANTI MICROELEMENTI CON TITOLO INFERIORE OD UGUALE AL 10% Metodo IX.1 Estrazione dei microelementi totali 1. Oggetto Il presente documento
= 9,3 10-5 M = 1,05 10-5 M
 - Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
- Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE
 REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE OSSIDORIDUTTIVA SECONDO IL METODO DELLO IONE-ELETTRIONE. 1) Si individuano le coppie di atomi il cui numero di ossidazione cambia
REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE OSSIDORIDUTTIVA SECONDO IL METODO DELLO IONE-ELETTRIONE. 1) Si individuano le coppie di atomi il cui numero di ossidazione cambia
P ARAMETRI FISICI, CHIMICI E CHIMICO-FISICI
 2020. Colore Il colore di un acqua è dovuto alla presenza di ioni metallici (ferro, manganese, rame), sostanze organiche (acidi umici e fulvici) e scarichi industriali. Il colore di un acqua si riferisce
2020. Colore Il colore di un acqua è dovuto alla presenza di ioni metallici (ferro, manganese, rame), sostanze organiche (acidi umici e fulvici) e scarichi industriali. Il colore di un acqua si riferisce
Esame del corso di ANALISI DEI Farmaci 1, Laurea Specialistica in CTF Camerino, 4 Giugno 2004
 Esame del corso di AALISI DEI Farmaci 1, Laurea Specialistica in CTF Camerino, 4 Giugno 2004 1) Una bottiglia di HCl ha sull'etichetta i seguenti dati: d = 1,185; percentuale HCl 36,5% (p/p). Calcolare:
Esame del corso di AALISI DEI Farmaci 1, Laurea Specialistica in CTF Camerino, 4 Giugno 2004 1) Una bottiglia di HCl ha sull'etichetta i seguenti dati: d = 1,185; percentuale HCl 36,5% (p/p). Calcolare:
ELETTROCHIMICA. Uso di reazioni chimiche per produrre corrente elettrica (Pile)
 ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Sommario Finalità... 2 Viraggi ai solfuri... 2 Viraggi all'oro... 4 Viraggi ai ferrocianuri... 5 Viraggi - 1/6
 VIRAGGI Sommario Finalità... 2 Viraggi ai solfuri... 2 Viraggi all'oro... 4 Viraggi ai ferrocianuri... 5 Viraggi - 1/6 Finalità Il viraggio è un trattamento per sostituire, in tutto o in parte, l'argento
VIRAGGI Sommario Finalità... 2 Viraggi ai solfuri... 2 Viraggi all'oro... 4 Viraggi ai ferrocianuri... 5 Viraggi - 1/6 Finalità Il viraggio è un trattamento per sostituire, in tutto o in parte, l'argento
Analisi di Controllo di un Acqua Minerale Naturale
 Analisi di Controllo di un Acqua Minerale aturale ITODUZIOE Le acque potabili possono essere in diverse tipologie: si definiscono acque destinate al consumo umano, quelle acque rese potabili dopo aver
Analisi di Controllo di un Acqua Minerale aturale ITODUZIOE Le acque potabili possono essere in diverse tipologie: si definiscono acque destinate al consumo umano, quelle acque rese potabili dopo aver
TITOLAZIONI ACIDO-BASE.
 TITOLAZIONI ACIDO-BASE. La titolazione è una operazione di laboratorio che permette di determinare la concentrazione incognita (o titolo, da cui titolazione) di una specie chimica (chiamata analita) in
TITOLAZIONI ACIDO-BASE. La titolazione è una operazione di laboratorio che permette di determinare la concentrazione incognita (o titolo, da cui titolazione) di una specie chimica (chiamata analita) in
P ARAMETRI FISICI, CHIMICI E CHIMICO-FISICI
 2030. Conducibilità Si definisce conducibilità elettrica (o conduttanza) di un mezzo omogeneo il reciproco della sua resistenza (espressa in ohm). Per conducibilità elettrica specifica (o conduttività)
2030. Conducibilità Si definisce conducibilità elettrica (o conduttanza) di un mezzo omogeneo il reciproco della sua resistenza (espressa in ohm). Per conducibilità elettrica specifica (o conduttività)
Materiale Occorrente:
 Materiale Occorrente: una provetta, una molletta per supporta, un fornellino a gas, una cartina di indicatore universale, albume d'uovo, Idrossido di sodio Na(OH) Procedimento: aggiunge nella provetta
Materiale Occorrente: una provetta, una molletta per supporta, un fornellino a gas, una cartina di indicatore universale, albume d'uovo, Idrossido di sodio Na(OH) Procedimento: aggiunge nella provetta
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
2H 2 H H 3 E H H 2 E 2 E 2 H HE 3. tale acido può originare 4 diversi sali. Ad esempio, nel caso dello ione sodio ( Na ) i sali possono essere NaH 3
 DETERMINAZIONE COMPLESSOMETRICA DELLA DUREZZA DI UN'ACQUA. I complessi. I cationi metallici sono specie chimiche assimilabili ad atomi che hanno perso 1 o più elettroni acquistando nel contempo carica
DETERMINAZIONE COMPLESSOMETRICA DELLA DUREZZA DI UN'ACQUA. I complessi. I cationi metallici sono specie chimiche assimilabili ad atomi che hanno perso 1 o più elettroni acquistando nel contempo carica
