REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE
|
|
|
- Laura Olivia Pagano
- 8 anni fa
- Visualizzazioni
Transcript
1 REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE OSSIDORIDUTTIVA SECONDO IL METODO DELLO IONE-ELETTRIONE. 1) Si individuano le coppie di atomi il cui numero di ossidazione cambia nel corso della reazione. Gli atomi il cui numero di ossidazione cambia nelle reazioni a, b e c di seguito riportate vengono messi in evidenza dalla scrittura in grassetto. a) MnO 2 + HCl MnCl 2 + Cl 2 + H 2 O b) KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + O 2 + K 2 SO 4 + H 2 O c) K 2 Cr 2 O 7 + H 2 S + H 2 SO 4 Cr 2 (SO 4 ) 3 + S 8 + K 2 SO 4 + H 2 O 2) Si scrive lo scheletro delle semi reazioni di ossidazione e di riduzione. E' importante, a questo stadio del bilanciamento, scrivere nelle semireazioni di riduzione e di ossidazione, la formula completa di ciascuna delle specie il cui numero di ossidazione cambia tenendo eventualmente conto anche delle regole di dissociazione e di solubilità. Per esempio, lo scheletro delle semireazioni Red/Ox per le reazioni a, b e c è: a) Riduzione MnO 2 Mn 2+ Ossidazione Cl - Cl 2 Le regole di solubilità suggeriscono che MnO 2 (ossido metallico) è solido; quelle di dissociazione indicano l'acido cloridrico ed il cloruro di manganese(ii) come elettroliti forti completamente dissociati, mentre il cloro elementare, prodotto per ossidazione di Cl -, è costituito da molecole indissociate. b) Riduzione MnO 4 - Mn 2+ Ossidazione H 2 O 2 O 2 Nella semireazione di riduzione non si scrive Mn 7+ ma MnO 4 - poiché quest'ultima è la reale forma chimica nella quale si presenta il manganese con numero di ossidazione +7 in soluzione acquosa; nella reazione di ossidazione si scrive H 2 O 2 e O 2 (sulla base delle regole di dissociazione). c) Riduzione: Cr 2 O = 7 Cr 3+ Ossidazione H 2 S S 8 Anche in questo caso, come specie ossidata contenente cromo con numero di ossidazione +6, si scrive Cr 2 O = 7 e non Cr 6+, né tanto meno Cr E' importante far notare che le regole di dissociazione salina stabiliscono che Cr 2 (SO 4 ) 3 è dissociato secondo la reazione Cr 2 (SO 4 ) 3 2Cr 3+ + SO4 = per cui la specie ridotta contenente cromo con numero di ossidazione +3 è Cr 3+. Non essendo H 2 S acido forte si dovrà inoltre scrivere nella semireazione di ossidazione H 2 S ( e non S = ) per la specie ridotta contenente zolfo. Essendo inoltre lo zolfo che appare tra i prodotti di reazione scritto come zolfo molecolare ( S 8 ), quella sarà la forma che deve apparire come specie ossidata di S nella semireazione di ossidazione. 3) Si bilanciano le due semi reazioni per tutti gli atomi diversi da O e H. a) Riduzione MnO 2 Mn 2+ Ossdazione 2Cl - Cl 2 b) Riduzione MnO - 4 Mn 2+ Ossidazione H 2 O 2 O 2 c) Riduzione: Cr 2 O = 7 2Cr 3+ Ossidazione 8H 2 S S 8 Qui si bilancia la zolfo, non l'idrogeno. 4) Si bilanciano gli atomi di O aggiungendo H 2 O ( con opportuno coefficiente) dalla parte della semireazione carente di O. a) Rid.: MnO 2 Mn H 2 O Oss.: 2Cl - Cl 2 b) Rid.: MnO - 4 Mn H 2 O Ossidazione H 2 O 2 O 2 c) Rid.: Cr 2 O = 7 2Cr H 2 O. Oss.: 8H 2 S S 8.
2 5) Si bilanciano gli atomi di H aggiungendo H + ( con opportuno coefficiente) dalla parte della semireazione carente di H. a) Rid.: MnO 2 + 4H + Mn H 2 O Oss.: 2Cl - Cl 2 b) Rid.: MnO H + Mn H 2 O Oss.: H 2 O 2 O 2 + 2H + c) Rid.: Cr 2 O = H + 2Cr H 2 O. Oss.: 8H 2 S S H + 6) Si bilanciano le due semireazioni dal punto di vista della legge della conservazione della carica aggiungendo e - (elettroni) fino ad ottenere la stessa carica totale in entrambi i lati delle semireazioni. a) Rid.: MnO 2 + 4H + + 2e - Mn H 2 O A sx.:+2 [+4( H + ) - 2( e - )]; a dx. +2 (Mn 2+ ) Oss.: 2Cl - Cl 2 + 2e - A sx.:-2(cl - ); a dx. -2 ( e - ) b) Rid.: MnO H + + 5e - Mn H 2 O A sx.:+2 [+8(H + )-5(e - )-1(MnO - 4 )]; a dx.: +2 (Mn 2+ ) Oss.: H 2 O 2 O 2 + 2H + + 2e - A sx.: 0; a dx.: 0 [+2(H + ) - 2(e - )]. c) Rid.: Cr 2 O = H + + 6e - 2Cr H 2 O A sx.:+6 [+14(H + )-6(e - )-2(Cr 2 O = 7 )]; a dx +6 (di due Cr 3+ ) Oss.: 8H 2 S S H e - A sx.: 0; a dx. 0 [+16 (H + ) - 16 (e - )] 7) Si moltiplicano le due semireazioni per opportuni coefficienti in modo da rendere il numero di elettroni acquistati nel corso del processo di riduzione uguale a quello degli elettroni liberati nel corso del processo di ossidazione. a) Rid.: (MnO 2 + 4H + + 2e - Mn H 2 O) X 1 N e - acquistati = 2 Oss.: (2Cl - Cl 2 + 2e - ) X 1 N e - ceduti= 2. b) Rid.: (MnO H + + 5e - Mn H 2 O) X 2 N e - acquistati = 10 Oss.: (H 2 O 2 O 2 + 2H + + 2e - ) X 5 N e - ceduti = 10. c) Rid.: (Cr 2 O = H + + 6e - 2Cr H 2 O) X 16 N e - acquistati = 96 Oss.: (8H 2 S S H e - ) X 6 N e - ceduti = 96 8) Si ricava l'equazione ionica netta sommando membro a membro le due semireazioni e semplificando, ove necessario, i termini uguali. a) Rid.: MnO 2 + 4H + + 2e - Mn H 2 O Oss.: 2Cl - Cl 2 + 2e -. MnO 2 + 4H + + 2Cl -- Mn H 2 O + Cl 2 b) Rid.: 2MnO H e - 2Mn H 2 O Oss.: 5H 2 O 2 5O H e -. 2MnO H + +5H 2 O 2 2Mn H 2 O + 5O 2 c) Rid.: 16Cr 2 O = H e - 32Cr H 2 O Oss.: 48H 2 S 6S H e -. 16Cr 2 O = H H 2 S 32Cr H 2 O + 6S 8 9) Si controlla che l'equazione ionica netta sia bilanciata sia dal punto di vista atomico che dal punto di vista elettrico. a) MnO 2 + 4H + + 2Cl -- Mn H 2 O + Cl 2 E' bilanciata sia come numero di atomi che come carica totale: 2+ a sx e 2+ a dx. della freccia di reazione b) 2MnO H + +5H 2 O 2 2Mn H 2 O + 5O 2 E' bilanciata sia come numero di atomi che come carica totale: 4+ a sx e 4+ a dx. della freccia di reazione c) 16Cr 2 O 7 = + 128H H 2 S 32Cr H 2 O + 6S 8 E' bilanciata sia come numero di atomi che come carica totale: +96 a sx( x3) e +96 a dx. (32x3) della freccia di reazione 10) Nel caso di bilanciamento di reazioni redox che avvengono in ambiente basico si eliminano gli ioni H + aggiungendo un uguale numero di ioni OH -, che reagendo con H + formeranno H 2 O, in entrambi i lati delle due semireazioni. (Vedi esempi successivi)
3 11) Si bilancia la reazione scritta in forma molecolare, tenendo in considerazione, nell'attribuire i coefficienti, che talvolta una specie chimica che partecipa al processo redox può anche essere utilizzata come salificante nella reazione scritta sotto forma molecolare. a) MnO 2 + 4HCl MnCl 2 + Cl 2 + 2H 2 O Il coefficiente 4 anteposto ad HCl è una dimostrazione di quanto esposto nella frase precedente. HCl nella reazione a) viene usato sia come riducente (due moli per ogni mole di MnO 2 ) che come salificante (due moli di HCl per ogni mole di MnCl 2 formato). Un ultimo controllo mostra che la reazione è bilanciata dal punto di vista atomico. b) 2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4 2MnSO 4 + 5O 2 + K 2 SO 4 + 8H 2 O Nella reazione b) si pone 3 come coefficiente di H 2 SO 4 in quanto l'indice dell'idrogeno in H 2 SO 4 è 2. La reazione è così bilanciata anche dal punto di vista atomico. c) 16K 2 Cr 2 O H 2 S + 64H 2 SO 4 16Cr 2 (SO 4 ) 3 + 6S K 2 SO H 2 O Nella reazione c) si nota come il coefficiente 64 anteposto ad H 2 SO 4 è necessario al bilanciamento di 16x3 ioni solfato che agiscono da salificanti di Cr 3+ e 16 SO 4 = che salificano K +. Un ultimo controllo mostra che la reazione è bilanciata dal punto di vista atomico. ESEMPI DI APPLICAZIONE DELLE REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE OSSIDORIDUTTIVA SECONDO IL METODO DELLO IONE-ELETTRIONE 1) L'acido nitrico concentrato è un ottimo ossidante in grado di attaccare e sciogliere il rame metallico secondo: Cu + HNO 3 Cu(NO 3 ) 2 + NO + H 2 O Rid.: (NO H + + 3e - NO + 2 H 2 O) X 2 Oss.: (Cu Cu e - ) X 3 moltiplicate per gli opportuni coefficienti (2 e 3, rispettivamente) consentono di ottenere l'equazione ionica netta: Rid.: 2NO H + + 6e - 2NO + 4 H 2 O Oss.: 3Cu 3Cu e -. 3Cu + 2NO H + 3Cu NO + 4 H 2 O dalla quale si ricavano anche i coefficienti dell'equazione scritta sotto forma molecolare: 3Cu + 8HNO 3 3 Cu(NO 3 ) 2 + 2NO + 4 H 2 O Il confronto tra l'equazione ionica netta e l'equazione bilanciata sotto forma molecolare mostra chiaramente che HNO 3 in questa reazione svolge un doppio ruolo. Infatti, come messo in evidenza dai coefficienti dell'equazione ionica netta, due delle 8 moli totali di HNO 3 vengono usate per ossidare il Cu e portano alla formazione di NO; altre 6 moli dell'acido vengono poi impegnate per formare il sale Cu(NO 3 ) 2. 2) Il manganato di sodio si può preparare trattando biossido di manganese con O 2 in ambiente basico secondo: MnO 2 + NaOH + O 2 Na 2 MnO 4 + H 2 O Rid.: (O 2 +4H + + 4e - 2H 2 O) X 1 Oss.: (MnO 2 + 2H 2 O MnO = 4 + 4H + + 2e - ) X 2 moltiplicate per gli opportuni coefficienti (1 e 2, rispettivamente) consentono di ottenere l'equazione ionica netta: Rid.: O 2 +4H + + 4e - 2 H 2 O Oss.: 2MnO 2 + 4H 2 O 2MnO = 4 + 8H + + 4e -. 2MnO 2 + 2H 2 O + O 2 2MnO = 4 + 4H + In questo caso è necessario trasformare l'equazione ionica netta valida per la reazione in ambiente acido (la presenza di H + tra i prodotti è indicativa a tal proposito) nell'equivalente reazione valida per ambiente basico sommando 4OH - ad entrambi membri dell'equazione: 2MnO 2 + 2H 2 O + O 2 + 4OH - 2MnO = 4 + 4H + + 4OH - raggruppando 4H + e 4OH - in 4H 2 O si ottiene: 2MnO 2 + 2H 2 O + O 2 + 4OH - 2MnO = 4 + 4H 2 O e semplificando si ricava 2MnO 2 + O 2 + 4OH - 2MnO = 4 + 2H 2 O l'equazione ionica netta in ambiente basico. dalla quale facilmente si ottengono i coefficienti della reazione scritta sotto forma molecolare:
4 2MnO 2 + 4NaOH + O 2 2Na 2 MnO 4 + 2H 2 O 3) In una reazione di dismutazione o disproporzione una sola sostanza è al tempo stesso ossidante e riducente. Ad esempio, il fosforo posto in ambiente fortemente basico forma fosfina (PH 3 ) e ipofosfito(h 2 PO - 2 ) secondo: P 4 + NaOH + H 2 O PH 3 + NaH 2 PO 2 Rid.: (P 4 +12H e - 4PH 3 ) X 1 Oss.: (P 4 + 8H 2 O 4H 2 PO H + + 4e - ) X 3 moltiplicate per gli opportuni coefficienti (1 e 3, rispettivamente) consentono di ottenere l'equazione ionica netta: Rid.: P 4 +12H e - 4PH 3 Oss.: 3P H 2 O 12H 2 PO H e - 4P H 2 O 4PH H 2 PO H + I coefficienti dell'equazione ionica netta devono innanzi tutto essere resi minimi. Dividendo per 4 i coefficienti di entrambi i membri dell'equazione si ottiene: P 4 + 6H 2 O PH 3 + 3H 2 PO H + Anche in questo caso si dovrà poi procedere alla trasformazione dell'equazione ionica netta da ambiente acido a ambiente basico aggiungendo ad entrambe le parti 3OH -. P 4 + 6H 2 O + 3OH - PH 3 + 3H 2 PO H + + 3OH - raggruppando 4H + e 4OH - in 4H 2 O si ottiene P 4 + 6H 2 O + 3OH - PH 3 + 3H 2 PO H 2 O e semplificando si ricava P 4 + 3H 2 O + 3OH - - PH 3 + 3H 2 PO 2 l'equazione ionica netta in ambiente basico dalla quale facilmente si ottengono i coefficienti della reazione scritta sotto forma molecolare: P 4 + 3H 2 O + 3NaOH PH 3 + 3NaH 2 PO 2 Altra reazione di dismutazione: Cl 2 + KOH KCl + KClO 3 + H 2 O Rid.: (Cl 2 + 2e - 2Cl - ) X 5 Oss.: (Cl 2 + 6H 2 O 2ClO H e - ) X 1 moltiplicate per gli opportuni coefficienti (5 e 1, rispettivamente) consentono di ottenere l'equazione ionica netta: Rid.: 5Cl e - 10Cl - Oss.: Cl 2 + 6H 2 O 2ClO H e -. 6Cl 2 + 6H 2 O 10Cl - + 2ClO H + I coefficienti dell'equazione ionica netta devono innanzi tutto essere resi minimi. Dividendo per 2 i coefficienti di entrambi i membri dell'equazione si ottiene: 3Cl 2 + 3H 2 O 5Cl - + ClO H + e trasformando da ambiente acido ad ambiente basico si ha: 3Cl 2 + 3H 2 O + 6OH - 5Cl - + ClO H + + 6OH - 3Cl 2 + 3H 2 O + 6OH - 5Cl - + ClO H 2 O 3Cl 2 + 6OH - 5Cl - + ClO H 2 O Equazione ionica netta in ambiente basico. Da cui si ricavano i coefficienti dell'equazione di disproporzione del cloro in ambiente basico: 3Cl 2 + 6KOH 5KCl + KClO 3 + 3H 2 O 4) In alcune reazioni due elementi della stessa sostanza sono al tempo stesso ossidante e riducente. Ad esempio: Pb(NO 3 ) 2 PbO + O 2 + NO 2 Rid.: (NO e - NO 2 + O = ) X 4 riduzione di NO - 3 a NO 2 Oss.: (2O = O 2 + 4e - ) X 1 ossidazione di O = a O 2.
5 N.B. Qualora, come in questo caso, H 2 O non sia presente né tra i prodotti né tra i reagenti, è conveniente bilanciare l'ossigeno nelle semireazioni di ossidazione e di riduzione aggiungendo ioni ossido (O = ) anziché H 2 O. Rid.: 4NO e - 4NO 2 + 4O = Oss.: 2O = O 2 + 4e -. 4NO - 3 4NO 2 + O 2 + 2O = da cui si ricavano i coefficienti di reazione: 2Pb(NO 3 ) 2 2PbO + O 2 + 4NO 2 5) Alcuni esempi di reazioni redox nelle quali non compare H 2 O. a) Il fosforo elementare può essere preparato per riscaldamento di fosfato di calcio in presenza di silice (biossido di silicio) e carbone (il carbonio notoriamente è un buon riducente) secondo la reazione: Ca 3 (PO 4 ) 2 + SiO 2 + C CaSiO 3 + CO + P 4 Rid.: (4PO e - P O = ) X 1 Oss.: (C + O = CO + 2e - ) X 10 Anche in questo caso non apparendo H 2 O né tra i reagenti né tra i prodotti, l'ossigeno si bilancia aggiungendo ioni ossido anziché molecole di acqua. Si fa notare che Si in questa reazione non cambia numero di ossidazione anche se il biossido di silicio si trasforma in ione silicato (SiO 3 = ). Rid.: 4PO e - P O = Oss.: 10C + 10O = 10CO + 20e -. 4PO C P CO + 6O = da cui si ricavano i coefficienti di reazione: 2Ca 3 (PO 4 ) 2 + 6SiO C 6CaSiO CO + P 4 b) Per riscaldamento dell'acido fosforoso si ottiene acido fosforico e fosfina secondo la reazione di dismutazione: H 3 PO 3 H 3 PO 4 + PH 3 Rid.: (H 3 PO 3 + 6e - PH 3 + 3O = ) X 1 Oss.: (H 3 PO 3 + O = H 3 PO 4 + 2e - ) X 3 opportunamente trasformate, danno l'equazione ionica netta Rid.: H 3 PO 3 + 6e - PH 3 + 3O = Oss.: 3H 3 PO 3 + 3O = 3H 3 PO 4 + 6e - 4H 3 PO 3 3H 3 PO 4 + PH 3 che, in questo caso, coincide con la reazione scritta in forma molecolare. 4H 3 PO 3 3H 3 PO 4 + PH 3 6) Due sostanze, reagendo, possono talvolta dare lo stesso prodotto. KIO 3 + NaI + H 2 SO 4 I 2 + K 2 SO 4 + Na 2 SO 4 + H 2 O Rid.: (2IO H e - I 2 + 6H 2 O) X 1 Oss.: (2I - I 2 + 2e - ) X 5 opportunamente trasformate, danno l'equazione ionica netta Rid.: 2IO H e - I 2 + 6H 2 O Oss.: 10I - 5I e -. 2IO H I - 6I 2 + 6H 2 O i cui coefficienti devono essere resi minimi: IO H + + 5I - 3I 2 + 3H 2 O
6 A questo punto si può procedere al bilanciamento dell'equazione scritta in forma molecolare KIO 3 + 5NaI + 3H 2 SO 4 3I 2 + 1/2K 2 SO 4 +5/2 Na 2 SO 4 + 3H 2 O I cui coefficienti dovranno essere resi interi secondo: 2KIO 3 +10NaI + 6H 2 SO 4 6I 2 + K 2 SO 4 +5Na 2 SO 4 + 6H 2 O 7) Talvolta uno dei prodotti di reazione è già presente nei reagenti. KMnO 4 + Na 2 SO 3 + H 2 SO 4 MnSO 4 + K 2 SO 4 + Na 2 SO 4 + H 2 O Rid.: (MnO H + + 5e - Mn H 2 O) X 2 Oss.: (SO = 3 + H 2 O SO = 4 + 2H + + 2e - ) X 5 opportunamente trasformate, danno l'equazione ionica netta Rid.: 2MnO H e - 2Mn H 2 O Oss.: 5SO = 3 + 5H 2 O 5SO = H e -. 2MnO H + + 5SO = 3 2Mn 2+ = + 3H 2 O + 5SO 4 A questo punto si può procedere al bilanciamento dell'equazione scritta in forma molecolare 2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 2MnSO 4 + K 2 SO 4 + 5Na 2 SO 4 + 3H 2 O 8) Spesso un processo di ossdo-riduzione viene rappresentato in forma ionica indicando solo le specie che subiscono una reale modificazione. Ad esempio a) la reazione del punto precedente può essere così scritta in forma ionica: MnO SO = 3 Mn 2+ = + SO 4 In questo caso il bilanciamento è di molto facilitato in quanto la forma ionica mette in evidenza solo le specie che devono essere presenti nelle semireazioni redox, a meno di H +, OH - e H 2 O. Le semireazioni saranno pertanto: Rid.: (MnO H + + 5e - Mn H 2 O) X 2 Oss.: (SO = 3 + H 2 O SO = 4 + 2H + + 2e - ) X 5 e, opportunamente trasformate, esse danno direttamente i coefficienti dell'equazione ionica netta Rid.: 2MnO H e - 2Mn H 2 O Oss.: 5SO = 3 + 5H 2 O 5SO = H e -. 2MnO H + + 5SO = 3 2Mn 2+ = + 3H 2 O + 5SO 4 b) l'ossidazione dello iodio da parte di un clorato, può essere così rappresentata: I 2 + ClO - 3 Cl IO 3 In questo caso le semireazioni sono: Rid.: (ClO H + + 6e - Cl - + 3H 2 O) X 5 Oss.:(I 2 + 6H 2 O 2IO H e - ) X 3 opportunamente trasformate, esse danno direttamente i coefficienti dell'equazione ionica netta Rid.: 5ClO H e - 5Cl H 2 O Oss.: 3I H 2 O 6IO H e -. 5ClO I 2 + 3H 2 O 5Cl - + 6IO H + 9) Due esempi di reazioni di ossido-riduzione con sostanze organiche. a) La combustione del glucosio (C 6 H 12 O 6 ) è una reazione di ossidoriduzione nella quale il carbonio del glucosio viene ossidato dall'ossigeno secondo:
7 C 6 H 12 O 6 + O 2 CO 2 + H 2 O In questo caso le semireazioni sono: Rid.: (O 2 + 4H + + 4e - 2H 2 O) X 6 Oss.:(C 6 H 12 O 6 + 6H 2 O 6CO H e - ) X 1 esse, opportunamente trasformate, danno direttamente i coefficienti di reazione Rid.: 6O H e - 12H 2 O Oss.: C 6 H 12 O 6 + 6H 2 O 6CO H e - C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O a) L'ossidazione dell'alcool etilico ad acido acetico ad opera dell'ossigeno atmosferico, può così essere rappresentata: CH 3 CH 2 OH + O 2 CH 3 COOH + H 2 O Con le seguenti semireazioni: Rid.: (O 2 + 4H + + 4e - 2H 2 O) X 1 Oss.:(CH 3 CH 2 OH + H 2 O CH 3 COOH + 4H + + 4e - ) X 1 esse, opportunamente trasformate, danno direttamente i coefficienti di reazione Rid.: O 2 + 4H + + 4e - 2H 2 O Oss.: CH 3 CH 2 OH + H 2 O CH 3 COOH + 4H + + 4e - CH 3 CH 2 OH + O 2 CH 3 COOH + H 2 O N.B. La scrittura secondo la formula razionale dell'alcool etilico in questa reazione mostra chiaramente che l'atomo di carbonio sul gruppo metilico non viene interessato dalla reazione (numero di ossidazione -3 in entrambi i composti) mentre quello del gruppo alcolico passa da un numero di ossidazione -1 a +3. Questa particolarità viene messa in evidenza solo utilizzando la formula razionale. Infatti, se si scrive la stessa reazione redox usando le formule brute dell'alcool e dell'acido acetico: C 2 H 6 O + O 2 C 2 H 4 O 2 + H 2 O si vede solamente che il numero di ossidazione medio del carbonio passa da -2 (nell'alcool etilico) a 0 (nell'acido acetico).
Le reazioni di ossidoriduzione (redox)
 Le reazioni di ossidoriduzione (redox) Reazioni nelle quali si ha variazione del numero di ossidazione ( n. o. ) di ioni o atomi. La specie chimica che si ossida(funge da riducente) cede elettroni ed aumenta
Le reazioni di ossidoriduzione (redox) Reazioni nelle quali si ha variazione del numero di ossidazione ( n. o. ) di ioni o atomi. La specie chimica che si ossida(funge da riducente) cede elettroni ed aumenta
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
DALLA MOLE AI CALCOLI STECHIOMETRICI
 Conversione Massa Moli DALLA MOLE AI CALCOLI STECHIOMETRICI - ESERCIZI GUIDATI - LEGENDA DEI SIMBOLI: M = Peso molecolare m(g) = quantità in g di elemento o di composto n = numero di moli Ricorda che l'unità
Conversione Massa Moli DALLA MOLE AI CALCOLI STECHIOMETRICI - ESERCIZI GUIDATI - LEGENDA DEI SIMBOLI: M = Peso molecolare m(g) = quantità in g di elemento o di composto n = numero di moli Ricorda che l'unità
Scritto Chimica generale 13.02.2012 Gruppo A
 Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012)
 CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z)
 Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Quesiti e problemi (sul libro da pag. 510)
 Quesiti e problemi (sul libro da pag. 510) 2 Il numero di ossidazione 1 Assegna il n.o. a tutti gli elementi dei seguenti composti. a) Hg 3 (PO 3 ) 2 Hg: +2; P: +3; O: 2 b) Cu(NO 2 ) 2 Cu: +2; N: +3; O:
Quesiti e problemi (sul libro da pag. 510) 2 Il numero di ossidazione 1 Assegna il n.o. a tutti gli elementi dei seguenti composti. a) Hg 3 (PO 3 ) 2 Hg: +2; P: +3; O: 2 b) Cu(NO 2 ) 2 Cu: +2; N: +3; O:
COMPITO A DI CHIMICA DEL 13-02-12
 COMPITO A DI CHIMICA DEL 13-02-12 1A) Un campione impuro di bromito di potassio, del peso di 2,19 g, viene trattato in eccesso di acido solforico con del bicromato di potassio, ottenendo bromato di potassio
COMPITO A DI CHIMICA DEL 13-02-12 1A) Un campione impuro di bromito di potassio, del peso di 2,19 g, viene trattato in eccesso di acido solforico con del bicromato di potassio, ottenendo bromato di potassio
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Chimica Analitica e Complementi di Chimica Modulo di Chimica Analitica 8 Novembre 2012
 Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
NUMERI DI OSSIDAZIONE
 NUMERI DI OSSIDAZIONE Numeri in caratteri romani dotati di segno Tengono conto di uno squilibrio di cariche nelle specie poliatomiche Si ottengono, formalmente, attribuendo tutti gli elettroni di valenza
NUMERI DI OSSIDAZIONE Numeri in caratteri romani dotati di segno Tengono conto di uno squilibrio di cariche nelle specie poliatomiche Si ottengono, formalmente, attribuendo tutti gli elettroni di valenza
2) Calcolare la molarità di una soluzione di acido solforico al 17%,d = 1.12 g/ml
 Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari.
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ]
![ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ] ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ]](/thumbs/19/303703.jpg) ESERCIZI DI CHIMICA 1. Calcolare:a) le moli di H 2 O e le moli di atomi d idrogeno ed ossigeno contenuti in 10g di H 2 O; b) il numero di molecole di H 2 O e di atomi di idrogeno e di ossigeno. [0,55 moli;
ESERCIZI DI CHIMICA 1. Calcolare:a) le moli di H 2 O e le moli di atomi d idrogeno ed ossigeno contenuti in 10g di H 2 O; b) il numero di molecole di H 2 O e di atomi di idrogeno e di ossigeno. [0,55 moli;
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni
 Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
MPT Capitolo 12 Redox. Le ossidoriduzioni. Obiettivo. Definizioni di ossidazione e di riduzione
 1 Le ossidoriduzioni Obiettivo In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta di conoscenze fondamentali sia per la vita comune, sia, per molti di
1 Le ossidoriduzioni Obiettivo In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta di conoscenze fondamentali sia per la vita comune, sia, per molti di
COMPITO DI CHIMICA DEL 19-04-2013
 COMPITO DI CHIMICA DEL 19-04-2013 1) Una certa quantità di solfato di ferro (II), sciolta in una soluzione acquosa di acido solforico, viene trattata con 1.0 10-3 mol di permanganato di potassio. Si ottengono
COMPITO DI CHIMICA DEL 19-04-2013 1) Una certa quantità di solfato di ferro (II), sciolta in una soluzione acquosa di acido solforico, viene trattata con 1.0 10-3 mol di permanganato di potassio. Si ottengono
a 25 C da cui si ricava che:
 Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
Esercizi sul calcolo del ph. Generalità introduttive. 2. Spiega il significato del termine «acido coniugato» e «base coniugata».
 Esercizi sul calcolo del ph Generalità introduttive 1. L'ammoniaca :NH 3 non possiede alcun ruppo ossidrilico. Come puoi spieare il suo comportamento basico? 2. Spiea il sinificato del termine «acido coniuato»
Esercizi sul calcolo del ph Generalità introduttive 1. L'ammoniaca :NH 3 non possiede alcun ruppo ossidrilico. Come puoi spieare il suo comportamento basico? 2. Spiea il sinificato del termine «acido coniuato»
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
LEZIONE 12. Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA. Scaricato da Sunhope.it
 LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda
 6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda Autoionizzazione (o autoprotolisi) dell acqua. Prodotto ionico dell acqua M = mol/l AA1011 IN L6d p1! AA1011 IN L6d p2! NB: se si
6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda Autoionizzazione (o autoprotolisi) dell acqua. Prodotto ionico dell acqua M = mol/l AA1011 IN L6d p1! AA1011 IN L6d p2! NB: se si
Pb Pb 2+ + 2e 2Ag + + 2e 2Ag
 ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
Esercizi di Chimica (2 a prova in itinere)
 Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
= 9,3 10-5 M = 1,05 10-5 M
 - Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
- Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
... corso di chimica elettrochimica 1
 ... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
Esercitazione 8. Gli equilibri acido-base: Ka, Kb. L autoprotolisi dell acqua. Misura del ph Soluzioni tampone 1,0 10-14
 Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Appunti di Chimica Le reazioni chimiche reattività reazione chimica equazione chimica bilanciare
 Appunti di Chimica Le reazioni chimiche Premesse... 1 Tipi di reazioni chimiche... 2 Reazioni di ossido-riduzione... 2 Reazioni di formazione... 2 Numero di ossidazione nei composti binari di tipo salino...
Appunti di Chimica Le reazioni chimiche Premesse... 1 Tipi di reazioni chimiche... 2 Reazioni di ossido-riduzione... 2 Reazioni di formazione... 2 Numero di ossidazione nei composti binari di tipo salino...
Dipendenza della Solubilità dalla temperatura
 SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085]
![) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085] ) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085]](/thumbs/26/9134725.jpg) Chimica Analitica Prova scritta del 19 Gennaio 2004 1) 375 ml di soluzione acquosa contengono 21.2 µg di un principio attivo. Esprimere la concentrazione della soluzione in parti per milione (ppm) [0.056
Chimica Analitica Prova scritta del 19 Gennaio 2004 1) 375 ml di soluzione acquosa contengono 21.2 µg di un principio attivo. Esprimere la concentrazione della soluzione in parti per milione (ppm) [0.056
. 7H 2 O (solfato di nickel eptaidrato)
 Formula minima Formula molecolare - atomo isotopi mole rapporti stechiometrici reagente limitante resa di reazione bilanciamento equazioni chimiche semplici concentrazione delle soluzioni - densità Esercizio
Formula minima Formula molecolare - atomo isotopi mole rapporti stechiometrici reagente limitante resa di reazione bilanciamento equazioni chimiche semplici concentrazione delle soluzioni - densità Esercizio
BILANCIAMENTO DELLE REAZIONI REDOX
 BILANCIAMENTO DELLE REAZIONI REDOX NUMERO DI OSSIDAZIONE Per descrivere lo stato di combinazione di un atomo, oltre alla valenza, si può usare il numero di ossidazione. La valenza indica il numero di atomi
BILANCIAMENTO DELLE REAZIONI REDOX NUMERO DI OSSIDAZIONE Per descrivere lo stato di combinazione di un atomo, oltre alla valenza, si può usare il numero di ossidazione. La valenza indica il numero di atomi
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI
 DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
Definiamo Entalpia la funzione: DH = DU + PDV. Variando lo stato del sistema possiamo misurare la variazione di entalpia: DU = Q - PDV.
 Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
EQUILIBRI SIMULTANEI
 EQUILIBRI SIMULTANEI 1. Soluzioni tampone. Per soluzione tampone si intende una soluzione acquosa in grado di mantenere pressoché inalterato il proprio ph, in seguito all'aggiunta di moderate quantità
EQUILIBRI SIMULTANEI 1. Soluzioni tampone. Per soluzione tampone si intende una soluzione acquosa in grado di mantenere pressoché inalterato il proprio ph, in seguito all'aggiunta di moderate quantità
DIPARTIMENTO DI SCIENZE INTEGRATE CHIMICA FISICA SCIENZE DELLA TERRA - BIOLOGIA
 IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
Numero o stato di ossidazione. n. ox. (O) = -2 n. ox. (H) = +1
 Si definisce numero o stato di ossidazione l ipotetica carica elettrica che un atomo, facente parte di una molecola, assumerebbe se tutti gli elettroni di legame fossero attribuiti all atomo più elettronegativo.
Si definisce numero o stato di ossidazione l ipotetica carica elettrica che un atomo, facente parte di una molecola, assumerebbe se tutti gli elettroni di legame fossero attribuiti all atomo più elettronegativo.
SOLUZIONI COMPITO DI CHIMICA DEL 07-10-09
 SOLUZIONI COMPITO DI CHIMICA DEL 07-10-09 1A) 500 ml di una soluzione contengono 6,8 g di KMnO 4. L aggiunta di 20 ml di tale soluzione a 10 ml di una soluzione di SnCl 2 fa avvenire la seguente reazione
SOLUZIONI COMPITO DI CHIMICA DEL 07-10-09 1A) 500 ml di una soluzione contengono 6,8 g di KMnO 4. L aggiunta di 20 ml di tale soluzione a 10 ml di una soluzione di SnCl 2 fa avvenire la seguente reazione
La catalasi: un enzima in azione
 Percorso di Didattica laboratoriale La catalasi: un enzima in azione Scuola Secondaria di Secondo Grado IISS - IPSIA E. Majorana Bari Classe IV B Docente: Miralma Serio Organizzatore cognitivo: Le trasformazioni
Percorso di Didattica laboratoriale La catalasi: un enzima in azione Scuola Secondaria di Secondo Grado IISS - IPSIA E. Majorana Bari Classe IV B Docente: Miralma Serio Organizzatore cognitivo: Le trasformazioni
Reazioni redox. Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new. University of Camerino, ITALY
 Reazioni redox Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Con reazioni di ossido-riduzione
Reazioni redox Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Con reazioni di ossido-riduzione
Determinazione del pka per un acido moderatamente debole per via potenziometrica C.Tavagnacco - versione 02.02.05
 Determinazione del pka per un acido moderatamente debole per via potenziometrica C.Tavagnacco - versione 02.02.05 Dall equazione di Henderson-Hasselbalch (H-H), ph = pka + log ([A - ]/[HA]) si ricava che
Determinazione del pka per un acido moderatamente debole per via potenziometrica C.Tavagnacco - versione 02.02.05 Dall equazione di Henderson-Hasselbalch (H-H), ph = pka + log ([A - ]/[HA]) si ricava che
CONCENTRAZIONE DELLE SOLUZIONI. Solvente: normalmente liquido in eccesso Soluto: gas, liquido o solido, normalmente in difetto
 CONCENTRAZIONE DELLE SOLUZIONI Solvente: normalmente liquido in eccesso Soluto: gas, liquido o solido, normalmente in difetto Percentuale in peso = g soluto / g soluzione x 100 H 2 O 2 al 3% Percentuale
CONCENTRAZIONE DELLE SOLUZIONI Solvente: normalmente liquido in eccesso Soluto: gas, liquido o solido, normalmente in difetto Percentuale in peso = g soluto / g soluzione x 100 H 2 O 2 al 3% Percentuale
LA TERRA E LA CHIMICA: LA TAVOLA PERIODICA DEGLI ELEMENTI ELEMENTI E COMPOSTI
 I.I.S. A. PACINOTTI IST. TECNICO STATALE INDUSTRIALE Antonio PACINOTTI IST. TECNICO STATALE per GEOMETRI "Giorgio MASSARI" http://www.iispacinottive.it/ Via Caneve, n. 93 30173 - Mestre (VE) tel. 041 5350355
I.I.S. A. PACINOTTI IST. TECNICO STATALE INDUSTRIALE Antonio PACINOTTI IST. TECNICO STATALE per GEOMETRI "Giorgio MASSARI" http://www.iispacinottive.it/ Via Caneve, n. 93 30173 - Mestre (VE) tel. 041 5350355
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
ELETTROCHIMICA. Uso di reazioni chimiche per produrre corrente elettrica (Pile)
 ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
Corso di Laurea in Farmacia (A-E) Esame di Chimica Generale e Inorganica - 24 Gennaio 2014
 Esame di Chimica Generale e Inorganica - 24 Gennaio 2014 1) Riportare su ogni foglio consegnato nome, cognome, matricola e data. 1) a) Descrivere e fornire almeno un esempio per ciascuno dei seguenti tipi
Esame di Chimica Generale e Inorganica - 24 Gennaio 2014 1) Riportare su ogni foglio consegnato nome, cognome, matricola e data. 1) a) Descrivere e fornire almeno un esempio per ciascuno dei seguenti tipi
Teoria di Arrhenius. Vengono definiti acidi quei composti che, in soluzione acquosa, sono in grado di dissociarsi liberando ioni H +
 Teoria di Arrhenius Vengono definiti acidi quei composti che, in soluzione acquosa, sono in grado di dissociarsi liberando ioni H + H-Cl H + + Cl - Vengono definiti basi quei composti che, in soluzione
Teoria di Arrhenius Vengono definiti acidi quei composti che, in soluzione acquosa, sono in grado di dissociarsi liberando ioni H + H-Cl H + + Cl - Vengono definiti basi quei composti che, in soluzione
Esempi di calcolo del numero di ossidazione
 ESERCITAZIONE 3 1 Esempi di calcolo del numero di ossidazione 1) Calcolare il numero di ossidazione del Mn nel KMnO 4. K n.o. +1 O n.o. 2 La molecola è neutra per cui: n.o. Mn + n.o. K + 4 n.o. O = 0 Mn
ESERCITAZIONE 3 1 Esempi di calcolo del numero di ossidazione 1) Calcolare il numero di ossidazione del Mn nel KMnO 4. K n.o. +1 O n.o. 2 La molecola è neutra per cui: n.o. Mn + n.o. K + 4 n.o. O = 0 Mn
SDD - Seconde Equilibrio e ph. Equilibrio e ph. Obiettivo
 1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
Corso di Laboratorio di Chimica Generale Esperienza 4: Proprietà dei sistemi in equilibrio chimico: Il principio di Le Châtelier
 Corso di Laboratorio di Chimica Generale Esperienza 4: Proprietà dei sistemi in equilibrio chimico: Il principio di Le Châtelier Quando si lavora in laboratorio spesso si osservano dei fenomeni che sono
Corso di Laboratorio di Chimica Generale Esperienza 4: Proprietà dei sistemi in equilibrio chimico: Il principio di Le Châtelier Quando si lavora in laboratorio spesso si osservano dei fenomeni che sono
Concetti fondamentali su acidità e basicità delle soluzioni acquose
 Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
ESERCIZI STECHIOMETRICI
 ESERCIZI STECHIOMETRICI (con risultato) Differenze di qualche unità sull ultima cifra del risultato potrebbero essere dovute a una diversa approssimazione dei calcoli NB: Qualsiasi problema relativo alla
ESERCIZI STECHIOMETRICI (con risultato) Differenze di qualche unità sull ultima cifra del risultato potrebbero essere dovute a una diversa approssimazione dei calcoli NB: Qualsiasi problema relativo alla
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]
![Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ] Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]](/thumbs/34/16945364.jpg) La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
ESERCIZI ph SOLUZIONI
 ESERCIZI ph SOLUZIONI 1. Una soluzione contiene 3,6 g di LiOH (PM = 23,9 g/mole). Calcolare il ph di questa soluzione [13,3] 2. Calcolare il ph di una soluzione preparata con 10,85 ml di HCl (PM = 36,46
ESERCIZI ph SOLUZIONI 1. Una soluzione contiene 3,6 g di LiOH (PM = 23,9 g/mole). Calcolare il ph di questa soluzione [13,3] 2. Calcolare il ph di una soluzione preparata con 10,85 ml di HCl (PM = 36,46
CHIMICA ORGANICA. Gli alcoli
 1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Intervallo di viraggio ph
 CLASSE 2 A ocb 22/11/2009 1 DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Principi Teorici: gli indicatori acido-base sono sostanze organiche complesse, che si comportano
CLASSE 2 A ocb 22/11/2009 1 DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Principi Teorici: gli indicatori acido-base sono sostanze organiche complesse, che si comportano
Giochi della Chimica 1996 Fase regionale Classi A e B
 Giochi della Chimica 1996 Fase regionale Classi A e B 1. Indicare le percentuali in massa degli elementi K, S e O presenti in K 2 SO 4 : A) 44,9% K; 18,4% S; 36,7% O B) 22,3% K; 52,6 % S; 25,1% O C) 56,1%
Giochi della Chimica 1996 Fase regionale Classi A e B 1. Indicare le percentuali in massa degli elementi K, S e O presenti in K 2 SO 4 : A) 44,9% K; 18,4% S; 36,7% O B) 22,3% K; 52,6 % S; 25,1% O C) 56,1%
Conoscere gli acidi e le basi
 Conoscere gli acidi e le basi 1 1) Determinazione dell acidità totale del latte 2) Determinazione dell acidità totale del vino INTRODUZIONE: Gli acidi sono sostanze che possiedono alcune proprietà chimiche
Conoscere gli acidi e le basi 1 1) Determinazione dell acidità totale del latte 2) Determinazione dell acidità totale del vino INTRODUZIONE: Gli acidi sono sostanze che possiedono alcune proprietà chimiche
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
Fondamenti di chimica Raymond Chang Copyright 2009 The McGraw-Hill Companies srl CAPITOLO 18. Le reazioni redox e l elettrochimica
 CAPITOLO 18 Le reazioni redox e l elettrochimica 18.1 Seguiamo i passaggi descritti in dettaglio nella Sezione 18.1 del testo. (a) sono: Il problema è dato in forma ionica, così combinando lo step 1 co
CAPITOLO 18 Le reazioni redox e l elettrochimica 18.1 Seguiamo i passaggi descritti in dettaglio nella Sezione 18.1 del testo. (a) sono: Il problema è dato in forma ionica, così combinando lo step 1 co
REAZIONI CHIMICHE : FORMALISMO
 Per reazione chimica si intende una trasformazione della materia in cui alcune sostanze (reagenti) si trasformano in altre (prodotti) attraverso un cambiamento delle interazioni fra gli atomi (legami)
Per reazione chimica si intende una trasformazione della materia in cui alcune sostanze (reagenti) si trasformano in altre (prodotti) attraverso un cambiamento delle interazioni fra gli atomi (legami)
ossidazione/riduzione, ossidante/riducente
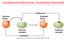 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO
 IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 4/1995 Gli insegnanti di chimica, durante l esposizione dei concetti fondamentali di acidità
IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 4/1995 Gli insegnanti di chimica, durante l esposizione dei concetti fondamentali di acidità
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
PROVA STRUTTURATA DI CHIMICA ORGANICA
 1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
ossidazione/riduzione, ossidante/riducente
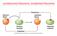 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
ossigeno e ne facilita la diffusione dai capillari all ambiente intracellulare.
 Ricostituzione e attività pseudoenzimatica della mioglobina modificata Giulia Bertelegni e Carolina Ferrari I.I.S. A.Maserati Facoltà di Scienze MM.FF.NN. Dipartimento di Chimica generale Università degli
Ricostituzione e attività pseudoenzimatica della mioglobina modificata Giulia Bertelegni e Carolina Ferrari I.I.S. A.Maserati Facoltà di Scienze MM.FF.NN. Dipartimento di Chimica generale Università degli
REAZIONI ESOTERMICHE ED ENDOTERMICHE
 REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
Elettrochimica. 1. Celle elettrolitiche. 2. Celle galvaniche o pile
 Elettrochimica L elettrochimica studia l impiego di energia elettrica per promuovere reazioni non spontanee e l impiego di reazioni spontanee per produrre energia elettrica, entrambi i processi coinvolgono
Elettrochimica L elettrochimica studia l impiego di energia elettrica per promuovere reazioni non spontanee e l impiego di reazioni spontanee per produrre energia elettrica, entrambi i processi coinvolgono
OSSIDORIDUZIONI N H H. H ammoniaca. acido nitroso N = + 3. acido nitrico N = + 5
 OSSIDORIDUZIONI Le reazioni acido-base sono quelle in cui viene scambiato, fra due specie reagenti, un H. Come si è visto, esistono casi di reazioni acido-base in cui ciò non avviene (definizione di Lewis),
OSSIDORIDUZIONI Le reazioni acido-base sono quelle in cui viene scambiato, fra due specie reagenti, un H. Come si è visto, esistono casi di reazioni acido-base in cui ciò non avviene (definizione di Lewis),
IL SISTEMA INTERNAZIONALE DI MISURA
 IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Progetto Lauree Scientifiche Dipartimento di Chimica Università degli Studi di Sassari
 Progetto Lauree Scientifiche Dipartimento di Chimica Università degli Studi di Sassari Estrazione ed impiego di indicatori acido-base vegetali ACIDI E BASI NELLA VITA QUTIDIANA Acidi Sono di sapore aspro
Progetto Lauree Scientifiche Dipartimento di Chimica Università degli Studi di Sassari Estrazione ed impiego di indicatori acido-base vegetali ACIDI E BASI NELLA VITA QUTIDIANA Acidi Sono di sapore aspro
Quesiti e problemi. 9 Calcola, con l aiuto della tavola periodica, la massa. 10 Calcola la massa molecolare di tre acidi piuttosto
 SUL LIBRO DA PAG 101 A PAG 10 Quesiti e problemi 1 La massa atomica e la massa molecolare 1 Qual è la definizione di unità di massa atomica u? a) è uguale a 1/12 della massa dell atomo di 12 C b) è uguale
SUL LIBRO DA PAG 101 A PAG 10 Quesiti e problemi 1 La massa atomica e la massa molecolare 1 Qual è la definizione di unità di massa atomica u? a) è uguale a 1/12 della massa dell atomo di 12 C b) è uguale
