Gli Enzimi. catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche
|
|
|
- Albana Manzo
- 5 anni fa
- Visualizzazioni
Transcript
1 catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per il substrato Operano in soluzioni acquose con temperature e ph blandi
2 Struttura generale degli enzimi Sono proteine globulari complesse : Addotto enzima-substrato Parte proteica Parte non-proteica Cofattore (ione metallico) Coenzima (natura organica: vitamina o altro) Gruppo Prostetico
3 SITO ATTIVO: specifica porzione dell enzima, deputata al legame con il substrato che porta alla formazione dell addotto ES Addotto ES
4 Proprietà dei Catalizzatori I catalizzatori sono sostanze capaci di abbassare l energia di attivazione rendendo piú facile la formazione dell addotto ES: la reazione diviene quindi piú veloce.
5 A(S) B(P) I catalizzatori abbassano l energia di attivazione delle reazioni favoriscono lo stato di transizione formando l addotto ES G prodotti -G substrati ( G ) < 0 Reazione esoergonica
6 Molti catalizzatori non facilitano la formazione dello stato di transizione, ma sostituiscono la reazione difficile con 2 o più reazioni entrambe con uno stato di transizione facile da formare E+S ES EP E+P Risultato: accelerazione della reazione globale. ΔG =energia di attivazione
7 ADDOTTO Enzima-Substrato L energia usata per aumentare la velocità enzimatica deriva dalle interazioni deboli (legami idrogeno, interazioni ioniche e idrofobiche) che si formano tra enzima e substrato ENERGIA di LEGAME
8 CATALISI ENZIMATICA Adattamento indotto
9 CINETICA ENZIMATICA velocità di una reazione (V): numero di molecole di substrato che si trasformano in prodotto nell unità di tempo. (V) si esprime come mmol/l di prodotto formatosi in un minuto (mm/min). Velocità iniziale V 0 Nelle analisi delle reazioni enzimatiche si utilizzano soltanto le velocità di reazione iniziali (v 0 ), quelle che si misurano non appena si mescolano l enzima ed il substrato. In tal modo la variazione di [S] può essere considerata trascurabile.
10 FATTORI CHE MODIFICANO LA VELOCITA DELLE REAZIONI ENZIMATICHE: 1) ph (curva a campana) 2) temperatura (curva bifasica a causa della denaturazione) 3) [S] (iperbole rettangolare a causa della saturazione) 4) inibitori CINETICA ENZIMATICA
11 CINETICA ENZIMATICA: ph Ciascun enzima ha un ph ottimale al quale la reazione è catalizzata con la massima efficienza. Esso in genere rispecchia il ph dell ambiente in cui l enzima svolge normalmente le sue funzioni. La concentrazione degli H + (ph) influenza l attività enzimatica modificando la geometria del sito attivo e la distribuzione delle cariche elettriche dei gruppi coinvolti nel legame del substrato o nel processo catalitico stesso. Valori di ph estremi possono anche provocare la denaturazione dell enzima.
12 CINETICA ENZIMATICA: ph
13 CINETICA ENZIMATICA: temperatura La velocità di reazione aumenta con l aumentare della temperatura fino a raggiungere un picco. Un ulteriore innalzamento della temperatura provoca una diminuzione della velocità di reazione a causa della denaturazione dell enzima.
14 CINETICA ENZIMATICA: temperatura
15 CINETICA ENZIMATICA: concentrazione del substrato La velocità di una reazione catalizzata da un enzima aumenta all aumentare della concentrazione del substrato fino a raggiungere una velocità massima (V max ). In questa condizione i siti attivi dell enzima sono saturi del substrato Quando tutto l enzima è saturato con il substrato: [ES] = [E tot ] V 0 = Vmax
16 L equazione di Michaelis-Menten descrive la variazione della velocità di reazione al variare della concentrazione del substrato. v 0 = velocità iniziale della reazione V max = velocità massima K m = costante di Michaelis-Menten [S] = concentrazione del substrato
17 La curva che esprime la relazione tra V 0 e S ha un andamento iperbolico ed è espressa algebricamente dalla equazione di Michaelis-Menten Costante di Michaelis e Menten La Km è quella concentrazione di substrato a cui la V 0 è pari a metà della Vmax
18 Caratteristiche della K m La K m è pari alla concentrazione di substrato alla quale la velocità della reazione (V 0 ) è 1/2 della V max. La K m riflette l affinità dell enzima per il substrato: K m piccola = alta affinità dell enzima per il substrato K m grande = bassa affinità dell enzima per il substrato. Ogni enzima ha una K m caratteristica per un dato substrato. La K m non varia al variare della [E].
19 I PARAMETRI CINETICI POSSONO ESSERE USATI PER CONFRONTARE LE ATTIVITA DEGLI ENZIMI
20 Inibizione Enzimatica Inibitori ostacolano o impediscono il funzionamento degli enzimi Inibitore reversibile: Ha un azione temporanea, è possibile allontanare l inibitore dall enzima, consentendo il regolare esplicarsi dell attività catalitica. inibitore irreversibile: la ripresa dell attività enzimatica non è possibile, in quanto non è possibile in nessun modo allontanare l inibitore dall enzima
21 Enzimi regolatori Aumentano o diminuiscono la loro attività catalitica in risposta a determinati segnali tali enzimi non seguono la cinetica di Michaelis Menten e sono responsabili della modulazione della velocità con cui decorre interi processi metabolici struttura quaternaria (due o più subunità proteiche) in essi esistono più siti chimicamente attivi ENZIMI ALLOSTERICI Legano Effettori o MODULATORI: molecola che interagendo con l enzima in siti lontani dal sito attivo, esercita un effetto positivo o negativo sulla sua attività Modificazioni covalenti reversibili
22 Enzimi regolatori Enzimi allosterici: Agiscono mediante legame non covalente e reversibile di Modulatori allosterici Modificazione allosterica OMOTROPICI Il substrato è esso stesso un modulatore ETEROTROPICI Il modulatore è una molecola diversa dal substrato
23 Enzimi regolatori
24 Enzimi regolatori Inibizione retroattiva Gli enzimi allosterici possono essere inibiti dai prodotti terminali di una via metabolica un enzima regolatore controlla le quantità di sostanze che devono essere trasformate in una via metabolica (catalizza la reazione più lenta, in genere la prima di una serie)
25 Enzimi regolatori modificazione covalente reversibile
26 Enzimi regolatori Scissione proteolitica di un precursore (zimogeno inattivo) modificazione covalente irreversibile
27 Coenzimi e Cofattori Molti enzimi per poter essere attivi richiedono la presenza di ioni metallici o di altre molecole, talvolta legate con legami covalenti: Coenzimi o cofattori Cofattore: ione o molecola NON PROTEICA la cui presenza è indispensabile perché l enzima possa svolgere la sua attività catalitica. Interagiscono con l apoezima solo durante il ciclo catalitico. Tra i cofattori hanno rilevante importanza gli ioni di alcuni elementi metallici, Ca, Mg, Mn, Zn, Cu (tutti gli enzimi che utilizzano ATP richiedono la presenza di ioni Mg 2+ ).
28 Coenzimi e Cofattori Molti enzimi per poter essere attivi richiedono la presenza di ioni metallici o di altre molecole, talvolta legate con legami covalenti: Coenzimi o cofattori Coenzimi: sono molecole organiche (alcuni di essi derivano da vitamine idrosolubili) prendono parte direttamente all azione catalitica dell enzima spesso si ritrovano modificati chimicamente al termine della reazione (es. NAD + / NADH).
29 Coenzimi I coenzimi da soli sono cataliticamente inattivi ma, unendosi all apoenzima, formano l enzima cataliticamente attivo. Uno stesso coenzima può essere unito a diverse proteine per cui si deduce che la specificità dell azione enzimatica è proprietà dell apoenzima e non del coenzima. La maggior parte dei coenzimi è strettamente legata alle vitamine. Per diventare coenzima, la vitamina subisce delle trasformazioni che vanno dalla semplice fosforilazione (uno dei casi più comuni) a trasformazioni più complesse. La trasformazione della vitamina in coenzima avviene all interno delle cellule ed è di natura enzimatica. I coenzimi possono essere classificati in gruppi diversi, in base al tipo di reazione catalizzata.
30 Coenzimi Coenzimi derivati dalle vitamine idrosolubili Le vitamine sono necessarie per la sintesi di coenzimi e devono essere ottenute con la dieta Piante e microorganismi sono produttori di vitamine La maggior parte delle vitamine deve essere ulteriormente trasformata per generare coenzimi
31 Cofattori Niacina (Vit. B 3 o PP) NAD + e NADP + La niacina (acido nicotinico) è un precursore di NAD + e NADP + NAD = Nicotinamide Adenina Dinucleotide NADP = Nicotinamide Adenina Dinucleotide Fosfato NAD + e NADP + fungono da coenzimi in molte reazioni di ossidoriduzione
32 Cofattori NAD + NADH
33 Cofattori Il NAD + funziona da deidrogenante: porta via 2 atomi di H dal substrato. Uno viene perso sotto forma di ione H +, l altro viene perso come idruro H - che si lega immediatamente all anello piridinico cationico
34 PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA
35 Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado di garantire alle cellule dei tessuti un flusso di O 2 sufficiente e costante: un sistema circolatorio; molecole trasportatrici di O 2, che permettono di superare la limitazione imposta dalla bassa solubilità dell ossigeno in acqua.
36 Nei vertebrati le molecole coinvolte nel rifornimento dell ossigeno sono: Emoglobina (Hb) Mioglobina (Mb) Legano reversibilmente l O 2 (LIGANDO) ne rendono possibile il trasporto dai polmoni ai tessuti e l immagazzinamento nel muscolo.
37 Proteina monomerica (153 AA) Immagazzinamento dell O 2 nella cellula 80% degli AA sono disposti ad α-elica Mioglobina (Mb) La Mb si trova nei muscoli e funziona soprattutto come deposito di O 2 ; Facilita la diffusione dell ossigeno nel muscolo che sta respirando rapidamente
38 Emoglobina (Hb) Eterotetramero costituita da 4 diverse subunità: 2 subunità α 2 subunità β Trasporto dell O 2 dai polmoni alla cellula
39 L Emoglobina trasporta l O 2 dai polmoni ai tessuti La Mioglobina lega l ossigeno rilasciato dall Emoglobina nel circolo Sanguigno e ne facilita la diffusione nel muscolo che sta respirando rapidamente
40 EME Emoglobina Mioglobina
41 EME 4 anelli pirrolici Fe 2+ al centro EME: PROTOPORFIRINA IX Fe 2+
42 EME
43 EME
44 EME
45 EME
46 EME Il Fe 2+ dell eme può legare: O 2 CO H 2 O (metaemoglobina) Fe 2+ Fe 3+
47 EME Il Fe 2+ dell eme può legare: O 2 (ossiemoglobina)
48 EME Il Fe 2+ dell eme può legare: CO (carbossiemoglobina)
49 I derivati carbossi-mioglobina e carbossi-emoglobina presentano CO (non CO 2!!!) legato al gruppo eme. Il legame con il CO è circa 300 volte più stabile di quello con l O 2 ed è irreversibile! Quando nell aria è presente 0.2% di CO in 1 ora si ha perdita di coscienza e in circa 4 ore si ha morte per asfissia (circa 2/3 di Hb sono legati a CO).
50 Protezione dell eme da parte della globina Le globine che circondano l'eme in Mb ed in Hb hanno funzioni di estrema importanza: - impediscono al ferro dell eme di ossidarsi da Fe 2+ ferroso a Fe 3+ ferrico; - creano un sito attivo idrofobico, in cui si lega O 2 che è lipofilo * ; - proteggono l eme da ligandi indesiderati (esempio CO). * la solubilità di O 2 nel plasma è molto bassa; grazie all'emoglobina nel sangue c'è una concentrazione di O volte superiore a quella del plasma.
51 Mioglobina (Mb) Costituita da 153 residui aa 8 α-eliche Gruppo eme Tasca idrofobica eliche E ed F His E7: istidina distale; His F8: istidina prossimale
52 Saturazione frazionale Legame all ossigeno della Mb (MbO 2 ) Deposito di O 2 a livello muscolare Muscolo a riposo: Mb lega O 2 Muscolo attivo: consumo di O 2 Quando diminuisce la pressione a livello dei tessuti, Mb rilascia l O 2 Pressione tessuti Pressione polmoni Numero di molecole che hanno legato l O 2 rispetto al totale Y Curva iperbolica P 50 Pressione parziale di O 2 alla quale è saturato il 50% delle molecole SEMISATURAZIONE Misura dell affinità per l O 2 Più piccola è la P 50 maggiore è l affinità
53 1. contenuta negli eritrociti Emoglobina (Hb) 2. trasporto di O 2 dai polmoni ai tessuti (legame reversibile) 3. trasporto reversibile di CO 2. struttura quaternaria tetramerica 4 catene polipetiditiche 4 gruppi eme HbA (α 2 β 2 ): emoglobina adulta umana 2 catene α, 2 catene β HbF (α 2 2 ): emoglobina fetale 2 catene α, 2 catene La sostituzione delle catene β (Hb adulta) con le catene (Hb fetale) comporta differente funzionalità.
54 Emoglobina (Hb) La struttura terziaria è simile tra subunità α e subunità β, entrambe inoltre sono simili alla Mb, anche se le tre catene polipeptidiche hanno solo il 18% dei residui aa in comune
55 Emoglobina (Hb) Interazioni tra subunità di tipo diverso: Interazioni idrofobiche Legami idrogeno Legami ionici
56 Emoglobina (Hb)
57 L emoglobina esiste in due forme: ossigenata =R; deossigenata =T Il legame di Hb con O 2 determina una grande modificazione della struttura quaternaria. La proteina passa da una forma tesa T, mantenuta da interazioni ioniche (ponti salini) fra catene laterali di aminoacidi (es. Asp-His) presenti nelle subunità, a una forma rilassata R (ponti salini spezzati). Il fenomeno avviene in direzione opposta quando l emoglobina rilascia l ossigeno.
58 Modificazione conformazionale: Transizione T R deossigenata =T ossigenata =R Le modificazioni della struttura quaternaria avvengono alle interfacce α 1 β 2 e α 2 β 1 Il dimero α 1 β 1 ruota di circa 15 rispetto al dimero α 2 β 2
59 Modificazione conformazionale: Transizione T R deossigenata =T ossigenata =R passando da T ad R, il Fe 2+ si sposta nel centro del piano dell EME. Questo movimento trascina anche l His F8 che a sua volta trascina con se tutta l elica F.
60 Modificazione conformazionale: Transizione T R deossigenata =T ossigenata =R
61 L emoglobina è una proteina allosterica la cui struttura quaternaria viene modificata dal legame di O 2 alle 4 subunità: i 4 siti attivi cooperano positivamente, legando O 2 con affinità crescente e questo causa cambiamento progressivo di struttura quaternaria. Allosterismo (modificazione della struttura quaternaria) proteine con struttura quaternaria possono andare incontro a modificazioni nella disposizione spaziale delle subunità costituenti.
62 Curva di dissociazione dell O 2 per l Emoglobina Hb Hb + 4O 2 = Hb(O 2 ) 4 sigmoidale La quantità di ossigeno legato si modifica significativamente anche con piccole variazioni di po 2. Hb lega l O 2 quando la pressione parziale del gas (po 2 ) è elevata (polmoni) e lo rilascia quando la pressione è bassa (tessuti).
63 La mioglobina è un ottimo sistema per immagazzinare O 2 : -si lega all O 2 anche a basse po 2 e lo lega strettamente. L emoglobina è un ottimo sistema per trasportare l O 2 : -si carica di O 2 quando po 2 è alta e cede O 2 quando po 2 è bassa.
64 La curva di dissociazione sigmoide indica la presenza di interazioni cooperative: il legame di una molecola influenza il legame delle altre Hb lega O 2 con affinità crescente Hb + 4 O 2 =Hb(O 2 ) 4
65 Modello simmetrico Modello sequenziale
66 Fattori che influenzano l affinità dell Hb per O 2 piccole molecole e ioni, presenti negli eritrociti possono regolare il legame di O 2 ad Hb EFFETTORI O MODULATORI ETEROTROPICI: [H + ], CO 2, acido 2,3 bisfosfoglicerico (2,3-BPG) si legano con interazioni deboli in siti diversi da quello di legame dell O 2 diminuiscono l affinità dell emoglobina per l ossigeno. MODULATORI ETEROTOPICI NEGATIVI. L aumento di concentrazione di questi modulatori causa una diminuzione dell affinità di Hb per O 2 e stabilizzano la forma T.
67 EFFETTO BOHR Il legame di Hb con O 2 è fortemente influenzato dal ph e dalla pco 2. Polmoni: ph alto; pco 2 bassa: l'affinità di Hb per O 2 aumenta, O 2 viene legato e H + e CO 2 vengono rilasciato. Aumentando il ph si rimuove il protone (H +) legato all Hb, stimolandone l ossigenazione
68 EFFETTO BOHR Il legame di Hb con O 2 è fortemente influenzato dal ph e dalla pco 2. Tessuti: ph basso; pco 2 alta: l'affinità di Hb per O 2 diminuisce, O 2 viene liberato e H + e CO 2 si legano ad Hb. Nei tessuti Hb(O 2 ) 4 perde affinità per O 2, lo rilascia a causa delle basse po 2 e, essendo la forma deossigenata più affine per H +, si comporta come un ottimo tampone intracellulare (azione di alcuni residui di istidina). L'azione tampone si accompagna al trasporto dell'anidride carbonica.
69 EFFETTO BOHR In aggiunta al trasporto di O 2 dai polmoni ai tessuti, Hb trasporta anche due prodotti della respirazione, H + e CO 2, dai tessuti ai polmoni ed ai reni, organi deputati alla loro escrezione. Trasporto della CO 2 CO 2 liberamente disciolta nel plasma CO 2 trasportata come bicarbonato (HCO 3- ) CO 2 trasportata come carbammati(15-20%) formatosi dalla reazione con i gruppi α aminici terminali non ionizzati dell Hb
70 EFFETTO BOHR Dai tessuti verso i capillari, la CO 2 diffonde disciolta in acqua. Mentre negli eritrociti, l enzima anidrasi carbonica, catalizza la reazione seguente: CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - Si lega all Hb che viene indotta a rilasciare l O 2 H + HCO 3 - passano dal globulo rosso al plasma attraverso una proteina di membrana Quindi la maggior parte di CO 2 nel sangue viene trasportata sotto forma di bicarbonato.
71 EFFETTO BOHR Gli ioni H + si legano a 3 coppie di siti sull Hb: la più nota è l His 146 delle catene β Nei tessuti ad elevato metabolismo, come nei muscoli in attività in cui c è una notevole produzione di composti acidi e di CO 2, l Hb cede più facilmente l O 2 e lega gli H + e la CO 2. Nei polmoni avviene esattamente il contrario.
72 EFFETTO BOHR ph & pco 2 venoso arterioso Il legame di ioni H + induce l Hb a rilasciare l ossigeno nei tessuti e a legare la CO 2 prodotta dalla respirazione muscolare.
73 EFFETTO BOHR ph & pco 2
74 pco 2 pco 2 Influenza della pco 2
75 Influenza del ph tessuti polmoni
76 Influenza del 2,3- BPG 2,3-bisfosfoglicerato
77 Influenza del 2,3- BPG Il 2,3 BPG è una piccola molecola dotata di cariche negative che consentono il legame a una serie di cariche positive delle catene laterali di AA situati sulle due catene β, formando ponti salini e stabilizzando la forma T (deossigenata) Il sito per il 2,3 BPG è presente solo nella forma tesa T.
78 Influenza del 2,3- BPG Nell Hb deossigenata (T) è presente una cavità centrale che si restringe consistentemente in Hb in forma R (ossigenata): tale cavità nella forma T ospita il 2,3 BPG, modulatore allosterico negativo.
79 Influenza del 2,3- BPG Nell Hb deossigenata (T) è presente una cavità centrale che si restringe consistentemente in Hb in forma R (ossigenata): tale cavità nella forma T ospita il 2,3 BPG, modulatore allosterico negativo.
80 EMOGLOBINA FETALE (HbF) Il significato del 2,3 BPG appare chiaro se si confronta la curva di saturazione dell HbA materna e dell Hb e fetale. Gli eritrociti fetali contengono un Hb con struttura quaternaria α2 2. Fra le catene il 2,3-BPG si lega più debolmente rispetto a quello che avviene nell HbA. La curva di saturazione dell Hb fetale è a sinistra rispetto a quella della HbA materna, indicando maggiore affinità per O 2. L'O 2 rilasciato nella circolazione placentare dall Hb materna a certe pressioni parziali, viene assunto dall Hb fetale, più affine, e ciò soddisfa l'esigenza fisiologica di rifornimento di O 2 al feto da parte della madre.
81
82 emoglobinopatie Anemia falciforme
83 emoglobinopatie
84 Le talassemie
85 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
Nel corso dell evoluzione, con il passaggio dalla. progressivamente differenziati due meccanismi. un sistema circolatorio adeguato;
 PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado
PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado
Gli Enzimi. catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche
 catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
GLI ENZIMI ALLOSTERICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM)
 Effetti allosterici - Modelli d azione GLI ENZIMI ALLOSEICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM) Negli enzimi allosterici le
Effetti allosterici - Modelli d azione GLI ENZIMI ALLOSEICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM) Negli enzimi allosterici le
Mioglobina ed emoglobina
 Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
Mioglobina Emoglobina
 Mioglobina Emoglobina RESPIRAZIONE : assunzione di O 2 dall ambiente e rilascio di CO 2 La RESPIRAZIONE CELLULARE è un processo redox attraverso il quale vengono trasferiti atomi di idrogeno da un composto
Mioglobina Emoglobina RESPIRAZIONE : assunzione di O 2 dall ambiente e rilascio di CO 2 La RESPIRAZIONE CELLULARE è un processo redox attraverso il quale vengono trasferiti atomi di idrogeno da un composto
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine:
 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
Le proteine che legano l ossigenol
 Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Emoglobina e mioglobina
 Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
STRUTTURA E FUNZIONE
 STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
Regolano il metabolismo, sia come enzimi, sia come ormoni (insulina, glucagone, ecc.)
 Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme.
 1 Forma T Forma R Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme. 2 1 3 La forma sigmoide della curva indica che
1 Forma T Forma R Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme. 2 1 3 La forma sigmoide della curva indica che
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
EMOGLOBINA (Hb) nei globuli rossi e
 Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Modulo 4. Una proteina in azione
 Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Legano reversibilmente l OSSIGENO. La mioglobina (monomerica) è presente nelle cellule muscolari. L emoglobina (tetramerica) è presente negli
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Legano reversibilmente l OSSIGENO. La mioglobina (monomerica) è presente nelle cellule muscolari. L emoglobina (tetramerica) è presente negli
Mioglobina Emoglobina
 Mioglobina Emoglobina Eventi successivi i alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione
Mioglobina Emoglobina Eventi successivi i alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione
Ripiegamento e stabilità delle proteine
 Ripiegamento e stabilità delle proteine Ripiegamento e stabilità delle proteine La conformazione nativa di una proteina è quella a cui si associa la sua funzione biologica. Il termine stabilità può essere
Ripiegamento e stabilità delle proteine Ripiegamento e stabilità delle proteine La conformazione nativa di una proteina è quella a cui si associa la sua funzione biologica. Il termine stabilità può essere
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Le proteine che legano ossigeno:
 Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
EME (Fe-PROTOPORFIRINA IX)
 EME (Fe-PROTOPORFIRINA IX) 1,3,5,8-tetrametil 2,4-divinil 6,7-dipropionil-porfirina 1 Il ferro può formare sei legami di coordinazione 4 con gli azoti dell anello tetrapirrolico 2 perpendicolari al piano
EME (Fe-PROTOPORFIRINA IX) 1,3,5,8-tetrametil 2,4-divinil 6,7-dipropionil-porfirina 1 Il ferro può formare sei legami di coordinazione 4 con gli azoti dell anello tetrapirrolico 2 perpendicolari al piano
Trasporto gas nel sangue
 Trasporto gas nel sangue Trasporto O2 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 97% 3% O 2 disciolto nel plasma O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Trasporto gas nel sangue Trasporto O2 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 97% 3% O 2 disciolto nel plasma O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
proteine enzimi RNA ribozimi substrati altamente specifici -asi
 I catalizzatori sono sostanze che aumentano la velocità delle reazioni senza subire modificazioni. Un catalizzatore non induce una reazione che non può avvenire, fa solo in modo che avvenga più velocemente.
I catalizzatori sono sostanze che aumentano la velocità delle reazioni senza subire modificazioni. Un catalizzatore non induce una reazione che non può avvenire, fa solo in modo che avvenga più velocemente.
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
Trasporto dei gas. Pressioni Volumi
 Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Regolazione dell attività enzimatica. Allosteria Modificazioni covalenti Isoenzimi
 Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
Fisiologia della Respirazione
 Fisiologia della Respirazione 8.Trasporto dei gas nel sangue FGE aa.2016-17 Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità dell O 2 nel sangue: l emoglobina Curva di dissociazione
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue FGE aa.2016-17 Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità dell O 2 nel sangue: l emoglobina Curva di dissociazione
2) La presenza di gruppi funzionali specifici che partecipano alla catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o quelli
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
CATALISI COVALENTE. H 2 O Enz-R-OH + P. Enz-R-O S Enz-R-O-S
 CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale re dell enzima può comportarsi
CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale re dell enzima può comportarsi
Il metalloma Struttura e reattività di metalloproteine. Il trasporto dell O 2
 Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
- natura riduttiva - richiede energia
 - natura ossidativa - produce energia - natura riduttiva - richiede energia 1 L O 2 è poco solubile in acqua (10 ml/l a 20 C): se esso fosse semplicemente disciolto, potrebbe diffondere efficacemente solo
- natura ossidativa - produce energia - natura riduttiva - richiede energia 1 L O 2 è poco solubile in acqua (10 ml/l a 20 C): se esso fosse semplicemente disciolto, potrebbe diffondere efficacemente solo
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE
 FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
Emoglobina e mioglobina
 Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 Fisiologia della Respirazione 8.Trasporto dei gas nel sangue Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno
 Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno Eritrociti umani Ciascun eritrocita contiene circa 300 milioni di molecole di emoglobina Possiedono un motivo strutturale comune.
Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno Eritrociti umani Ciascun eritrocita contiene circa 300 milioni di molecole di emoglobina Possiedono un motivo strutturale comune.
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE 1) Il collagene è una proteina (globulare / fibrosa). È formata da tre (catene alfa/alfa eliche) con andamento (destrorso/sinistrorso) che vanno
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE 1) Il collagene è una proteina (globulare / fibrosa). È formata da tre (catene alfa/alfa eliche) con andamento (destrorso/sinistrorso) che vanno
ENZIMI : catalizzatori biologici
 ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
v = Δ[P] = _ Δ[S] S P
![v = Δ[P] = _ Δ[S] S P v = Δ[P] = _ Δ[S] S P](/thumbs/98/137173050.jpg) CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazione della concentrazione del prodotto o del reagente in un dato
CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazione della concentrazione del prodotto o del reagente in un dato
θ = (siti occupati)/(siti disponibili totali) Al numeratore ritrovo solo la mioglobina che ha complessato l'ossigeno, solo l'ossigenata)
 LEZIONE DEL 03/04/2017 Emoglobina - complesso del metallo di transizione (ferro protoporfirina IX) complesso metallorganico. Derivazione della curva di legame iperbolica dell'ossigeno della mioglobina
LEZIONE DEL 03/04/2017 Emoglobina - complesso del metallo di transizione (ferro protoporfirina IX) complesso metallorganico. Derivazione della curva di legame iperbolica dell'ossigeno della mioglobina
degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l l anidride carbonica tra i polmoni e i tessuti
 l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
Lo scambio gassoso negli animali
 Lo scambio gassoso negli animali Durante la RESPIRAZIONE CELLULARE (mitocondri) le cellule consumano O2 e producono CO2 L approvvigionamento di O2 e la rimozione della CO2 avvengono tramite SCAMBI GASSOSI
Lo scambio gassoso negli animali Durante la RESPIRAZIONE CELLULARE (mitocondri) le cellule consumano O2 e producono CO2 L approvvigionamento di O2 e la rimozione della CO2 avvengono tramite SCAMBI GASSOSI
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della
 Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della CO2 in direzione opposta. R = quoziente respiratorio,
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della CO2 in direzione opposta. R = quoziente respiratorio,
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI. A + B AB (100 Kcal= E. Attiv.) A + B AB (50 Kcal) SUBSTRATO ENZIMA E N E R G I A
 ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
REAZIONI CHIMICHE. Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: I reagenti (substrati) devono entrare in collisione
 ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
TRASPORTO CELLULARE. Movimento di molecole e ioni attraverso la membrana plasmatica
 TRASPORTO CELLULARE Movimento di molecole e ioni attraverso la membrana plasmatica Il trasporto attraverso le membrane è governato da Fattori cinetici Fattori termodinamici MEMBRANE BIOLOGICHE gradienti
TRASPORTO CELLULARE Movimento di molecole e ioni attraverso la membrana plasmatica Il trasporto attraverso le membrane è governato da Fattori cinetici Fattori termodinamici MEMBRANE BIOLOGICHE gradienti
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Eventi successivi alla comparsa dell O 2
 Eventi successivi alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione dell ossigeno: infatti,
Eventi successivi alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione dell ossigeno: infatti,
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
REAZIONI CHIMICHE. Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: I reagenti (substrati) devono entrare in collisione
 ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
Regolazione allosterica
 Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento
Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento
Trasporto O 2 nel sangue
 Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto (determina il valore di po 2 ) Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto (determina il valore di po 2 ) Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
Scaricato da 1
 A AB B Scaricato da www.sunhope.it 1 1 1 1 2 2 2 3 45 5 5 4 20 20 5 40 40 6 40 20 23 7 5 12 8 35 2 6 9 1 1 Numero di mole ecole 30 25 20 15 10 5 0 0 2 4 6 8 10 Energia Scaricato da www.sunhope.it 2 Scaricato
A AB B Scaricato da www.sunhope.it 1 1 1 1 2 2 2 3 45 5 5 4 20 20 5 40 40 6 40 20 23 7 5 12 8 35 2 6 9 1 1 Numero di mole ecole 30 25 20 15 10 5 0 0 2 4 6 8 10 Energia Scaricato da www.sunhope.it 2 Scaricato
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA
 PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
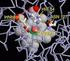 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
I Mitocondri Centrale elettrica cellulare
 I Mitocondri Centrale elettrica cellulare Potenziale redox standard Fe 2+ D Fe 3+ + e - Fe 2+ + Cu 2+ D Fe 3+ + Cu + Cu 2+ + e - D Cu + Ε = E + RT nf ln [accettore elettroni] [donatore elettroni] n = n
I Mitocondri Centrale elettrica cellulare Potenziale redox standard Fe 2+ D Fe 3+ + e - Fe 2+ + Cu 2+ D Fe 3+ + Cu + Cu 2+ + e - D Cu + Ε = E + RT nf ln [accettore elettroni] [donatore elettroni] n = n
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
2. Quale delle seguenti affermazioni relative ad una reazione enzimatica è vera?
 1. Gli enzimi agendo come catalizzatori: a) innalzano l'energia di attivazione b) innalzano il livello energetico dei prodotti c) abbassano il livello energetico dei reagenti d) diminuiscono l'energia
1. Gli enzimi agendo come catalizzatori: a) innalzano l'energia di attivazione b) innalzano il livello energetico dei prodotti c) abbassano il livello energetico dei reagenti d) diminuiscono l'energia
Informazioni sul corso a.a v.1. Insegnamento di Biochimica 090SM BIO/10 6 CFU 48 ore
 Informazioni sul corso a.a 2017-18 v.1 Insegnamento di Biochimica 090SM BIO/10 6 CFU 48 ore Informazioni sul corso Marco Scocchi Dip. Di Scienze della Vita - Prof. Associato Tel. 040-5588704 mscocchi@units.it
Informazioni sul corso a.a 2017-18 v.1 Insegnamento di Biochimica 090SM BIO/10 6 CFU 48 ore Informazioni sul corso Marco Scocchi Dip. Di Scienze della Vita - Prof. Associato Tel. 040-5588704 mscocchi@units.it
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
Fondamenti di Chimica Farmaceutica. Inibizione enzimatica
 Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Determinazione dell attività enzimatica
 Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
catalizzatori biologici RUOLO DEGLI ENZIMI: 16/03/15
 I sistemi viventi sono caratterizzati da un enorme varietà reazioni chimiche la maggior parte delle quali è mediata da una serie di eccezionali CATALIZZATORI BIOLOGICI : GLI ENZIMI L ENZIMOLOGIA E UNA
I sistemi viventi sono caratterizzati da un enorme varietà reazioni chimiche la maggior parte delle quali è mediata da una serie di eccezionali CATALIZZATORI BIOLOGICI : GLI ENZIMI L ENZIMOLOGIA E UNA
Riabilitativa 2015/2016
 Emoglobina e collageno Spina Riabilitativa 2015/2016 WWW.SUNHOPE.IT Alla grande varietà di strutture tridimensionali corrisponde una grande varietà di funzioni Ogni proteina presenta diversi livelli di
Emoglobina e collageno Spina Riabilitativa 2015/2016 WWW.SUNHOPE.IT Alla grande varietà di strutture tridimensionali corrisponde una grande varietà di funzioni Ogni proteina presenta diversi livelli di
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
 Costante catalitica o n di Turnover k 1 k 2 S + E ES E + P k -1 Vmax = k 2 [ES] = k 2 [E] TOT k Vmax 2 = [E] TOT k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
Costante catalitica o n di Turnover k 1 k 2 S + E ES E + P k -1 Vmax = k 2 [ES] = k 2 [E] TOT k Vmax 2 = [E] TOT k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
: : H-Cl + H-N: H-N-H + : Cl : H
 Negli organismi viventi la maggior parte dell energia libera richiesta per promuovere le reazioni biochimiche deriva dall ossidazione dei substrati organici. L ossigeno, l accettore finale degli elettroni
Negli organismi viventi la maggior parte dell energia libera richiesta per promuovere le reazioni biochimiche deriva dall ossidazione dei substrati organici. L ossigeno, l accettore finale degli elettroni
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
5. Trasporto di membrana
 5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
- CINETICA ENZIMATICA
 - CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
- CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO)
 CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) - Decarb. ossid. piruvato - -Ossidazione acidi grassi - Vie ossidative aa -Ciclo di Krebs avvengono tutte nella matrice mitocondriale In tutte queste
CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) - Decarb. ossid. piruvato - -Ossidazione acidi grassi - Vie ossidative aa -Ciclo di Krebs avvengono tutte nella matrice mitocondriale In tutte queste
