GRUPPI PROSTETICI : il gruppo eme dei citocromi
|
|
|
- Dionisia Silvana Massaro
- 4 anni fa
- Visualizzazioni
Transcript
1 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni blande di Temperatura e ph Hanno pesi molecolari >> dei substrati o gruppi funzionali su cui agiscono Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
2 I cofattori possono essere Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + Alcuni Cofattori sono associati solo temporaneamente COSUBSTRATI Alcuni Cofattori sono associati in modo permanente con la proteina, anche mediante legami covalenti: GRUPPI PROSTETICI : il gruppo eme dei citocromi Il complesso La proteina enzima-cofattore cataliticamente attivo = oloenzima cataliticamente inattiva = apoenzima Apoenzima (inattivo) + cofattore oloenzima ( attivo)
3 I coenzimi vengono modificati chimicamente durante le reazioni : NADH, FADH 2 Per completare il ciclo catalitico, il coenzima deve tornare al suo stato originale: reazione di rigenerazione anche a carico di un E. diverso Alcune vitamine idrosolubili sono precursori di coenzimi le VITAMINE devono essere presenti nella dieta Si ritiene che le vie biochimiche per la sintesi delle vitamine siano andate perse negli animali superiori durante il corso dell evoluzione perché superflue.
4 Coenzima Precursore Funzione Enzimi Tiamina pirofosfato Tiamina (Vitamina B 1 ) Trasporto gruppo aldeidico "attivato" Decarbossilazione α-chetoacidi Piruvico deidrogenasi Piruvico decarbossilasi FAD e FMN Riboflavina (Vitamina B 2 ) Trasferimento di atomi di H (elettroni) Succinico deidrogenasi Acil-CoA deidrogenasi NAD e NADP Acido nicotinico (Vitamina PP) Trasferimento di atomi di H (elettroni) Deidrogenasi piridiniche Coenzima A Acido pantotenico "Attivazione" e trasporto di gruppi acile o acetile Diidrolipoil transacetilasi Acil-CoA sintetasi - Le vitamine liposolubili come la D e la A, non sono componenti di coenzimi.
5 NAD= Nicotinammide-adenin -dinucleotide è un nucleotide PIRIDINICO nicotin amide adenina La nicotinamìde è, anche conosciuta come niacina (o vitamina PP, Pellagra-Preventing) e derivata dalla piridina. È questa struttura che svolge il ruolo biologico generale della molecola, potendo essa donare/accettare atomi di idrogeno. L'adenina è presente negli acidi nucleici, essendo una delle cinque basi azotate, e si trova inoltre nell'atp, nell'adp e nell'amp.e una base detta purinica Il di-nucleotide è contrassegnata dai numeri 3 e 4.In ciascuno di essi è presente un gruppo fosfato ed uno zucchero pentoso, il ribosio.
6 Il NADP differisce dal NAD per avere il ribosio adenosinico fosforilato in posizione 2'. Il gruppo funzionale è la nicotinammide, derivata dall'acido nicotinico o niacina. La nicotinammide accetta uno ione idruro (un protone con una coppia di elettroni) dal substrato, riducendosi, mentre il secondo idrogeno viene rilasciato nel mezzo come ione H +. A differenza dalle flavoproteine, i coenzimi piridinici non sono legati saldamente alla deidrogenasi, ma funzionano piuttosto come cosubstrati.
7 FMN il gruppo isoallosazinico della flavina, il quale è a sua volta legato al ribitolo (aldolo a cinque atomi di carbonio, ovvero il composto derivato dalla riduzione del ribosio) tramite l'atomo di azoto (N) dell'anello centrale. Se l'fmn, reagisce con un'altra molecola di ATP, quest'ultimo rilascia sia il nucleotide adeninico che il gruppo fosfato in α. si forma il FAD Il FMN (Flavin Mono Nucleotide) è semplicemente la riboflavina fosforilata sul CH 2 OH terminale. Non è un vero nucleotide, manca dello zucchero pentosio.
8 FAD e FMN sono i coenzimi derivanti dalla RIBOFLAVINA (Vit B2) FAD e FMN sono i coenzimi tipici delle flavoproteine = enzimi che trasferiscono elettroni. Gli elettroni (atomi di H) possono essere trasferiti singolarmente o in coppia. Entrambi i coenzimi sono saldamente legati alla proteina gr. prostetici;
9 Nucleotidi Flavinici FAD Flavinadenindinucleotide Nel FAD (Flavin Adenin Dinucleotide), la riboflavina è legata tramite il CH 2 OH terminale al gruppo pirofosforico di un ADP
10 L'acido pantotenico (vitamina B5) è un componente essenziale del Coenzima A. va incontro ad una fosforilazione e legame con ß-mercapto-etilammina Il Coenzima A ha la funzione di trasportare gruppi acetile in forma "attivata". Il gruppo trasportato è legato al gruppo funzionale tiolico (-SH) legame tioestere con elevata energia libera di idrolisi: grazie a questa caratteristica le reazioni di trasferimento del gruppo acetile possono procedere spontaneamente. CoA-SH
11 Il piruvato viene decarbossilato e da origine a una forma attivata di acetato Acetil-CoA
12 Gli enzimi non influiscono sul rapporto dell equilibrio fra reagenti e prodotti: Le velocità delle reazioni, in entrambe le direzioni, vengono aumentate della stessa entità Non sono in grado di fare avvenire una reazione non spontanea, ( ΔG>0 energicamente in salita ) La reazione dell enzima (catalisi) avviene nel SITO ATTIVO = Tasca o fenditura sulla superficie dell E. sito di legame per il substrato gruppi catalitici Gr. COOH o NH 2 di catene laterali di a.a -S- di cisteina Cofattori che garantiscono la rottura e formazione di legami
13 Il legame del substrato con sito attivo coinvolge interazioni non covalenti La forma e la polarità del sito di legame sono responsabili della specificità enzimatica Esiste complementarietà fra la forma e la polarità del substrato con quelle del sito attivo Meccanismo della catalisi enzimatica Nel 1894 teoria di Emil Fischer Modello chiave-serratura contatto rigido fra E e S Tale adattamento non consentirebbe una reazione reversibile essendo P diverso da S Nel 1958: ipotesi dello Adattamento indotto La vicinanza di S o P all Enzima provoca modificazioni della conformazione del sito attivo dell E Migliore combinazione E-S e E-P
14
15 L'enzima esochinasi è un buon esempio del modello dell'adattamento indotto: quando il glucosio si avvicina al sito attivo, l'enzima cambia conformazione, avvolgendosi attorno al substrato
16 Come agisce un enzima? Consideriamo la reazione di I ordine : A P A= reagente P= prodotto A temperatura costante, la velocità di reazione è proporzionale alla frequenza con cui le molecole di A si incontrano La velocità è proporzionale alla concentrazione di A La velocità di reazione : intesa come comparsa del prodotto P o scomparsa V = d P = - d A = K A dt dt del reagente A K = cost. di velocità. E la costante di proporzionalità
17 m n m ed n esponenti determinano l'ordine di reazione, rispetto al proprio componente la somma m+n determina l'ordine globale della reazione m n ordine globale di reazione legge cinetica
18 E una reazione bimolecolare di II ordine : 2 tipi di reagenti A reagisce con B, dando origine a P e Q. 2 molecole di reagenti diversi devono incontrarsi simultaneamente Collisione formazione di P e Q Le concentrazioni di A e B diminuiscono mentre quelle di P e Q aumentano. Esprimiamo la velocità in un certo periodo di tempo tramite il rapporto tra la variazione di concentrazione di un reagente o di un prodotto e l intervallo di tempo considerato v = K A B il segno - indica la variazione negativa della concentrazione dei reagenti
19 Affinchè la reazione avvenga : Alcune molecole di A e B devono possedere + energia rispetto alle altre STATO ATTIVATO raggiungimento dello STATO DI TRANSIZIONE Punto + alto della barriera energetica E uno stato instabile, le molecole possono: o trasformarsi nei prodotti o tornare allo stato non eccitato con emissione di energia (calore, luce) La probabilità che una reazione avvenga in una direzione dipende dal ΔG fra reagenti e prodotti ΔG < 0 la reazione procede spontaneamente verso i prodotti ΔG > 0 è la reazione inversa a procedere spontaneamente
20 Nello stato di transizione i reagenti sono parzialmente convertiti in prodotti Energia di attivazione = energia (calorie) richiesta per portare 1 mole di reagente allo stato di transizione La velocità di una reazione chimica è proporzionale alla concentrazione delle molecole allo stato di transizione
21 H 2 + I 2 2 HI
22 Vi sono 2 vie per aumentare la velocità di reazione 1. Incremento della Temperatura aumento dei moti termici delle molecole aumento del numero di molecole con en. interna sufficiente a raggiungere lo stato di transizione La vel. quasi si raddoppia per ogni aumento di T=10 C Q 10 è il rapporto tra vel di reazione a una data temp. e la vel della reaz ad una temp inferiore di 10 C Q 10 = 2 2. Impiego di un catalizzatore abbassamento della barriera energetica Il catalizzatore si combina transitoriamente con A e B in un complesso con uno stato di transizione energeticamente + basso
23 Abbassamento dell energia di attivazione Maggior numero di molecole nell unità di tempo in grado di reagire rispetto al numero che reagirebbero in assenza di catalizzatore Alla fine della reazione il catalizzatore viene rilasciato e può combinarsi con altre molecole di A e B
24 Reazione chimica a 2 tappe 2 stati di transizione 2 diverse energie di attivazione
25 La velocità di una reazione catalizzata si può misurare progressivamente nel tempo mediante saggi discontinui o saggi continui La velocità di reazione diminuisce con il passare del tempo: Se il substrato si consuma :la concentrazione di substrato non è elevata Se la reazione è reversibile : la formazione del prodotto innesca la reazione contraria L enzima può andare incontro a denaturazione Il prodotto di reazione può inibire l attività dell enzima Per misurare la velocità di una reazione enzimatica conviene misurare la velocità iniziale (V 0 )
26 misurando la velocità iniziale (V 0 ) tutti i fattori prima elencati sono trascurabili Se la concentrazione del substrato S è maggiore dell Enzima S >> E e il tempo di analisi è ridotto La quantità di S trasformato è trascurabile e può essere considerata costante nel tempo
27
28
29
30 Cinetica di reazioni enzimatiche ad un substrato. La prima equazione generale di velocità per una reazione enzimatica fu derivata nel 1903 da Victor Henri. la velocità iniziale della reazione è direttamente proporzionale alla concentrazione dell'enzima, ma cresce in modo non lineare al crescere della concentrazione del substrato fino ad un valore limite massimo Gli studi di Henri furono ripresi ed ampliati da Michaelis e Menten (1913) che hanno dato il nome alla equazione generale di velocità di reazioni enzimatiche ad un substrato.
31 Il meccanismo di reazione proposto prevede: La prima assunzione è nota come del "quasi equilibrio" o dello "equilibrio rapido" la formazione del complesso ES è una reazione molto veloce ed è reversibile : Il complesso enzima-substrato è in equilibrio con l'enzima libero ed il substrato questa situazione di equilibrio non è disturbata dalla formazione del prodotto: la velocità di formazione del prodotto a partire da ES è molto piccola rispetto alla velocità con cui ES si scinde a dare E+S k3 <<k2
32 L E si combina reversibilmente con S in una reazione veloce Il complesso ES si scinde in una reazione lenta che rappresenta la tappa limitante Briggs e Haldane (1925) introdussero l assunzione dello "stato stazionario" [ES] rimane costante assumendo k3 <<k2 cioè la velocità di trasformazione di ES in E+P sia trascurabile la concentrazione di ES è costante quando la sua velocità di formazione di ES eguaglia la sola velocità di decomposizione in E+S (K1=K2)
33 In ogni istante l Enzima è presente in 2 forme Forma libera E Forma legata ES Equazione di conservazione di massa per l'enzima La velocità della reazione sarà max quando tutto sarà come complesso ES e la concentrazione di enzima libero E sarà minima Questa condizione si verifica quando [S] >> [E] la concentrazione del substrato è molto più grande della concentrazione dell'enzima [S] è elevata l E reagirà velocemente con S e sarà sempre saturo con il substrato Forma ES stato stazionario
34 ENZIMA-SUBSTRATO
35 Stato stazionario: La conc di ES resta costante: Velocità di sintesi = Vel di consumo quando tutto S viene consumato l E torna ad essere libero conversione max in P l'equazione di velocità di formazione del prodotto si può esprimere come funzione della concentrazione di ES:
36 RAPPRESENTAZIONE GRAFICA
37 Le cinetiche enzimatiche vengono di solito determinate in condizioni di Stato stazionario L'assunzione [S] >> [E tot ] garantisce che tutto l'enzima sia presente in forma di complesso con il substrato, per cui potremo scrivere ma k 3 [ES] non è altro che la massima velocità ottenibile per una data quantità di enzima in condizioni di saturazione del substrato.
38 l'equazione di velocità delle reazioni enzimatiche viene descritta con l equazione di Michaelis-Menten: la velocità iniziale di una reazione enzimatica ad un substrato è in relazione tramite due costanti (Vmax e Km) con la sola concentrazione del substrato, che per la assunzione [S] >> [Etot ] è assimilabile sempre alla concentrazione iniziale di substrato.
39 La Vmax indica la saturazione dell enzima a [S] infinita La Km è una costante che dipende dal sistema enzimatico considerato, correlata alla costante di dissociazione di ES, rappresenta la concentrazione di S richiesta perché la vel di reazione sia V = ½ della Vmax
40 Vmax Km
41 Minore è il valore di Km Solitamente maggiore sarà il legame (affinità) fra E e S 1 μm < Km < 1 mm Conoscendo la Vmax e la Km di un enzima si può calcolare la velocità di reazione ad una data concentrazione di S Un E. che catalizza una reazione fra 2 o + substrati diversi avrà una diversa Km per ciascun substrato
42 Importanza della Km: Rappresenta una misura inversa dell affinità dell E per un dato S: Minore è la Km + stabile è il complesso ES Se lo stesso E catalizza una reazione con 2 substrati simili Es: Glucosio e Fruttosio Il substrato su cui agirà + di frequente è quello con Km minore La Km dà informazioni sulla concentrazione di un substrato nel comparto cellulare dove avviene la reazione: Enzimi che catalizzano reazioni a concentrazioni elevate di substrato (saccarosio) avranno Km elevate Enzimi che catalizzano reazioni con substrati presenti a concentrazioni molto basse (ormoni) Km piccole
43 EQUAZIONE DI LINEWEAVER BURK O DIAGRAMMA DEI DOPPI RECIPROCI È il metodo migliore per calcolare Km e Vmax è il reciproco dell equazione di Michaelis-Menten:
44 E l equazione di una retta
45
46 le variabili sono 1/v e 1/[S] 1/Vmax è l' intercetta sull' asse y -1/Km è l' intercetta sull' asse x.
47 E l equazione di una retta che occupa il I e II quadrante A concentrazioni crescenti di S la retta assume valori decrescenti e si può calcolare 1/Vmax Migliore situazione nell intervallo 0,5 Km < S < 5 Km Quando la S è elevata i punti tendono ad affollarsi Uno svantaggio è che per molti valori di S si va nel quadrante sinistro del grafico
48 INIBIZIONE ENZIMATICA INIBITORE= qualsiasi agente in grado di diminuire la velocità di una reazione catalizzata INATTIVATORE quando l inibizione è irreversibile Inibitori IRREVERSIBILI formano legami covalenti con gli enzimi denaturano gli Enzimi Inibitori REVERSIBILI formano legami deboli e non covalenti 3 tipi di inibizione reversibile: Inibizione COMPETITIVA Aumenta la Km e non ha nessun effetto sulla Vmax Inibizione NON COMPETITIVA Diminuisce Vmax, la Km resta inalterata Inibizione INCOMPETITIVA Diminuiscono Km e Vmax
49 Inibizione competitiva L inibitore competitivo compete con S per il sito catalitico È una molecola molto simile a S Può adattarsi e legarsi al sito dell E ma non può reagire con l E Es. inibizione competitiva: L'acido malonico è in grado di legarsi nel sito attivo dell' enzima, ma non può essere ossidato avendo un solo gruppo CH 2
50 per l assunzione dell equilibrio rapido K I = E I EI e + basso è il valore di KI, maggiore è l inibizione Parte dell enzima è sottratto alla reazione come EI diminuzione dell affinità per S aumento della Km Km apparente
51 Aumento della Km di un fattore α = (1 + [ I ] / KI) La velocità massima della reazione non è influenzata dalla presenza dell'inibitore ad elevate concentrazioni di substrato tutto l'enzima viene complessato in forma di ES. la reazione è rallentata la Vmax è raggiunta + tardi
52 La Vmax è raggiunta con una quantità maggiore di S K m I Km 2 Enzima non inibito Enzima inibito K m I < Km 2
53 Km Vmax Aumento del coefficiente angolare (pendenza) il valore aumentato di Km ci dice che più substrato è necessario per raggiungere la stessa Vmax / 2 che si avrebbe in assenza dell'inibitore Km app> Km La Km apparente non è costante è in funzione del fattore α che considera I
54 Inibizione non competitiva Un inibitore non competitivo è una sostanza che si lega sia all'enzima libero che al complesso ES La presenza di I non impedisce ad S di legarsi ( e viceversa) l'inibitore non ha alcun effetto sul legame del substrato con l' enzima, ed il substrato non ha alcun effetto sulla formazione del legame tra inibitore ed enzima, in quanto entrambi si legano reversibilmente all' enzima in síti differenti. ES ed ESI hanno le stesse costanti di dissociazione E ed EI hanno quindi uguale affinità per S
55 I si lega tanto ad E che a ES S si lega sia ad E che a EI. La presenza di uno di essi non ha alcun effetto sulla costante di dissociazione dell'altro, ma il complesso ESI è inattivo in presenza di I, anche ad infinite concentrazioni di S, l'enzima non potrà essere tutto sotto forma di ES, ma parte rimarrà come complesso non-produttivo ESI. La presenza di un inibitore non competitivo fa sembrare che meno enzima sia presente
56 Vmax 1 Vmax 2 Vmax 2 < Vmax 1 Gli inibitori si legano reversibilmente in un sito diverso dal sito attivo. Una parte dell enzima resta inattivo L inibizione non è influenzata dalla concentrazione del substrato S
57 Vmax sarà più bassa in presenza dell'inibitore; la Km non sarà variata in quanto i complessi ES ed ESI hanno le stesse costanti di dissociazione E ed EI hanno quindi uguale affinità per S
58 Strutturalmente gli inibitori non competitivi sono meno simili a S rispetto a quelli competitivi Sono metalli pesanti, fluoruri Es: l eccesso di O 2 può provocare l ossidazione di gruppi -SH vicini : - rimozione di H - formazione di ponti S S Modificazione della struttura dell Enzima Il sito attivo non può + combinarsi con S Anche gli agenti denaturanti per le proteine: Acidi e basi forti, detergenti, urea Rottura legami H Inibizione non competitiva
59 Inibizione incompetitiva o Acompetitiva Un inibitore incompetitivo è una sostanza che si lega reversibilmente solo al complesso ES dando origine al complesso non produttivo ESI i rispettivi valori all'equilibrio: La causa può essere: o il substrato sia direttamente coinvolto nel legare l'inibitore, o il substrato produca dei cambiamenti conformazionali nel sito dell'inibitore da permettergli di entrare. In presenza di una qualsiasi concentrazione di I, per quanto elevata possa essere la concentrazione di S, l'enzima non può essere presente solo come ES
60 presenza di rette parallele: - la Vmax e la Km sono diminuite dello stesso fattore. La Vmax raggiunta è inferiore a quella dell E non inibito il valore della Km apparente sarà più basso: il complesso ESI non può liberare il substrato, mostrando per esso una affinità infinita (KS = 0)., L inibizione aumenta con l aumento della concentrazione di S in quanto l'inibitore incompetitivo si lega al solo complesso ES, e la [ES] cresce al crescere di [ S ].
61 L'inibitore incompetitívo è inibitore per il suo effetto sulla Vmax, ma è virtualmente un attivatore per quanto riguarda la Km Gli inibitori incompetitivi sono poco rappresentati:
62 ph Ogni enzima ha il suo valore ottimale di ph In genere 6 > ph ottimale < 8 I diagrammi delle attività enzimatiche in Funzione del ph possono essere: 1. Curve a campana 2. Curve quasi piatte - a valori estremi di ph Denaturazione dell enzima - Il ph influenza anche la ionizzazione dei Gruppi COOH e NH 2 importanti per l attività catilitica
63 Temperatura Le piante non possono regolare la loro temperatura la velocità delle reazioni enzimatiche aumenta da 0 a C Aumento dell energia cinetica delle molecole - La temperatura può agire modificando la conformazione dell enzima Effetto sulla Km e Vmax - Enzimi diversi, ma della stessa famiglia possono rispondere in modo diverso alla temperatura A temp > C o Temp basse : Denaturazione = Inattivazione dell enzima
64 Le temperature ottimali dipendono dall habitat delle piante : - Nelle piante alpine e artiche : Enzimi fotosintetici con una temp ottimale di C - Nelle piante dei climi temperati ( mais ) la temperatura ottimale per gli stessi enzimi è 30 C ISOZIMI enzimi in grado di agire sullo stesso substrato e di convertirlo nello stesso prodotto, sono molto simili hanno piccole differenze nella sequenza degli a.a Differenze codificate a livello genetico, traduzionale Una pianta con isozimi differenti in grado di catalizzare la stessa reazione Gli isozimi differiscono nella risposta a fattori ambientali
65 Le ISOFORME degli enzimi sono modificazioni post-traduzionali : Gli E. dopo la sintesi subiscono modificazioni chimiche che possono influenzare la loro attività catalitica Le isoforme sono codificate dallo stesso gene stessa sequenza di a.a. Le modificazioni successive sono dovute a: - Fosforilazione di un OH di un a.a. - Glicosilazione attacco di 1 o + zuccheri - Metilazione attacco di CH 3 Tali modificazioni che possono avvenire nella stessa cellula e in diversi stadi di sviluppo inducono un altro tipo di regolazione sull enzima. Es: La luce induce segnali nelle piante che si traducono in meccanismi di fosforilazione o defosforilazione di certe proteine enzimatiche L enzima modificato risponde meglio all ambiente
66 L azione di enzimi può essere inibita da - ioni o molecole estranei alterazione della configurazione mancata formazione del complesso ES - normali costituenti cellulari, prodotti del metabolismo attivazione o inibizione dell attività enzimatica INIBIZIONE da feedback o da prodotto finale È l inibizione a carico di un metabolita non correlato chimicamente al normale substrato su cui agisce l enzima inibito È un importante meccanismo di regolazione metabolica gli organismi producono solo quantità adeguate dei composti che utilizzano
67 INIBIZIONE da feedback o da prodotto finale si verifica solo quando f è in concentrazione elevata ATTIVAZIONE a è il substrato di 2 enzimi con 2 diverse vie e 2 diversi prodotti finali: Una sintesi eccessiva di k viene impedita dall attivazione di k sull E della I reazione nella sequenza che porta alla formazione di e
68 REGOLAZIONE e CONTROLLO dell attività enzimatica ENZIMI REGOLATORI = enzimi capaci di modulare la loro attività catalitica positivamente o negativamente in risposta a certi segnali Enzimi allosterici azione regolata dal legame reversibile, non covalente di piccole molecole (modulatori) Sono proteine con maggiore complessità (+ subunità) e contengono due o più siti di legame : siti allosterici (diversi e distinti dal sito catalitico) (Allo= diverso; stereo= forma) La formazione del legame con il modulatore nel sito allosterico modificazione transitoria e reversibile della conformazione dell enzima Influenza sul sito attivo inibizione o attivazione dell attività enzimatica
69 Cooperatività = cambiamento della costante di legame della proteina nei confronti di piccole molecole a causa di precedente formazione di legami con un'altra piccola molecola La costante di legame è analoga al Ks per il substrato e alla Ki per l'inibitore il legame di 1 molecola del modulatore (o S) alla proteina aumenterà o diminuirà la capacità della proteina di legare una II A molecola di modulatore ( o S). cooperatività positiva Se la modificazione aumenta la capacità di legame (o affinità) cooperatività negativa Se questa capacità di legame viene diminuita. Due meccanismi per spiegare le proprietà delle proteine e degli enzimi allosterici. 1. ipotesi corcertata, o simmetrica, ( o ipotesi MWC), 2. ipotesi sequenziale. (o ipotesi KNF).
70 Ipotesi concertata o simmetrica Si basa sull'idea che un enzima allosterico sia costituito da un certo numero di subunità che possono esistere in due differenti conformazioni: 1. stato R, forma attiva, ad alta affinità (Conformazione Rilassata) 2. stato T, forma inattiva a bassa affinità. (Conformazione Tesa) Le subunità di un particolare enzima interagiscono in modo tale da avere tutte la stessa conformazione. l'enzima deve essere costituito o da soli R o da soli T, non sono ammesse miscele. equilibrio tra due forme consistenti o solo di subunità R o solo di T.
71 Quando il modulatore è il substrato Il substrato è più probabile che si leghi alla conformazione R data la maggiore affinità. Spostamento dell equilibrio verso sinistra diminuisce la concentrazione della forma T e aumenta quella della forma R. Aumento della probabilità di transizione dalla forma inattiva a quella attiva cooperatività positiva
72 Nel caso degli Effettori (o modulatori) Allosterici L'enzima avrà un sito di legame con l'effettore che, come il sito attivo, modificherà le sue proprietà con la conversione tra le forme R e T. Un attivatore si legherà più fortemente allo stato R, in modo simile a quanto fatto dal substrato, e avrà lo stesso effetto sull'equilibrio, di spostarlo verso la più alta affinità verso il substrato, un inibitore si legherà alla forma T spostando l'equilibrio in direzione inversa, di minore affinità. In seguito alla presenza di un attivatore più molecole di enzima si trovano nella conformazione R, con conseguente diminuzione di lavoro per convertire T in R.
73 L'ipotesi sequenziale accetta la possibilità che possano trovarsi enzimi misti, contenenti cioè entrambe le subunità. Le forme pure R e T rappresentano gli estremi di questo equilibrio. l effettore (in questo esempio è il S) ha un'influenza più diretta sulla forma dell'enzima. In assenza di substrato l'enzima esisterebbe quasi interamente nella forma T Quando il substrato entra nel sito attivo a causa delle collisioni casuali, adattamento indotto = la subunità a cui si è legato il substrato viene convertita nella conformazione R.
74 un'unità è stata convertita in R, mentre le altre si trovano ancora nello stato T. le subunità sono legate l'una all'altra e interagiranno tra loro. il cambiamento di forma tende a spingere le altre subunità verso la forma R cooperatività positiva da substrato più unità si potranno trovare nello stato a maggiore affinità. Influenza degli effettori allosterici:. Un attivatore lavora allo stesso modo del substrato, anche se si lega ad un sito differente della subunità, un inibitore rende l'enzima più rigido e diventa più difficile l'adattamento indotto con il cambio da R a T. Cooperatività Negativa da substrato (non è un fenomeno comune) : le interazioni tra subunità sono tali che la conversione di una di loro alla forma R per adattamento indotto rende più difficili il cambiamento delle altre.
75 Gli enzimi allosterici spesso non seguono la cinetica di M.M. forma sigmoidale della curva: a basse concentrazioni di substrato un aumento di concentrazione del substrato lieve incremento della velocità Interazione di tipo cooperativo fra le subunità dell Enzima Ad alti livelli di substrato il grafico è molto simile all'iperbolico Il legame con effettori allosterici positivi o negativi possono influenzare il legame con S (Km, Vmax)
76 La presenza di un attivatore, aumenta la velocità di reazione mentre l'inibitore la deprime, L'inibitore esalta la forma sigmoidale allungando il piede della curva, mentre l'attivatore ha l'effetto opposto fino alla completa scomparsa del piede per alte concentrazioni di attivatore giungendo ad una curva iperbolica. Tutte le curve tendono al valore di Vmax. Gli effettori operano sulla capacità di legare il substrato cioè sulla Km.
77
Alcuni Cofattori sono associati in modo permanente con la proteina, anche mediante legami covalenti: GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + COSUBSTRATI GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + COSUBSTRATI GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Alcuni Cofattori sono associati in modo permanente con la proteina, anche mediante legami covalenti: GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
Coenzimi. Ioni essenziali. Molti coenzimi hanno come precursori le vitamine.
 COENZIMI Molti enzimi richiedono l associazione con particolari COFATTORI per poter esplicare la loro attività catalitica. Ioni essenziali Coenzimi Ioni attivatori, Mg 2+, K +, Ca 2+ (legati debolmente)
COENZIMI Molti enzimi richiedono l associazione con particolari COFATTORI per poter esplicare la loro attività catalitica. Ioni essenziali Coenzimi Ioni attivatori, Mg 2+, K +, Ca 2+ (legati debolmente)
proteine enzimi RNA ribozimi substrati altamente specifici -asi
 I catalizzatori sono sostanze che aumentano la velocità delle reazioni senza subire modificazioni. Un catalizzatore non induce una reazione che non può avvenire, fa solo in modo che avvenga più velocemente.
I catalizzatori sono sostanze che aumentano la velocità delle reazioni senza subire modificazioni. Un catalizzatore non induce una reazione che non può avvenire, fa solo in modo che avvenga più velocemente.
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Regolazione dell attività enzimatica. Allosteria Modificazioni covalenti Isoenzimi
 Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
2) La presenza di gruppi funzionali specifici che partecipano alla catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o quelli
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA
 Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Processi molecolari in cui è coinvolto il consumo
Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Processi molecolari in cui è coinvolto il consumo
Casi più complicati. inibizione mista (competitiva e non competitiva)
 Casi più complicati inibizione mista (competitiva e non competitiva) reazioni reversibili reazioni a più substrati effetto del ph inibizione mista (competitiva e non competitiva) K I K I E + I EI ES +
Casi più complicati inibizione mista (competitiva e non competitiva) reazioni reversibili reazioni a più substrati effetto del ph inibizione mista (competitiva e non competitiva) K I K I E + I EI ES +
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA
 Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
2. Quale delle seguenti affermazioni relative ad una reazione enzimatica è vera?
 1. Gli enzimi agendo come catalizzatori: a) innalzano l'energia di attivazione b) innalzano il livello energetico dei prodotti c) abbassano il livello energetico dei reagenti d) diminuiscono l'energia
1. Gli enzimi agendo come catalizzatori: a) innalzano l'energia di attivazione b) innalzano il livello energetico dei prodotti c) abbassano il livello energetico dei reagenti d) diminuiscono l'energia
REAZIONI CHIMICHE. Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: I reagenti (substrati) devono entrare in collisione
 ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
Fondamenti di Chimica Farmaceutica. Inibizione enzimatica
 Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
REAZIONI CHIMICHE. Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: I reagenti (substrati) devono entrare in collisione
 ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI : catalizzatori biologici
 ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Respirazione cellulare: processi molecolari medianti i quali le cellule consumano O 2 e producono CO 2
 AVVERTENZA Il presente materiale didattico è messo a disposizione degli studenti per facilitare la comprensione degli argomenti trattati nel corso delle lezioni e lo studio individuale Non sostituisce
AVVERTENZA Il presente materiale didattico è messo a disposizione degli studenti per facilitare la comprensione degli argomenti trattati nel corso delle lezioni e lo studio individuale Non sostituisce
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
Il laboratorio di Biochimica si svolgerà nei seguenti giorni;
 Il laboratorio di Biochimica si svolgerà nei seguenti giorni; Lunedì 7 marzo 2016 Lezione 9-11 aula 1 Martedì 8 marzo Mercoledì 9 marzo ESERCITAZ. Lab. PP1 Giovedì 10 marzo 14:00-18:00 La frequenza è obbligatoria
Il laboratorio di Biochimica si svolgerà nei seguenti giorni; Lunedì 7 marzo 2016 Lezione 9-11 aula 1 Martedì 8 marzo Mercoledì 9 marzo ESERCITAZ. Lab. PP1 Giovedì 10 marzo 14:00-18:00 La frequenza è obbligatoria
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
 Costante catalitica o n di Turnover k 1 k 2 S + E ES E + P k -1 Vmax = k 2 [ES] = k 2 [E] TOT k Vmax 2 = [E] TOT k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
Costante catalitica o n di Turnover k 1 k 2 S + E ES E + P k -1 Vmax = k 2 [ES] = k 2 [E] TOT k Vmax 2 = [E] TOT k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
CINETICA ENZIMATICA - velocità di reazione
 [P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
[P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
PRINCIPALI CARATTERISTICHE DEGLI ENZIMI. 1) Aumentano la velocità di reazione. 2) Non modificano l equilibrio della reazione
 PRINCIPALI CARATTERISTICHE DEGLI ENZIMI 1) Aumentano la velocità di reazione 2) Non modificano l equilibrio della reazione S P 3) Presentano specificità di reazione 4) Richiedono condizioni di reazione
PRINCIPALI CARATTERISTICHE DEGLI ENZIMI 1) Aumentano la velocità di reazione 2) Non modificano l equilibrio della reazione S P 3) Presentano specificità di reazione 4) Richiedono condizioni di reazione
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Ossidazione dell α-chetoglutarato: questa reazione porta alla formazione di un legame TIOESTERE ad alta energia e alla produzione di NADH
 Ossidazione dell α-chetoglutarato: questa reazione porta alla formazione di un legame TIOESTERE ad alta energia e alla produzione di NADH TPP Lipoammide FAD α-chetoglutarato Complesso dell αchetoglutarato
Ossidazione dell α-chetoglutarato: questa reazione porta alla formazione di un legame TIOESTERE ad alta energia e alla produzione di NADH TPP Lipoammide FAD α-chetoglutarato Complesso dell αchetoglutarato
3) La presenza di gruppi funzionali specifici che partecipano alla catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o quelli
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
Una panoramica del ciclo dell acido ciclico
 Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Esercitazione Esempi di domande del 1 test
 Esercitazione Esempi di domande del 1 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
Esercitazione Esempi di domande del 1 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Velocità di reazione. Consideriamo una generica reazione
 Velocità di reazione. Consideriamo una generica reazione Esprimiamo perciò la velocità di un processo chimico in un certo periodo di tempo tramite il rapporto tra la variazione di concentrazione di un
Velocità di reazione. Consideriamo una generica reazione Esprimiamo perciò la velocità di un processo chimico in un certo periodo di tempo tramite il rapporto tra la variazione di concentrazione di un
v = Δ[P] = _ Δ[S] S P
![v = Δ[P] = _ Δ[S] S P v = Δ[P] = _ Δ[S] S P](/thumbs/98/137173050.jpg) CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazione della concentrazione del prodotto o del reagente in un dato
CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazione della concentrazione del prodotto o del reagente in un dato
Esercitazione Esempi di domande del 2 test
 Esercitazione Esempi di domande del 2 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
Esercitazione Esempi di domande del 2 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
catalizzatori biologici RUOLO DEGLI ENZIMI: 16/03/15
 I sistemi viventi sono caratterizzati da un enorme varietà reazioni chimiche la maggior parte delle quali è mediata da una serie di eccezionali CATALIZZATORI BIOLOGICI : GLI ENZIMI L ENZIMOLOGIA E UNA
I sistemi viventi sono caratterizzati da un enorme varietà reazioni chimiche la maggior parte delle quali è mediata da una serie di eccezionali CATALIZZATORI BIOLOGICI : GLI ENZIMI L ENZIMOLOGIA E UNA
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi
 1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
La materia vivente è costituita da molecole, che costruiscono strutture ordinate partendo da materiali disordinati, tramite una spesa energetica
 LA LOGICA DELLA VITA La materia vivente è costituita da molecole, che costruiscono strutture ordinate partendo da materiali disordinati, tramite una spesa energetica G = H - T S Le reazioni dei processi
LA LOGICA DELLA VITA La materia vivente è costituita da molecole, che costruiscono strutture ordinate partendo da materiali disordinati, tramite una spesa energetica G = H - T S Le reazioni dei processi
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe. Substrato
 Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
: : H-Cl + H-N: H-N-H + : Cl : H
 Negli organismi viventi la maggior parte dell energia libera richiesta per promuovere le reazioni biochimiche deriva dall ossidazione dei substrati organici. L ossigeno, l accettore finale degli elettroni
Negli organismi viventi la maggior parte dell energia libera richiesta per promuovere le reazioni biochimiche deriva dall ossidazione dei substrati organici. L ossigeno, l accettore finale degli elettroni
Come le cellule traggono energia dal cibo: produzione di ATP
 Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia.
 La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
Determinazione dell attività enzimatica
 Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in Scienze Biologiche. Insegnamento di. Anno Accademico
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
Modulo 14 Il ciclo di Krebs
 Modulo 14 Il ciclo di Krebs Il destino ossidativo del piruvato In condizioni aerobie il piruvato viene decarbossilato ad acetato. L acetato è ossidato ulteriormente nel ciclo dell acido citrico. Una serie
Modulo 14 Il ciclo di Krebs Il destino ossidativo del piruvato In condizioni aerobie il piruvato viene decarbossilato ad acetato. L acetato è ossidato ulteriormente nel ciclo dell acido citrico. Una serie
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA
 TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
ENZIMI. Molecole proteiche globulari che consentono alle reazioni biochimiche di procedere ad una velocità adeguata alle
 ENZIMI Molecole proteiche globulari che consentono alle reazioni biochimiche di procedere ad una velocità adeguata alle condizioni fisiologiche Aumentano la velocità delle reazioni senza alterarne l equilibrio
ENZIMI Molecole proteiche globulari che consentono alle reazioni biochimiche di procedere ad una velocità adeguata alle condizioni fisiologiche Aumentano la velocità delle reazioni senza alterarne l equilibrio
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
Introduzione al metabolismo
 Introduzione al metabolismo 1 2 Funzioni del metabolismo 1- Ottenere energia chimica 2- Convertire le molecole 3-Polimerizzare i precursori monomerici 4- Sintetizzare e degradare le biomolecole Il metabolismo
Introduzione al metabolismo 1 2 Funzioni del metabolismo 1- Ottenere energia chimica 2- Convertire le molecole 3-Polimerizzare i precursori monomerici 4- Sintetizzare e degradare le biomolecole Il metabolismo
Energia di attivazione
 Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
CATALISI COVALENTE. H 2 O Enz-R-OH + P. Enz-R-O S Enz-R-O-S
 CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale re dell enzima può comportarsi
CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale re dell enzima può comportarsi
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico
 Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico Dalla glicolisi alla fosforilazione ossidativa NAD + e NADP + Sono coinvolti nelle reazioni di trasferimento dell idruro H: -. Tutte le reazioni
Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico Dalla glicolisi alla fosforilazione ossidativa NAD + e NADP + Sono coinvolti nelle reazioni di trasferimento dell idruro H: -. Tutte le reazioni
ENZIMI : catalizzatori biologici
 ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Il trasporto del glucosio
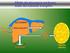 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Velocità di reazione
 1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
I processi mediante i quali le molecole biologiche vengono scisse e risintetizzate formano una rete di reazioni enzimatiche, complessa e finemente
 I processi mediante i quali le molecole biologiche vengono scisse e risintetizzate formano una rete di reazioni enzimatiche, complessa e finemente regolata, detta metabolismo dell organismo. Questa rete
I processi mediante i quali le molecole biologiche vengono scisse e risintetizzate formano una rete di reazioni enzimatiche, complessa e finemente regolata, detta metabolismo dell organismo. Questa rete
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
Scaricato da 1
 A AB B Scaricato da www.sunhope.it 1 1 1 1 2 2 2 3 45 5 5 4 20 20 5 40 40 6 40 20 23 7 5 12 8 35 2 6 9 1 1 Numero di mole ecole 30 25 20 15 10 5 0 0 2 4 6 8 10 Energia Scaricato da www.sunhope.it 2 Scaricato
A AB B Scaricato da www.sunhope.it 1 1 1 1 2 2 2 3 45 5 5 4 20 20 5 40 40 6 40 20 23 7 5 12 8 35 2 6 9 1 1 Numero di mole ecole 30 25 20 15 10 5 0 0 2 4 6 8 10 Energia Scaricato da www.sunhope.it 2 Scaricato
Cinetica Chimica. Cinetica chimica
 Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
TARGETS DEI FARMACI ATTUALMENTE IN USO
 TARGETS DEI FARMACI ATTUALMENTE IN USO INIBITORI ENZIMATICI INIBITORI ENZIMATICI Sintesi dell'uridine-5'-monophosphate (UMP) INIBITORI ENZIMATICI EFFICACIA DI INIBITORI COME AGENTI TERAPEUTICI Potenza
TARGETS DEI FARMACI ATTUALMENTE IN USO INIBITORI ENZIMATICI INIBITORI ENZIMATICI Sintesi dell'uridine-5'-monophosphate (UMP) INIBITORI ENZIMATICI EFFICACIA DI INIBITORI COME AGENTI TERAPEUTICI Potenza
ENZIMI. Catalizzatori delle reazioni biologiche
 ENZIMI Catalizzatori delle reazioni biologiche I CATALIZZATORI ABBASSANO L ENERGIA DI ATTIVAZIONE FACILITANDO LA FORMAZIONE DELLO STATO DI TRANSIZIONE Il legame tra enzima e substrato genera un percorso
ENZIMI Catalizzatori delle reazioni biologiche I CATALIZZATORI ABBASSANO L ENERGIA DI ATTIVAZIONE FACILITANDO LA FORMAZIONE DELLO STATO DI TRANSIZIONE Il legame tra enzima e substrato genera un percorso
I Mitocondri Centrale elettrica cellulare
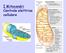 I Mitocondri Centrale elettrica cellulare Potenziale redox standard Fe 2+ D Fe 3+ + e - Fe 2+ + Cu 2+ D Fe 3+ + Cu + Cu 2+ + e - D Cu + Ε = E + RT nf ln [accettore elettroni] [donatore elettroni] n = n
I Mitocondri Centrale elettrica cellulare Potenziale redox standard Fe 2+ D Fe 3+ + e - Fe 2+ + Cu 2+ D Fe 3+ + Cu + Cu 2+ + e - D Cu + Ε = E + RT nf ln [accettore elettroni] [donatore elettroni] n = n
Trattamento quantitativo della complessazione e della reattività nei sistemi supramolecolari
 Trattamento quantitativo della complessazione e della reattività nei sistemi supramolecolari Assunzione di principio: i sistemi si trovano in condizioni di controllo termodinamico e non cinetico (tutti
Trattamento quantitativo della complessazione e della reattività nei sistemi supramolecolari Assunzione di principio: i sistemi si trovano in condizioni di controllo termodinamico e non cinetico (tutti
Respirazione cellullare
 Respirazione cellullare 1 luce La respirazione è un processo complementare alla fotosintesi e permette di completare il ciclo del Carbonio. fotosintesi CO 2 H 2 O O 2 Carboidrati respirazione Energia utile
Respirazione cellullare 1 luce La respirazione è un processo complementare alla fotosintesi e permette di completare il ciclo del Carbonio. fotosintesi CO 2 H 2 O O 2 Carboidrati respirazione Energia utile
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
