MINI SCHEDA HTA EVEROLIMUS (AFINITOR ) INDICAZIONE CARCINOMA MAMMARIO
|
|
|
- Rocco Raimondi
- 8 anni fa
- Visualizzazioni
Transcript
1 1/7 MINI SCHEDA HTA EVEROLIMUS (AFINITOR ) INDICAZIONE CARCINOMA MAMMARIO Nome Commerciale AFINITOR Principio Attivo everolimus Ditta Produttrice Novartis Farma spa ATC L01XE10 Formulazione Compresse Dosaggio 5-10 mg Categoria Terapeutica Inibitori della proteina chinasi Afinitor è indicato per il trattamento del carcinoma mammario avanzato con stato recettoriale ormonale positivo, HER2/neu negativo, in combinazione con Indicazione oggetto di valutazione exemestane, in donne in postmenopausa in assenza di malattia viscerale sintomatica dopo recidiva o progressione a seguito di trattamento con un inibitore dell aromatasi non steroideo. Classe di rimborsabilità: H Ai fini delle prescrizioni a carico del SSN i centri utilizzatori dovranno compilare la scheda raccolta dati informatizzata di arruolamento che indica i pazienti Classificazione ai fini della rimborsabilità eleggibili e la scheda di follow-up e applicare le condizioni negoziali secondo le indicazioni pubblicate sul sito dell'agenzia, piattaforma web - all'indirizzo Medicinale soggetto a prescrizione medica limitativa, da rinnovare volta per volta, vendibile al pubblico su Classificazione ai fini della fornitura prescrizione di centri ospedalieri o di specialisti - Oncologo, internista (RNRL). 30 cpr da 5 mg = 2.144,34 Prezzo SSR* 30 cpr da 10 mg = 3.049,73 SI L eleggibilità del paziente prevede una diagnosi di carcinoma mammario, con stadio della malattia localmente avanzato non candidabile a trattamento locoregionale con intento curativo o metastatico. Inoltre lo status dei recettori ormonali (ER, PgR) deve essere positivo; lo status Her2/neu, valutato tramite analisi immunoistochimica e FISH, deve essere negativo. Può essere usato in prima linea, in terapia metastatica, in Registro AIFA pazienti con recidiva durante o dopo trattamento adiuvante con inibitore dell aromatasi non steroideo. Può essere usato fino alla quarta linea, in terapia metastatica, in pazienti con progressione durante o dopo un precedente trattamento con un inibitore dell aromatasi non steroideo. Le pazienti devono essere donne in menopausa, in assenza di metastasi viscerali sintomatiche e con funzionalità epatica normale (se compromessa, non oltre il grado Child Pugh B). Payment-by-results, con rimborso per le pazienti non Ulteriori condizioni negoziali responders a 6 mesi. *Prezzo SSN al netto degli sconti negoziali e dell IVA 10%
2 2/7 Parere CTRF L associazione di everolimus più exemestane ha dimostrato di migliorare la sopravvivenza libera da progressione (PFS) nelle pazienti affette da cancro in stato avanzato della mammella pretrattate con inibitori dell aromatasi non steroidei. Infatti le pazienti con la terapia combinata hanno mostrato una PFS mediana di 11,0 mesi contro 4,1 mesi del gruppo con il solo exemestane. Inoltre, benché non siano ancora disponibili i dati di sopravvivenza globale dell analisi finale, al raggiungimento di 200 decessi la mortalità è stata del 25,4% con la terapia combinata e del 32,2% con il solo exemestane. Nonostante siano evidenti i benefici derivanti dalla terapia con everolimus, questi andrebbero soppesati in considerazione della maggiore incidenza di eventi avversi rispetto al comparator. Gli eventi avversi più comuni, di grado 3/4, sono stati: stomatiti (8% nel gruppo con everolimus più exemestane vs. 1% nel gruppo con il solo exemestane), anemia (6% vs. <1%), dispnea (6% vs. <1%), iperglicemia (4% vs. <1%), stanchezza (4% vs. <1%) e polmonite (3% vs. 0%). Da sottolineare inoltre alcune criticità relative alla scelta del comparator dello studio, evidenziate anche nella Scientific Discussion dell EMA, che riporta che i pazienti inclusi nello studio, già pesantemente pretrattati, erano refrattari agli inibitori dell'aromatasi. Inoltre l EMA, come condizione all autorizzazione all immissione in commercio, ha richiesto all azienda la sottomissione dei risultati di un ulteriore studio, grazie al quale si possa confermare l effetto sinergico/aggiuntivo di exemestane alla terapia con everolimus. Il costo di un mese di terapia con everolimus in associazione ad exemestane è di circa e risulta nettamente superiore rispetto all alternativa da studio clinico (exemestane, costo per un mese di terapia pari a 59). Se paragonato anche alle altre alternative, quali tamoxifene e fulvestrant, il costo di un mese di terapia risulta essere comunque superiore. Nell ipotesi che il numero di pazienti eleggibili al trattamento per la Regione Veneto sia compreso tra 86 e 113 pazienti per anno e tenuto conto del payment by results a 6 mesi per i pazienti non responder (30% come da studio clinico), la spesa, una volta che il farmaco vada a regime, potrebbe essere compresa tra 2,2 e 2,9 milioni/anno. In conclusione Efficacia: al di là dei buoni risultati ottenuti dallo studio registrativo non è possibile stabilire il reale valore della terapia in quanto il comparator scelto non è il solo disponibile e l EMA stessa ha richiesto ulteriori evidenze. Sicurezza: profilo peggiore rispetto al comparator utilizzato nello studio clinico. Costo: incremento elevato rispetto alle alternative. Eventuali specifiche raccomandazioni sull'utilizzo potranno essere perfezionate dalla Rete Oncologica Veneta.
3 Meccanismo d azione e posologia Everolimus è un inibitore selettivo del mtor, una serin treonin chinasi chiave la cui attività è nota per essere sovraregolata in un numero di tumori nell uomo [1]. Everolimus si lega alla proteina intracellulare FKBP 12, formando un complesso che inibisce l attività di mtor complex 1 (mtorc1). L inibizione della via del segnale di mtorc1 interferisce con la traduzione e la sintesi di proteine riducendo l attività della protein chinasi S6 ribosomiale (S6K1) e della proteina eucariotica di legame del fattore 4E di allungamento della traduzione (4EBP 1), che regolano le proteine coinvolte nel ciclo cellulare, nell angiogenesi e nella glicolisi. Si ritiene che S6K1 fosforili il dominio funzionale 1 di attivazione del recettore per gli estrogeni, che è responsabile dell attivazione ligando indipendente del recettore. Everolimus riduce i livelli del fattore di crescita endoteliale vascolare (VEGF), che potenzia i processi angiogenici tumorali ed inoltre inibisce la crescita e la proliferazione delle cellule tumorali, delle cellule endoteliali, dei fibroblasti e delle cellule muscolari lisce associate ai vasi sanguigni. La dose raccomandata di everolimus è di 10 mg una volta al giorno. Il trattamento deve continuare fino a quando si osserva un beneficio clinico o finché non compaia tossicità inaccettabile. Se una dose viene omessa, il paziente non deve assumere una dose aggiuntiva, ma assumere la successiva dose abituale prescritta. [1] Linee Guida Le Linee Guida AIOM aggiornate al 2013 [2] raccomandano per le pazienti con carcinoma mammario metastatico ER-positivo e/o PgR positivo in postmenopausa: - se non sono state pretrattate con ormonoterapia adiuvante o se presentano stadio IV all esordio, l uso degli inibitori dell aromatasi come prima linea ormonale (livello di evidenza: A; forza della raccomandazione: positiva forte); - se sono state pretrattate in adiuvante con tamoxifene, l uso di fulvestrant ad alte dosi (livello di evidenza: B; forza della raccomandazione: positiva debole); - se sono state pretrattate in adiuvante o in fase metastatica con inibitore delle aromatasi non steroideo, l uso di everolimus in associazione con exemestane (livello di evidenza: A; forza della raccomandazione: positiva forte). GReFO, il Gruppo Regionale Farmaci Oncologici della Regione Emilia-Romagna, sulla combinazione everolimus più exemestane esprime la seguente raccomandazione [3]: Nelle donne in postmenopausa affette da carcinoma mammario avanzato, con stato recettoriale ormonale positivo, HER2/neu negativo, in assenza di malattia viscerale sintomatica, dopo recidiva o progressione a seguito di trattamento con un inibitore dell aromatasi non steroideo, everolimus in combinazione con exemestane non dovrebbe essere utilizzato nella maggior parte delle pazienti dopo una prima linea di trattamento ormonale (forza della raccomandazione: negativa debole). Gli autori del documento prevedono che everolimus in associazione con exemestane potrebbe essere utilizzato in una minoranza di pazienti (30-40%). Tale ipotesi tiene conto del fatto che lo studio sia stato condotto in una popolazione pluritrattata e che quindi i dati di efficacia dell associazione siano trasferibili principalmente in una popolazione sottoposta a più linee di terapia ormonale. In considerazione di ciò, il comparator dello studio non sembra essere adeguato per la popolazione presa in esame, ponendo quindi grandi problemi di trasferibilità dei risultati nella pratica clinica. GReFO ritiene siano disponibili trattamenti più efficaci (fulvestrant, monochemioterapia). Efficacia L obiettivo dello studio BOLERO-2 [4,5], un RCT internazionale di fase III, in doppio cieco e multicentrico, è stato dimostrare la superiorità di everolimus in combinazione con exemestane verso il solo exemestane, in donne in postmenopausa affette da cancro avanzato della mammella ER positivo, e refrattario a precedenti trattamenti con letrozolo o anastrozolo. 3/7
4 Le pazienti incluse nello studio dovevano avere almeno una lesione evidente oppure lesioni ossee principalmente litiche, un ECOG performance status da 0 a 2, un adeguata funzionalità d organo e valori ematologici adeguati. Le pazienti che avevano assunto in precedenza altri trattamenti endocrini antitumorali ed un singolo ciclo di chemioterapia per la fase avanzata della patologia sono state comunque incluse nello studio. I precedenti trattamenti includono letrozolo o anastrazolo (100%), tamoxifene (48%), fulvestrant (16%) e chemioterapia (68%), con una media di tre precedenti linee di terapia. In questo studio, 724 pazienti sono state randomizzate (in rapporto 2:1) a ricevere everolimus per via orale (10 mg/die) o placebo, entrambi in associazione con exemestane per via orale (25 mg/die). Il trattamento è proseguito fino a progressione della malattia, sviluppo di una tossicità inaccettabile e revoca del consenso. L end-point primario dello studio era la sopravvivenza libera da progressione (PFS), valutata secondo i criteri RECIST (Response Evaluation Criteria in Solid Tumors) e basata sulla valutazione dello sperimentatore (valutazione radiologica locale). Le analisi di supporto per la PFS sono state basate sulla revisione radiologica centralizzata indipendente. Gli end-point secondari comprendevano la sopravvivenza globale (OS), il tasso di risposta obiettiva, il tasso di beneficio clinico, il tempo al peggioramento dell ECOG Performance Status, la sicurezza e la qualità di vita. Tabella 1. Dati di efficacia Referenza Trattamenti Misure di Esito Risultati Principali BOLERO-2 Analisi interim [4] BOLERO-2 Analisi finale [5] everolimus 10 mg/die + exemestane 25 mg/die (N= 485) vs. placebo + exemestane (25 mg/die) (N=239) everolimus 10 mg/die + exemestane 25 mg/die (N= 485) vs. placebo + exemestane (25 mg/die) (N=239) 1) PFS valutazione sperimentatore 2) PFS valutazione commissione indipendente 3) PFS valutazione sperimentatore 4) PFS valutazione commissione indipendente EVE: everolimus; EXE: exemestane; PBO: placebo. 4/7 Dimostrata la superiorità di EVE + EXE rispetto a per l end-point primario. 1) 6,9 mesi per EVE + EXE vs 2,8 mesi per (HR: 0,43; IC 95%: 0,35 a 0,54, p<0,001) 2) 10,6 mesi per EVE + EXE vs 4,1 mesi per (HR: 0,36; IC 95%: 0,27 a 0,47, p<0,001) Dimostrata la superiorità di EVE + EXE rispetto a per l end-point primario. 3) 7,8 mesi per EVE + EXE vs 3,2 mesi per (HR: 0,45; IC 95%: 0,38 a 0,54, p<0,0001) 4) 11,0 mesi per EVE + EXE vs 4,1 mesi per (HR: 0,38; IC 95%: 0,31 a 0,48, p<0,0001) Nell EPAR [6] inoltre sono riportati i dati di PFS valutata in diversi sottogruppi di pazienti, suddivisi per esempio sulla base del numero di linee di trattamento precedenti. In questi sottogruppi, la PFS è stata valutata come rischio relativo (RR) con un intervallo di confidenza del 95%. I risultati sono stati: 1) pazienti con una sola precedente terapia: RR = 0,52 (IC 95% = 0,31-0,88); 2) pazienti con due precedenti terapie: RR = 0,55 (IC 95% = 0,38-0,81);
5 5/7 3) pazienti con o più precedenti terapie: RR = 0,36 (IC 95% = 0,27 0,48). Attualmente i dati di OS non sono ancora disponibili, in quanto si attende il raggiungimento di 398 morti per l analisi finale. Al raggiungimento di 200 eventi, la mortalità era del 25,4% nel braccio con everolimus più exemestane e del 32,2% nel braccio con il solo exemestane. L EPAR [6] evidenzia che la scelta del comparator non è appropriata per la popolazione presa in esame, in quanto i pazienti, già pesantemente pretrattati, erano refrattari agli inibitori dell'aromatasi. Nello studio clinico si è inoltre registrato un tasso di risposta obiettiva (ORR) del 0,4% nei pazienti trattati con il solo exemestane: una percentuale di molto inferiore rispetto a quanto previsto (15%). C è quindi la possibilità che i pazienti abbiano ricevuto un trattamento sub-ottimale con exemestane. Inoltre l EMA, come condizione all autorizzazione all immissione in commercio, ha richiesto all azienda la sottomissione dei risultati dello studio BOLERO-6, uno studio randomizzato che mette a confronto il solo everolimus con everolimus più exemestane dopo precedente terapia con un inibitore dell aromatasi non steroideo. L obiettivo dello studio è di confermare l effetto sinergico/aggiuntivo di exemestane. Sicurezza La terapia con everolimus più exemestane è stata associata ad una maggiore incidenza di eventi avversi rispetto al solo exemestane [4,5]. Le reazioni avverse gravi si sono manifestate in circa il 23% delle pazienti nel gruppo con everolimus più exemestane (di cui l 11% attribuite al trattamento in studio) e nel 12% delle pazienti nel gruppo con il solo exemestane (di cui l 1% attribuite al trattamento in studio). Le reazioni avverse più comuni di grado 3/4 sono state: stomatiti (8% nel gruppo con everolimus più exemestane vs. 1% nel gruppo con il solo exemestane), anemia (6% vs. <1%), dispnea (6% vs. <1%), iperglicemia (4% vs. <1%), stanchezza (4% vs. <1%) e polmonite (3% vs. 0%). Report di HTA HAS France [7] non ha attribuito ad everolimus, utilizzato per l indicazione in esame, alcun miglioramento del servizio medico (ASMR V)1, in considerazione delle incertezze riguardanti il beneficio derivante dall aggiunta di exemestane ad everolimus, e della scelta discutibile del comparator dello studio. Infatti exemestane è stato utilizzato nei casi di recidiva o progressione della malattia a seguito del trattamento con letrozolo o anastrazolo, quindi in un indicazione diversa rispetto a quella per cui è stato autorizzato, che è limitata al fallimento degli antiestrogeni. Sebbene HAS France individui come potenziali comparator exemestane, fulvestrant e tamoxifene, ritiene che ad oggi non vi sia alcun comparator clinicamente rilevante per everolimus. Lo Scottish Medicine Consortium (SMC) [8] non raccomanda l uso di everolimus nell indicazione in esame, specificando che l analisi economica presentata dalla ditta non era sufficientemente robusta. SMC inoltre, come HAS France, esprime dubbi riguardanti il reale contributo di exemestane nella terapia combinata. L ente scozzese individua come comparator principali fulvestrant, tamoxifene ed exemestane, anche se considera quest ultimo come un alternativa subottimale. Costo dei trattamenti Si è stimato il costo di everolimus in combinazione con exemestane e dei principali competitor (exemestane, fulvestrant e tamoxifene) confrontando i costi di questi trattamenti ad un mese. 1 Il report HTA francese classifica il beneficio terapeutico apportato dal trattamento su una scala da I a V, dove I è considerato un beneficio significativo mentre V rappresenta l'assenza di miglioramento.
6 Per everolimus e fulvestrant si sono considerati i prezzi ospedalieri, mentre per exemestane e tamoxifene si sono considerati i prezzi alla convenzionata. Everolimus presenta un meccanismo di condivisione del rischio, che prevede un payment by results per i pazienti no responder a 6 mesi (rimborso in caso di progressione della malattia e/o fallimento della terapia e/o tossicità inaccettabile). Il calcolo dei costi non considera il meccanismo di condivisione del rischio previsto per everolimus: payment by results a sei mesi per i pazienti no responders. Tabella 2. Costo delle terapie a un mese 6/7 Farmaco Schedula Costo die* everolimus + exemestane 10 mg/die + 25 mg/die 111,82** + 1,98# Costo Mese di terapia* 3.414,20 exemestane 25 mg/die 1,98# 59,50 fulvestrant 500 mg mg per il primo mese 500 mg per i mesi successivi Primo mese = 936,23** Successivi = 468,12** tamoxifene 20 mg/die 20 mg/bid 0,22 6,64 0,44 13,27 *Costo comprensivo IVA 10%. **Costo Ospedaliero # Per la convenzionata si è considerato uno sconto del 9% sul prezzo al pubblico al netto dell IVA. L n 289, art 52 c.6. Per la convenzionata si è considerato uno sconto del 3.75% sul prezzo al pubblico al netto dell IVA. L n 289, art 52 c.6. Popolazione target Il Registro Tumori Regione Veneto stima un numero medio annuo di nuovi casi di tumore alla mammella che è pari a 4482 [9]; non tutti i nuovi casi sono però eleggibili alla terapia. Considerando i dati e le stime presenti nel documento di HAS France cioè: 1) 78,7% pazienti in post menopausa; 2) 60-70% HR+ e HER negativo; 3) 85-95% con tumore localizzato; 4) 8% dei casi con tumore localizzato che progredirà ad uno stato metastatico; 5) 60% che non ha utilizzato una precedente linea con exemestane, non sottoposto a chemioterapia e senza malattia viscerale sintomatica. È possibile stimare per la Regione Veneto un numero di pazienti eleggibili compresi tra 86 e 113. Impatto di budget In considerazione del numero di casi eleggibili al trattamento compreso tra 86 e 113, della durata della terapia da studio clinico, e di una percentuale di rimborso col payment by results a 6 mesi del 30%, si stima che la spesa per everolimus in associazione con exemestane sarà compresa tra 2,2 e 2,9 milioni di euro. Per il primo anno, considerando cioè un entrata graduale in terapia (6 mesi di terapia per paziente) la spesa potrebbe essere circa la metà, cioè tra 1,1 e 1,5 milioni di euro. L incremento di spesa nello scenario più conservativo, in cui lo schema di terapia con everolimus + exemestane si sostituisca al solo exemestane è circa uguale al costo del solo everolimus.
7 Bibliografia [1] Scheda tecnica Afinitor [2] Linee guida AIOM. Neoplasie della mammella. Edizione 2013 (aggiornamento a luglio 2013) [3] Gruppo Regionale Farmaci Oncologici (GReFO). Everolimus nel carcinoma mammario avanzato dopo il fallimento di terapia con antiaromatasico. Raccomandazione d uso n. 24. Settembre 2013 [4] Baselga J. et al.; Everolimus in Postmenopausal Hormone-Receptor-Positive Advanced Breast Cancer. The New England Journal of Medicine 2012; 366: [5] Yardley D. et al.; Everolimus Plus Exemestane in Postmenopausal Patients with HR+ Breast Cancer: BOLERO-2 Final Progression-Free Survival Analysis. Advances in Therapy 2013; 30: [6] Afinitor-H-C-1038-II-20 : EPAR - Assessment Report Variation [7] Avis 3 aprile 2013 [8] SMC (872/13) [9] (ultimo accesso gennaio 2014) 7/7
SINOSSI DELLO STUDIO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO
 SINOSSI DELLO STUDIO TITOLO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO SPONSOR Sequenza ottimale di ormonoterapia in pazienti con carcinoma mammario metastatico ricadute dopo terapia
SINOSSI DELLO STUDIO TITOLO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO SPONSOR Sequenza ottimale di ormonoterapia in pazienti con carcinoma mammario metastatico ricadute dopo terapia
EVEROLIMUS - AFINITOR
 giunta regionale Allegato D al Decreto n. 119 del 12 maggio 2015 pag. 1/10 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED EVEROLIMUS - AFINITOR Indicazione in esame: Everolimus
giunta regionale Allegato D al Decreto n. 119 del 12 maggio 2015 pag. 1/10 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED EVEROLIMUS - AFINITOR Indicazione in esame: Everolimus
MINI SCHEDA HTA AXITINIB (INLYTA )
 1/6 MINI SCHEDA HTA AXITINIB (INLYTA ) FARMACO IN ESAME Nome commerciale Inlyta Principio Attivo Axitinib Ditta Produttrice Pfizer Italia srl ATC L01XE17 Formulazione Compresse rivestite Dosaggio 1 mg
1/6 MINI SCHEDA HTA AXITINIB (INLYTA ) FARMACO IN ESAME Nome commerciale Inlyta Principio Attivo Axitinib Ditta Produttrice Pfizer Italia srl ATC L01XE17 Formulazione Compresse rivestite Dosaggio 1 mg
MINI SCHEDA HTA CRIZOTINIB (XALKORI )
 1/7 MINI SCHEDA HTA CRIZOTINIB (XALKORI ) Nome Commerciale XALKORI Principio Attivo Crizotinib Ditta Produttrice Pfizer Italia Srl ATC L01XE16 Formulazione Capsule rigide Dosaggio 200 mg 250 mg Altri antineoplastici
1/7 MINI SCHEDA HTA CRIZOTINIB (XALKORI ) Nome Commerciale XALKORI Principio Attivo Crizotinib Ditta Produttrice Pfizer Italia Srl ATC L01XE16 Formulazione Capsule rigide Dosaggio 200 mg 250 mg Altri antineoplastici
SCHEDA FARMACO. Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
Neoplasie della mammella - 2
 Neoplasie della mammella - 2 Fattori prognostici Numero di N+ : >3 Età e stato menopausale Diametro di T Invasione linfatica e vascolare Tipo istologico Grading Recettore per Estrogeni/Progesterone Amplificazione
Neoplasie della mammella - 2 Fattori prognostici Numero di N+ : >3 Età e stato menopausale Diametro di T Invasione linfatica e vascolare Tipo istologico Grading Recettore per Estrogeni/Progesterone Amplificazione
SEBASTIANO FILETTI. Dipartimento di Medicina Interna e Specialità Mediche. Università di Roma Sapienza, Roma
 SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
16th World Conference on Lung Cancer (WCLC): highlights
 16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
Specialità: Herceptin (Roche spa) Forma farmaceutica:
 TRASTUZUMAB per l'indicazione: in associazione ad un inibitore dell aromatasi nel trattamento di pazienti in postmenopausa affetti da carcinoma mammario metastatico positivo per i recettori ormonali, non
TRASTUZUMAB per l'indicazione: in associazione ad un inibitore dell aromatasi nel trattamento di pazienti in postmenopausa affetti da carcinoma mammario metastatico positivo per i recettori ormonali, non
Everolimus (AFINITOR )
 Raccomandazioni evidence-based Everolimus (AFINITOR ) Nel carcinoma mammario avanzato dopo fallimento di terapia con inibitore dell aromatasi non steroideo A cura del gruppo di lavoro Farmaci Innovativi
Raccomandazioni evidence-based Everolimus (AFINITOR ) Nel carcinoma mammario avanzato dopo fallimento di terapia con inibitore dell aromatasi non steroideo A cura del gruppo di lavoro Farmaci Innovativi
MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO
 1/7 MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO Nome Commerciale Avastin Principio Attivo Bevacizumab Ditta Produttrice Roche ATC L01XC07 Formulazione Concentrato per soluzione
1/7 MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO Nome Commerciale Avastin Principio Attivo Bevacizumab Ditta Produttrice Roche ATC L01XC07 Formulazione Concentrato per soluzione
Espressione di geni specifici per un determinato tumore
 Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
Sinossi di studio clinico Codice: GECP06/01 Pag. 1 di 5
 Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Documento PTR n.212 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Il ruolo di CA15-3 nel monitoraggio della terapia nel carcinoma mammario metastatico: un caso clinico
 Il ruolo di CA15-3 nel monitoraggio della terapia nel carcinoma mammario metastatico: un caso clinico C. Cocco 1, B. Caruso 1, E. Fiorio 2 1 Laboratorio Analisi (sede di BT) 2 Oncologia (sede di BT), AOUI,
Il ruolo di CA15-3 nel monitoraggio della terapia nel carcinoma mammario metastatico: un caso clinico C. Cocco 1, B. Caruso 1, E. Fiorio 2 1 Laboratorio Analisi (sede di BT) 2 Oncologia (sede di BT), AOUI,
MONOGRAFIA SINTESI. IBRANCE (palbociclib) Carcinoma Mammario. A cura della Commissione Terapeutica Oncologica
 MONOGRAFIA SINTESI IBRANCE (palbociclib) Carcinoma Mammario A cura della Commissione Terapeutica Oncologica 1 SINTESI DELLA VALUTAZIONE 1.1 SINTESI DELLE EVIDENZE Palbociclib è indicato per il trattamento
MONOGRAFIA SINTESI IBRANCE (palbociclib) Carcinoma Mammario A cura della Commissione Terapeutica Oncologica 1 SINTESI DELLA VALUTAZIONE 1.1 SINTESI DELLE EVIDENZE Palbociclib è indicato per il trattamento
La terapia medica primaria e adiuvante e il follow-up: le principali novità. a cura di Claudio Zamagni (Bologna) e Antonio Frassoldati (Ferrara)
 Protocollo diagnostico-terapeutico per le Pazienti con carcinoma mammario La terapia medica primaria e adiuvante e il follow-up: le principali novità a cura di Claudio Zamagni (Bologna) e Antonio Frassoldati
Protocollo diagnostico-terapeutico per le Pazienti con carcinoma mammario La terapia medica primaria e adiuvante e il follow-up: le principali novità a cura di Claudio Zamagni (Bologna) e Antonio Frassoldati
SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
Sofosbuvir: Up to date in regione Veneto
 Sofosbuvir: Up to date in regione Veneto Il caso Sofosbuvir è considerato il paradigma attuale e futuro di riferimento su cui basare la politica nazionale del farmaco per i farmaci ad alto costo. AIFA
Sofosbuvir: Up to date in regione Veneto Il caso Sofosbuvir è considerato il paradigma attuale e futuro di riferimento su cui basare la politica nazionale del farmaco per i farmaci ad alto costo. AIFA
Quali strategie per un utilizzo razionale dei farmaci oncologici innovativi? L esperienza della Regione Veneto
 FARMACI ONCOLOGICI INNOVATIVI: SCENARIO ATTUALE E LORO VALUTAZIONE Quali strategie per un utilizzo razionale dei farmaci oncologici innovativi? L esperienza della Regione Veneto Roberto Leone Dipartimento
FARMACI ONCOLOGICI INNOVATIVI: SCENARIO ATTUALE E LORO VALUTAZIONE Quali strategie per un utilizzo razionale dei farmaci oncologici innovativi? L esperienza della Regione Veneto Roberto Leone Dipartimento
Commissione Regionale Farmaco LAPATINIB
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
A cura del Gruppo Regionale Farmaci Oncologici (GReFO) (pubblicato a maggio 2014) Aggiornata alla pubblicazione della negoziazione AIFA (luglio 2014)
 Raccomandazioni evidence-based Pertuzumab Nel carcinoma mammario avanzato HER2/neu positivo (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 26 Settembre
Raccomandazioni evidence-based Pertuzumab Nel carcinoma mammario avanzato HER2/neu positivo (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 26 Settembre
Accesso ai farmaci innovativi e controllo della spesa a livello regionale
 FARMACI INNOVATIVI Qualità efficacia appropriatezza 9 ottobre 2009 Camera dei Deputati Palazzo Marini (Roma) Accesso ai farmaci innovativi e controllo della spesa a livello regionale Stefania Melena Direzione
FARMACI INNOVATIVI Qualità efficacia appropriatezza 9 ottobre 2009 Camera dei Deputati Palazzo Marini (Roma) Accesso ai farmaci innovativi e controllo della spesa a livello regionale Stefania Melena Direzione
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel.
 BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel. (09-09-2008) Specialità: Avastin(Roche spa) Forma farmaceutica:
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel. (09-09-2008) Specialità: Avastin(Roche spa) Forma farmaceutica:
IL REGISTRO ONCOLOGICO COME STRUMENTO DI IMPLEMENTAZIONE DELLE DECISIONI: QUALE RUOLO NELL HTA
 IL REGISTRO ONCOLOGICO COME STRUMENTO DI IMPLEMENTAZIONE DELLE DECISIONI: QUALE RUOLO NELL HTA Francesca Caprari Direttore Affari Istituzionali e Relazioni Esterne Celgene srl L inizio Il Registro AIFA
IL REGISTRO ONCOLOGICO COME STRUMENTO DI IMPLEMENTAZIONE DELLE DECISIONI: QUALE RUOLO NELL HTA Francesca Caprari Direttore Affari Istituzionali e Relazioni Esterne Celgene srl L inizio Il Registro AIFA
ONCOVIEW 2012. Istruzioni per la compilazione delle schede pazienti
 ONCOVIEW 2012 Istruzioni per la compilazione delle schede pazienti ONCOVIEW - COME SI COLLABORA Lo studio ONCOVIEW ha l obiettivo di fornire un quadro esaustivo ed approfondito delle terapie farmacologiche
ONCOVIEW 2012 Istruzioni per la compilazione delle schede pazienti ONCOVIEW - COME SI COLLABORA Lo studio ONCOVIEW ha l obiettivo di fornire un quadro esaustivo ed approfondito delle terapie farmacologiche
Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008
 Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008 1 Quali aspetti della menopausa possono essere divulgati come problemi di salute?
Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008 1 Quali aspetti della menopausa possono essere divulgati come problemi di salute?
Cetuximab e mutazione K-Ras nel tumore del colon-retto
 Università di Pisa Dipartimento di Farmacia Corso di laurea in CTF Corso: Basi biochimiche dell azione dei farmaci Cetuximab e mutazione K-Ras nel tumore del colon-retto Pisa, 27/03/2014 Samuela Fabiani
Università di Pisa Dipartimento di Farmacia Corso di laurea in CTF Corso: Basi biochimiche dell azione dei farmaci Cetuximab e mutazione K-Ras nel tumore del colon-retto Pisa, 27/03/2014 Samuela Fabiani
Premessa. Tratto da American Heart Journal 2004; 147: 705-712
 Effetti del cambiamento di terapia con statine sul raggiungimento delle concentrazioni lipidiche ottimali: lo studio Measuring Effective Reductions in Cholesterol Using Rosuvastatin Therapy (MERCURY I)
Effetti del cambiamento di terapia con statine sul raggiungimento delle concentrazioni lipidiche ottimali: lo studio Measuring Effective Reductions in Cholesterol Using Rosuvastatin Therapy (MERCURY I)
LEGGE 29 NOVEMBRE 2007 N. 222 ART. 5 COMMA 1 E 2. NOTA SULLA METODOLOGIA APPLICATIVA
 LEGGE 29 NOVEMBRE 2007 N. 222 ART. 5 COMMA 1 E 2. NOTA SULLA METODOLOGIA APPLICATIVA PREMESSA L articolo 5 della legge 29 novembre 2007, n. 222 prevede al comma 1 che: l onere a carico del SSN per l assistenza
LEGGE 29 NOVEMBRE 2007 N. 222 ART. 5 COMMA 1 E 2. NOTA SULLA METODOLOGIA APPLICATIVA PREMESSA L articolo 5 della legge 29 novembre 2007, n. 222 prevede al comma 1 che: l onere a carico del SSN per l assistenza
PASQUALE FREGA Assobiotec
 ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
Rassegna Stampa. Comunicato stampa. Intermedia s.r.l. per la comunicazione integrata
 Rassegna Stampa Comunicato stampa TUMORE DEL SENO: FUNZIONA LA TERAPIA "ACCELERATA" "IL 94% DEI PAZIENTI GUARISCE CON I TEMPI DI CURA PIU' BREVI" Intermedia s.r.l. per la comunicazione integrata Via Malta,
Rassegna Stampa Comunicato stampa TUMORE DEL SENO: FUNZIONA LA TERAPIA "ACCELERATA" "IL 94% DEI PAZIENTI GUARISCE CON I TEMPI DI CURA PIU' BREVI" Intermedia s.r.l. per la comunicazione integrata Via Malta,
DECRETI E DELIBERE DI ALTRE AUTORITÀ
 DECRETI E DELIBERE DI ALTRE AUTORITÀ AGENZIA ITALIANA DEL FARMACO DETERMINA 17 giugno 2013. Classificazione del medicinale per uso umano «Kristexxa», secondo procedura centralizzata. (Determina n. 583/2013).
DECRETI E DELIBERE DI ALTRE AUTORITÀ AGENZIA ITALIANA DEL FARMACO DETERMINA 17 giugno 2013. Classificazione del medicinale per uso umano «Kristexxa», secondo procedura centralizzata. (Determina n. 583/2013).
Grazie dell attenzione
 Grazie dell attenzione http://www.registri-tumori.it/pdf/aiom2012/i_numeri_del_cancro_2012.pdf In Italia circa 2.250mila persone (4% del totale della popolazione) vivono avendo avuto una precedente
Grazie dell attenzione http://www.registri-tumori.it/pdf/aiom2012/i_numeri_del_cancro_2012.pdf In Italia circa 2.250mila persone (4% del totale della popolazione) vivono avendo avuto una precedente
CARTA INTESTATA DEL CENTRO CLINICO
 CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
CRIZOTINIB - XALKORI
 giunta regionale Allegato A al Decreto n. 253 del 28 agosto 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED CRIZOTINIB - XALKORI Indicazione in esame: é indicato per
giunta regionale Allegato A al Decreto n. 253 del 28 agosto 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED CRIZOTINIB - XALKORI Indicazione in esame: é indicato per
Prove di efficacia, ruolo in terapia dei nuovi farmaci e pratica clinica
 Prove di efficacia, ruolo in terapia dei nuovi farmaci e pratica clinica Corso teorico-pratico per medici e farmacisti per una introduzione consapevole e condivisa dei farmaci innovativi in oncologia Aviano
Prove di efficacia, ruolo in terapia dei nuovi farmaci e pratica clinica Corso teorico-pratico per medici e farmacisti per una introduzione consapevole e condivisa dei farmaci innovativi in oncologia Aviano
Nella provincia di Latina sono diagnosticati in media ogni anno 98 casi ogni 100.000 uomini e 27 ogni 100.000 donne.
 TUMORE DEL POLMONE Nel periodo 27-211 sono stati registrati complessivamente in provincia di Latina 172 nuovi casi di tumore del polmone. E risultato al 1 posto in termini di frequenza fra le neoplasie
TUMORE DEL POLMONE Nel periodo 27-211 sono stati registrati complessivamente in provincia di Latina 172 nuovi casi di tumore del polmone. E risultato al 1 posto in termini di frequenza fra le neoplasie
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Marzo 2009 Nuove modalità di prescrizione per i medicinali contenenti isotretinoina ad
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Marzo 2009 Nuove modalità di prescrizione per i medicinali contenenti isotretinoina ad
Quando il dolore è ancora un problema. XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013
 Quando il dolore è ancora un problema XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013 Marta Gentili vivere senza dolore onlus In Italia, nel 2012, si stimano circa 364 mila nuove diagnosi per tumore
Quando il dolore è ancora un problema XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013 Marta Gentili vivere senza dolore onlus In Italia, nel 2012, si stimano circa 364 mila nuove diagnosi per tumore
E.Molfese, P.Matteucci, A.Iurato, M. Fiore, L.E. Trodella, L. Poggesi, R.M. D Angelillo, E. Iannacone, L.Trodella!
 Il trattamento stereotassico delle lesioni surrenaliche in pazienti oligometastatici affetti da NSCLC: una promettente arma per il controllo locale di malattia?! E.Molfese, P.Matteucci, A.Iurato, M. Fiore,
Il trattamento stereotassico delle lesioni surrenaliche in pazienti oligometastatici affetti da NSCLC: una promettente arma per il controllo locale di malattia?! E.Molfese, P.Matteucci, A.Iurato, M. Fiore,
EPIDEMIOLOGIA DEL TUMORE DELLA MAMMELLA NELLE DONNE GIOVANI IN VENETO. PERIODO 2005-2008 E ANDAMENTI TEMPORALI DAL 1990.
 agosto 2015 EPIDEMIOLOGIA DEL TUMORE DELLA MAMMELLA NELLE DONNE GIOVANI IN VENETO. PERIODO 2005-2008 E ANDAMENTI TEMPORALI DAL 1990. Registro Tumori del Veneto Baracco M, Baracco S, Bovo E, Cesco G, Dal
agosto 2015 EPIDEMIOLOGIA DEL TUMORE DELLA MAMMELLA NELLE DONNE GIOVANI IN VENETO. PERIODO 2005-2008 E ANDAMENTI TEMPORALI DAL 1990. Registro Tumori del Veneto Baracco M, Baracco S, Bovo E, Cesco G, Dal
Specificare quale ospedale, dipartimento e/o soggetti inoltrano la proposta
 1. Chi è il proponente? - l ospedale - il dipartimento - un singolo soggetto Specificare quale ospedale, dipartimento e/o soggetti inoltrano la proposta 2. Chi sono i soggetti coinvolti nella proposta?
1. Chi è il proponente? - l ospedale - il dipartimento - un singolo soggetto Specificare quale ospedale, dipartimento e/o soggetti inoltrano la proposta 2. Chi sono i soggetti coinvolti nella proposta?
Trials clinici. Disegni di studio
 Trials Clinici Dott.ssa Pamela Di Giovanni Studi descrittivi Disegni di studio Popolazioni Individui Studi analitici Osservazionali Sperimentali Studi di correlazione o ecologici Case report - Case series
Trials Clinici Dott.ssa Pamela Di Giovanni Studi descrittivi Disegni di studio Popolazioni Individui Studi analitici Osservazionali Sperimentali Studi di correlazione o ecologici Case report - Case series
L'ESPERIENZA DEL PROGETTO EMILI: PREVENZIONE NELLE DONNE CON TUMORE MAMMARIO ATTRAVERSO L'EDUCAZIONE ALIMENTARE E AL MOVIMENTO
 L'ESPERIENZA DEL PROGETTO EMILI: PREVENZIONE NELLE DONNE CON TUMORE MAMMARIO ATTRAVERSO L'EDUCAZIONE ALIMENTARE E AL MOVIMENTO Latina, 26 Maggio 2012 Dott.ssa Federica Sebastiani Dipartimento di Oncologia.
L'ESPERIENZA DEL PROGETTO EMILI: PREVENZIONE NELLE DONNE CON TUMORE MAMMARIO ATTRAVERSO L'EDUCAZIONE ALIMENTARE E AL MOVIMENTO Latina, 26 Maggio 2012 Dott.ssa Federica Sebastiani Dipartimento di Oncologia.
LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO
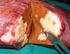 LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO Cetuximab può ridurre la massa tumorale per permettere la resezione delle metastasi, anche, in pazienti inizialmente non resecabili,
LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO Cetuximab può ridurre la massa tumorale per permettere la resezione delle metastasi, anche, in pazienti inizialmente non resecabili,
HTA e farmaci: il ruolo dell AIFA
 HTA e farmaci: il ruolo dell AIFA Simona Montilla 12 luglio 2013 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun modo l AIFA
HTA e farmaci: il ruolo dell AIFA Simona Montilla 12 luglio 2013 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun modo l AIFA
Osservatorio SosTariffe.it Telefonia Mobile
 Osservatorio SosTariffe.it Telefonia Mobile TARIFFE IN PORTABILITA DEL NUMERO: ANALISI SUL RISPARMIO CHE SI OTTIENE EFFETTUANDO IL PASSAGGIO DEL NUMERO AD UN ALTRO OPERATORE SIA PER ABBONAMENTI CHE PER
Osservatorio SosTariffe.it Telefonia Mobile TARIFFE IN PORTABILITA DEL NUMERO: ANALISI SUL RISPARMIO CHE SI OTTIENE EFFETTUANDO IL PASSAGGIO DEL NUMERO AD UN ALTRO OPERATORE SIA PER ABBONAMENTI CHE PER
Scritto da Giovanni Creton Domenica 27 Febbraio 2011 17:32 - Ultimo aggiornamento Domenica 27 Marzo 2011 19:43
 E evidente che lo screening per un tumore può diagnosticare la malattia molto precocemente, ma nel caso del tumore alla prostata il ricorso al test del PSA può creare dati incerti e rischi sanitari in
E evidente che lo screening per un tumore può diagnosticare la malattia molto precocemente, ma nel caso del tumore alla prostata il ricorso al test del PSA può creare dati incerti e rischi sanitari in
Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto. Carmelo Lupo
 Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto Carmelo Lupo RAS-RAF signaling Activation of the RAS-RAF signaling cascade occurs via the following sequential steps 1 : Activation
Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto Carmelo Lupo RAS-RAF signaling Activation of the RAS-RAF signaling cascade occurs via the following sequential steps 1 : Activation
SINOSSI. Studio di Fase II: Obiettivo primario Determinare l attività antitumorale della combinazione in termini di tempo alla progressione
 SINOSSI TITOLO Studio di fase I-II con Lapatinib in combinazione con capecitabina e vinorelbina come seconda linea di trattamento in pazienti con carcinoma mammario con iperespressione di ErbB2 localmente
SINOSSI TITOLO Studio di fase I-II con Lapatinib in combinazione con capecitabina e vinorelbina come seconda linea di trattamento in pazienti con carcinoma mammario con iperespressione di ErbB2 localmente
Dr. Francesco Rastrelli. 19 gennaio 2015. Reti per promuovere gli screening: il ruolo dei Farmacisti
 Dr. Francesco Rastrelli 19 gennaio 2015 Reti per promuovere gli screening: il ruolo dei Farmacisti Riassetto organizzativo Farmacisti territoriali Medici specialisti MEDICINA GENERALE Infermieri Medici
Dr. Francesco Rastrelli 19 gennaio 2015 Reti per promuovere gli screening: il ruolo dei Farmacisti Riassetto organizzativo Farmacisti territoriali Medici specialisti MEDICINA GENERALE Infermieri Medici
Indicatori sulla terapia di oncologia medica
 Indicatori sulla terapia di oncologia medica Michela Donadio Oncologia Medica Senologica Azienda Ospedaliera Città della Salute e della Scienza di Torino Torino, 2 dicembre 20 Terapie mediche neoad/adiuvanti:
Indicatori sulla terapia di oncologia medica Michela Donadio Oncologia Medica Senologica Azienda Ospedaliera Città della Salute e della Scienza di Torino Torino, 2 dicembre 20 Terapie mediche neoad/adiuvanti:
Allegato I. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
ANALISI CRITICA DELLA DOCUMENTAZIONE TECNICA RELATIVA ALLA CENTRALE TERMOELETTRICA DI QUILIANO E VADO LIGURE
 6.1 Salute umana Dall analisi della documentazione di progetto sottoposta ad autorizzazione emerge come la tematica della Salute Umana sia stata affrontata in modo inadeguato, ovvero con estrema superficialità
6.1 Salute umana Dall analisi della documentazione di progetto sottoposta ad autorizzazione emerge come la tematica della Salute Umana sia stata affrontata in modo inadeguato, ovvero con estrema superficialità
Scritto da RyderItalia Mercoledì 12 Maggio 2010 11:19 - Ultimo aggiornamento Mercoledì 03 Novembre 2010 15:57
 LA TERAPIA METRONOMICA Per oltre mezzo secolo, la terapia sistemica per i tumori è stata caratterizzata dalla somministrazione dei farmaci chemioterapici. La maggior parte di questi farmaci ha lo scopo
LA TERAPIA METRONOMICA Per oltre mezzo secolo, la terapia sistemica per i tumori è stata caratterizzata dalla somministrazione dei farmaci chemioterapici. La maggior parte di questi farmaci ha lo scopo
Il Direttore della Direzione Regionale Programmazione Sanitaria -Risorse Umane e Sanitarie
 Oggetto: Aggiornamento della determinazione 1875 del Modalità di erogazione dei farmaci classificati in regime di rimborsabilità in fascia H e in regime di fornitura OSP2, così come modificata dalla determinazione
Oggetto: Aggiornamento della determinazione 1875 del Modalità di erogazione dei farmaci classificati in regime di rimborsabilità in fascia H e in regime di fornitura OSP2, così come modificata dalla determinazione
ANALISI DI ALCUNI INDICATORI DI FOLLOW-UP NEL TUMORE DELLA MAMMELLA NELL ASL DELLA PROVINCIA DI VARESE ANNO 2009
 ANALISI DI ALCUNI INDICATORI DI FOLLOW-UP NEL TUMORE DELLA MAMMELLA NELL ASL DELLA PROVINCIA DI VARESE ANNO 2009 A cura di: Dr.ssa M. Gambino, Dr.ssa Ass. San. L. Balconi, Dr. S. Pisani U. O. S. Sorveglianza
ANALISI DI ALCUNI INDICATORI DI FOLLOW-UP NEL TUMORE DELLA MAMMELLA NELL ASL DELLA PROVINCIA DI VARESE ANNO 2009 A cura di: Dr.ssa M. Gambino, Dr.ssa Ass. San. L. Balconi, Dr. S. Pisani U. O. S. Sorveglianza
Specialità: Avastin(Roche spa)
 BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in ricaduta in aggiunta a chemioterapia a base
BEVACIZUMAB per l'indicazione: trattamento in prima linea di pazienti con carcinoma polmonare non a piccole cellule, non resecabile, avanzato, metastatico o in ricaduta in aggiunta a chemioterapia a base
STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO
 STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO FAX: 0916552413 SITO WEB: www.gstu.it E-MAIL: gstu@gstu.it CRITERI
STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO FAX: 0916552413 SITO WEB: www.gstu.it E-MAIL: gstu@gstu.it CRITERI
coin lesion polmonare
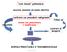 coin lesion polmonare accurata anamnesi ed esame obiettivo impossibile confronto con precedenti radiogrammi lesione non preesistente o modificatasi TC Follow-up caratteri di benignità lesione sospetta
coin lesion polmonare accurata anamnesi ed esame obiettivo impossibile confronto con precedenti radiogrammi lesione non preesistente o modificatasi TC Follow-up caratteri di benignità lesione sospetta
16/05/2012. La Legge 648/96: una risorsa tutta italiana, da perfezionare e mutare. Carlo Tomino. Roma, 10 Maggio 2012
 La Legge 648/96: una risorsa tutta italiana, da perfezionare e mutare. Carlo Tomino Roma, 10 Maggio 2012 1 Dichiarazione di trasparenza/interessi: Carlo Tomino, dirigente Le opinioni espresse in questa
La Legge 648/96: una risorsa tutta italiana, da perfezionare e mutare. Carlo Tomino Roma, 10 Maggio 2012 1 Dichiarazione di trasparenza/interessi: Carlo Tomino, dirigente Le opinioni espresse in questa
Incidenza, mortalità e prevalenza per tumore del polmone in Italia
 Incidenza, mortalità e prevalenza per tumore del polmone in Sintesi L incidenza e la mortalità per il tumore del polmone stimate in nel periodo 197-215 mostrano andamenti differenti tra uomini e donne:
Incidenza, mortalità e prevalenza per tumore del polmone in Sintesi L incidenza e la mortalità per il tumore del polmone stimate in nel periodo 197-215 mostrano andamenti differenti tra uomini e donne:
I programmi di screening mammografico in Italia e nel Veneto: criticità e prospettive
 Padova, 7 dicembre 2010 I programmi di screening mammografico in Italia e nel Veneto: criticità e prospettive Manuel Zorzi Istituto Oncologico Veneto IRCCS Registro Tumori del Veneto Estensione dello screening
Padova, 7 dicembre 2010 I programmi di screening mammografico in Italia e nel Veneto: criticità e prospettive Manuel Zorzi Istituto Oncologico Veneto IRCCS Registro Tumori del Veneto Estensione dello screening
ANALISI DI IMPATTO DI BUDGET DI UNA NUOVA STRATEGIA VACCINALE PATRIZIA BERTO, NICOLA PRINCIPI
 ANALISI DI IMPATTO DI BUDGET DI UNA NUOVA STRATEGIA VACCINALE PATRIZIA BERTO, NICOLA PRINCIPI INTRODUZIONE Le Infezioni da Pneumococco (PNU) rappresentano un problema sanitario grave, soprattutto a causa
ANALISI DI IMPATTO DI BUDGET DI UNA NUOVA STRATEGIA VACCINALE PATRIZIA BERTO, NICOLA PRINCIPI INTRODUZIONE Le Infezioni da Pneumococco (PNU) rappresentano un problema sanitario grave, soprattutto a causa
AIFA Agenzia Italiana del Farmaco Valproato
 AIFA - Valproato 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Valproato Rivalutazione CHMP file:///c /documenti/val9510.htm [18/12/2009 12.44.38] Domande e risposte sulla rivalutazione dei
AIFA - Valproato 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Valproato Rivalutazione CHMP file:///c /documenti/val9510.htm [18/12/2009 12.44.38] Domande e risposte sulla rivalutazione dei
REPORT HTA REGIONALE. Decisioni CTR Data riunione: 20/02/2012 fd. Decisione: Inserito
 REPORT HTA REGIONALE Decisioni CTR Data riunione: 20/02/2012 fd Decisione: Inserito CARATTERISTICHE DEL PRODOTTO PRINCIPIO ATTIVO: Pazopanib NOME COMMERCIALE: Votrient DITTA PRODUTTRICE: Glaxosmithkline
REPORT HTA REGIONALE Decisioni CTR Data riunione: 20/02/2012 fd Decisione: Inserito CARATTERISTICHE DEL PRODOTTO PRINCIPIO ATTIVO: Pazopanib NOME COMMERCIALE: Votrient DITTA PRODUTTRICE: Glaxosmithkline
Studio di ricerca clinica sul dolore da endometriosi. Il dolore che Lei sente è reale... anche se gli altri non possono vederlo.
 Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
Sorafenib indicazione epatocarcinoma (09-09-2008)
 Sorafenib indicazione epatocarcinoma (09-09-2008) Specialità: Nexavar (Bayer spa) Forma farmaceutica: 112 compresse 200 mg - Prezzo: euro 5.305 ATC: L01XE05 Categoria terapeutica: Citostatici: inibitori
Sorafenib indicazione epatocarcinoma (09-09-2008) Specialità: Nexavar (Bayer spa) Forma farmaceutica: 112 compresse 200 mg - Prezzo: euro 5.305 ATC: L01XE05 Categoria terapeutica: Citostatici: inibitori
MINI SCHEDA HTA FIDAXOMICINA (DIFICLIR )
 1/10 MINI SCHEDA HTA FIDAXOMICINA (DIFICLIR ) Nome Commerciale DIFICLIR Principio Attivo Fidaxomicina Ditta Produttrice Astellas Pharma SpA ATC A07AA12 Formulazione Compresse rivestite Dosaggio 200 mg
1/10 MINI SCHEDA HTA FIDAXOMICINA (DIFICLIR ) Nome Commerciale DIFICLIR Principio Attivo Fidaxomicina Ditta Produttrice Astellas Pharma SpA ATC A07AA12 Formulazione Compresse rivestite Dosaggio 200 mg
T.E.V. E CHEMIOTERAPIA. Dott. Pietro Masullo
 T.E.V. E CHEMIOTERAPIA Dott. Pietro Masullo I MECCANISMI SONO MOLTEPLICI, SPESSO PRESENTI CONTEMPORANEAMENTE E NON ANCORA DEL TUTTO CHIARI LA CHEMIOTERAPIA PU0 AUMENTARE IL RISCHIO TEV ATTRAVERSO
T.E.V. E CHEMIOTERAPIA Dott. Pietro Masullo I MECCANISMI SONO MOLTEPLICI, SPESSO PRESENTI CONTEMPORANEAMENTE E NON ANCORA DEL TUTTO CHIARI LA CHEMIOTERAPIA PU0 AUMENTARE IL RISCHIO TEV ATTRAVERSO
ANNO MASCHI FEMMINE TOTALE TOTALE 1974 2513 4487
 MORTALITÀ Tra i residenti della ULSS n. 1 nel corso del triennio 2010-2012 si sono verificati 4487 decessi (1974 nei maschi e 2513 nelle femmine, media per anno 1496), in leggero aumento rispetto al dato
MORTALITÀ Tra i residenti della ULSS n. 1 nel corso del triennio 2010-2012 si sono verificati 4487 decessi (1974 nei maschi e 2513 nelle femmine, media per anno 1496), in leggero aumento rispetto al dato
 Agenzia Italiana del Farmaco Bando di assegnazione di finanziamento per la Ricerca indipendente sui farmaci Area 2 - Studi comparativi fra farmaci e strategie farmacologiche Art. 48, commi 5 lett. g) e
Agenzia Italiana del Farmaco Bando di assegnazione di finanziamento per la Ricerca indipendente sui farmaci Area 2 - Studi comparativi fra farmaci e strategie farmacologiche Art. 48, commi 5 lett. g) e
LA TERAPIA FARMACOLOGICA
 FATIGUE: INTERVENTISTI O MINIMALISTI? STATO DELL ARTE SULLE POSSIBILI TERAPIE LA TERAPIA FARMACOLOGICA Fausto Roila S.C. Oncologia, Terni FATIGUE DA CANCRO: DEFINIZIONE (NCCN) Sensazione soggettiva, stressante,
FATIGUE: INTERVENTISTI O MINIMALISTI? STATO DELL ARTE SULLE POSSIBILI TERAPIE LA TERAPIA FARMACOLOGICA Fausto Roila S.C. Oncologia, Terni FATIGUE DA CANCRO: DEFINIZIONE (NCCN) Sensazione soggettiva, stressante,
L età dei vincitori La presenza femminile. L età dei vincitori La presenza femminile. Confronto tra il concorso ordinario ed il concorso riservato
 Premessa Corso-concorso ordinario L età dei vincitori La presenza femminile Corso-concorso riservato L età dei vincitori La presenza femminile Confronto tra il concorso ordinario ed il concorso riservato
Premessa Corso-concorso ordinario L età dei vincitori La presenza femminile Corso-concorso riservato L età dei vincitori La presenza femminile Confronto tra il concorso ordinario ed il concorso riservato
Osservatorio 2. L INDUSTRIA METALMECCANICA E IL COMPARTO SIDERURGICO. I risultati del comparto siderurgico. Apparecchi meccanici. Macchine elettriche
 Osservatorio24 def 27-02-2008 12:49 Pagina 7 Osservatorio 2. L INDUSTRIA METALMECCANICA E IL COMPARTO SIDERURGICO 2.1 La produzione industriale e i prezzi alla produzione Nel 2007 la produzione industriale
Osservatorio24 def 27-02-2008 12:49 Pagina 7 Osservatorio 2. L INDUSTRIA METALMECCANICA E IL COMPARTO SIDERURGICO 2.1 La produzione industriale e i prezzi alla produzione Nel 2007 la produzione industriale
L USO DEGLI ANTIPSICOTICI
 L USO DEGLI ANTIPSICOTICI NELLA REGIONE VENETO Valentina Fantelli Settore Farmaceutico Regionale Mestre - Venezia, 22 ottobre 2014 Area Sanità e Sociale Sezione Attuazione Programmazione Sanitaria Governance
L USO DEGLI ANTIPSICOTICI NELLA REGIONE VENETO Valentina Fantelli Settore Farmaceutico Regionale Mestre - Venezia, 22 ottobre 2014 Area Sanità e Sociale Sezione Attuazione Programmazione Sanitaria Governance
 Indicatori di qualità nei carcinomi genitali femminili: ovaio e utero Serata di presentazione progetto Zonta Club Locarno 13.04.2010 Registro Tumori Canton Ticino Istituto Cantonale di Patologia Via in
Indicatori di qualità nei carcinomi genitali femminili: ovaio e utero Serata di presentazione progetto Zonta Club Locarno 13.04.2010 Registro Tumori Canton Ticino Istituto Cantonale di Patologia Via in
DIFFERENZA DI GENERE E MEDICINA
 DIFFERENZA DI GENERE E MEDICINA L ONU, l Europa e l OMS raccomandano che il determinante genere sia tenuto presente nella programmazione delle politiche sanitarie. L ONU ha inserito la medicina di genere
DIFFERENZA DI GENERE E MEDICINA L ONU, l Europa e l OMS raccomandano che il determinante genere sia tenuto presente nella programmazione delle politiche sanitarie. L ONU ha inserito la medicina di genere
Comitato Scientifico: Gianni Amunni Oscar Bertetto Antonio Frassoldati Roberto Labianca Riccardo Masetti Paolo Pronzato
 Coordinamento Scientifico Pierfranco Conte Valentina Guarneri Comitato Scientifico: Gianni Amunni Oscar Bertetto Antonio Frassoldati Roberto Labianca Riccardo Masetti Paolo Pronzato A cura di OVER SRL
Coordinamento Scientifico Pierfranco Conte Valentina Guarneri Comitato Scientifico: Gianni Amunni Oscar Bertetto Antonio Frassoldati Roberto Labianca Riccardo Masetti Paolo Pronzato A cura di OVER SRL
Rionero in Vulture (PZ), 13 giugno 2014. Michele Aieta
 Corso Residenziale INIBIZIONE DI mtor IN ONCOLOGIA, 13 giugno 2014 DIRETTORE Sezione di ONCOLOGIA OBIETTIVI La mammalian target of rapamycin (mtor) è una chinasi intracitoplasmatica fondamentale nei processi
Corso Residenziale INIBIZIONE DI mtor IN ONCOLOGIA, 13 giugno 2014 DIRETTORE Sezione di ONCOLOGIA OBIETTIVI La mammalian target of rapamycin (mtor) è una chinasi intracitoplasmatica fondamentale nei processi
L Investigator s Brochure. Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari. Maglie 25 novembre 2004
 L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
«Avere i nuovi farmaci al momento giusto»
 «Avere i nuovi farmaci al momento giusto» I tempi del percorso autorizzativo di 16 farmaci oncologici innovativi in 10 Regioni italiane La ricerca Censis Favo - Aiom Carla Collicelli Fondazione CENSIS
«Avere i nuovi farmaci al momento giusto» I tempi del percorso autorizzativo di 16 farmaci oncologici innovativi in 10 Regioni italiane La ricerca Censis Favo - Aiom Carla Collicelli Fondazione CENSIS
Piano di Sviluppo della RTN
 Piano di Sviluppo della RTN Consultazione pubblica edizioni 2015 del PdS (D.Lgs. 93/2011 - Art. 36, comma 13) Le analisi di costo per i Piani di Sviluppo Milano, 20 gennaio 2016 1 1. Criteri di pianificazione
Piano di Sviluppo della RTN Consultazione pubblica edizioni 2015 del PdS (D.Lgs. 93/2011 - Art. 36, comma 13) Le analisi di costo per i Piani di Sviluppo Milano, 20 gennaio 2016 1 1. Criteri di pianificazione
PROGRAMMA DI PREVENZIONE CARDIOVASCOLARE nella REGIONE VENETO
 PROGRAMMA DI PREVENZIONE CARDIOVASCOLARE nella REGIONE VENETO Il programma di prevenzione cardiovascolare è stato attivato nella Regione Veneto nel corso del 2008, dopo una fase di preparazione durata
PROGRAMMA DI PREVENZIONE CARDIOVASCOLARE nella REGIONE VENETO Il programma di prevenzione cardiovascolare è stato attivato nella Regione Veneto nel corso del 2008, dopo una fase di preparazione durata
Informazioni per potenziali partecipanti. Possiamo sciogliere l'amiloidosi AL?
 Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Impiego clinico della vitamina D e dei suoi metaboliti ABSTRACT. 26 Gennaio 2013, Roma Università di Roma Sapienza
 CORSO DI AGGIORNAMENTO E.C.M. Impiego clinico della vitamina D ABSTRACT 26 Gennaio 2013, Roma Università di Roma Sapienza CORSO DI AGGIORNAMENTO E.C.M. Roma 26/01/2013 Confronto tra 25(OH) -calcifediolo
CORSO DI AGGIORNAMENTO E.C.M. Impiego clinico della vitamina D ABSTRACT 26 Gennaio 2013, Roma Università di Roma Sapienza CORSO DI AGGIORNAMENTO E.C.M. Roma 26/01/2013 Confronto tra 25(OH) -calcifediolo
Screening per il tumore della mammella Ruolo dei medici di medicina generale. Riportare al singolo paziente le evidenze dei grandi numeri
 Screening per il tumore della mammella Ruolo dei medici di medicina generale Riportare al singolo paziente le evidenze dei grandi numeri Prevenzione:due direttrici parallele Gli studi di popolazione Health
Screening per il tumore della mammella Ruolo dei medici di medicina generale Riportare al singolo paziente le evidenze dei grandi numeri Prevenzione:due direttrici parallele Gli studi di popolazione Health
PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI CLOPIDOGREL
 20-3-2009 GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale - n. 66 ALLEGATO 1 PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI CLOPIDOGREL Centro prescrittore Nome cognome del clinico prescrittore
20-3-2009 GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale - n. 66 ALLEGATO 1 PIANO TERAPEUTICO AIFA PER PRESCRIZIONE DI CLOPIDOGREL Centro prescrittore Nome cognome del clinico prescrittore
PREVENZIONE POLMONITE
 fiammaz o l m o n a r e struzione br avità pleuri Streptococcus p n e u m o n i a Infezione Mal Respiratorio PREVENZIONE POLMONITE Vaccino Pneumococcico Polisaccaridico Coniugato, (13Valente Adsorbito)
fiammaz o l m o n a r e struzione br avità pleuri Streptococcus p n e u m o n i a Infezione Mal Respiratorio PREVENZIONE POLMONITE Vaccino Pneumococcico Polisaccaridico Coniugato, (13Valente Adsorbito)
CABAZITAXEL - JEVTANA
 giunta regionale Allegato F al Decreto n. 139 del 3 giugno 2015 pag. 1/7 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED CABAZITAXEL - JEVTANA Indicazione in esame: in combinazione
giunta regionale Allegato F al Decreto n. 139 del 3 giugno 2015 pag. 1/7 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED CABAZITAXEL - JEVTANA Indicazione in esame: in combinazione
Allegato II Conclusioni scientifiche e motivi della modifica di riassunto delle caratteristiche del prodotto
 Allegato II Conclusioni scientifiche e motivi della modifica di riassunto delle caratteristiche del prodotto, etichettatura e foglio illustrativo presentati dall Agenzia europea per i medicinali 6 Conclusioni
Allegato II Conclusioni scientifiche e motivi della modifica di riassunto delle caratteristiche del prodotto, etichettatura e foglio illustrativo presentati dall Agenzia europea per i medicinali 6 Conclusioni
Raccolta prospettica di dati di rilevanza prognostica in pazienti con Leucemia Linfatica Cronica a cellule B.
 O-CLL1 CHRONIC LYMPHOCYTIC LEUKEMIA PROGNOSTIC FACTOR PROJECT Raccolta prospettica di dati di rilevanza prognostica in pazienti con Leucemia Linfatica Cronica a cellule B. O-CLL1-PROTOCOL Sinossi O-CLL1-sinossi,
O-CLL1 CHRONIC LYMPHOCYTIC LEUKEMIA PROGNOSTIC FACTOR PROJECT Raccolta prospettica di dati di rilevanza prognostica in pazienti con Leucemia Linfatica Cronica a cellule B. O-CLL1-PROTOCOL Sinossi O-CLL1-sinossi,
STUDIO OSSERVAZIONALE SULLA PREVALENZA DELLE PIU COMUNI PATOLOGIE UROLOGICHE E DEL LORO IMPATTO SULLA QUALITA DI VITA IN PAZIENTI
 STUDIO OSSERVAZIONALE SULLA PREVALENZA DELLE PIU COMUNI PATOLOGIE UROLOGICHE E DEL LORO IMPATTO SULLA QUALITA DI VITA IN PAZIENTI SOTTOPOSTI A DIALISI. Introduzione 2 Obiettivo dello studio 4 Materiali
STUDIO OSSERVAZIONALE SULLA PREVALENZA DELLE PIU COMUNI PATOLOGIE UROLOGICHE E DEL LORO IMPATTO SULLA QUALITA DI VITA IN PAZIENTI SOTTOPOSTI A DIALISI. Introduzione 2 Obiettivo dello studio 4 Materiali
IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici genovesi
 Università degli Studi di Genova Facoltà di Medicina e Chirurgia IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici
Università degli Studi di Genova Facoltà di Medicina e Chirurgia IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici
Lo screening mammografico una revisione sui dati di letteratura
 Lo screening mammografico una revisione sui dati di letteratura Cos è uno screening Strategia di indagini diagnostiche generalizzate, utilizzate per identificare una malattia in una popolazione standard
Lo screening mammografico una revisione sui dati di letteratura Cos è uno screening Strategia di indagini diagnostiche generalizzate, utilizzate per identificare una malattia in una popolazione standard
DIRITTI E DELLE RESPONSABILITÀ
 CARTA INTERNAZIONALE DEI DIRITTI E DELLE RESPONSABILITÀ DELLE PERSONE AFFETTE DA DIABETE Federazione Internazionale del Diabete INTRODUZIONE Il diabete rappresenta una vera sfida nel campo della sanità
CARTA INTERNAZIONALE DEI DIRITTI E DELLE RESPONSABILITÀ DELLE PERSONE AFFETTE DA DIABETE Federazione Internazionale del Diabete INTRODUZIONE Il diabete rappresenta una vera sfida nel campo della sanità
NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE CONSIDERATO ETICO
 COME E QUANDO GLI ASPETTI TECNICI DEI PROTOCOLLI POSSONO-DEVONO ESSERE OGGETTO-ARGOMENTO DI DECISIONI ETICHE? Fausto Roila Oncologia Medica, Terni NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE
COME E QUANDO GLI ASPETTI TECNICI DEI PROTOCOLLI POSSONO-DEVONO ESSERE OGGETTO-ARGOMENTO DI DECISIONI ETICHE? Fausto Roila Oncologia Medica, Terni NESSUNO STUDIO METODOLOGICAMENTE SCORRETTO PUO ESSERE
Presentazione: AFI CRS: Sistemi Terapeutici Innovativi. Relatore: Dr. Mario Bruzzone
 Presentazione: AFI CRS: Sistemi Terapeutici Innovativi Relatore: Dr. Mario Bruzzone Data 9 Giugno 20 Sala Fellini AFI CRS: Sistemi Terapeutici Innovativi La posizione di AIFA riguardo alle nuove formulazioni
Presentazione: AFI CRS: Sistemi Terapeutici Innovativi Relatore: Dr. Mario Bruzzone Data 9 Giugno 20 Sala Fellini AFI CRS: Sistemi Terapeutici Innovativi La posizione di AIFA riguardo alle nuove formulazioni
HIGHLIGHTS IN TEMA DI NEOPLASIA PROSTATICA: DIAGNOSI, TERAPIA, RICERCA Aviano (PN), venerdì 7 dicembre 2012
 HIGHLIGHTS IN TEMA DI NEOPLASIA PROSTATICA: DIAGNOSI, TERAPIA, RICERCA Aviano (PN), venerdì 7 dicembre 2012 QUESTIONARIO DI APPRENDIMENTO RISPOSTE ESATTE Il test si supera se le risposte esatte sono 26
HIGHLIGHTS IN TEMA DI NEOPLASIA PROSTATICA: DIAGNOSI, TERAPIA, RICERCA Aviano (PN), venerdì 7 dicembre 2012 QUESTIONARIO DI APPRENDIMENTO RISPOSTE ESATTE Il test si supera se le risposte esatte sono 26
