L elemento carbonio e il suo più semplice composto con l idrogeno
|
|
|
- Ambra Carlini
- 7 anni fa
- Visualizzazioni
Transcript
1 L elemento carbonio e il suo più semplice composto con l idrogeno L elemento carbonio è caratterizzato dal numero atomico Z=6, per cui la sua configurazione elettronica di base sarà: 6 C 1s 2 2s 2 2p 2 Figura 1 Schema della configurazione di base del carbonio Secondo tale configurazione ci si attende che il carbonio dia luogo alla formazione di due legami covalenti (avendo solo due elettroni spaiati nell ultimo livello). Ad esempio con l idrogeno (Z=1) il più semplice composto che si origina dalla combinazione dei due elementi dovrebbe avere formula CH 2. Figura 2 Ipotetica formula del più semplice composto tra il carbonio e l idrogeno. In realtà il più semplice composto idrogeno-carbonio ha formula CH 4 (metano) in cui un carbonio lega contemporaneamente quattro idrogeni, mediante altrettanti legami covalenti. Questo si può spiegare solo ammettendo che il carbonio disponga non di due, bensì di quattro elettroni spaiati. Ciò è ancora più vero se si riflette sul fatto che pressoché in tutti i suoi composti il carbonio si comporta sempre da tetravalente. Per raggiungere questo risultato dovremo eccitare un elettrone dell'orbitale 2s (dando l'energia di promozione), mandandolo ad occupare un orbitale p vuoto: 6C* 1s 2 2s 1 2p 3 Tutto sommato la cosa non è difficile essendo l'orbitale di partenza e quello di arrivo appartenenti al medesimo guscio 2. Questa momentanea destabilizzazione è comunque accettabile perché nelle fasi successive, che andremo a descrivere tra poco, il carbonio guadagnerà in stabilità, potendo raggiungere l'ottetto completo e soprattutto perché potrà ora formare quattro legami invece di due (ricordiamoci che la formazione di un legame chimico è un processo esotermico: se il sistema forma quattro legami invece di due ovviamente si stabilizza di più). Figura 3 Schema elettronico del carbonio eccitato. Ora è teoricamente possibile sfruttare i 4 elettroni spaiati per dare 4 legami covalenti. Tuttavia poiché questi elettroni occupano orbitali di tipo diverso (s e p) per forma ed energia, il loro utilizzo dovrebbe generare due diversi tipi di legame: uno ottenuto dall'utilizzo dell'elettrone posto nel 2s e tre (tra loro uguali) ottenuti dall'utilizzo degli elettroni posti negli orbitali 2p. Poiché già Van't Hoff nel secolo scorso aveva dimostrato che, almeno nel metano, i 4 legami del carbonio erano perfettamente equivalenti, DEVE avvenire un ulteriore processo che renda identici i "contenitori", cioè gli orbitali, in cui si trovano gli elettroni. Questo processo viene detto di IBRIDAZIONE. Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5 a Serale 1
2 Tuttavia, ahimè, il carbonio, a seconda dei composti in cui si trova, è in grado di ibridarsi in modo differente. Prendiamo in considerazione per prima cosa il comportamento del carbonio negli alcani e, vista la nostra inesperienza, partiamo dall'alcano più semplice, il metano. I quattro orbitali del C* eccitato, un orbitale s e tre orbitali p, si mescolano tra loro per formare quattro orbitali ibridi identici. Tali orbitali sono detti sp 3 perché formati da un orbitale s e da tre orbitali p. Figura 4 Attraverso l ibridazione da due tipi di orbitali si ottiene un unico tipo: in ogni caso il numero complessivo degli orbitali coinvolti nel processo di mescolamento non cambia. La loro forma è intermedia tra quella sferica dell'orbitale s e quella a otto dei tre orbitali p. Essendo quest'ultimi predominanti (tre su quattro) è da prevedere che gli orbitali sp 3 siano più simili ai p che non al solo orbitale s. Figura 5 Forma di un singolo orbitale sp 3, con il suo asse di simmetria. Essi sono diretti verso i 4 angoli di un tetraedro regolare, con angoli di ~109, raggiungendo un assetto geometrico più stabile (cioè massima distanza l uno dall altro 1 ) ed equivalenti tra loro (cioè indistinguibili). Figura 6 Da quattro orbitali, uno di tipo s e tre di tipo p si ottengono quattro orbitali ibridi sp 3, disposti a tetraedro, come in figura. A questo punto siamo in dirittura di arrivo: il carbonio può legarsi con 4 atomi di idrogeno, sovrapponendo i sui orbitali sp 3 con gli orbitali s degli idrogeni: si forma finalmente il metano! 1 Non dimentichiamo che ciascuno degli orbitali sp 3 contiene un elettrone e che gli elettroni si respingono tra loro. Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5 a Serale 2
3 Figura 7 _ Formazione del metano CH 4, a partire da un carbonio tetraedrico e quattro atomi di idrogeno, ciascuno con 1 elettrone in un orbitale s. Cosa dovete ricordare alla fine di questo capitolo: 1. Il carbonio forma nei suoi composti quattro legami 2. Se è ibridato secondo uno schema sp 3 i quattro legami covalenti servono a unire quattro atomi ben distinti: in altre parole ogni atomo si pappa un legame covalente e così via 3. La disposizione spaziale degli atomi uniti al carbonio è quella di un tetraedro, con angoli di legame di circa 109. Gli alcani I più semplici composti organici sono gli IDROCARBURI, composti che contengono esclusivamente carbonio e idrogeno. Nonostante ciò sono molto numerosi, grazie alla grande versatilità del carbonio che è in grado non solo di formare quattro legami covalenti ma anche di giocarseli in modo diversificato rispetto allo schema sp 3 finora affrontato 2. Tradizionalmente lo studio degli idrocarburi inizia con gli ALCANI, composti le cui molecole presentano tutti i carboni con ibridazione sp 3 con una geometria tetraedrica, dotate di uno scheletro carbonioso a catena aperta, che può essere lineare oppure ramificata 3. Come conseguenza sono presenti esclusivamente legami semplici di tipo σ (sigma), formati da una coppia di elettroni, o tra carbonio e carbonio o tra carbonio e idrogeno. Si suole anche affermare che gli alcani sono degli idrocarburi saturi, in quanto contengono nelle loro molecole il numero massimo consentito di atomi di idrogeno, rispetto ai carboni presenti. La loro formula bruta generale è: C n H 2n+2 Sono dotati di un' elevata inerzia chimica e per questo vengono ancora oggi indicati con il termine PARAFFINE, che deriva dal latino parum affinis, cioè poco affine, poco reattivo. Essendo saturi e non potendo addizionare alcunché gli alcani quando reagiscono danno principalmente reazioni di sostituzione. La famiglia degli alcani costituisce una serie omologa, dove ogni membro differisce dal successivo di un termine costante CH 2. Il più semplice membro degli alcani è il metano (CH 4 ), formato da un solo carbonio legato a 4 idrogeni. Il suo nome è ottenuto mettendo insieme la radice relativa alla presenza di un solo carbonio (met-) a quella del suffisso caratterizzante la famiglia (-ano) in modo da ottenere il termine metano. 2 Rimandiamo in ogni caso a una lezione successiva lo studio degli altri tipi di ibridazione. 3 Essi appartengono in realtà a un gruppo più ampio, quello degli ALIFATICI (il cui nome deriva dalla parola greca che sta ad indicare una sostanza grassa, oleosa): gli altri membri verranno studiati nel proseguo del programma. Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5 a Serale 3
4 Altri semplici membri della famiglia possono essere ottenuti legando tra loro più carboni in una sequenza lineare e poi completando con un numero adeguato di idrogeni, fino a soddisfare la tetravalenza dei carboni (e rispettando la monovalenza dell'idrogeno). Le formule e i nomi di questi composti a struttura lineare (fino a 10 carboni) sono mostrati nella seguente tabella. numero di atomi di carbonio formanti la catena formule brute formule razionali contratte nome secondo le regole IUPAC 1 CH 4 - metano 2 C 2 H 6 CH 3 -CH 3 etano 3 C 3 H 8 CH 3 -CH 2 -CH 3 propano 4 C 4 H 10 CH 3 -(CH 2 ) 2 -CH 3 butano 5 C 5 H 12 CH 3 -(CH 2 ) 3 -CH 3 pentano 6 C 6 H 14 CH 3 -(CH 2 ) 4 -CH 3 esano 7 C 7 H 16 CH 3 -(CH 2 ) 5 -CH 3 eptano 8 C 8 H 18 CH 3 -(CH 2 ) 6 -CH 3 ottano 9 C 9 H 20 CH 3 -(CH 2 ) 7 -CH 3 nonano 10 C 10 H 22 CH 3 -(CH 2 ) 8 -CH 3 decano In realtà, a partire da alcani con quattro atomi di carbonio, è possibile il fenomeno dell isomeria, per cui a una medesima formula bruta corrispondono più composti. Ad esempio, di composti a formula C 4 H 10 non c'è ne uno solo, bensì 2. Infatti con il butano inizia per gli alcani la possibilità di manifestare il fenomeno dell'isomeria DI CATENA. Esistono in pratica due alcani, rappresentati dalle formule scritte a fianco. Per gli alcani la possibilità di isomeria cresce in modo esponenziale man mano che aumenta il numero di atomi di carbonio. Numero di atomi di carbonio Numero di isomeri Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5 a Serale 4
5 Classificazione dei carboni e degli idrogeni Poiché il carbonio forma 4 legami è possibile che un singolo carbonio sia contemporaneamente legato fino a 4 altri atomi di carbonio. Si ricordi a questo proposito che: o un carbonio viene definito primario se è legato solo ad un altro atomo di carbonio. o un carbonio è detto secondario se è legato contemporaneamente ad altri due carboni. o un carbonio è terziario quando è contemporaneamente legato a tre carboni o un carbonio si dice quaternario quando si lega contemporaneamente ad altri quattro atomi di carbonio. N.B. Gli atomi di idrogeno eventualmente legati ad un carbonio hanno la stessa classificazione di quel carbonio. Cosa dovete ricordare alla fine di questo capitolo: 1. Gli alcani hanno tutti i loro carboni con ibridazione sp 3 con una geometria tetraedrica 2. Le loro molecole presentano uno scheletro carbonioso a catena aperta, che può essere lineare oppure ramificata 3. Nelle loro molecole sono presenti esclusivamente legami semplici di tipo σ (sigma), formati da una coppia di elettroni, o tra carbonio e carbonio o tra carbonio e idrogeno. 4. Gli alcani sono degli idrocarburi saturi, in quanto contengono nelle loro molecole il numero massimo consentito di atomi di idrogeno, rispetto ai carboni presenti. 5. La loro formula bruta generale è C n H 2n+2 6. Sono dotati di un' elevata inerzia chimica e per questo vengono ancora oggi indicati con il termine PARAFFINE 7. Gli alcani, essendo saturi e non potendo addizionare alcunché, quando reagiscono danno principalmente reazioni di sostituzione. 8. Ogni membro della serie omologa differisce dal successivo di un termine costante CH 2 9. I nomi e le formule brute e razionali dei primi dieci membri della serie omologa 10. Il significato di isomeria di catena negli alcani 11. La classificazione dei carboni (primario, secondario, terziario, quaternario) e dei relativi idrogeni nella molecola di un generico alcano Le regole IUPAC, ossia come risparmiare tempo e fatica! Come si è già compreso, il carbonio con l'idrogeno (e con pochi altri elementi) è in grado di formare numerosissimi composti. Per poter assegnare e sopratutto ricordare il nome di così tanti composti è necessario memorizzare poche semplici regole, stabilite dalla IUPAC (International Union of Pure and Applied Chemistry). Questo metodo è tuttavia relativamente recente per cui sono ancora in uso in chimica organica nomi tradizionali che possiamo definire di fantasia, i quali venivano assegnati in base all'origine o a certe proprietà dei composti. C è da dire che per molti composti (in particolare quelli di uso più comune) viene ancora utilizzato, anche in campo scientifico, il loro nome tradizionale. I due principi fondamentali su cui si basa la nomenclatura IUPAC o Il primo principio su cui è basata la nomenclatura IUPAC dei composti organici è fondato sulla determinazione nel numero di atomi di carbonio legati assieme nella catena principale, catena che deve essere la più lunga possibile. o Il secondo principio è basato sull'osservazione che un ristretto numero di atomi è in grado da solo di caratterizzare in maniera determinante le proprietà chimiche di una molecola, per cui molecole Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5 a Serale 5
6 "macroscopicamente" molto diverse tra loro possono avere in realtà un comportamento molto simile. Questi piccoli raggruppamenti, a volte formati anche da un solo atomo, vengono detti gruppi funzionali. Ciò permette di raggruppare i milioni di composti organici oggi noti in un gruppo piuttosto limitato di famiglie, basandosi proprio sul gruppo funzionale che le molecole presentano, sempre che ce l'abbiano. Ognuno di questi gruppi funzionali viene caratterizzato nella nomenclatura IUPAC da particolari suffissi e a volte anche da dei prefissi. Nella sostanza il nome IUPAC di un composto organico è, nei casi più semplici, costituito da due parti: 1. una radice che indica quanti carboni sono presenti nella catena principale 2. un suffisso finale (a volte, raramente, accompagnato da un prefisso) che indica la famiglia a cui il composto organico appartiene. Ad esempio il nome ETANOLO, l'alcol contenuto nel vino, birra, grappa,ecc. indica ad un chimico che la catena carboniosa è fatta di 2 atomi di carbonio (come nell'et-ano) e che è inoltre presente il gruppo funzionale -OH. All'inizio comunque sarà opportuno che si affronti la nomenclatura IUPAC riferita ai soli idrocarburi, sicuramente più facili da studiare. Applicazione delle regole IUPAC Andiamo allora a verificare un applicazione concreta delle regole IUPAC ai due alcani a formula C 4 H 10 dell esempio fatto in precedenza. L'isomero A presenta i carboni in sequenza lineare ed è quindi il butano o, se preferite il n-butano (si legge normal-butano). L'isomero B ha invece nella catena principale solo tre carboni, mentre un quarto carbonio forma una ramificazione in posizione centrale. Il suo nome, secondo le regole IUPAC, è così definito: 1. si determina la radice corrispondente al numero di carboni della catena principale che, come abbiamo già detto, deve contenere il maggior numero di atomi di carbonio: in questo caso la radice da utilizzarsi è prop-, avendo la catena principale solo 3 carboni; essendo il composto in questione appartenente alla famiglia degli alcani a questa radice si aggiunge il suffisso finale -ano; la catena principale sarà quindi definita dal termine (prop-)(-ano), cioè propano 2. si determina adesso il nome della ramificazione: anche in questo caso si definisce la radice del nome che caratterizzerà il nome della ramificazione (in questo caso met-, essendo presente un solo carbonio; ad essa si aggiunge la desinenza finale -il ad indicare che si tratta di una ramificazione, che sarà quindi definita dal termine (met-)(-il), cioè metil 3. si mettono insieme le tre parti che definiranno il nome (ramificazione + radice catena principale + desinenza finale indicante la famiglia di appartenenza) Alla fine avremo per il composto B il nome metilpropano. Non dimentichiamo che questo composto ha un nome tradizionale, ancora molto usato, isobutano. La ramificazione ora vista costituisce il caso più semplice di una catena laterale, rappresentata in generale da un gruppo alchilico, indicato con R- in cui manca sempre un idrogeno, rispetto al relativo alcano. Questo perché deve rimanere una valenza libera per saldare la catena laterale con quella principale. Ad esempio il metano è CH 4 mentre il gruppo alchilico da esso derivato è il metile con formula CH 3 -. Ricordatevi che quando il nome del gruppo alchilico verrà assemblato nel nome finale dell'idrocarburo la lettera finale -e viene omessa, per cui si dirà metilbutano e non metilebutano. Di seguito si riportano i nomi dei gruppi alchilici che dovrete riconoscere ed utilizzare. Nomi dei gruppi alchilici da CH 3 - a C 4 H 9 - n di atomi di carbonio presenti Nome formula bruta Formula di struttura 1 metile CH 3-2 etile C 2 H 5-3 propile C 3 H 7 - Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5 a Serale 6
7 3 isopropile 4 butile 4 isobutile 4 sec-butile C 4 H 9-4 terz-butile Ora che abbiamo imparato a riconoscere le ramificazioni laterali vediamo di assegnare i nomi agli isomeri dell esano. Ci sono ben cinque isomeri dell'esano, C 6 H 14, caratterizzati dal fatto di avere lo "scheletro molecolare" tra loro diverso (ISOMERIA DI CATENA). REGOLE DI NOMENCLATURA 1. Si individua la catena principale che deve essere una catena carboniosa lineare la più lunga possibile. 2. Si individuano i tipi di ramificazioni presenti: se una data ramificazione si ripete più volte lungo la catena, si antepone al nome della ramificazione il prefisso di-, tri-, ecc. che indica quante volte essa si ripresenta lungo la catena principale 3. Si numera la catena principale in modo da poter poi precisare la posizione delle ramificazioni. Il verso di numerazione della catena principale è condotta dal lato della catena che consente di individuare la posizione della ramificazione mediante il numero più basso possibile. Nel caso di più ramificazioni la numerazione della catena parte dal lato che permette di avere nel complesso i numeri più piccoli per indicare le ramificazioni: in pratica si fa la somma dei numeri e si sceglie il lato che dà la somma più bassa. 4. Il numero che identifica la posizione della ramificazione è anteposto al nome della ramificazione, usando un trattino per separare il numero dal nome. Se una data ramificazione si ripete più volte lungo la catena, prima del prefisso di-, tri-, ecc. si premettono tanti numeri, ognuno per le varie posizioni, usando le virgole per separarli tra loro. 5. Le ramificazioni precedono il nome della catena principale e fanno corpo unico con il nome di quest ultima; in caso di più ramificazioni, l ordine di chiamata preferibile è quello alfabetico (eventuali prefissi di- tri- ecc. vanno qui ignorati). Applicando queste regole: il composto A) n-esano il composto B) 2-metilpentano e non 4-metilpentano il composto C) 3-metilpentano il composto D) 2,2-dimetilbutano e non 3,3-dimetilbutano il composto E) 2,3-dimetilbutano Cosa dovete ricordare alla fine di questo capitolo: 1. Le regole di nomenclatura, per filo e per segno! Può bastare?? Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5 a Serale 7
IBRIDAZIONE DEL CARBONIO NEGLI ALCANI PREMESSA: COSA SONO GLI ORBITALI IBRIDI.
 ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
Idrocarburi Al A ifatici Ar A oma m tici
 GLI IDROCARBURI Gli idrocarburi sono i più semplici composti del carbonio con l'idrogeno. Sono le molecole di base della chimica organica poiché, oltre ad essere molto numerosi, tutti gli altri composti
GLI IDROCARBURI Gli idrocarburi sono i più semplici composti del carbonio con l'idrogeno. Sono le molecole di base della chimica organica poiché, oltre ad essere molto numerosi, tutti gli altri composti
IDROCARBURI: classificazione
 ALCANI 1 IDROCARBURI: classificazione 2 ALCANI Formula bruta: C n H 2n+2 1 C CH 4 2 C C 2 H 6 3 C C 3 H 8 4 C C 4 H 10 3 ALCANI: ibridazione Orbitali s, p e sp 3 z orbitale 2s y x z z z orbitali 2p y x
ALCANI 1 IDROCARBURI: classificazione 2 ALCANI Formula bruta: C n H 2n+2 1 C CH 4 2 C C 2 H 6 3 C C 3 H 8 4 C C 4 H 10 3 ALCANI: ibridazione Orbitali s, p e sp 3 z orbitale 2s y x z z z orbitali 2p y x
Alcani e cicloalcani. Nomenclatura e nomi comuni Struttura e proprietà Reazioni
 Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
3. Indicare quale (o quali) delle seguenti coppie di formule strutturali rappresenta la stessa molecola:
 . Indicare quale (o quali) delle seguenti coppie di formule strutturali rappresenta la stessa molecola: l a) NO b) l l l c) l l 4. Quali tra i seguenti scheletri di atomi di carbonio non rappresentano
. Indicare quale (o quali) delle seguenti coppie di formule strutturali rappresenta la stessa molecola: l a) NO b) l l l c) l l 4. Quali tra i seguenti scheletri di atomi di carbonio non rappresentano
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
Diagramma di flusso degli idrocarburi
 Glialcanisonoidrocarburi saturi. saturi (solo legami semplici) idrocarburi (solo e ) n 2n+2 Esano 6 14 Diagramma di flusso degli idrocarburi Idrocarburi Saturi Insaturi Alcani Aciclici iclici atena lineare
Glialcanisonoidrocarburi saturi. saturi (solo legami semplici) idrocarburi (solo e ) n 2n+2 Esano 6 14 Diagramma di flusso degli idrocarburi Idrocarburi Saturi Insaturi Alcani Aciclici iclici atena lineare
- il DNA, la molecola che contiene l informazione genetica, - le proteine dei nostro organismo ( proteine dei muscoli, della pelle, gli enzimi),
 La chimica organica è la chimica dei composti del carbonio, che sono i mattoni con cui sono costruiti tutti i corpi viventi della terra. Questi composti comprendono ad esempio - il DNA, la molecola che
La chimica organica è la chimica dei composti del carbonio, che sono i mattoni con cui sono costruiti tutti i corpi viventi della terra. Questi composti comprendono ad esempio - il DNA, la molecola che
IDROCARBURI. Alcani Alcheni Alchini C-C C=C C C
 IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
CHIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO. energia superiore. energia inferiore. orbitale s
 CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
IDROCARBURI I ALCANI ANALISI CONFORMAZIONALE
 IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
Teoria degli orbitali ibridi
 Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
IDROCARBURI INSATURI: GLI ALCHENI
 IDROCARBURI INSATURI: GLI ALCHENI Benvenuti nella famiglia degli alcheni! Si tratta di idrocarburi, come gli alcani ma rispetto a questi, a parità di atomi di carbonio, presentano un minor numero di atomi
IDROCARBURI INSATURI: GLI ALCHENI Benvenuti nella famiglia degli alcheni! Si tratta di idrocarburi, come gli alcani ma rispetto a questi, a parità di atomi di carbonio, presentano un minor numero di atomi
Chimica Organica. In passato, i composti chimici erano suddivisi in due grandi gruppi,
 Chimica Organica In passato, i composti chimici erano suddivisi in due grandi gruppi, inorganici e organici, in base alla loro origine. La chimica organica diveniva così la chimica dei composti del carbonio.
Chimica Organica In passato, i composti chimici erano suddivisi in due grandi gruppi, inorganici e organici, in base alla loro origine. La chimica organica diveniva così la chimica dei composti del carbonio.
IBRIDAZIONE e GEOMETRIA MOLECOLARE
 IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
06/03/2012. Elementi in chimica organica
 CORSO DI LAUREA IN BIOINFORMATICA CHIMICA ORGANICA E DELLE MACROMOLECOLE BIOLOGICHE MICHAEL ASSFALG Lezione: 6 CFU = 48 ORE Lun 14:30-16:30, 16:30, Mer 8:30-10:30 PROVA FINALE: SCRITTO (+ ORALE) TESTI:
CORSO DI LAUREA IN BIOINFORMATICA CHIMICA ORGANICA E DELLE MACROMOLECOLE BIOLOGICHE MICHAEL ASSFALG Lezione: 6 CFU = 48 ORE Lun 14:30-16:30, 16:30, Mer 8:30-10:30 PROVA FINALE: SCRITTO (+ ORALE) TESTI:
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
I composti organici. Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H)
 I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi dondi@unipv.it Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
Introduzione alla chimica organica Daniele Dondi dondi@unipv.it Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
Introduzione alla Chimica Organica. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
La Chimica Organica idrogeno carbonio azoto ossigeno composti covalenti catene di atomi di carbonio strutture covalenti e debolmente polarizzate
 LA IMIA ORGANIA La himica Organica I quattro elementi idrogeno, carbonio, azoto e ossigeno rappresentano più del 95% dei costituenti della materia vivente. I composti organici sono composti covalenti che
LA IMIA ORGANIA La himica Organica I quattro elementi idrogeno, carbonio, azoto e ossigeno rappresentano più del 95% dei costituenti della materia vivente. I composti organici sono composti covalenti che
Elementi di Chimica Organica
 CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio (mariapina.donofrio@univr.it) Orario ricevimento: mar e giov 11:30-13:30 Corso: 6 CFU = 48 ORE Lezioni: Mar 8:30-10:30,
CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio (mariapina.donofrio@univr.it) Orario ricevimento: mar e giov 11:30-13:30 Corso: 6 CFU = 48 ORE Lezioni: Mar 8:30-10:30,
Nome degli alcheni a catena lineare
 Gli alcheni sono idrocarboni insaturi. insaturi (almeno un doppio legame) idrocarboni (solo e ) n 2n 1-Esene 6 12 opyright 1999, Michael J. Wovkulich. All rights reserved. Nome degli alcheni a catena lineare
Gli alcheni sono idrocarboni insaturi. insaturi (almeno un doppio legame) idrocarboni (solo e ) n 2n 1-Esene 6 12 opyright 1999, Michael J. Wovkulich. All rights reserved. Nome degli alcheni a catena lineare
Nomi e formule dei principali composti organici
 Il numero davvero sterminato dei e la necessità quindi di doverli distinguere ciascuno con la propria formula e il proprio nome, ha costretto i chimici (attraverso un apposito organismo, la IUPAC) a mettere
Il numero davvero sterminato dei e la necessità quindi di doverli distinguere ciascuno con la propria formula e il proprio nome, ha costretto i chimici (attraverso un apposito organismo, la IUPAC) a mettere
CHIMICA ORGANICA Gli alcani e i cicloalcani
 1 C1-ALCANI E CICLOALCANI CHIMICA ORGANICA Gli alcani e i cicloalcani ALCANI Formula generale C n H 2n+2 Desinenza -ano Gli alcani Gli alcani, detti anche paraffine, appartengono alla classe degli idrocarburi
1 C1-ALCANI E CICLOALCANI CHIMICA ORGANICA Gli alcani e i cicloalcani ALCANI Formula generale C n H 2n+2 Desinenza -ano Gli alcani Gli alcani, detti anche paraffine, appartengono alla classe degli idrocarburi
TAVOLA PERIODICA DEGLI ELEMENTI
 TAVOLA PERIODIA DEGLI ELEMENTI Idrogeno = 1 legame Ossigeno = 2 legami O Azoto = 3 legami N arbonio = 4 legami Questi sono gli atomi che intervengono maggiormente nelle reazioni che tratteremo nella
TAVOLA PERIODIA DEGLI ELEMENTI Idrogeno = 1 legame Ossigeno = 2 legami O Azoto = 3 legami N arbonio = 4 legami Questi sono gli atomi che intervengono maggiormente nelle reazioni che tratteremo nella
Legame chimico unità 1, modulo D del libro
 Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
CHIMICA ORGANICA. Gli alcheni
 1 2-ALENI IMIA ORGANIA ALENI Formula generale n 2n Desinenza -ene Gli alcheni La prima classe di idrocarburi insaturi è quella degli alcheni, detti anche olefine, che presentano lungo la catena uno o più
1 2-ALENI IMIA ORGANIA ALENI Formula generale n 2n Desinenza -ene Gli alcheni La prima classe di idrocarburi insaturi è quella degli alcheni, detti anche olefine, che presentano lungo la catena uno o più
Gli idrocarburi e il petrolio
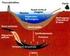 Gli idrocarburi e il petrolio Le proprietà degli atomi di carbonio di legarsi fra loro mediante legami semplici, doppi, tripli, formando catene stabili delle più diverse forme e lunghezze rende praticamente
Gli idrocarburi e il petrolio Le proprietà degli atomi di carbonio di legarsi fra loro mediante legami semplici, doppi, tripli, formando catene stabili delle più diverse forme e lunghezze rende praticamente
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi dondi@unipv.it 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
Introduzione alla chimica organica Daniele Dondi dondi@unipv.it 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
LA CHIMICA DELLA VITA
 LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
Alcheni: struttura e proprietà
 Chimica Organica Informazione Scientifica sul Farmaco Alcheni: struttura e proprietà Organic Chemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: struttura degli alcheni nomenclatura proprietà fisiche
Chimica Organica Informazione Scientifica sul Farmaco Alcheni: struttura e proprietà Organic Chemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: struttura degli alcheni nomenclatura proprietà fisiche
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
un legame covalente due legami covalenti? tre legami covalenti due legami covalenti un legame covalente
 e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Nomenclatura chimica
 Nomenclatura chimica Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione
Nomenclatura chimica Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Le reazioni di ossido-riduzione
 Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA
 INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 12 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 12 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 16 Classificazione e nomenclatura dei composti 3 Sommario 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 16 Classificazione e nomenclatura dei composti 3 Sommario 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
Lezione n. 22. Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Chimica Organica. Studio dei composti del CARBONIO
 Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
Teoria dell Orbitale Molecolare
 Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Il termine arene viene impiegato per descrivere gli idrocarburi aromatici, in analogia con gli alcheni. prodotto di sostituzione.
 I Il termine aromatico venne riferito inizialmente all odore caratteristico di questa categoria di idrocarburi. Successivamente, tale nome è stato usato per indicare che questi composti sono altamente
I Il termine aromatico venne riferito inizialmente all odore caratteristico di questa categoria di idrocarburi. Successivamente, tale nome è stato usato per indicare che questi composti sono altamente
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
ALCANI metano. etano. pentano. butano. propano. Idrocarburo: molecola contenente solo carbonio ed idrogeno
 ALCANI Idrocarburo: molecola contenente solo carbonio ed idrogeno Idrocarburo saturo: molecola contenente solo legami semplici carbonio-carbonio Alcano: Idrocarburo saturo contenente solo catene aperte
ALCANI Idrocarburo: molecola contenente solo carbonio ed idrogeno Idrocarburo saturo: molecola contenente solo legami semplici carbonio-carbonio Alcano: Idrocarburo saturo contenente solo catene aperte
CLASSE SECONDA (chimica)
 CLASSE SECONDA (chimica) MODULO N.1 : LA MATERIA Analizzare dati e interpretarli sviluppando deduzioni e ragionamenti sugli stessi anche con l ausilio di rappresentazioni grafiche UNITA DI APPRENDIMENTO
CLASSE SECONDA (chimica) MODULO N.1 : LA MATERIA Analizzare dati e interpretarli sviluppando deduzioni e ragionamenti sugli stessi anche con l ausilio di rappresentazioni grafiche UNITA DI APPRENDIMENTO
Chimica. Lezione 2 Il legame chimico Parte I
 Chimica Lezione 2 Il legame chimico Parte I GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUALVOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA CONDIZIONE
Chimica Lezione 2 Il legame chimico Parte I GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUALVOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA CONDIZIONE
Chimica Organica. Definizione. La chimica organica è la chimica dei composti contenenti carbonio
 Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Teorie del legame chimico. Teorie del legame chimico
 Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
CHIMICA ORGANICA. Gli alchini
 1 C3-ALCHINI CHIMICA ORGANICA ALCHINI Formula generale C n n 2 Desinenza -ino Gli alchini Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carboniocarbonio e sono anch essi classificati
1 C3-ALCHINI CHIMICA ORGANICA ALCHINI Formula generale C n n 2 Desinenza -ino Gli alchini Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carboniocarbonio e sono anch essi classificati
Nomenclatura chimica. di Giorgio Benedetti Lezioni d'autore
 Nomenclatura chimica di Giorgio Benedetti Lezioni d'autore VIDEO Introduzione (I) La nomenclatura chimica è un sistema di classificazione utilizzato dalla chimica per individuare un composto attribuendogli
Nomenclatura chimica di Giorgio Benedetti Lezioni d'autore VIDEO Introduzione (I) La nomenclatura chimica è un sistema di classificazione utilizzato dalla chimica per individuare un composto attribuendogli
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Esercizio 1. CF 2 CS 2 CCl 4 ClF 3
 Esercizio 1 Determinare in base al metodo del legame di valenza la forma delle seguenti molecole, tenendo conto delle repulsioni coulombiane tra le coppie elettroniche di valenza CF 2 CS 2 CCl 4 ClF 3
Esercizio 1 Determinare in base al metodo del legame di valenza la forma delle seguenti molecole, tenendo conto delle repulsioni coulombiane tra le coppie elettroniche di valenza CF 2 CS 2 CCl 4 ClF 3
Capitolo 23 Dal carbonio agli idrocarburi
 Capitolo 23 Dal carbonio agli idrocarburi 1. I composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani 3. L isomeria 4. La nomenclatura degli idrocarburi saturi 5. Proprietà fisiche e chimiche
Capitolo 23 Dal carbonio agli idrocarburi 1. I composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani 3. L isomeria 4. La nomenclatura degli idrocarburi saturi 5. Proprietà fisiche e chimiche
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
Nomenclatura. Gli idrocarburi alifatici
 Gli idrocarburi alifatici Gli idrocarburi sono i composti organici più semplici, sono infatti costituiti solo da carbonio e idrogeno (da cui il nome, appunto, di idro-carburi). Pur essendo relativamente
Gli idrocarburi alifatici Gli idrocarburi sono i composti organici più semplici, sono infatti costituiti solo da carbonio e idrogeno (da cui il nome, appunto, di idro-carburi). Pur essendo relativamente
PROF. ALFONSO ANGUILLA ELEMENTI DI CHIMICA: I MATTONI DELLA MATERIA
 http://www.youtube.com/watch?v=q4ki1fa4yj0 PROF. ALFONSO ANGUILLA ELEMENTI DI CHIMICA: I MATTONI DELLA MATERIA 1 Gli elettroni ruotano intorno al nucleo, trattenuti dalla loro carica elettrica negativa,
http://www.youtube.com/watch?v=q4ki1fa4yj0 PROF. ALFONSO ANGUILLA ELEMENTI DI CHIMICA: I MATTONI DELLA MATERIA 1 Gli elettroni ruotano intorno al nucleo, trattenuti dalla loro carica elettrica negativa,
SCIENZE INTEGRATE CHIMICA
 SCIENZE INTEGRATE CHIMICA Classi 2 e TECNICO ECONOMICO (REL- AMM-SPO) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D.A. Periodo Ore lezione 1. Classificazione della materia: stati fisici e miscugli settembre
SCIENZE INTEGRATE CHIMICA Classi 2 e TECNICO ECONOMICO (REL- AMM-SPO) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D.A. Periodo Ore lezione 1. Classificazione della materia: stati fisici e miscugli settembre
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
Combustione. Energia chimica. Energia termica Calore. Combustibili fossili
 Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Chimica. Lezione 2 La materia Il legame chimico (Parte I)
 Chimica Lezione 2 La materia Il legame chimico (Parte I) Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido,
Chimica Lezione 2 La materia Il legame chimico (Parte I) Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido,
CONFIGURAZIONE ELETTRONICA. In generale la configurazione elettronica indica come sono posizionati gli elettroni intorno al nucleo di un atomo.
 CONFIGURAZIONE ELETTRONICA In generale la configurazione elettronica indica come sono posizionati gli elettroni intorno al nucleo di un atomo. ORBITA : Zona intorno al nucleo di diversa energia dove ruotano
CONFIGURAZIONE ELETTRONICA In generale la configurazione elettronica indica come sono posizionati gli elettroni intorno al nucleo di un atomo. ORBITA : Zona intorno al nucleo di diversa energia dove ruotano
CHIMICA ORGANICA. Gli idrocarburi aromatici
 1 D-IDROCARBURI AROMATICI CHIMICA ORGANICA IDROCARBURI AROMATICI Formula generale C n H n Desinenza -benzene Gli idrocarburi aromatici Gli idrocarburi aromatici (areni o alchilbenzeni) sono caratterizzati
1 D-IDROCARBURI AROMATICI CHIMICA ORGANICA IDROCARBURI AROMATICI Formula generale C n H n Desinenza -benzene Gli idrocarburi aromatici Gli idrocarburi aromatici (areni o alchilbenzeni) sono caratterizzati
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di energia.
 LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
Orbitali nei primi tre livelli
 Orbitali nei primi tre livelli La tavola periodica degli elementi Numeri quantici e tavola Configurazioni elettroniche degli atomi Elenco degli orbitali occupati in un atomo nel suo stato fondamentale
Orbitali nei primi tre livelli La tavola periodica degli elementi Numeri quantici e tavola Configurazioni elettroniche degli atomi Elenco degli orbitali occupati in un atomo nel suo stato fondamentale
ITI Manciano Classe 3 A.S. 2009-10 Docente: Gianni ROMEO Test n. 3 di Chimica Organica pagina 1 di 8
 ITI Manciano lasse 3 A.S. 2009-10 Docente: Gianni ROMEO Test n. 3 di himica Organica pagina 1 di 8 Argomento: TEST N. 3 (il correttore del test è a pag. 3) Gli alcheni parte I; argomenti precedentemente
ITI Manciano lasse 3 A.S. 2009-10 Docente: Gianni ROMEO Test n. 3 di himica Organica pagina 1 di 8 Argomento: TEST N. 3 (il correttore del test è a pag. 3) Gli alcheni parte I; argomenti precedentemente
I composti organici. Il carbonio e i composti organici
 I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
Chimica Organica. Breve storia della chimica organica
 Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
PROPRIETA FISICHE DEI COMPOSTI ORGANICI
 PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
Configurazione. Conformazione
 Configurazione Posizione relativa degli atomi nello spazio che caratterizza un particolare stereoisomero Sono in numero limitato (in genere 2) Conformazione Particolare geometria di una molecola che dipende
Configurazione Posizione relativa degli atomi nello spazio che caratterizza un particolare stereoisomero Sono in numero limitato (in genere 2) Conformazione Particolare geometria di una molecola che dipende
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
ORBITA ORBIT LI ALI MOLECOLARI
 ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
SCHEDA DI APPROFONDIMENTO: TAVOLA PERIODICA DEGLI ELEMENTI
 ORGANIZZAZIONE DELLA TABELLA BLOCCHI LA STRUTTURA DELLA TAVOLA PERIODICA È STRETTAMENTE CORRELATA CON LA STRUTTURA DELL ATOMO, INFATTI È POSSIBILE INDIVIDUARE QUATTRO BLOCCHI DI ELEMENTI (s, p, d, f) CHE
ORGANIZZAZIONE DELLA TABELLA BLOCCHI LA STRUTTURA DELLA TAVOLA PERIODICA È STRETTAMENTE CORRELATA CON LA STRUTTURA DELL ATOMO, INFATTI È POSSIBILE INDIVIDUARE QUATTRO BLOCCHI DI ELEMENTI (s, p, d, f) CHE
Alcheni: : struttura e reattività. Alcheni. Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n. H 2n. Alcheni in biologia
 Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
CHIMICA ORGANICA. Gli esteri
 1 E8-ESTERI CHIMICA RGANICA ESTERI Formula generale R C R' Desinenza -ato Gli esteri I composti organici di questa classe presentano una struttura che deriva da quella degli acidi carbossilici in cui,
1 E8-ESTERI CHIMICA RGANICA ESTERI Formula generale R C R' Desinenza -ato Gli esteri I composti organici di questa classe presentano una struttura che deriva da quella degli acidi carbossilici in cui,
