) hν n = 0, 1, 2,...
|
|
|
- Davide Pippi
- 6 anni fa
- Visualizzazioni
Transcript
1 EFFETTO ISOTOPIO on buona approssimazione, la sostituzione in un composto di un isotopo con un altro non altera la superficie dell'energia potenziale. Gli isotopi sono isoelettronici: la struttura elettronica (e quindi tutte le forze di legame) rimane la stessa. Energia _ coordinata di vibrazione e differenze di reattività (K o k) conseguenti alla sostituzione isotopica sono attribuibili solo alla variazione della massa, che si manifesta nella frequenza dei modi vibrazionali Per un atomo piccolo, di massa m, legato ad un atomo di massa molto maggiore: ν = 2π f m f costante di forza se le masse sono confrontabili, si deve usare la massa ridotta μ = m m 2 m m 2 il trattamento quantomeccanico porta ai livelli di energia ε n = ( n 2 ) hν n = 0,, 2,... ed alle separazioni dei livelli energetici Δε = hν e energie sono misurate dal punto più basso sulla curva dell'energia potenziale con n = 0 ε = 2 hν ε energia del punto zero ν vibrazione del punto zero (ZPV) 'energia del punto zero è inversamente proporzionale alla massa a molecola che contiene l'isotopo più pesante (di solito 2 al posto di ) nel livello fondamentale si trova ad un'energia più bassa della molecola con l'analogo isotopico più leggero E' da questa differenza di energia che nasce l'effetto isotopico
2 EFFETTO ISOTOPIO SUGI EQUIIBI onsideriamo l'equilibrio: A B K A B Poiché la sostituzione isotopica non altera la superficie dell'energia potenziale, A e A differiscono solo nella loro energia di vibrazione del punto zero (ZPV) e così fanno B e B. a differenza tra le energie del punto zero tra stato finale e stato iniziale ΔE 0 = { E 0 (A) E 0 (B) E 0 (A) E 0 (B)} si può esprimere come differenze di ZPV delle frequenze fondamentali di vibrazione ΔE 0 = 2 3n6 Nhc { ν Σ i (A) ν i (B) ν i (A) ν i (B)} i= E' possibile dimostrare che la costante di equilibrio dipende principalmente dalla differenza di energia di ZPV K = exp exp T T 3n A 6 { ν Σ i (A) ν i (A)} i= 3n B 6 { ν Σ i (B) ν i (B)} i= E' possibile (per molecole piccole) calcolare la costante di equilibrio dalle frequenze vibrazionali a percentuale di deuterio in A sarà più pronunciata se K >, cioè se: 3n A 6 { ν Σ 3n B i (A) ν i (A)} Σ 6 > { ν i (B) ν i (B)} i= i= a somma delle differenze delle frequenze può essere influenzata da due fattori n il numero di atomi nella molecola aumenterà il numero di termini nella sommatoria f un legame più forte ha una costante di forza maggiore ed il valore della frequenza è proporzionale alla radice quadrata della costante di forza f ν = 2πc μ ciascun Δν i è proporzionale alla radice quadrata della sua costante di forza Δν i = ν i (A) ν i (A) = 2πc ( ) μ A μ A In un equilibrio l'isotopo più pesante sarà più abbondante nella molecola con il maggior numero di atomi e preferisce occupare la posizione che governa il legame più forte. f i 2
3 Esempio 3 3 l 3 3 K K calc = 2.35 (25 ) K exp = l 3 e relazioni valgono per qualunque coppia di isotopi. Però l'effetto isotopico per e è il più grande, perché l'incremento di massa è circa 00%. a 2 a 3 la massa aumena solo dell'8.33%: il rapporto delle costanti converge ad un valore non lontano dall'unità l K K 2 /K 3 = Esempio: equilibrio di protonazione di una base (B) in acqua ed in acqua deuterata 3 O B K b B 2 O K b 3 O B B 2 O Si dimostra che la differenza osservata tra le costanti di equilibrio misurate in acqua ed in acqua deuterata è il risultato della differenza delle energie di vibrazione del punto zero. K b / Kb 3.26 (calcolato) 3.0 (sperimentale) ~ EFFETTO ISOTOPIO INETIO Il livello dell'energia del punto zero per la vibrazione di stiramento (stretching) del legame è più alto di quello del legame Se il legame (e ) si rompe nello stadio ratedetermining, la vibrazione di stretching dei reagenti si trasforma in moto traslazionale al di sopra della barriera e, per quel particolare grado di libertà, l'energia del punto zero sparisce 3
4 E stato di transizione stato dei reagenti coordinata di vibrazione Poiché la molecola con parte da un'energia più alta, la sua energia di attivazione è minore e / sarà maggiore di alle frequenze di 2 e 2 si possono calcolare le loro energie vibrazionali del punto zero (ZPV) E 0 = 2 Nhcν E 2 2 E kj moli kj moli E 0 2 E 0 2 r urve potenziali per le molecole 2 e 2, che specificano l'energia della vibrazione al punto zero (E 0 ) e l'energia di dissociazione ( 0 ) Per 2 ν = 4370 cm Per E 2 0 = 25.9 kj moli E = 43.7 kj moli ν r = 309 cm = 8.4 kj moli = kj moli più grande perché l'energia ZPV è più bassa 4
5 Si può calcolare l'effetto isotopico atteso, se il solo contributo fosse la perdita della differenza di energia del punto zero (rottura completa del legame) a frequenza di dovrebbe essere più piccola di quella di di un fattore circa = sperimentale Esprimendo la frequenza in cm, la differenza di energia di attivazione è: E E = ν ν 2 hc ( ) onsiderando la differenza di energia di attivazione approssimativamente uguale alla differenza di entalpia di attivazione, facendo il rapporto delle costanti di velocità ed assumendo che ΔS sia uguale per due molecole che differiscono solo per la sostituzione di un con un : E E κt (dove κ è la costante di Boltzmann) = exp ( ) ~ exp hc 2κT ( ) ν = exp ( ν ) T a vibrazione di stretching di nello spettro I è attorno a 3000 cm ; a T = 298 K, l'effetto isotopico sarà: ~ T (3000) = 6.5 / (e quindi l'effetto isotopico) diminuisce con l'aumento della T Questo modello semplice è troppo grossolano per spiegare l'intervallo osservato di effetti isotopici. in molti casi l'idrogeno, piuttosto che dissociarsi come atomo libero, si trasferisce da una molecola ad un'altra e rimane parzialmente legato per tutto il processo Nello stato di transizione ci sarà di solito uno o più modi vibrazionali (oltre al movimento lungo la coordinata di reazione) che comportano il movimento dell'idrogeno Energia oordinata di reazione Stato di transizione in cui l'idrogeno rimane legato e contribuisce all'energia del punto zero attraverso un modo vibrazionale indipendente dalla coordinata di reazione. a differenza di energia tra e può cancellare in parte o tutta la differenza che viene dallo stato di transizione 5
6 A B (AB) prodotti A B (AB) prodotti Si può dimostrare che: = exp exp T T 3n A 6 {ν i (A) ν i (A)} Σ i = Σi = 3n 7 {ν () ν () } i i ν i (A) e ν i (A) ν i () e ν i () misurabili sperimentalmente si possono fare solo "ipotesi ragionevoli" 'effetto isotopico cinetico è determinato dalla differenza di energia vibrazionale del punto zero tra reagenti e stato di transizione a) Se nello stato di transizione il legame di () è completamente rotto: ν i () ~ ν i () >> b) Se nello stato di transizione il legame di () è allentato: > 6
7 c) se nello stato di transizione il legame di () è invariato rispetto ai reagenti, non si osserva effetto isotopico cinetico = d) se, per qualche motivo, nello stato di transizione la differenza tra le energie del punto zero è maggiore che non nei reagenti in questo caso si parla di < effetto isotopico cinetico inverso Esempio Mn(O) Mn(O) 5 ν Mn = 800 cm ν = 2900 cm { ν i () ν i () k } > { ν i (Mn) ν i (Mn) } < Qualche volta si può osservare effetto isotopico intramolecolare quando con due isotopi diversi si formano due siti, altrimenti equivalenti, ed il reagente può attaccarli entrambi Esempio: clorurazione del metanod 3. l 2. l 3. l 3. l 'energia del punto zero per i reagenti delle due reazioni è la stessa l'effetto isotopico viene dalle energie del punto zero degli stati di transizione che portano ai due radicali 2. e 3. 'energia del punto zero dello stato di transizione che porta al radicale. 2 è < la reazione che comporta rottura del legame è più veloce 7
8 EFFETTO ISOTOPIO INETIO PIMAIO 'effetto isotopico cinetico primario si ha quando il legame che si rompe (o si forma) è marcato isotopicamente (per es., con e ). l'effetto maggiore si ha se () è completamente rotto nello stato di transizione frequenza di stretching ν = 2900 cm ν = 250 cm frequenza di bending δ = 400 cm (2) δ = 050 cm (2) Se nelle strutture dello stato di transizione i legami e sono completamente rotti, spariscono le frequenze ad essi associate ν i () = ν i () = 0 A 298 K, il massimo effetto isotopico cinetico sarà: = exp { } 298 = 33 Questo valore superiore è troppo alto, l'effetto isotopico cinetico osservato sperimentalmente è < < 9 Spiegazione il legame () non è completamente rotto Un modo più realistico di stimare la grandezza dell'effetto isotopico cinetico comporta il processo di trasferimento di o da un atomo A ad un atomo B A B A B A B In questo trasferimento, illustrato come disposizione lineare, nello stato di transizione ci sono due modi di stretching e due modi degenerati di bending (identici, ma in due piani perpendicolari) A B A B ν as () ν s () A B A B δ() δ() ( =, ) 8
9 l'effetto isotopico cinetico è dato dall'equazione: = exp { ν(a) ν(a) 2 δ(a) 2 δ(a)} 298 exp { ν as () ν as () ν s () ν s () 2 δ() 2 δ() } 298 a coordinata di reazione per il trasferimento di () dall'atomo A all'atomo B comprende ν as nello stato di transizione ν as () = ν as () nessun contributo al rapporto a frequenza della vibrazione di stretching simmetrico è data da: f A e f B m ν s = o costanti di forza dei legami A e B nello stato di transizione masse 2πc f A m A f A f B 2 f A f B m f B m B Se ( o ) occupa una posizione simmetricamente centrale (f A = f B ), non cambia la posizione nella vibrazione simmetrica ν s è indipendente dalla differenza di massa tra e e perciò nello stato di transizione: ν s () = ν s () Se nello stato di transizione le vibrazioni di bending sono sostanzialmente ridotte (per esempio, δ() = 050 cm, δ() = 780 cm ) exp { } 298 = = 9 exp { } 298 limite superiore realistico per l'effetto isotopico cinetico primario, se il legame () si rompe nello stato di transizione Applicando questo metodo, si trovano i seguenti limiti superiori: = per N; 3 per ; 8 per S In molte reazioni, il valore misurato di / è considerevolmente più piccolo 9
10 Se () è più vicino ad A f A >> f B stato di transizione simile oppure ai reagenti Se () è più vicino a B f A << f B stato di transizione simile ai prodotti ν s non è più indipendente dalla differenza di massa tra e ν s () > ν s () Perciò / è più piccolo del limite superiore: più lo stato di transizione è vicino ai reagenti (o ai prodotti), più piccolo è l'effetto isotopico cinetico Se () è simmetricamente centrale, ma lo stato di transizione non è lineare ν s () > ν s () / si abbassa notevolmente / > 5 per stati di transizione lineari A ν s () B / tra e 3 per stati di transizione non lineari Esempi di effetto isotopico cinetico primario a) Sostituzione elettrofila aromatica a grandezza dell'effetto isotopico cinetico primario dipende dalla struttura del substrato, perché da questa dipende se lo stadio ratedetermining è il primo o il secondo nitrazione del benzene NO 2 NO 2 = o T NO 2 lento..... /k T =.3 veloce accoppiamento dei sali di diazonio con il sale dell'acido 4idrossinaftalensolfonico ArN 2 lento N NAr veloce N NAr SO 3 = o SO 3 SO 3 / =.04 0
11 Se la scissione del legame è ostacolata da gruppi voluminosi, diventa ratedetermining il secondo stadio e si osserva effetto isotopico cinetico NO 2 NO 2 veloce NO lento = o / = 3.7 O 3 S SO 3 = o ArN SO N NAr 3 2 O 3 S / = 6.55 lento O 3 S SO 3 N NAr b) Eliminazione E2 / dipende dal gruppo uscente cattivo gruppo uscente β potenziale carbanione buon gruppo uscente α potenziale carbocatione 2 X EtO Et.....X β α. = o... EtO 2 X EtO X Br OTs Me 2 S Me 3 N / con X buon gruppo uscente in β occupa una posizione quasi centrale tra e l'o della base effetto isotopico grande con X cattivo gruppo uscente in β nello stato di transizione e più vicino alla base (stato di transizione late) effetto isotopico più piccolo
12 c) Alogenazione del toluene BrBr ll = o / = 4.6 / =.3 Bromurazione: occupa una posizione simmetricamente centrale: l'energia del legame che si rompe (, 85 kcal/mole, kj/mole) e di quello che si forma (Br, 87 kcal/mole, kj/mole) sono molto simili effetto isotopico relativamente grande lorurazione: l'energia di l è relativamente maggiore (05 kcal/mole, kj/mole), lo stato di transizione è simile ai reagenti effetto isotopico considerevolmente più piccolo d) Trasposizione pinacolica 2 O 2 O O O = Ph, veloce = o = Me, lento = Ph / = 3.3 = Me / =.8 stato di transizione non lineare on Me, cambia lo stadio ratedetermining: non si rompe e quindi non c'è effetto isotopico primario lento e) effetto isotopico cinetico primario è stato usato per verificare l ipotesi di meccanismo per l ossidrilazione di alchili ad alcooli in sistemi biologici ad opera del itocromo P450. dati sperimentali: perdita di stereochimica assenza di trasposizione effetto isotopico primario grande ipotesi: radical cage mechanism (meccanismo radicalico nella gabbia del solvente) 2
13 Sistemi modello: osso derivati di porfirine di Fe Br l Br l I O O l l 2,6l N 2 Br Br Br Br Br N Br N Fe N N Fe N Br N Br Br Br l N Br Br l 2,6l 2 2,6l2 Br l Br l substrato modello: biciclo[2.2.]eptano (norbornano) Porf(Fe=O) 2,6l 2 isultato: assenza di trasposizione (no carbocatione) effetto isotopico cinetico primario come nei sistemi biologici: / = 5 Porf(Fe=O).. Porf(FeO) PorfFe solv radical cage mechanism endo O eso O f) eprotonazione del nitroetano N 2 NO 2 NO 2 N 3 = o effetto isotopico cinetico primario dipende dalla forza dell ammina è massimo quanto più l acidità del nitroetano e dello ione ammonio sono vicine (costante di forza simile) : () simmetricamente centrato nello stato di transizione 3
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
Lezione n. 26. Principi generali della spettroscopia IR. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 26 Principi generali della spettroscopia IR 02/03/2008 Antonino Polimeno 1 Spettroscopia infrarossa (1) - La spettroscopia infrarossa studia
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 26 Principi generali della spettroscopia IR 02/03/2008 Antonino Polimeno 1 Spettroscopia infrarossa (1) - La spettroscopia infrarossa studia
AMMINE. con acidi RNH 2. con O come elettrofilo RNH 2 + H + + R NH 3 NESSUNA REAZIONE. atomo basico, atomo nucleofilo
 AMME : 2 1. come atomo basico o nucleofilo atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE con acidi 2 con come elettrofilo SL con ammine terziarie 2 2
AMME : 2 1. come atomo basico o nucleofilo atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE con acidi 2 con come elettrofilo SL con ammine terziarie 2 2
larghezza del segnale
 FATTORI CHE DETERMINANO: posizione del segnale intensità del segnale larghezza del segnale.la FORMA DI UNO SPETTRO IR 1 Posizione delle bande di assorbimento Nella maggior parte delle prossime lezioni
FATTORI CHE DETERMINANO: posizione del segnale intensità del segnale larghezza del segnale.la FORMA DI UNO SPETTRO IR 1 Posizione delle bande di assorbimento Nella maggior parte delle prossime lezioni
Molecole. 04/09/13 3-MOL-0.doc 0
 Molecole 04/09/13 3-MOL-0.doc 0 Legame covalente H 2 + Il potenziale cui è soggetto l elettrone ha 2 minimi equivalenti 1) H + si avvicina a H 2) Se la barriera diventa abbastanza sottile la probabilità
Molecole 04/09/13 3-MOL-0.doc 0 Legame covalente H 2 + Il potenziale cui è soggetto l elettrone ha 2 minimi equivalenti 1) H + si avvicina a H 2) Se la barriera diventa abbastanza sottile la probabilità
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Reazioni Stereospecifiche e Stereoselettive
 Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Identificazione di un composto organico:
 Identificazione di un composto organico: Laboratorio di Chimica Organica II Analisi elementare: formula bruta (C x H y O z N x )? Analisi cromatografica: purezza, confronto con campioni noti Punto di fusione:
Identificazione di un composto organico: Laboratorio di Chimica Organica II Analisi elementare: formula bruta (C x H y O z N x )? Analisi cromatografica: purezza, confronto con campioni noti Punto di fusione:
p e c = ev Å
 Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO. Fig. 4
 CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO Fig. 4 1 E PERCE BANDE E NON RIGE? E 3 Nell pratica : E 2 E 1 E 0 4000 600 cm -1 4000 600 cm -1 Tra 2 livelli vibrazionali puliti Sottolivelli rotazionali 2
CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO Fig. 4 1 E PERCE BANDE E NON RIGE? E 3 Nell pratica : E 2 E 1 E 0 4000 600 cm -1 4000 600 cm -1 Tra 2 livelli vibrazionali puliti Sottolivelli rotazionali 2
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
La radiazione infrarossa si trova nella parte dello spettro elettromagnetico tra le regioni del visibile e delle microonde. La porzione di maggiore
 La radiazione infrarossa si trova nella parte dello spettro elettromagnetico tra le regioni del visibile e delle microonde. La porzione di maggiore interesse per la spettroscopia IR è quella compresa tra
La radiazione infrarossa si trova nella parte dello spettro elettromagnetico tra le regioni del visibile e delle microonde. La porzione di maggiore interesse per la spettroscopia IR è quella compresa tra
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA
 REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
CHIMICA ORGANICA I con Elementi di Laboratorio Corso di Laurea in CHIMICA, Chimica Applicata, Scienza dei Materiali (L.T.)
 IMIA GANIA I con Elementi di Laboratorio orso di Laurea in IMIA, himica Applicata, Scienza dei Materiali (L.T.) Esercitazione n. 8 Aspetti generali di reazioni e meccanismi. TEMINI ED AGMENTI PE L SVLGIMENT
IMIA GANIA I con Elementi di Laboratorio orso di Laurea in IMIA, himica Applicata, Scienza dei Materiali (L.T.) Esercitazione n. 8 Aspetti generali di reazioni e meccanismi. TEMINI ED AGMENTI PE L SVLGIMENT
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Stabilità dei complessi
 Stabilità dei complessi v stabilità o instabilità termodinamica di un complesso è una misura del grado in cui un complesso è presente all equilibrio insieme alle sue specie costituenti, ossia allo ione
Stabilità dei complessi v stabilità o instabilità termodinamica di un complesso è una misura del grado in cui un complesso è presente all equilibrio insieme alle sue specie costituenti, ossia allo ione
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
2. Indicare l'affermazione che descrive più accuratamente il comportamento di un catalizzatore:
 1. "L'energia di attivazione, cioè l'energia necessaria a formare un composto ad alta energia potenziale, intermedio della reazione (il cosiddetto complesso attivato), è una grandezza caratteristica di
1. "L'energia di attivazione, cioè l'energia necessaria a formare un composto ad alta energia potenziale, intermedio della reazione (il cosiddetto complesso attivato), è una grandezza caratteristica di
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Corso di Chimica e Propedeutica Biochimica
 Corso di Chimica e Propedeutica Biochimica Termodinamica 1 Macchina a moto perpetuo di R. Fludd, 1618 Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III
Corso di Chimica e Propedeutica Biochimica Termodinamica 1 Macchina a moto perpetuo di R. Fludd, 1618 Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III
Bilancio di energia: il Primo Principio della Termodinamica. Termodinamica dell Ingegneria Chimica
 Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
La Funzione di Patterson A.A Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 A.A. 2009-2010 Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano La Funzione di Patterson Sviluppo in serie di Fourier svolto con i quadrati dei moduli dei fattori
A.A. 2009-2010 Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano La Funzione di Patterson Sviluppo in serie di Fourier svolto con i quadrati dei moduli dei fattori
Analisi sismica di un sistema lineare viscoso a più gradi di libertà con il metodo dello Spettro di Risposta
 Analisi sismica di un sistema lineare viscoso a più gradi di libertà con il metodo dello Spettro di Risposta Prof. Adolfo Santini - Dinamica delle Strutture 1 Analisi sismica con lo spettro di risposta
Analisi sismica di un sistema lineare viscoso a più gradi di libertà con il metodo dello Spettro di Risposta Prof. Adolfo Santini - Dinamica delle Strutture 1 Analisi sismica con lo spettro di risposta
Capitolo 12. Moto oscillatorio
 Moto oscillatorio INTRODUZIONE Quando la forza che agisce su un corpo è proporzionale al suo spostamento dalla posizione di equilibrio ne risulta un particolare tipo di moto. Se la forza agisce sempre
Moto oscillatorio INTRODUZIONE Quando la forza che agisce su un corpo è proporzionale al suo spostamento dalla posizione di equilibrio ne risulta un particolare tipo di moto. Se la forza agisce sempre
PROGRAMMA DISCIPLINARE SVOLTO a. s / N.B. il programma è pubblico ad uso degli studenti e delle famiglie.
 Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi stato fondamentale stati eccitati
 4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
PCl5 (g) <====> PCl3(g) + Cl2(g)
 ESERCITAZIONE 10 DISSOCIAZIONE TERMICA Alcuni gas si decompongono per effetto del riscaldamento in altre sostanze, che possono essere tutte o solo in parte gassose. Ad esempio: PCl5 (g) PCl3(g)
ESERCITAZIONE 10 DISSOCIAZIONE TERMICA Alcuni gas si decompongono per effetto del riscaldamento in altre sostanze, che possono essere tutte o solo in parte gassose. Ad esempio: PCl5 (g) PCl3(g)
Velocità di reazione Una trasformazione chimica modifica completamente la natura delle sostanze iniziali ( i reagenti), formando altre specie (i prodo
 Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
COMPOSTI AROMATICI. Formula C 6 H 6
 COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
Unità didattica 7 (segue) Reattività del benzene. Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili
 Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Sapienza, Università di Roma. Antonella Goggiamani
 Sapienza, Università di Roma CHIMICA ORGANICA Antonella Goggiamani antonella.goggiamani@uniroma1.it Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea in Scienze Naturali, canale M Z LEZIONI
Sapienza, Università di Roma CHIMICA ORGANICA Antonella Goggiamani antonella.goggiamani@uniroma1.it Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea in Scienze Naturali, canale M Z LEZIONI
Oscillazioni. Si produce un oscillazione quando un sistema viene perturbato rispetto a una posizione di equilibrio stabile
 Oscillazioni Si produce un oscillazione quando un sistema viene perturbato rispetto a una posizione di equilibrio stabile Caratteristica più evidente del moto oscillatorio è di essere un moto periodico,
Oscillazioni Si produce un oscillazione quando un sistema viene perturbato rispetto a una posizione di equilibrio stabile Caratteristica più evidente del moto oscillatorio è di essere un moto periodico,
Misura del coefficiente di assorbimento di vari materiali in funzione dell'energia del fascio dei fotoni incidenti
 materiali in funzione dell'energia del fascio dei fotoni Esperto Qualificato LNF - INFN Interazioni delle particelle indirettamente ionizzanti con la materia Le particelle indirettamente ionizzanti, principalmente
materiali in funzione dell'energia del fascio dei fotoni Esperto Qualificato LNF - INFN Interazioni delle particelle indirettamente ionizzanti con la materia Le particelle indirettamente ionizzanti, principalmente
Amministrazione, finanza e marketing - Turismo Ministero dell Istruzione, dell Università e della Ricerca PROGRAMMAZIONE DISCIPLINARE PER U. di A.
 MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
Lezione 3. Legame Chimico. Teoria degli Orbitali Molecolari
 Lezione 3 Legame Chimico Teoria degli Orbitali Molecolari 1 Perchè si formano i legami? Un diagramma di energia mostra che un legame fra due atomi si forma se l energia del sistema diminuisce quando i
Lezione 3 Legame Chimico Teoria degli Orbitali Molecolari 1 Perchè si formano i legami? Un diagramma di energia mostra che un legame fra due atomi si forma se l energia del sistema diminuisce quando i
La Chimica Organica idrogeno carbonio azoto ossigeno composti covalenti catene di atomi di carbonio strutture covalenti e debolmente polarizzate
 LA IMIA ORGANIA La himica Organica I quattro elementi idrogeno, carbonio, azoto e ossigeno rappresentano più del 95% dei costituenti della materia vivente. I composti organici sono composti covalenti che
LA IMIA ORGANIA La himica Organica I quattro elementi idrogeno, carbonio, azoto e ossigeno rappresentano più del 95% dei costituenti della materia vivente. I composti organici sono composti covalenti che
Università di Roma Tor Vergata
 Università di Roma Tor Vergata Facoltà di Ingegneria Dipartimento di Ingegneria Industriale Corso di: TERMOTECNICA TRASMISSIONE DEL CALORE: RESISTENZA DI CONTATTO Ing. G. Bovesecchi gianluigi.bovesecchi@gmail.com
Università di Roma Tor Vergata Facoltà di Ingegneria Dipartimento di Ingegneria Industriale Corso di: TERMOTECNICA TRASMISSIONE DEL CALORE: RESISTENZA DI CONTATTO Ing. G. Bovesecchi gianluigi.bovesecchi@gmail.com
Lavoro. Esempio. Definizione di lavoro. Lavoro motore e lavoro resistente. Lavoro compiuto da più forze ENERGIA, LAVORO E PRINCIPI DI CONSERVAZIONE
 Lavoro ENERGIA, LAVORO E PRINCIPI DI CONSERVAZIONE Cos è il lavoro? Il lavoro è la grandezza fisica che mette in relazione spostamento e forza. Il lavoro dipende sia dalla direzione della forza sia dalla
Lavoro ENERGIA, LAVORO E PRINCIPI DI CONSERVAZIONE Cos è il lavoro? Il lavoro è la grandezza fisica che mette in relazione spostamento e forza. Il lavoro dipende sia dalla direzione della forza sia dalla
LA VELOCITA DELLE REAZIONI
 LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
L energia assorbita dall atomo durante l urto iniziale è la stessa del fotone che sarebbe emesso nel passaggio inverso, e quindi vale: m
 QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
Sottodiscipline della Chimica Fisica Storicamente
 Sottodiscipline della Chimica Fisica Storicamente Termodinamica Chimica. Si occupa di tutti i processi (principalmente macroscopici) legati all energia e al suo scambio, nelle varie forme che esso può
Sottodiscipline della Chimica Fisica Storicamente Termodinamica Chimica. Si occupa di tutti i processi (principalmente macroscopici) legati all energia e al suo scambio, nelle varie forme che esso può
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Forze su cariche nei fili: il motore elettrico
 Forze su cariche nei fili: il motore elettrico In presenza di un campo magnetico B, un tratto di filo (d l) percorsa da una corrente i è soggetto ad una forza F = id l B. Un tratto rettilineo di filo di
Forze su cariche nei fili: il motore elettrico In presenza di un campo magnetico B, un tratto di filo (d l) percorsa da una corrente i è soggetto ad una forza F = id l B. Un tratto rettilineo di filo di
Grandezze angolari. Lineare Angolare Relazione x θ x = rθ. m I I = mr 2 F N N = rf sin θ 1 2 mv2 1
 Grandezze angolari Lineare Angolare Relazione x θ x = rθ v ω v = ωr a α a = αr m I I = mr 2 F N N = rf sin θ 1 2 mv2 1 2 Iω 2 Energia cinetica In forma vettoriale: v = ω r questa collega la velocità angolare
Grandezze angolari Lineare Angolare Relazione x θ x = rθ v ω v = ωr a α a = αr m I I = mr 2 F N N = rf sin θ 1 2 mv2 1 2 Iω 2 Energia cinetica In forma vettoriale: v = ω r questa collega la velocità angolare
Il legame chimico I: il legame covalente. Capitolo 9
 Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
PROVA 1. Dati i composti con formula KBr e HClO 2 :
 PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
I legami chimici. (parte seconda) Lezioni d'autore
 I legami chimici (parte seconda) Lezioni d'autore Introduzione (I) La teoria del legame di Lewis considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente dal fatto che
I legami chimici (parte seconda) Lezioni d'autore Introduzione (I) La teoria del legame di Lewis considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente dal fatto che
1. COS È LA CHIMICA ORGANICA?
 Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
Prova scritta del corso di Fisica con soluzioni. Prof. F. Ricci-Tersenghi 14/11/2014
 Prova scritta del corso di Fisica con soluzioni Prof. F. icci-tersenghi 14/11/214 Quesiti 1. Si deve trascinare una cassa di massa m = 25 kg, tirandola con una fune e facendola scorrere su un piano scabro
Prova scritta del corso di Fisica con soluzioni Prof. F. icci-tersenghi 14/11/214 Quesiti 1. Si deve trascinare una cassa di massa m = 25 kg, tirandola con una fune e facendola scorrere su un piano scabro
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
Stampa Preventivo. A.S Pagina 1 di 11
 Stampa Preventivo A.S. 2009-2010 Pagina 1 di 11 Insegnante BADALINI RENZO Classe 2BT Materia elementi di chimica e fisica preventivo consuntivo 99 84 titolo modulo 1. STRUTTURA E TRASFORM. DELL 2. L'ATOMO
Stampa Preventivo A.S. 2009-2010 Pagina 1 di 11 Insegnante BADALINI RENZO Classe 2BT Materia elementi di chimica e fisica preventivo consuntivo 99 84 titolo modulo 1. STRUTTURA E TRASFORM. DELL 2. L'ATOMO
L1 - Come si conclude questa serie di simboli? ><, <>, <<, ][, [], [[, )(,...
![L1 - Come si conclude questa serie di simboli? ><, <>, <<, ][, [], [[, )(,... L1 - Come si conclude questa serie di simboli? ><, <>, <<, ][, [], [[, )(,...](/thumbs/51/27413874.jpg) Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di simboli? >
Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di simboli? >
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Combustione. Energia chimica. Energia termica Calore. Combustibili fossili
 Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Termodinamica. Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico
 Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
MECCANISMI DELLE REAZIONI ORGANICHE
 MEAIMI DELLE EAZII GAIE orso di Laurea Magistrale in himica Esercitazione #1 Metodi non cinetici nello studio dei meccanismi 1 a) Progettare un esperimento per verificare se il gruppo Ph che migra nella
MEAIMI DELLE EAZII GAIE orso di Laurea Magistrale in himica Esercitazione #1 Metodi non cinetici nello studio dei meccanismi 1 a) Progettare un esperimento per verificare se il gruppo Ph che migra nella
Lezione 20: Atomi e molecole
 Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa.
 La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa. ChimicaGenerale_lezione17 1 L'Equilibrio Chimico Nella chimica
La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa. ChimicaGenerale_lezione17 1 L'Equilibrio Chimico Nella chimica
Ammine R N + H. ammina terziaria ammina secondaria ammina primaria sale di ammonio quaternario
 AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
Funzioni Pari e Dispari
 Una funzione f : R R si dice Funzioni Pari e Dispari PARI: se f( ) = f() R In questo caso il grafico della funzione è simmetrico rispetto all asse DISPARI: se f( ) = f() R In questo caso il grafico della
Una funzione f : R R si dice Funzioni Pari e Dispari PARI: se f( ) = f() R In questo caso il grafico della funzione è simmetrico rispetto all asse DISPARI: se f( ) = f() R In questo caso il grafico della
Attrito statico e attrito dinamico
 Forza di attrito La presenza delle forze di attrito fa parte dell esperienza quotidiana. Se si tenta di far scorrere un corpo su una superficie, si sviluppa una resistenza allo scorrimento detta forza
Forza di attrito La presenza delle forze di attrito fa parte dell esperienza quotidiana. Se si tenta di far scorrere un corpo su una superficie, si sviluppa una resistenza allo scorrimento detta forza
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
dq = C P (T ) dt dq = T 1 C P (T ) dt q = [16.10T ] K K (JK 1 ) + 2 K 1 ( K)2 = 18.6 kj
![dq = C P (T ) dt dq = T 1 C P (T ) dt q = [16.10T ] K K (JK 1 ) + 2 K 1 ( K)2 = 18.6 kj dq = C P (T ) dt dq = T 1 C P (T ) dt q = [16.10T ] K K (JK 1 ) + 2 K 1 ( K)2 = 18.6 kj](/thumbs/52/30664943.jpg) Esercizio 1 Calcolo q, w, U e H per riscaldamento gas ideale Calcolare q, w, U e H per un gas ideale in seguito all'aumento della sua temperatura da 25 C a 120 C in condizioni di pressione costante, sapendo
Esercizio 1 Calcolo q, w, U e H per riscaldamento gas ideale Calcolare q, w, U e H per un gas ideale in seguito all'aumento della sua temperatura da 25 C a 120 C in condizioni di pressione costante, sapendo
Cenni di Fisica del Nucleo
 Capitolo 8 Cenni di Fisica del Nucleo 8.1 Proprietà generali dei nuclei In questo capitolo affrontiamo lo studio dei nuclei. Un nucleo è un insieme di neutroni e protoni legati insieme ( incollati ) dalla
Capitolo 8 Cenni di Fisica del Nucleo 8.1 Proprietà generali dei nuclei In questo capitolo affrontiamo lo studio dei nuclei. Un nucleo è un insieme di neutroni e protoni legati insieme ( incollati ) dalla
Il Monossido di Di-Idrogeno
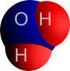 Il Monossido di Di-Idrogeno Equilibri in Soluzione Acquosa In soluzione acquosa, per un equilibrio generico: + + La legge di azione di massa si scrive: = Si usano le concentrazioni molari dei soluti in
Il Monossido di Di-Idrogeno Equilibri in Soluzione Acquosa In soluzione acquosa, per un equilibrio generico: + + La legge di azione di massa si scrive: = Si usano le concentrazioni molari dei soluti in
Sono processi unitari le Sintesi industriali.
 1 1 Per risolvere i problemi relativi agli impianti chimici è necessario fare uso di equazioni, esse vengono classificate in : equazioni di bilancio e equazioni di trasferimento. -Le equazioni di bilancio
1 1 Per risolvere i problemi relativi agli impianti chimici è necessario fare uso di equazioni, esse vengono classificate in : equazioni di bilancio e equazioni di trasferimento. -Le equazioni di bilancio
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
CORSO DI FISICA DELLA MATERIA CONDENSATA A. A. 2013/14
 1 CORSO DI FISICA DELLA MATERIA CONDENSATA 3 MODI NORMALI DI VIBRAZIONE DELLE MOLECOLE POLIATOMICHE Appunti dalle Lezioni del Prof. P. Calvani A. A. 2013/14 Queste dispense sono per solo uso interno e
1 CORSO DI FISICA DELLA MATERIA CONDENSATA 3 MODI NORMALI DI VIBRAZIONE DELLE MOLECOLE POLIATOMICHE Appunti dalle Lezioni del Prof. P. Calvani A. A. 2013/14 Queste dispense sono per solo uso interno e
Le radiazioni e la loro misura
 Le radiazioni e la loro misura Le radiazioni e le radiazioni ionizzanti Nuclei, radioattività, reazioni nucleari Einstein, la legge E = mc 2 e l'energia nucleare Uso degli strumenti di misura Che cosa
Le radiazioni e la loro misura Le radiazioni e le radiazioni ionizzanti Nuclei, radioattività, reazioni nucleari Einstein, la legge E = mc 2 e l'energia nucleare Uso degli strumenti di misura Che cosa
Esercitazioni di Meccanica Razionale
 Esercitazioni di Meccanica Razionale a.a. 2002/2003 Meccanica analitica I parte Maria Grazia Naso naso@ing.unibs.it Dipartimento di Matematica Università degli Studi di Brescia Esercitazioni di Meccanica
Esercitazioni di Meccanica Razionale a.a. 2002/2003 Meccanica analitica I parte Maria Grazia Naso naso@ing.unibs.it Dipartimento di Matematica Università degli Studi di Brescia Esercitazioni di Meccanica
Teorie Acido-Base. valutazione degli acidi
 Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
OSCILLATORE ARMONICO SEMPLICE
 OSCILLATORE ARMONICO SEMPLICE Un oscillatore è costituito da una particella che si muove periodicamente attorno ad una posizione di equilibrio. Compiono moti oscillatori: il pendolo, un peso attaccato
OSCILLATORE ARMONICO SEMPLICE Un oscillatore è costituito da una particella che si muove periodicamente attorno ad una posizione di equilibrio. Compiono moti oscillatori: il pendolo, un peso attaccato
Lezione del F t = componente lungo la tangente della forza lungo il percorso.
 Lezione del 04.03.2016 Lavoro = lo si indica con W. Il lavoro prodotto da una forza F produce uno spostamento dal punto A al B punto lungo la linea γ. Il lavoro da A ad B è diverso da quello fatto da B
Lezione del 04.03.2016 Lavoro = lo si indica con W. Il lavoro prodotto da una forza F produce uno spostamento dal punto A al B punto lungo la linea γ. Il lavoro da A ad B è diverso da quello fatto da B
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Lezione n. 22. Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
LA FORZA...SIA CON TE!
 LA FORZA...SIA CON TE! CHE COS'E' LA FORZA? E' UNA GRANDEZZA FISICA VETTORIALE. L'UNITA' DI MISURA NEL S.I. E' IL "NEWTON" ( N ), DAL CELEBRE SCIENZIATO INGLESE ISAAC NEWTON, CHE NE HA STUDIATO LE LEGGI,
LA FORZA...SIA CON TE! CHE COS'E' LA FORZA? E' UNA GRANDEZZA FISICA VETTORIALE. L'UNITA' DI MISURA NEL S.I. E' IL "NEWTON" ( N ), DAL CELEBRE SCIENZIATO INGLESE ISAAC NEWTON, CHE NE HA STUDIATO LE LEGGI,
Diffrazione di Raggi-X da Monocristalli A.A Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Diffrazione di Raggi-X da Monocristalli A.A. 2009-2010 Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Raccolta Dati di Diffrazione: Diffrazione di Raggi X Raccolta
Diffrazione di Raggi-X da Monocristalli A.A. 2009-2010 Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Raccolta Dati di Diffrazione: Diffrazione di Raggi X Raccolta
Test di Matematica di base e Logica
 Università degli Studi di Perugia. Facoltà di Scienze MM.FF.NN. Test di Autovalutazione per l accesso al corso di laurea triennale in chimica 1 ottobre 2010 Test di Matematica di base e Logica 1) Un triangolo
Università degli Studi di Perugia. Facoltà di Scienze MM.FF.NN. Test di Autovalutazione per l accesso al corso di laurea triennale in chimica 1 ottobre 2010 Test di Matematica di base e Logica 1) Un triangolo
Facoltà di Scienze M.F.N.
 Facoltà di Scienze M.F.N. Laboratorio di Chimica rganica II Anno Accademico. Relazione Gruppo: Modello Modello: a cura di V. Lucchini, M. Selva 1 Generale. + Tutti i composti impiegati nelle sintesi descritte
Facoltà di Scienze M.F.N. Laboratorio di Chimica rganica II Anno Accademico. Relazione Gruppo: Modello Modello: a cura di V. Lucchini, M. Selva 1 Generale. + Tutti i composti impiegati nelle sintesi descritte
Radioattività. 1. Massa dei nuclei. 2. Decadimenti nucleari. 3. Legge del decadimento XVI - 0. A. Contin - Fisica Generale Avanzata
 Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Tabella. Permittività relativa, parametro di solubilità, parametri empirici di polarità di alcuni solventi Solvente (a 25 C) ε r.
 Tabella. Permittività relativa, parametro di solubilità, parametri empirici di polarità di alcuni solventi ε r δ Z E T S π* (a 25 ) kcal/mole kcal/mole Esano 1.88 7.27 0.9 0.7 0.08 icloesano 2.02 8.2 1.2
Tabella. Permittività relativa, parametro di solubilità, parametri empirici di polarità di alcuni solventi ε r δ Z E T S π* (a 25 ) kcal/mole kcal/mole Esano 1.88 7.27 0.9 0.7 0.08 icloesano 2.02 8.2 1.2
Esercitazione 2. Soluzione
 Esercitazione 2 Esercizio 1 - Resistenza dell aria Un blocchetto di massa m = 0.01 Kg (10 grammi) viene appoggiato delicatamente con velocità iniziale zero su un piano inclinato rispetto all orizziontale
Esercitazione 2 Esercizio 1 - Resistenza dell aria Un blocchetto di massa m = 0.01 Kg (10 grammi) viene appoggiato delicatamente con velocità iniziale zero su un piano inclinato rispetto all orizziontale
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Chimica. Lezione 1 La materia
 Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
