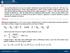
La funzione energia interna nei gas ideali. dv =( V p ) dp+( V. T ) p
|
|
|
- Bianca Tortora
- 5 anni fa
- Visualizzazioni
Transcript
1 La funzione energia interna nei gas ideali Si vuole dimostrare che er quei gas i cui stati sono descritti dall'equazione =nr l' energia interna è funzione solo della temeratura. In altri termini si verificherà che in un gas ideale U =U ( ). Per far ciò, assumiamo inizialmente il contrario e cioè che in un gas ideale, come in qualsiasi altra sostanza, l'energia interna è funzione di iù variabili (che ossono essere ressione o volume). Per descrivere gli stati della nostra sostanza disoniamo er l'aunto di tre variabili,,, ciascuna delle quali è er forza funzione delle altre due. Per comodità ossiamo servirci della funzione = (, ) ed esrimerne il differenziale totale d =( ) d+( ) d Fisicamente, quando una sostanza è sottoosta ad una variazione del suo volume, il valore di questa variazione dienderà dalle condizioni ambientali, e cioè dal valore della ressione e della temeratura durante la comressione e la loro reciroca evoluzione. Serimentalmente è stato dimostrato che esistono dei coefficienti che aiutano a redire il comortamento di secifiche sostanze durante queste trasformazioni. È doveroso erciò introdurre il modulo di comressibilità, er il quale esiste una relazione 1 = 1 ( ) D'altra arte è anche vero che un coro sottoosto ad una variazione di temeratura risonde con una variazione del suo volume. Questo comortamento, la cui criticità è caratteristica di ogni sostanza, è er l'aunto descritto da un coefficiente di dilatazione cubica φ er il quale sussiste la relazione φ= 1 ( ) Risulta di immediata comodità l'eslicitazione dei coefficienti delle derivate arziali attraverso i coefficienti soracitati. Si uò ertanto riscrivere il differenziale totale d = d+φ d Dal quale si ricavano le esressioni dei differenziali er le altre due variabili d=φ d d d = 1 φ d + 1 φ d Mantenendo costante ciascuna variabile a turno ed esrimendo i raorti dei differenziali si ossono ricavare i valori secifici risetto alle diverse trasformazioni che si ossono effettuare su di una sostanza. A noi sono già noti i raorti di variazione volumica in funzione di una variazione di ressione a temeratura costante e in funzione di una variazione di temeratura a ressione costante ( ) =, ( ) =φ
2 Se durante la trasformazione manteniamo costante il volume, dovrà essere d = 1 φ d. Per una trasformazione in cui si mantiene costante la temeratura si ricava allo stesso modo d= d. In definitiva, si ottengono le relazioni {( ) ( ) =φ, ( ) = 1 φ = 1 φ, ( ) =φ Ci rooniamo ora di ricavare il valore di questi coefficienti er quelle sostanze che obbediscono alla relazione =nr e cioè i gas ideali. Dall'equazione di stato ricaviamo la funzione (, )= nr Mantenendo costante la ressione, la derivata risetto alla temeratura sarà ( ) = nr In base alle relazioni dei coefficienti trovate in recedenza, si ha che Allora si ricava il coefficiente φ nr =φ φ= 1 oiché si evince facilmente dall'equazione di stato che = nr. Eslicitando a scelta un'altra variabile dalla funzione di stato ricaveremo il valore del coefficiente di comressibilità. Sia (, )= nr Considerando una trasformazione isocora, la derivata risetto alla temeratura sarà ( ) = nr =φ Ovvero il modulo di comressibilità assume un valore = nr Dunque er un gas ideale i coefficienti di dilatazione volumica e di comressibilità valgono =
3 { φ= 1 = Avendo assunto che l'energia interna dei gas ideali sia funzione di iù variabili, ovvero U =U (, ), U =U (, ), U =U (, ) er queste funzioni varranno i risettivi differenziali totali du = ) d +( U ) d du = ) d + ) d du = ) d+ ) d Consideriamo ora il rimo rinciio della termodinamica dq=du + d dove er semlicità e affinità con la definizione di lavoro termodinamico, scegliamo di sostituire la funzione U =U (, ). dq= ) d + ) d + d D'altra arte è definita calore secifico a volume costante la quantità 1 n ) =c dove n è il numero di moli. In definitiva il rimo rinciio della termodinamica uò essere scritto come dq=n c d +[( U ) + ] d Quest'ultima equazione uò essere esressa attraverso l'utilizzo dei otenziali termodinamici (risettivamente: entalia, energia libera, otenziale di Gibbs) H =U +, F =U S, G=H S servendoci della definizione di entroia di un sistema ds= dq Scriviamo il differenziale di ciascun otenziale du =ds d dh =d (U + )=du + d + d=ds + d df =d (U S)=dU S d ds= S d d dg=d ( H S )=dh ds Sd =d Sd { du =ds d dh =ds+d df = Sd d dg=d Sd
4 Se l'energia interna è funzione di iù variabili allora ognuno dei differenziali trovati dovrà soddisfare questa condizione. Prima di ciò sarà necessario calcolare i valori dei vari coefficienti dei otenziali aena trovati. Iniziamo col mantenere costante la variabile ressione nelle tre equazioni dei otenziali. Ci si accorge che in articolar modo si avrà ( G ) = S, ( H S ) = Se ora assumiamo =costante notiamo che ( F ) =, ( G ) = Del ari, er una isoentroica Infine, mantenendo costante il volume si ha che Possiamo relazionare i risultati ottenuti { ( H ) =, ( U S ) = S S ) =, ( F ) = S H =( ) =( G S ) = S ) =( H S ) = ( U ) = ( F S ) S = ( G ) =( F ) Alla luce di ciò, considerando il differenziale dell'energia interna du =ds d dove abbiamo dimostrato che =( U S ) e = ), alichiamo il teorema sulla S simmetria delle derivate seconde miste, er il rinciio di integrabilità. In tal modo si ha S ) = S ) S Ovvero ( ) = ( S S ) Procedendo in modo analogo, otteniamo le relazioni di Maxwell
5 { ( ) = ( S S ) ( ) =( S S ) ) =( ) ) = ( ) Queste equazioni valgono in qualsiasi stato di equilibrio di un sistema. Ora, in funzione dei otenziali termodinamici abbiamo scritto la variazione infinitesima di energia interna come du =ds d dove la variazione di entroia uò essere esressa tramite i differenziali totali nelle variabili,, ds= ) d + ) d ds= ) d + ) d Per definizione ds=dq / allora ) = 1 ( dq d ), ) = 1 ( dq d ) Si rammenti che in una trasformazione a volume costante il raorto tra la quantità di calore scambiato e la conseguente variazione di temeratura è definito come caacità termica C =n c, mentre nell'isobara questo raorto vale n c.in recedenza erò abbiamo definito il calore secifico c come raorto tra variazione di energia interna e variazione di temeratura. Per recisare ciò, iniziamo col dimostrare che l'equivalenza tra calore ed energia interna diende di fatto dal tio di trasformazione. Consideriamo darima una isocora, dove si avrà d =0. Dalla definizione di variazione di energia interna e dal rimo rinciio della termodinamica con il termine del lavoro nullo n c d =dq e abbiamo dimostrato che er una trasformazione a volume costante la caacità termica è anche uguale al raorto tra calore scambiato e variazione di temeratura. Consideriamo ora un'isobara, dove il rimo rinciio assume la forma generica n c d + d =dq D'altra arte il differenziale della funzione di stato si uò scrivere Pertanto dovrà essere d + d=nrd n c d +nrd d=dq
6 Essendo d=0 nella isobara n(c +R)d =dq Per la facilmente dimostrabile relazione di Mayer c c =R si ottiene infine n c d =dq come volevasi dimostrare. Di conseguenza risulterà naturale riscrivere le relazioni trovate in recedenza ) = nc, ) = n c Il differenziale dell'entroia assume la forma iù immediata d ds=nc + ) d d ds=nc + ) d Ora, dalle relazioni di Maxwell è abbiamo aurato che ) =( ) In virtù di ciò, si sostituisce nel differenziale dell'energia interna d du = [n c +( ) ] d d =n c d +[ ( ) ]d In questa equazione l'energia interna risulta funzione di temeratura e volume. Ne concludiamo che dovrà esistere un'analogia tra il differenziale totale di U =U (, ) e l'equazione soracitata. Dovrà infatti valere l'uguaglianza du =n c d + ) d =n c d +[ ( ) ] d ) = ( ) Dove saiamo che il coefficiente della derivata arziale assume il valore Detto ciò, dovrà essere vero che ( ) =φ ) =φ
7 Ma in un gas ideale è stato dimostrato che φ= 1 otteniamo ) =0 e =, andando a sostituire questi valori L'energia interna di un gas ideale non uò quindi essere funzione del volume, contrariamente alla nostra assunzione iniziale. Consideriamo ora l'energia interna come funzione U =U (, ) e ancora l'equazione infinitesimale du =ds d dove andiamo a sostituire convenientemente il differenziale er l'entroia d ds=n c + ) d Allora il differenziale della funzione U =U (, ) uò essere eguagliato a d du = [n c + ) d] d du =n c d + ) d=nc d + ) d d Dalle relazioni di Maxwell Avendo trovato in recedenza che Pertanto sarà ) = ( ) ( ) =φ ) d= φ d d Dal valore dei coefficienti ricavati er un gas ideale si ha che Dal differenziale dell'equazione di stato ) d= d d In definitiva ) d= d nrd + d ) d= nrd Ma er la validità di questa equazione è stato assunto =costante d =0 ertanto, dovrà necessariamente essere
8 ) =0 Contrariamente alla nostra assunzione iniziale, l'energia interna non uò essere funzione della ressione. Conseguentemente ai risultati ottenuti, anche l'ultimo differenziale totale du = ) d+ ) d sarà necessariamente eguale a zero. Si evince quindi che tutte le nostre assunzioni iniziali erano false,e che come volevasi dimostrare, in un gas ideale l'energia interna è funzione solo ed esclusivamente della temeratura. Questo risultato caratteristico, valido solamente er i gas ideali, è giustificato dalla teoria cinetica molecolare, secondo la quale U = l 2 N k B dove l è il numero di gradi di libertà delle molecole ed N il numero totale di queste ultime, mentre k B è la costante di Boltzmann. Questo risultato fu inoltre verificato serimentalmente fin dal XIX secolo da Joule quando, facendo esandere liberamente un gas da un reciiente ad un altro contenuti in un calorimetro e collegati da un rubinetto, registrava variazioni della temeratura ressoché nulle nel suo termometro. Nell'esansione libera non si ha variazione di volume, in quanto il gas finisce semlicemente con l'occuare tutto il nuovo volume a disosizione senza comiere lavoro esterno. Per il rimo rinciio della termodinamica Δ U=Q, ma a giudicare dalle variazioni di temeratura registrate, non si ha scambio di calore Q=0 e quindi anche Δ U=0. Joule dovette concludere che in una esansione libera a temeratura costante non si ha variazione di energia interna, quest'ultima sarà dunque funzione solo della temeratura. Matteo Parriciatu
dz dx + dy y x x y se z e una funzione di due generiche variabili x ed y ossia se z= a prescindere dal fatto che le variabili x ed y
 Richiami matematici se z e una funzione di due generiche variabili x ed y ossia se z= zxy (, ) a rescindere dal fatto che le variabili x ed y siamo indiendenti o siano diendenti da altre variabili il differenziale
Richiami matematici se z e una funzione di due generiche variabili x ed y ossia se z= zxy (, ) a rescindere dal fatto che le variabili x ed y siamo indiendenti o siano diendenti da altre variabili il differenziale
Lezione 10 Termodinamica
 rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
Prova scritta del 27 novembre 2018
 Prova scritta del 27 novembre 2018 1 Un reciiente della caacità di 1.00 L e contenente un gas A alla ressione di 10.0 kpa viene connesso ad un altro reciiente avente il volume di 3.00 L con all interno
Prova scritta del 27 novembre 2018 1 Un reciiente della caacità di 1.00 L e contenente un gas A alla ressione di 10.0 kpa viene connesso ad un altro reciiente avente il volume di 3.00 L con all interno
Complementi di Termologia. III parte
 Prof. Michele Giugliano (Dicembre 00) Comlementi di Termologia. III arte N. 3. - Lavoro nelle trasformazioni. In generale se un gas, soggetto ad una variazione della ressione, varia il volume, esso comie
Prof. Michele Giugliano (Dicembre 00) Comlementi di Termologia. III arte N. 3. - Lavoro nelle trasformazioni. In generale se un gas, soggetto ad una variazione della ressione, varia il volume, esso comie
Fisica Generale A estensione principio di conservazione dell energia energia termica teoria cinetica dei gas 14. I Principio della Termodinamica
 Fisica Generale A 4. I Princiio della ermodinamica htt://camus.cib.unibo.it/2434/ December 3, 2 Primo Princiio e Moti Molecolari Il rimo rinciio della termodinamica è l estensione del rinciio di conservazione
Fisica Generale A 4. I Princiio della ermodinamica htt://camus.cib.unibo.it/2434/ December 3, 2 Primo Princiio e Moti Molecolari Il rimo rinciio della termodinamica è l estensione del rinciio di conservazione
Il primo principio della termodinamica
 Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Applicazione del principio di conservazione dell energia a sistemi aventi un gran numero di particelle.
 PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
SCIENZA DEI MATERIALI. Chimica Fisica. VII Lezione. Dr. Fabio Mavelli. Dipartimento di Chimica Università degli Studi di Bari
 SCENZA DE MAEAL Chimica Fisica V Lezione Dr. Fabio Mavelli Diartimento di Chimica Università degli Studi di Bari Equazione Fondamentale 2 l rimo ed il secondo rinciio ermettono di esrimere la variazione
SCENZA DE MAEAL Chimica Fisica V Lezione Dr. Fabio Mavelli Diartimento di Chimica Università degli Studi di Bari Equazione Fondamentale 2 l rimo ed il secondo rinciio ermettono di esrimere la variazione
a = V p V T Proprieta generali dei sistemi pvt sistemi semplici sistemi composti da una o piu sostanze pure sono detti
 Proprieta generali dei sistemi p sistemi composti da una o piu sostanze pure sono detti sistemi semplici o sistemi p in questi sistemi si definiscono il modulo di compressibilita isoterma il coefficiente
Proprieta generali dei sistemi p sistemi composti da una o piu sostanze pure sono detti sistemi semplici o sistemi p in questi sistemi si definiscono il modulo di compressibilita isoterma il coefficiente
Tre tipi di Sistema Un richiamo
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
Istituzione di Fisica Statistica
 Istituzione di Fisica Statistica Comito e rova arziale (December 9, 004) Mattia Donega 8 dicembre 006 Esercizio Un gas classico di N articelle di massa m in equilibrio alla temeratura T è riartito fra
Istituzione di Fisica Statistica Comito e rova arziale (December 9, 004) Mattia Donega 8 dicembre 006 Esercizio Un gas classico di N articelle di massa m in equilibrio alla temeratura T è riartito fra
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: dv dp. dv dt. nrt dt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
Lezione 4: Termodinamica. Seminario didattico
 Lezione 4: Termodinamica Seminario didattico Esercizio n 1 Un gas all interno di una camera percorre il ciclo mostrato in figura. Si determini il calore totale fornito al sistema durante la trasformazione
Lezione 4: Termodinamica Seminario didattico Esercizio n 1 Un gas all interno di una camera percorre il ciclo mostrato in figura. Si determini il calore totale fornito al sistema durante la trasformazione
Esercizi svolti di termodinamica applicata
 0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
TEORIA CINETICA DEI GAS
 TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
5. Energia libera e potenziale chimico
 5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
La Pressione (1) La Pressione è una grandezza scalare ed in un fluido rappresenta una proprietà meccanica dello stesso.
 La Pressione (1) Trasformazioni termodamiche del Gas Ideale - 1 ds La Pressione è una grandezza scalare ed un fluido raresenta una rorietà meccanica dello stesso. d n F df ds = 1 = mg h (1) = ds ds n π
La Pressione (1) Trasformazioni termodamiche del Gas Ideale - 1 ds La Pressione è una grandezza scalare ed un fluido raresenta una rorietà meccanica dello stesso. d n F df ds = 1 = mg h (1) = ds ds n π
Introduzione alle macchine termiche
 1 Introduzione alle macchine termiche In questa nota 1 introduciamo il concetto di macchina termica che oera con trasformazioni cicliche er trasformare calore in lavoro. In generale questo argomento viene
1 Introduzione alle macchine termiche In questa nota 1 introduciamo il concetto di macchina termica che oera con trasformazioni cicliche er trasformare calore in lavoro. In generale questo argomento viene
CLASSI SECONDE Formulario (con esercizi) LEGGI DEI GAS
 CLASSI SECONDE Formulario con esercizi) LEGGI DEI GAS Germano D Abramo Versione 1.1 10/03/2016 N.B. Si invita a trovare errori e/o imrecisioni o a richiedere una stesura del testo iù semlice.) Trasformzioni
CLASSI SECONDE Formulario con esercizi) LEGGI DEI GAS Germano D Abramo Versione 1.1 10/03/2016 N.B. Si invita a trovare errori e/o imrecisioni o a richiedere una stesura del testo iù semlice.) Trasformzioni
Lezione 5: Termodinamica. Seminario didattico
 Lezione 5: Termodinamica Seminario didattico Esercizio n 1 Ad una mole di gas monoatomico viene fatto percorrere il ciclo mostrato in figura il processo bc è una espansione adiabatica; p B =1.03 bar, V
Lezione 5: Termodinamica Seminario didattico Esercizio n 1 Ad una mole di gas monoatomico viene fatto percorrere il ciclo mostrato in figura il processo bc è una espansione adiabatica; p B =1.03 bar, V
Energia interna. 1 se non durante gli urti
 Energia interna L energia interna E int di un sistema è la somma delle energie cinetiche e potenziali (dovute alle interazioni) delle particelle che lo compongono. In un gas ideale le particelle sono indipendenti:
Energia interna L energia interna E int di un sistema è la somma delle energie cinetiche e potenziali (dovute alle interazioni) delle particelle che lo compongono. In un gas ideale le particelle sono indipendenti:
Calorimetria. Principio zero Trasformazioni termodinamiche Lavoro termodinamico
 Calorimetria Princiio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una articella è definito quando siano note, in un certo istante, la osizione
Calorimetria Princiio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una articella è definito quando siano note, in un certo istante, la osizione
Modello di Greitzer (1976) Simulazione del comportamento dinamico di compressori
 Modello di Greitzer (1976) Simulazione del comortamento dinamico di comressori Iotesi del modello. Si consideri un sistema fisico comosto, nell ordine, da un comressore, un lenum ed una valvola di strozzamento.
Modello di Greitzer (1976) Simulazione del comortamento dinamico di comressori Iotesi del modello. Si consideri un sistema fisico comosto, nell ordine, da un comressore, un lenum ed una valvola di strozzamento.
ma come si puo misurare una grandezza fisica della quale si postula l esistenza, ma di cui non si conosce nulla? chiaramente misurarla direttamente
 Princiio zero della termodinamica gli stati di equilibrio termico godono della articolare rorieta che i sistemi all equilibrio termico tra loro condividono una stessa grandezza fisica, detta temeratura
Princiio zero della termodinamica gli stati di equilibrio termico godono della articolare rorieta che i sistemi all equilibrio termico tra loro condividono una stessa grandezza fisica, detta temeratura
Fisica dell Atmosfera e del Clima
 Università degli studi di rento Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile, Ambientale e Meccanica Fisica dell Atmosfera e del
Università degli studi di rento Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile, Ambientale e Meccanica Fisica dell Atmosfera e del
1 TERMODINAMICA DELLE TURBINE A GAS 1.1 INTRODUZIONE
 TERMODINAMICA DELLE TURBINE A GAS. INTRODUZIONE Il ciclo termodinamico su cui è imostato il funzionamento delle turbine a gas è il ciclo Bryton, la cui analisi orta alla determinazione di due arametri
TERMODINAMICA DELLE TURBINE A GAS. INTRODUZIONE Il ciclo termodinamico su cui è imostato il funzionamento delle turbine a gas è il ciclo Bryton, la cui analisi orta alla determinazione di due arametri
Termologia. Paolo Bagnaia - CTF Esercizi di termologia e termodinamica 1
 ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
Fisica dell Atmosfera e del Clima
 Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
UGELLO CONVERGENTE. Dai valori noti si ricava: = = e quindi il rapporto: p a
 UGELLO CONVERGENE. Si consideri un ugello convergente che scarica in ambiente ( a atm). Sono noti la temeratura di ristagno K, il diametro di uscita dell ugello D.m e la differenza di ressione tra monte
UGELLO CONVERGENE. Si consideri un ugello convergente che scarica in ambiente ( a atm). Sono noti la temeratura di ristagno K, il diametro di uscita dell ugello D.m e la differenza di ressione tra monte
Gas ideale: velocità delle particelle e pressione (1)
 Gas ideale: velocità delle particelle e pressione (1) In un gas ideale le particelle sono considerate puntiformi e risentono di forze solo durante gli urti (perfettamente elastici) con le pareti del recipiente.
Gas ideale: velocità delle particelle e pressione (1) In un gas ideale le particelle sono considerate puntiformi e risentono di forze solo durante gli urti (perfettamente elastici) con le pareti del recipiente.
Energia di Gibbs. Questa equazione può essere espressa più semplicemente riferendosi ad una nuova funzione di stato così definita
 a, costanti Energia di Gibbs dh ds 0 dh ds 0 Questa equazione può essere espressa più semplicemente riferendosi ad una nuova funzione di stato così definita G = H S energia di Gibbs ( energia libera) Se
a, costanti Energia di Gibbs dh ds 0 dh ds 0 Questa equazione può essere espressa più semplicemente riferendosi ad una nuova funzione di stato così definita G = H S energia di Gibbs ( energia libera) Se
Soluzioni del problema adattato
 Soluzioni del problema 1412 adattato Tipo di problema fornito per la parte di termodinamica nella prova scritta Sommario Riportiamo tutte le possibili soluzioni del problema, anche con considerazioni didattiche
Soluzioni del problema 1412 adattato Tipo di problema fornito per la parte di termodinamica nella prova scritta Sommario Riportiamo tutte le possibili soluzioni del problema, anche con considerazioni didattiche
Sia dato un corpo su cui agisce una forza. Supponiamo che inizialmente il corpo sia fermo, dalla relazione
 Lavoro ed energia Sia dato un coro su cui agisce una forza. Suoniamo che inizialmente il coro sia fermo, dalla relazione F = ma doo un certo intervallo di temo in cui la forza agisce sull oggetto, il coro
Lavoro ed energia Sia dato un coro su cui agisce una forza. Suoniamo che inizialmente il coro sia fermo, dalla relazione F = ma doo un certo intervallo di temo in cui la forza agisce sull oggetto, il coro
Sperimentalmente si verifica che per una massa di gas segue alcune leggi valide per tutti i tipi di gas generalmente indicate come:
 Gas perfetti Fisica Tecnica G. Grazzini Sperimentalmente si verifica che per una massa di gas segue alcune leggi valide per tutti i tipi di gas generalmente indicate come: Legge di Boyle PV = cost. Legge
Gas perfetti Fisica Tecnica G. Grazzini Sperimentalmente si verifica che per una massa di gas segue alcune leggi valide per tutti i tipi di gas generalmente indicate come: Legge di Boyle PV = cost. Legge
Opera rilasciata sotto licenza CC BY-NC-SA 3.0 Italia da Studio Bells (www.studiobells.it)
 Esercizio Argomenti: gas perfetti, trasformazioni adiabatiche, primo principio. Livello: scuola superiore. Un gas perfetto monoatomico si trova in un contenitore chiuso da un pistone mobile. Inizialmente
Esercizio Argomenti: gas perfetti, trasformazioni adiabatiche, primo principio. Livello: scuola superiore. Un gas perfetto monoatomico si trova in un contenitore chiuso da un pistone mobile. Inizialmente
MOTI QUASI UNIDIMENSIONALI MOTI QUASI UNIDIMENSIONALI
 MOTI QUASI UNIDIMENSIONALI Nei moti quasi unidimensionali si iotizza la costanza del valore di tutte le grandezze termofluidodinamiche su ciascuna suerficie ermeabile aartenente alla suerficie esterna
MOTI QUASI UNIDIMENSIONALI Nei moti quasi unidimensionali si iotizza la costanza del valore di tutte le grandezze termofluidodinamiche su ciascuna suerficie ermeabile aartenente alla suerficie esterna
Energia e Sviluppo Sostenibile
 Termodinamica Applicata: Introduzione A. Servida - servida@unige.it Introduzione alla Termodinamica (1) La meccanica analizza solo una parte del principio di conservazione dell'energia: la conservazione
Termodinamica Applicata: Introduzione A. Servida - servida@unige.it Introduzione alla Termodinamica (1) La meccanica analizza solo una parte del principio di conservazione dell'energia: la conservazione
IIASS International Institute for Advanced Scientific Studies
 IIASS International Institute for Advanced Scientific Studies Eduardo R. Caianiello Circolo di Matematica e Fisica Diartimento di Fisica E.R. Caianiello Università di Salerno Premio Eduardo R. Caianiello
IIASS International Institute for Advanced Scientific Studies Eduardo R. Caianiello Circolo di Matematica e Fisica Diartimento di Fisica E.R. Caianiello Università di Salerno Premio Eduardo R. Caianiello
Appunti di Fisica _I Secondo semestre. Termodinamica Trasformazioni, lavoro e calore
 Pisa Aprile 2011 Cap.35 v 11 Appunti di Fisica _I Secondo semestre Termodinamica Trasformazioni, lavoro e calore Sommario Lavoro ed il primo principio...1 Trasformazione isoterma...2 Trasformazione isobara...2
Pisa Aprile 2011 Cap.35 v 11 Appunti di Fisica _I Secondo semestre Termodinamica Trasformazioni, lavoro e calore Sommario Lavoro ed il primo principio...1 Trasformazione isoterma...2 Trasformazione isobara...2
TESTI E SOLUZIONI DEI PROBLEMI
 Università degli Studi di Udine Corso di Laurea in Ingegneria Gestionale A.A. 05/06 Sessione di Giugno/Luglio 06 Esame di FISICA GENERALE CFU) Primo Appello PROVA SCRITTA 3 Giugno 06 TESTI E SOLUZIONI
Università degli Studi di Udine Corso di Laurea in Ingegneria Gestionale A.A. 05/06 Sessione di Giugno/Luglio 06 Esame di FISICA GENERALE CFU) Primo Appello PROVA SCRITTA 3 Giugno 06 TESTI E SOLUZIONI
Energia di Gibbs. introduciamo una nuova funzione termodinamica così definita. energia di Gibbs ( energia libera)
 a, costanti Energia di Gibbs dh ds 0 dh ds 0 introduciamo una nuova funzione termodinamica così definita G = H S energia di Gibbs ( energia libera) Se lo stato del sistema cambia e è costante allora la
a, costanti Energia di Gibbs dh ds 0 dh ds 0 introduciamo una nuova funzione termodinamica così definita G = H S energia di Gibbs ( energia libera) Se lo stato del sistema cambia e è costante allora la
Corso di Impianti Dispense a cura di Simone Lugli Realizzate a favore degli allievi dell Istituto C. Ferrini di Verbania. 1. Il teorema di Bernoulli 2
 Indice 1. Il teorema di Bernoulli. Strumenti er misure su tubazioni: generalità e metodi di utilizzo 3.1. Il Tubo di Pitot 3.. Il venturimetro 4.3 Il boccaglio 5.4 Il diaframma 6.5. ltri strumenti er la
Indice 1. Il teorema di Bernoulli. Strumenti er misure su tubazioni: generalità e metodi di utilizzo 3.1. Il Tubo di Pitot 3.. Il venturimetro 4.3 Il boccaglio 5.4 Il diaframma 6.5. ltri strumenti er la
CALORE E TERMODI NAMI CA - PRI MO PRI NCI PI O
 CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
Esercizi sugli stati ed il diagramma entalpico dell'aria umida
 Esercizi sugli stati ed il diagramma entalico dell'aria umida CESARE MARIA JOPPOLO, STEFANO DE ANTONELLIS, LUCA MOLINAROLI DIPARTIMENTO DI ENERGIA POLITECNICO DI MILANO C. M. Joolo, S. De Antonellis, L.
Esercizi sugli stati ed il diagramma entalico dell'aria umida CESARE MARIA JOPPOLO, STEFANO DE ANTONELLIS, LUCA MOLINAROLI DIPARTIMENTO DI ENERGIA POLITECNICO DI MILANO C. M. Joolo, S. De Antonellis, L.
Dal modellino dei Gas perfetti alla Tecnologia del vuoto
 Dal modellino dei Gas erfetti alla ecnologia del vuoto Il gas erfetto è un modellino teorico che ermette di rogettare e dimensionare I sistemi da vuoto, arte tutto da P Nk () (*) P ressione del gas olume
Dal modellino dei Gas erfetti alla ecnologia del vuoto Il gas erfetto è un modellino teorico che ermette di rogettare e dimensionare I sistemi da vuoto, arte tutto da P Nk () (*) P ressione del gas olume
Termodinamica Chimica. Calore
 Termodinamica Chimica Calore La Temperatura riflette il movimento casuale delle particelle, ed è quindi correlata all energia cinetica delle molecole Il Calore coinvolge un trasferimento di energia tra
Termodinamica Chimica Calore La Temperatura riflette il movimento casuale delle particelle, ed è quindi correlata all energia cinetica delle molecole Il Calore coinvolge un trasferimento di energia tra
ESERCITAZIONE N. 1 Equilibrio di mercato ed elasticità
 MICROCONOMIA CLA A.A. 003-004 ocente: Giacomo Calzolari RCITAZION N. quilibrio di mercato ed elasticità RCIZIO : quilibrio di mercato e sostamenti delle curve La quantità domandata di un certo bene è descritta
MICROCONOMIA CLA A.A. 003-004 ocente: Giacomo Calzolari RCITAZION N. quilibrio di mercato ed elasticità RCIZIO : quilibrio di mercato e sostamenti delle curve La quantità domandata di un certo bene è descritta
Dinamica molecolare. Moto molecolare, energia interna. e conservazione dell'energia
 Dinamica molecolare Moto molecolare, energia interna e conservazione dell'energia Dinamica dei gas La dinamica si applica a corpi di massa ordinaria (i moti sulla Terra) oppure a corpi molto grandi (i
Dinamica molecolare Moto molecolare, energia interna e conservazione dell'energia Dinamica dei gas La dinamica si applica a corpi di massa ordinaria (i moti sulla Terra) oppure a corpi molto grandi (i
A1. Soluzione. Ilcalore Q per unita di massa e negativo (ceduto all esterno) e vale:
 A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
Dal modellino dei Gas perfetti alla Tecnologia del vuoto
 Dal modellino dei Gas erfetti alla ecnologia del vuoto Il gas erfetto è un modellino teorico che ermette di rogettare e dimensionare I sistemi da vuoto, arte tutto dalla relazione: P= Nk (*) P ressione
Dal modellino dei Gas erfetti alla ecnologia del vuoto Il gas erfetto è un modellino teorico che ermette di rogettare e dimensionare I sistemi da vuoto, arte tutto dalla relazione: P= Nk (*) P ressione
Peso atomico (meglio massa atomica)
 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Enunciato di Kelvin-Plank
 ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
L entropia. Marina Cobal - Dipt.di Fisica - Universita' di Udine 1
 L entropia Universita' di Udine 1 L entropia secondo Clausius Prendiamo un ciclo reversibile qualunque ricopriamolo con una rete di adiabatiche i trattini del ciclo li sostituiamo con trattini di isoterme
L entropia Universita' di Udine 1 L entropia secondo Clausius Prendiamo un ciclo reversibile qualunque ricopriamolo con una rete di adiabatiche i trattini del ciclo li sostituiamo con trattini di isoterme
Lezione 24 IL TEOREMA DI BERNOULLI
 unti dei corsi di Idraulica e Idrodinamica Lezione 4 IL TEOREM DI ERNOULLI Nella LEZIONE 3 abbiamo dedotto il teorema di ernoulli er le correnti fluide, artendo dall equazione del moto valida in tali circostanze.
unti dei corsi di Idraulica e Idrodinamica Lezione 4 IL TEOREM DI ERNOULLI Nella LEZIONE 3 abbiamo dedotto il teorema di ernoulli er le correnti fluide, artendo dall equazione del moto valida in tali circostanze.
1) Si deve progettare un auto reattore per un missile che vola a M 1 := 1.8. Supponendo che
 Esercizi di Esame 1.mcd (1/9) 1) Si deve rogettare un auto reattore er un missile che vola a M 1 : 1.8. Suonendo che T 1 : 73.15 K, 1 : 0.7 atm, A : 0.0347 m, A 3 /A 1.34 e che la combustione roduce 196.7kJ/kg.
Esercizi di Esame 1.mcd (1/9) 1) Si deve rogettare un auto reattore er un missile che vola a M 1 : 1.8. Suonendo che T 1 : 73.15 K, 1 : 0.7 atm, A : 0.0347 m, A 3 /A 1.34 e che la combustione roduce 196.7kJ/kg.
1 Ripasso di Termodinamica
 Definizioni Il gas ideale Il primo principio della termodinamica Espansione libera di un gas ideale Energia interna Calori specifici Trasformazioni adiabatiche Il secondo principio della termodinamica
Definizioni Il gas ideale Il primo principio della termodinamica Espansione libera di un gas ideale Energia interna Calori specifici Trasformazioni adiabatiche Il secondo principio della termodinamica
LAVORO DI UN GAS. Espansione di un gas a pressione costante V A V B
 LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
ESERCIZI SULLA DINAMICA DI CORPI RIGIDI.
 ESERCIZI SULL DINMIC DI CRPI RIIDI. Risoluzione mediante equazioni di Lagrange, equilibrio relativo (forze aarenti), stazionarietà del otenziale U; stabilità dell equilibrio e analisi delle iccole oscillazioni.
ESERCIZI SULL DINMIC DI CRPI RIIDI. Risoluzione mediante equazioni di Lagrange, equilibrio relativo (forze aarenti), stazionarietà del otenziale U; stabilità dell equilibrio e analisi delle iccole oscillazioni.
Prova scritta di Fisica Generale I Corso di Laurea in Astronomia 23 giugno 2015
 Prova scritta di Fisica Generale I Corso di Laurea in Astronomia 3 giugno 015 Problema 1 Si consideri un sistema costituito da un cilindro omogeneo di raggio R 1 = 10 cm e altezza h = 0 cm, inserito all
Prova scritta di Fisica Generale I Corso di Laurea in Astronomia 3 giugno 015 Problema 1 Si consideri un sistema costituito da un cilindro omogeneo di raggio R 1 = 10 cm e altezza h = 0 cm, inserito all
Moto Monodimensionale in Condotti
 Diartimento di Ingegneria Industriale Moto Monodimensionale in Condotti Fluido Comrimibile - eoria Fig a Fig B Fig. A Moti D Comrimibili- ermodinamica Scuola di Ingegneria Corso di e Macchine A.A. 3 4
Diartimento di Ingegneria Industriale Moto Monodimensionale in Condotti Fluido Comrimibile - eoria Fig a Fig B Fig. A Moti D Comrimibili- ermodinamica Scuola di Ingegneria Corso di e Macchine A.A. 3 4
Calore, lavoro e trasformazioni termodinamiche (1)
 Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Il I principio della termodinamica. Calore, lavoro ed energia interna
 Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Fisica 1 Anno Accademico 2011/2012
 Matteo Luca Ruggiero DISAT@Politecnico di Torino Anno Accademico 2011/2012 (4 Giugno - 8 Giugno 2012) Sintesi Abbiamo formulato il primo principio della termodinamica che regola gli scambi di calore, la
Matteo Luca Ruggiero DISAT@Politecnico di Torino Anno Accademico 2011/2012 (4 Giugno - 8 Giugno 2012) Sintesi Abbiamo formulato il primo principio della termodinamica che regola gli scambi di calore, la
+2 3 = = =3 + =3 + =8 =15. Sistemi lineari. nelle stesse due incognite. + = + = = = Esempi + =5. Il sistema è determinato
 Sistemi di equazioni SISTEMI LINEARI Un sistema di equazioni è un insieme di equazioni per le quali si cercano eventuali soluzioni comuni. +=7 =1 Ognuna delle due equazioni ha infinite soluzioni. La coppia
Sistemi di equazioni SISTEMI LINEARI Un sistema di equazioni è un insieme di equazioni per le quali si cercano eventuali soluzioni comuni. +=7 =1 Ognuna delle due equazioni ha infinite soluzioni. La coppia
Termodinamica. by R. Pizzoferrato
 ermodinamica Comletiamo il quadro dei fenomeni fisici: cambiamenti di stato? dove finisce l energia ersa in meccanica? nuove grandezze fisiche: emeratura, Calore, ecc Definiamo Sistema ermodinamico: arte
ermodinamica Comletiamo il quadro dei fenomeni fisici: cambiamenti di stato? dove finisce l energia ersa in meccanica? nuove grandezze fisiche: emeratura, Calore, ecc Definiamo Sistema ermodinamico: arte
Capacità termica e calore specifico
 Calori specifici Capacità termica e calore specifico Il calore si trasferisce da un corpo ad un altro fintanto che i corpi sono a temperature differenti. Potremo scrivere quindi: Q = C ΔT = C (T f T i
Calori specifici Capacità termica e calore specifico Il calore si trasferisce da un corpo ad un altro fintanto che i corpi sono a temperature differenti. Potremo scrivere quindi: Q = C ΔT = C (T f T i
ALIMENTAZIONE PIU CONVENIENTE (CON MINORI PERDITE) DI UN CARICO CON UN SOLO TRASFORMATORE O CON DUE TRASFORMATORI IN PARALLELO
 ALIMETAZIOE IU COVEIETE (CO MIORI ERDITE) DI U CARICO CO U SOLO TRASFORMATORE O CO DUE TRASFORMATORI I ARALLELO La condizione iù conveniente è quella er la quale sono minori le erdite totali (nel ferro
ALIMETAZIOE IU COVEIETE (CO MIORI ERDITE) DI U CARICO CO U SOLO TRASFORMATORE O CO DUE TRASFORMATORI I ARALLELO La condizione iù conveniente è quella er la quale sono minori le erdite totali (nel ferro
A.A CORSO DI ALGEBRA 1. PROFF. P. PIAZZA, E. SPINELLI. SOLUZIONE ESERCIZI FOGLIO 5.
 A.A. 2015-2016. CORSO DI ALGEBRA 1. PROFF. P. PIAZZA, E. SPINELLI. SOLUZIONE ESERCIZI FOGLIO 5. Esercizio 5.1. Determinare le ultime tre cifre di n = 13 1625. (Suggerimento. Sfruttare il Teorema di Eulero-Fermat)
A.A. 2015-2016. CORSO DI ALGEBRA 1. PROFF. P. PIAZZA, E. SPINELLI. SOLUZIONE ESERCIZI FOGLIO 5. Esercizio 5.1. Determinare le ultime tre cifre di n = 13 1625. (Suggerimento. Sfruttare il Teorema di Eulero-Fermat)
ESERCIZIO (12) ( ) ( ) J ( ) ( )
 onsideriamo una mole di gas perfetto monoatomico che compie il ciclo di figura (motore di Stirling), composto da due isoterme ( e ) e ESEIZIO (1) due trasformazioni a volume costante ( e ). alcolare: il
onsideriamo una mole di gas perfetto monoatomico che compie il ciclo di figura (motore di Stirling), composto da due isoterme ( e ) e ESEIZIO (1) due trasformazioni a volume costante ( e ). alcolare: il
FISICA. V [10 3 m 3 ]
![FISICA. V [10 3 m 3 ] FISICA. V [10 3 m 3 ]](/thumbs/24/2838543.jpg) Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Lez 14 16/11/2016. Lezioni in didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617
 Lez 14 16/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Esperienza di Joule E. Fiandrini Fis. Sper. e 2 Esperienza di Joule
Lez 14 16/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Esperienza di Joule E. Fiandrini Fis. Sper. e 2 Esperienza di Joule
Liceo Scientifico Statale G. Stampacchia. Tricase
 Temo di lavoro Liceo Scientifico Statale G. Stamacchia 60 minuti Tricase Oggetto: Comito di Fisica Classe D Soluzione Pr1 Pr Pr3 Pr4 Tema: Dinamica: Alicazioni del secondo e del terzo rinciio Conservazione
Temo di lavoro Liceo Scientifico Statale G. Stamacchia 60 minuti Tricase Oggetto: Comito di Fisica Classe D Soluzione Pr1 Pr Pr3 Pr4 Tema: Dinamica: Alicazioni del secondo e del terzo rinciio Conservazione
Soluzioni del problema 14.21
 Soluzioni del problema 1421 Con ulteriori indicazioni sulle trasformazioni Sommario Riportiamo le soluzioni del problema, con considerazioni didattiche, per dare indicazioni su altre trasformazioni, non
Soluzioni del problema 1421 Con ulteriori indicazioni sulle trasformazioni Sommario Riportiamo le soluzioni del problema, con considerazioni didattiche, per dare indicazioni su altre trasformazioni, non
ESERCIZIO 1: Vincolo di bilancio lineare
 Microeconomia rof. Barigozzi ESERCIZIO 1: Vincolo di bilancio lineare Si immagini un individuo che ha a disosizione un budget di 500 euro e deve decidere come allocare tale budget tra un bene, che ha un
Microeconomia rof. Barigozzi ESERCIZIO 1: Vincolo di bilancio lineare Si immagini un individuo che ha a disosizione un budget di 500 euro e deve decidere come allocare tale budget tra un bene, che ha un
# STUDIO DELLA STABILITA COL CRITERIO DI NYQUIST#
 # STUIO ELLA STABILITA COL CRITERIO I NYQUIST# Sia il olinomio di variabile comlessa s : Q(s)=a n s n +a n-1 s n-1 + +a 1 s+a 0 (1) Tale olinomio si uo considerare, con riferimento al iano comlesso (iano
# STUIO ELLA STABILITA COL CRITERIO I NYQUIST# Sia il olinomio di variabile comlessa s : Q(s)=a n s n +a n-1 s n-1 + +a 1 s+a 0 (1) Tale olinomio si uo considerare, con riferimento al iano comlesso (iano
Chimica Fisica - Esercizi AA Rev. 2
 Chimica Fisica - Esercizi AA 2017-18 Rev. 2 Mirco Zerbetto, Antonino Polimeno htt://www.chimica.unid.it/antonino.olimeno Diartimento di Scienze Chimiche Università degli Studi di Padova 2 Indice 1 Nozioni
Chimica Fisica - Esercizi AA 2017-18 Rev. 2 Mirco Zerbetto, Antonino Polimeno htt://www.chimica.unid.it/antonino.olimeno Diartimento di Scienze Chimiche Università degli Studi di Padova 2 Indice 1 Nozioni
I liquidi. Viscosità Energia superficiale Pressione di vapore Temperatura di fusione Temperatura di ebollizione. Liquidi puri (proprietà) Liquidi
 I liquidi Liquidi puri (proprietà) Viscosità Energia superficiale ressione di vapore emperatura di fusione emperatura di ebollizione Liquidi Soluzioni (proprietà) Liquido id + Liquidoid Liquido + Gas Liquido
I liquidi Liquidi puri (proprietà) Viscosità Energia superficiale ressione di vapore emperatura di fusione emperatura di ebollizione Liquidi Soluzioni (proprietà) Liquido id + Liquidoid Liquido + Gas Liquido
Termodinamica. Francesco Lai. Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari
 Termodinamica Francesco Lai Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari Solubilità La solubilità di una sostanza (farmaco) ad
Termodinamica Francesco Lai Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari Solubilità La solubilità di una sostanza (farmaco) ad
Chimica Fisica - Esercizi AA
 Chimica Fisica - Esercizi AA 2017-18 Mirco Zerbetto, Antonino Polimeno htt://www.chimica.unid.it/antonino.olimeno Diartimento di Scienze Chimiche Università degli Studi di Padova 2 Indice 1 Nozioni di
Chimica Fisica - Esercizi AA 2017-18 Mirco Zerbetto, Antonino Polimeno htt://www.chimica.unid.it/antonino.olimeno Diartimento di Scienze Chimiche Università degli Studi di Padova 2 Indice 1 Nozioni di
Primo principio della termodinamica
 Primo riniio della termodinamia Priniio di equivalenza Due ori a temeratura diversa, in ontatto, raggiungono l'equilibrio termio Durante il ontatto, il "alore" si trasferise dal oro iù aldo al oro iù freddo
Primo riniio della termodinamia Priniio di equivalenza Due ori a temeratura diversa, in ontatto, raggiungono l'equilibrio termio Durante il ontatto, il "alore" si trasferise dal oro iù aldo al oro iù freddo
delle temperature iniziale e finale analogia con l energia potenziale in meccanica la funzione U e detta energia interna
 Lavoro adiabatico e calore, esperimenti di Joule si puo innalzare la temperatura dell acqua in un calorimetro anche effettuando lavoro senza scambiare calore ( lavoro adiabatico ) i risultati sperimentali
Lavoro adiabatico e calore, esperimenti di Joule si puo innalzare la temperatura dell acqua in un calorimetro anche effettuando lavoro senza scambiare calore ( lavoro adiabatico ) i risultati sperimentali
Per quanto detto prima il fenomeno di svuotamento termina quando la pressione di ristagno è pari a:
 Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Dalla legge dei gas perfetti si ha il rapporto tra il numero di moli dei due gas R T 1 V 2 P V 1. =n 1. RT 2 =V 2 qundi: n 1 = T 2. =n 2.
 Compito intercorso Fisica II ICI 1 giugno 2006 1 Due recipienti uguali, isolati termicamente dall'ambiente esterno, sono connessi da un condotto con un rubinetto, inizialmente chiuso. Uno dei recipienti
Compito intercorso Fisica II ICI 1 giugno 2006 1 Due recipienti uguali, isolati termicamente dall'ambiente esterno, sono connessi da un condotto con un rubinetto, inizialmente chiuso. Uno dei recipienti
Fondamenti di Meteorologia e Climatologia
 Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica Mod. 2 CHIMICA FISICA. Lezione 7
 Università egli stui i MILANO Facoltà i AGRARIA El. i Chimica e Chimica Fisica Mo. CHIMICA FIICA Lezione 7 Anno Accaemico 000-0 Docente: Dimitrios Fessas Prorietà i equilibrio ei sistemi a iù comonenti
Università egli stui i MILANO Facoltà i AGRARIA El. i Chimica e Chimica Fisica Mo. CHIMICA FIICA Lezione 7 Anno Accaemico 000-0 Docente: Dimitrios Fessas Prorietà i equilibrio ei sistemi a iù comonenti
ESERCIZI DI TERMODINAMICA
 ESERCIZI DI TERMODINAMICA Un otore a cobustione eroga una otenza effettiva di k con un rendiento totale del 8% Il cobustibile utilizzato ha un otere calorifico inferiore di 000 k Calcolare la assa di cobustibile
ESERCIZI DI TERMODINAMICA Un otore a cobustione eroga una otenza effettiva di k con un rendiento totale del 8% Il cobustibile utilizzato ha un otere calorifico inferiore di 000 k Calcolare la assa di cobustibile
Leggi dei gas Equazione di stato dei gas perfetti
 Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
Principio di induzione: esempi ed esercizi
 Principio di induzione: esempi ed esercizi Principio di induzione: Se una proprietà P n dipendente da una variabile intera n vale per n e se, per ogni n N vale P n P n + allora P vale su tutto N Variante
Principio di induzione: esempi ed esercizi Principio di induzione: Se una proprietà P n dipendente da una variabile intera n vale per n e se, per ogni n N vale P n P n + allora P vale su tutto N Variante
IL CICLO DI CARNOT. Scambi di energia durante il ciclo
 IL CICLO DI CNO Consideriamo un gas ideale, contenuto nel solito cilindro, che compie un ciclo di 4 trasformazioni reversibili (2 isoterme + 2 adiabatiche) rappresentate nel piano -p come in figura. cambi
IL CICLO DI CNO Consideriamo un gas ideale, contenuto nel solito cilindro, che compie un ciclo di 4 trasformazioni reversibili (2 isoterme + 2 adiabatiche) rappresentate nel piano -p come in figura. cambi
Primo principio della Termodinamica
 rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
ESAME DI AMMISSIONE ALLA TERZA LICEO SCIENZE SPERIMENTALI: FISICA
 LICO CANTONAL DI LUGANO 2 SAM DI AMMISSION ALLA TRZA LICO SCINZ SRIMNTALI: FISICA COGNOM: NOM:...... RONINZA SCOLASTICA:. unti esercizi 1 2 3 TOT 18 4 3 25 unti fatti Nota SRCIZIO 1 Annerire o crociare
LICO CANTONAL DI LUGANO 2 SAM DI AMMISSION ALLA TRZA LICO SCINZ SRIMNTALI: FISICA COGNOM: NOM:...... RONINZA SCOLASTICA:. unti esercizi 1 2 3 TOT 18 4 3 25 unti fatti Nota SRCIZIO 1 Annerire o crociare
Problemi di Fisica. Equilibrio Fluidi
 Problemi di isica Equilibrio luidi Comleta la seguente tabella: orza (N) 10 0 80 uerficie (m ) 1 5 4 Pressione (bar) 10 50 5 Tenendo resente la definizione di ressione: e le sue formule inverse: forza
Problemi di isica Equilibrio luidi Comleta la seguente tabella: orza (N) 10 0 80 uerficie (m ) 1 5 4 Pressione (bar) 10 50 5 Tenendo resente la definizione di ressione: e le sue formule inverse: forza
Chimica Fisica - Esercizi AA
 Chimica Fisica - Esercizi AA 2014-15 Mirco Zerbetto, Antonino Polimeno htt://www.chimica.unid.it/antonino.olimeno Diartimento di Scienze Chimiche Università degli Studi di Padova 2 Indice 1 Nozioni di
Chimica Fisica - Esercizi AA 2014-15 Mirco Zerbetto, Antonino Polimeno htt://www.chimica.unid.it/antonino.olimeno Diartimento di Scienze Chimiche Università degli Studi di Padova 2 Indice 1 Nozioni di
Elettromagnetismo. Prof. Francesco Ragusa Università degli Studi di Milano. Lezione n
 Elettromagnetismo Prof. Francesco Ragusa Università degli Studi di Milano Lezione n. 14 30.11.2018 Sfera di dielettrico polarizzata Carica puntiforme e semispazio dielettrico Energia elettrostatica Anno
Elettromagnetismo Prof. Francesco Ragusa Università degli Studi di Milano Lezione n. 14 30.11.2018 Sfera di dielettrico polarizzata Carica puntiforme e semispazio dielettrico Energia elettrostatica Anno
Elettromagnetismo. Prof. Francesco Ragusa Università degli Studi di Milano. Lezione n
 Elettromagnetismo Prof. Francesco Ragusa Università degli Studi di Milano Lezione n. 6 18.10.2017 Divergenza e teorema della divergenza Forma differenziale della Legge di Gauss Energia del campo elettrostatico
Elettromagnetismo Prof. Francesco Ragusa Università degli Studi di Milano Lezione n. 6 18.10.2017 Divergenza e teorema della divergenza Forma differenziale della Legge di Gauss Energia del campo elettrostatico
Le derivate parziali in termodinamica
 Capitolo 2 Le derivate parziali in termodinamica 2.1 La derivata di funzioni ad una variabile Sia f una funzione di una sola variabile La sua derivata è definita come f f(x (2.1 S(x = df dx = lim f(x +
Capitolo 2 Le derivate parziali in termodinamica 2.1 La derivata di funzioni ad una variabile Sia f una funzione di una sola variabile La sua derivata è definita come f f(x (2.1 S(x = df dx = lim f(x +
6. I GAS IDEALI. 6.1 Il Gas perfetto
 6. I GAS IDEALI 6. Il Gas erfetto Il gas erfetto o ideale costituisce un modello astratto del comortamento dei gas cui tendono molti gas reali a ressioni rossime a quella atmosferica. Questo modello di
6. I GAS IDEALI 6. Il Gas erfetto Il gas erfetto o ideale costituisce un modello astratto del comortamento dei gas cui tendono molti gas reali a ressioni rossime a quella atmosferica. Questo modello di
