REAZIONI PERICICLICHE
|
|
|
- Alice Giannini
- 9 anni fa
- Visualizzazioni
Transcript
1 EAZINI PEICICLICE eazioni concertate che prevedono la formazione e la rottura simultanea di due o più legami mediante uno stato di transizione ciclico. Il prodotto di queste reazioni può essere un sistema ciclico o aperto Le reazioni pericicliche sono reversibili Le principali reazioni pericicliche sono: EAZINI DI CICLADDIZINE (CICLEVESINE) EAZINI ELETTCICLICE EAZINI SIGMATPICE () ' ' ()
2 TEIA DEGLI BITALI DI FNTIEA Consente una trattazione semplificata delle interazioni orbitaliche che portano alla rottura e alla formazione di nuovi legami durante una reazione chimica. In pratica il decorso della reazione viene analizzato prendendo in considerazione solo gli orbitali di frontiera che sono così caratterizzati: M: ighest ccupied Molecular rbital rbitale molecolare occupato a energia più elevata LUM: Lowest Unoccupied Molecular rbital rbitale molecolare non occupato a energia più bassa a) ALCENI π LUM π M b) SISTEMI ALLILICI CATINE ANINE LUM LUM 0.7 M M
3 c) DIENI LUM M d) ALCANI - SISTEMI CN LEGAMI δ LUM σ M σ
4 INTEAZINE DI BITALI DI FNTIEA L utilizzo degli orbitali di frontiera consente una trattazione semplificata della interazione molecolare La teoria della perturbazione: quando si ha formazione di uno o più legami, il massimo guadagno energetico si ottiene per interazione di orbitali pieni con orbitali vuoti dei reagenti M LUM M LUM E a E b Il massimo guadagno energetico si ha con interazioni M-LUM (2E a > 2E b ) Interazioni M-M costringono 2 elettroni a disporsi su un orbitale antilegante ad elevata energia. Le variazioni di energia che si determinano in una reazione si possono calcolare tramite l Equazione di Klopman (semplificata): E = - Q A Q B ε AB 2 (C A C B β) 2 E M - E LUM E Q A e Q B AB C A e C B E M E LUM guadagno energetico della reazione carica reagente A e B distanza tra atomi interagenti coefficienti dell orbitale molecolare energie degli orbitali homo-lumo
5 Il guadagno energetico aumenta quanto minore è la differenza di energia M- LUM. Quando due molecole reagiscono, le interazioni principali sono di 3 tipi: 1. gli orbitali occupati (leganti) si respingono 2. cariche di segno opposto si attraggono 3. tutti gli orbitali occupati (specialmente M) interagiscono con quelli non occupati (specialmente LUM) attraendosi.
6 CICLADDIZINI E CICLEVESINI Vengono suddivise sulla base del tipo di legame (π, σ) coinvolto; del numero di elettroni (2, 4 ) e della geometria (suprafaciale, antarafaciale) con la quale le molecole interagiscono. CICLADDIZINI [2 2] a) EAZINE [π2 s π2 s ] Il sistema π di ciascuna molecola reagisce in maniera suprafaciale: LUM repulsione PIBITA M La reazione è proibita allo stato fondamentale poiché l interazione tra due orbitali nello stato di transizione è di tipo antilegante. Se un elettrone viene fatto passare sull orbitale LUM per mezzo di una radiazione elettromagnetica (reazione fotochimica) il processo diventa possibile nello stato eccitato. In questo caso è possibile un interazione di tipo SM-LUM. SM: Single ccupied Molecular rbital LUM LUM hν SM PEMESSA M
7 b) EAZINE [π2 s π2 a ] L approccio delle due molecole non è coplanare ma si sviluppa su due piani ortogonali: M LUM Questo tipo di interazione si chiama SUPAFACIALE-ANTAAFACIALE ed è una reazione permessa per simmetria allo stato fondamentale. Essa è però poco probabile su alcheni comuni a causa della elevata distorsione richiesta durante l approccio. c) EAZINE [π2 a π2 a ] E una reazione proibita per simmetria nello stato fondamentale. Inoltre prevede una doppia distorsione delle molecole interagenti: repulsione M repulsione LUM Sulla base di queste considerazioni è possibile ricavare delle regole di selezione che sulla base del numero di elettroni messi in gioco durante la reazione permette di sapere se la reazione è permessa allo stato fondamentale o in quello eccitato.
8 EGLE DI SELEZINE m n Permessa (st. fond.) Proibita (st. eccit) Permessa (st. eccit.) Proibita (st. fond.) 4 q SUPA-ANTAA ANTAA-SUPA 4 q 2 SUPA-SUPA ANTAA-ANTAA SUPA-SUPA ANTAA-ANTAA SUPA-ANTAA ANTAA-SUPA m n = numero elettroni π totali Se gli alcheni utilizzati per la reazione hanno dei requisiti stereochimici definiti questi si rifletteranno sulla stereochimica del prodotto (reazione stereospecifica) Ad esempio: etilene cis 2-butene 3 C C 3 π 2 s π 2 s SUPA ETILENE SUPA 2-BUTENE hν 3 C C 3 CIS 3 C C 3 π 2 s π 2 a SUPA ETILENE ANTAA 2-BUTENE 3 C C 3 TANS In maniera analoga: ANTAA ETILENE SUPA 2-BUTENE CIS ANTAA ETILENE ANTAA 2-BUTENE TANS
9 Esempio sintetico di π2 s π2 s: C 3 hν C 3 CuTf reazioni antarafaciali sono possibili solo in sistemi che impongono una torsione del doppio legame: π 2s π 2s π 2s π 2a 1,5-cicloottadiene Anche alleni e cheteni hanno un sistema p distorto che può favorire reazioni antarafaciali. Interazione LUM CETENE-M LEFINA. π2 s π2 a interazioni secondarie interazioni M-LUM Gli orbitali π del carbonio sp sono ortogonali quindi l allene si comporta come un legame π semplice. Il sistema sp non ha sostituenti e ha una bassa richiesta sterica. Le interazioni secondarie abbassano l energia del processo. I cheteni alogenati sono più reattivi (LUM a più bassa energia). La stereochimica prevedibile è la seguente:
10 L CIS C SFAVITA S L L C TANS FAVITA S L CICLADDIZINI [4 2] Questo processo rappresenta una classica reazione di Diels-Alder. E un processo π4 s π2 s L interazione più favorevole è di solito M-DIENE con LUM-ALCENE: LUM M Perché la reazione sia possibile il diene deve poter adottare una conformazione di tipo s-cis non reagisce s-trans reagisce s-cis
11 Quando i sostituenti si trovano fuori dal sistema π la reazione risulta essere più veloce per un minor ingombro sterico nello stato di transizione. più reattivo di Dienofili sostituiti possono dare prodotti ES o END. Il prodotto END è più ingombrato però è favorito. (EGLA DI ALDE) ES-lenta termodinamicamente più stabile END-veloce termodinamicamente meno stabile Le interazioni secondarie sono probabilmente reaponsabili della selettività osservata: M interazioni primarie interazioni secondarie LUM
12 Le reazioni di Diels-Alder non presentano effetto solvente (non ci sono intermedi carichi, si usa benzene o toluene). STEECIMICA: come tutte le reazioni pericicliche che sono concertate, la reazione di Diels-Alder è stereospecifica. C 2 Me C 2 Me C 2 Me Me 2 C C 2 Me C 2 Me C 2 Me C 2 Me Ac C 2 Me 90 C Ac C 2 Me Ac Ac La natura dei sostituenti influenza enormemente la velocità e l efficienza della reazione. In generale secondo la teoria degli orbitali di frontiera: - gruppi elettronattrattori: abbassano E M-LUM ; - gruppi elettrondonatori: aumentano E M-LUM. Questo principio è di carattere generale e quindi valido PE TUTTE LE EAZINI CIMICE, non solo per quelle pericicliche. La reazione di Diels-Alder è quindi favorita da: gruppi elettrondonatori sul diene gruppi elettronattrattori sul dienofilo.
13 E L L L L L L Z X Energie degli orbitali di frontiera di vari dienofili: 3.0 E (ev) LUM C Z X M C=, C=C 2 Z= C ; CN; N 2 ; C X = Me; Me 2 N; Me L esempio seguente illustra chiaramente l effetto pronunciato dei sostituenti nella reazione di Diels-Alder:
14 165 C - 17 h 900 atm - 78% 20 C - 24 h 100 % Effetto di sostituzione in C-1 nei dieni. 2.5 E (ev) LUM M C Z X La sostituzione in C-2 produce lo stesso effetto ma di minore intensità. Ciò avviene perché i coefficienti degli orbitali centrali sono più piccoli rispetto a quelli dei carboni terminali (vedere equazione di Klopman) M - 0.6
15 EGISELETTIVITA Nell interazione M-LUM è favorito il legame tra atomi che hanno coefficienti di grandezza simile (grande-grande o piccolo-piccolo). X Z LUM DIENFIL C X Z M DIENE C X Z Ciò favorisce lo sviluppo di reazioni maggiormente regioselettive com e si può vedere dai seguenti esempi: 8 : 1 20 : 1
16 Me C Me C Me CATALISI La reazione di Diels-Alder è catalizzata da acidi di Lewis: C 2 Me C 2 Me C 2 Me CNDIZINI: 120 C /6h AlCl 3 / 20 C / 6 h 95 5 L acido di Lewis non funziona solo da catalizzatore poiché influenza anche la distribuzione dei prodotti. Quando sul dienofilo sono presenti dei gruppi carbonilici l acido di Lewis ha un duplice effetto: 1- abbassa l energia del LUM dienofilo 2- diminuisce il valore del coefficiente orbitalico sul carbonio in α al C=. AlCl 3 AlCl 3
17 E (ev) FATTE 1: reazione più veloce FATTE 2: reazione più regioselettiva. EATTIVITA Me N 2 Et 2 25 C 85% N 2 S 2 S C 94% P 3 P 3 96% Si Me C 6 6 Si Me C 3 C 72% Br Br Zn-Ag 74% C 3 Si Et 2 AlCl C Si 3 62%
18 EAZINI ELETTCICLICE Prevedono la formazione di un legame singolo agli estremi di un sistema lineare contenente k elettroni π e naturalmente il processo inverso. K π K 2 π a) eazione butadiene ciclobutene La reazione di chiusura (o apertura se si considera il processo inverso) può avvenire con due distinti meccanismi: Movimento CNTATI dei legami terminali nel quale il senso di rotazione è lo stesso. Movimento DISTATI con un senso di rotazione opposto. conrorotatoria M δ PEMESSA disrorotatoria LUM δ PIBITA Allo stato fondamentale è permessa unicamente la reazione conrotatoria perché il legame del sistema ciclobutenico finale è di tipo legante (M δ). In maniera analoga il ciclobutene si convertirà un butadiene solo attraverso un processo di apertura conrotatorio
19 EGLE DI SELEZINE: K Permesse (termiche) Proibite (fotochimiche) Proibite (termiche) Permesse (fotochimiche) 4 q CNTATIE DISTATIE 4 q 2 DISTATIE CNTATIE K = numero elettroni π; q = 0, 1, 2, 3 Chiusura dell 1,3,5-esatriene 1,3-cicloesadiene: L analisi degli orbitali di frontiera da il seguente risultato: LUM π conrotatoria PIBITA M (2 nodi) LUM δ LUM π disrotatoria PEMESSA M M δ
20 Le reazioni elettrocicliche possono essere applicate anche a sistemi ionici: disrotatorio conrotatorio conrotatorio Implicazioni di tipo stereochimico: CIS-TANS CIS CIS-CIS TANS TANS-TANS Si forma solo prodotto TANS-TANS per ragioni steriche.
21 CICLADDIZINI 1,3-DIPLAI Sono reazioni [π 4s π 2s] permesse per simmetria, danno luogo alla formazione di anelli a 5 termini. dipolo a b d e c a b c d e dipolarofilo 1,3-dipoli sono isoelettronici con l anione allile: NITILE SSID C N C N AZIDI N N N N N N DIAZMETAN 2 C N N 2 C N N NITNI C N C N NITILE IMMINE C N N C N N Per reazioni concertate queste reazioni sono stereospecifiche: C 3 7 C 3 7 N N N N N N N N N 3 C C 3 7 FENILAZIDE 3 C C 3 7
22 eazioni a stadi possono infatti comportare rotazioni che possono compromettere i requisiti stereochimici della reazione: C N N N Considerando le interazioni M-LUM: M N N N N LUM LUM M La situazione nelle reazioni 1,3-dipolari è più articolata rispetto alle Diels-Alder. Vediamo il caso del diazometano con vari dipolarofili: 3.0 E (ev) C N N C - Z X 2 C N N - 2 C N N
23 Le reazioni 1,3-dipolari possono in funzione della natura dei reagenti essere M o LUM controllate Sostituenti elettronattrattori: M DIPL -LUM LEFINA ; Sostituenti elettrondonatori: M LEFINA -LUM DIPL. N N N - k vel N N N LUM M N C 2 Me log k vel C 2Me? E M
24 EGISELETTIVITA E opportuno considerare i coefficienti orbitalici negli orbitali di frontiera. Cambiando la natura dell interazione si possono avere considerevoli cambiamenti nella regioselettività del processo fino ad avere una inversione della stessa. M LUM E (ev) E (ev) N N N azide (-11.5) N N N (0.1) N N N C N (-9.7) 2 C N (-0.5) 2 C N nitrone C N N (-9.0) 2 C N N (1.8) 2 C N N diazoalcano C N (-11.0) C N (-0.5) C N nitrile ossido
25 I coefficienti M-LUM dei dipolarofili sono così caratterizzati: LUM C Z X M C Z X L L L L Controllo LUM Controllo M 3 C C N 3 C C N C 3 CMe C 3 MeC C 3 3 C N N C 3 Da notare: nelle Diels-Alder è preferibile la reazione tra dieni elettronricchi e dienofili elettronpoveri; nelle 1,3-dipolari la reazione può essere favorita da entrambe le combinazioni.
26 L ingombro sterico presente nei substrati può modificare la regiochimica rispetto a quella prevedibile sulla base di semplici considerazioni orbitaliche C N Y Y Y 5 N 4 2-isossazoline N Y 5 4 C 6 5 CMe 95 5 C 6 5 Bu S Cl Cl Applicazioni sintetiche: a) C 3 N N C3 N
27 b) N S N S N Zn Ac N S S c) ' C N N '
28 EAZINI SIGMATPICE iguardano la riorganizzazione concertata di elettroni durante la quale un gruppo attaccato attraverso un legame σ migra su un legame più lontano attraverso un legame π coniugato: [3,3] D 4 5 D [1,5] D D Le reazioni sigmatropiche vengono identificate con due numeri che a partire dagli atomi del legame che si rompe vanno agli atomi che andranno acostituire il nuovo legame. MIGAZINE DI IDGENI: a) Migrazione di tipo [1,3]: Anche in questo caso la migrazione può avvenire in due maniere distinte: suprafaciale o antarafaciale: SUPA PIBITA! SUPA M LUM ANTAA ANTAA PEMESSA!
29 eazioni [1,3] ANTAA sono teoricamente possibili ma sono in pratica impedite da fattori sterici. Nello stato eccitato: SUPA PEMESSA! SUPA LUM SM ANTAA ANTAA PIBITA! In definitiva quindi le [1,3] possono avvenire solo SUPA [ragioni steriche] e nello stato eccitato [l unico permesso per simmetria]. b) Migrazione di tipo [1,5]: LUM PEMESSA S SUPA A M ANTAA PIBITA
30 c) Migrazione di tipo [1,7] ANTAA PEMESSA La [1,7] SUPAFACIALE è proibita, quella ANTAA è permessa e avviene in pratica perché il sistema contiene più atomi e quindi a causa della sua maggiore flessibilità consente all atomo che migra di trovarsi nella posizione corretta per la formazione del nuovo legame: [1,7] Se il sistema è chiuso in un ciclo l ANTAAFACIALE non può più avvenire e quindi allo stato fondamentale avviene la [1,5] SUPA permessa: [1,5] 5 C [1,7] C 3 7 C 3 Una conferma che le [1,5] sono SUPA si può avere esaminando queste evidenze sperimentali: Me D Me s Et 250 C Me D Me Et
31 La migrazione di idrogeno avviene in maniera stereospecifica: da uno stereocentro di tipo S si forma un nuovo stereocentro di tipo. Ciò è possibile esclusivamente con una reazione suprafaciale. Questo triene è stabile e non si converte in toluene perché l unica maniera con la quale può avvenire il processo è attraverso delle reazioni [1,3] o [1,7] SUPA le quali sono proibite allo stato fondamentale. La [1,7] ANTAA non può avvenire per la rigidità dell anello. [1,3] o [1,7] C 3 EGLE DI SELEZINE 1 j SUPA ANTAA 4 n TEMICA PIBITA FTCIMICA PEMESSA 4 n 2 TEMICA PEMESSA FTCIMICA PIBITA TEMICA PEMESSA FTCIMICA PIBITA TEMICA PIBITA FTCIMICA PEMESSA 2. MIGAZINI AL CABNI IAANGIAMENTI [3,3]: CPE E CLAISEN Sono riarrangiamenti permessi per simmetria allo stato fondamentale Il riarrangiamento di CPE è un processo reversibile: 275 C CEt CEt
32 Permesso termicamente allo stato fondamentale, passa attraverso uno stato di transizione a sedia 2' 1 M 1' 3 LUM 3' 2 Eventuali sostituenti presenti nel sistema si dispongono in maniera equatoriale in modo da minimizzare le interazioni relative. 3 C 3 C () C 3 (E) C 3 C 3 C 3 3 C (Z) 13% C 3 () (E) C 3 87% (S) C 3 A causa della reversibilità di queste reazioni viene favorita la formazione dell isomero termodinamicamente più stabile. 350 C Tensioni di anello abbassano l energia richiesta per il processo: - 40 C
33 Metalli di transizione (Pd 2 ) catalizzano la reazione ma in questo caso essa non è più una reazione periciclica poiché avviene a stadi. Pd 2 Pd 2 Pd 2 = PdCl 2 (C 3 CN) 2 Se in posizione 3 c è un ossigeno carico negativamente si osserva un aumento consistente nella velocità del processo. La reazione corrispondente prende il nome di XY-CPE. XY-CPE ANINICA K TF 98% K 75% 25 C Il IAANGIAMENT DI CLAISEN è analogo alla CPE:
34 Il meccanismo è simile: La reazione di CLAISEN è stata studiata originariamente su aril allil eteri: Se entrambe le posizioni orto sono occupate da sostituenti si hanno due reazioni di Claisen consecutive : ' ' ' ' La reazione su allil vinil eteri è uno dei processi più utilizzati su sistemi lineari: Me 125 C
35 Metodo ortoestere (eazione di Claisen- Johnson): C 3 C(C 3 ) 3 3 C C 3 (-C 3 ) C 3 C 3 C 3
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Reazioni Stereospecifiche e Stereoselettive
 Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Alcheni: : struttura e reattività. Alcheni. Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n. H 2n. Alcheni in biologia
 Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
CHIMICA ORGANICA II. Fabrizio Mancin
 Università U di of Padova T Chimica rganica II CIMICA RGANICA II Fabrizio Mancin Dipartimento di Scienze Chimiche Edificio Chimica rganica, II Piano, Stanza 5 tel. 049 8275666, e-mail: [email protected],
Università U di of Padova T Chimica rganica II CIMICA RGANICA II Fabrizio Mancin Dipartimento di Scienze Chimiche Edificio Chimica rganica, II Piano, Stanza 5 tel. 049 8275666, e-mail: [email protected],
Alcheni: struttura e proprietà
 Chimica Organica Informazione Scientifica sul Farmaco Alcheni: struttura e proprietà Organic Chemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: struttura degli alcheni nomenclatura proprietà fisiche
Chimica Organica Informazione Scientifica sul Farmaco Alcheni: struttura e proprietà Organic Chemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: struttura degli alcheni nomenclatura proprietà fisiche
CHIMICA ORGANICA II. Fabrizio Mancin
 IMIA RGANIA II Fabrizio Mancin Dipartimento di Scienze himiche Edificio himica rganica, II Piano, Stanza 5 tel. 049 8275666, e-mail: [email protected], http://www.chimica.unipd.it/fabrizio.mancin/
IMIA RGANIA II Fabrizio Mancin Dipartimento di Scienze himiche Edificio himica rganica, II Piano, Stanza 5 tel. 049 8275666, e-mail: [email protected], http://www.chimica.unipd.it/fabrizio.mancin/
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
CHIMICA ORGANICA II. Corso di laurea in CHIMICA (LT)
 IMIA RGAIA II orso di laurea in IMIA (LT) Esercitazione n. 4 - Formazione di legami - (I) 1. Scrivere i prodotti delle seguenti reazioni indicare il nuovo legame carbonio-carbonio formato ed identificare
IMIA RGAIA II orso di laurea in IMIA (LT) Esercitazione n. 4 - Formazione di legami - (I) 1. Scrivere i prodotti delle seguenti reazioni indicare il nuovo legame carbonio-carbonio formato ed identificare
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
un legame covalente due legami covalenti? tre legami covalenti due legami covalenti un legame covalente
 e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
COMPOSTI AROMATICI POLICICLICI
 CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Aromaticità. Addizione elettrofila alcheni
 Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
LA STRUTTURA DELLE MOLECOLE. Le Molecole Poliatomiche
 LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
Configurazione. Conformazione
 Configurazione Posizione relativa degli atomi nello spazio che caratterizza un particolare stereoisomero Sono in numero limitato (in genere 2) Conformazione Particolare geometria di una molecola che dipende
Configurazione Posizione relativa degli atomi nello spazio che caratterizza un particolare stereoisomero Sono in numero limitato (in genere 2) Conformazione Particolare geometria di una molecola che dipende
Alchini. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alchini Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alchini Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Reazioni di decomposizione
 Reazioni di decomposizione Uno ione ad elett.. dispari Ione a elett.. pari + radicale Uno ione ad elett.. dispari Ione a elett.. dispari + molecola neutra Uno ione ad elett.. pari Ione a elett.. pari +
Reazioni di decomposizione Uno ione ad elett.. dispari Ione a elett.. pari + radicale Uno ione ad elett.. dispari Ione a elett.. dispari + molecola neutra Uno ione ad elett.. pari Ione a elett.. pari +
Composti organici del silicio
 Composti organici del silicio e B C N O F Ne P S Ar Br Kr : 1s 2 2s 2 2p 6 3s 2 3p 2 3d 0 Il silicio è un elemento della seconda riga della tavole periodica, è più grande, meno elettronegativo e più polarizzabile
Composti organici del silicio e B C N O F Ne P S Ar Br Kr : 1s 2 2s 2 2p 6 3s 2 3p 2 3d 0 Il silicio è un elemento della seconda riga della tavole periodica, è più grande, meno elettronegativo e più polarizzabile
IDROCARBURI I ALCANI ANALISI CONFORMAZIONALE
 IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
Teoria dell Orbitale Molecolare
 Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
CHIMICA ORGANICA II. Fabrizio Mancin
 CIMICA RGANICA II Fabrizio Mancin Dipartimento di Scienze Chimiche Edificio Chimica rganica, II Piano, Stanza 5 tel. 049 8275666, e-mail: [email protected], http://www.chimica.unipd.it/fabrizio.mancin/
CIMICA RGANICA II Fabrizio Mancin Dipartimento di Scienze Chimiche Edificio Chimica rganica, II Piano, Stanza 5 tel. 049 8275666, e-mail: [email protected], http://www.chimica.unipd.it/fabrizio.mancin/
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
Corso di Laurea in CTF Esame di CHIMICA ORGANICA II del 04 febbraio 2016
 Corso di Laurea in CTF Esame di CHIMICA RGAICA II del 04 febbraio 2016 1. Identificate il prodotto e discutete dettagliatamente la seguente reazione: 2. Progettate una via sintetica che porti alla formazione
Corso di Laurea in CTF Esame di CHIMICA RGAICA II del 04 febbraio 2016 1. Identificate il prodotto e discutete dettagliatamente la seguente reazione: 2. Progettate una via sintetica che porti alla formazione
Idrocarburi Al A ifatici Ar A oma m tici
 GLI IDROCARBURI Gli idrocarburi sono i più semplici composti del carbonio con l'idrogeno. Sono le molecole di base della chimica organica poiché, oltre ad essere molto numerosi, tutti gli altri composti
GLI IDROCARBURI Gli idrocarburi sono i più semplici composti del carbonio con l'idrogeno. Sono le molecole di base della chimica organica poiché, oltre ad essere molto numerosi, tutti gli altri composti
Complementi di Chimica Organica. Composti Aromatici: Benzene C 6 H 6 (1825) (1865) Friedrich August Kekulé
 Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Isomeria Costituzionale. Isomeria Conformazionale
 Isomeria ostituzionale Isomeri ostituzionali: omposti con uguale formula molecolare ma con un diverso ordine con cui sono legati gli atomi tra loro. Isomeria onformazionale onformazione: ciascuna disposizione
Isomeria ostituzionale Isomeri ostituzionali: omposti con uguale formula molecolare ma con un diverso ordine con cui sono legati gli atomi tra loro. Isomeria onformazionale onformazione: ciascuna disposizione
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Esercizio 1. CF 2 CS 2 CCl 4 ClF 3
 Esercizio 1 Determinare in base al metodo del legame di valenza la forma delle seguenti molecole, tenendo conto delle repulsioni coulombiane tra le coppie elettroniche di valenza CF 2 CS 2 CCl 4 ClF 3
Esercizio 1 Determinare in base al metodo del legame di valenza la forma delle seguenti molecole, tenendo conto delle repulsioni coulombiane tra le coppie elettroniche di valenza CF 2 CS 2 CCl 4 ClF 3
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Informazioni che si possono ricavare da uno spettro protonico
 Informazioni che si possono ricavare da uno spettro protonico Per interpretare uno spettro 1 H NMR bisogna: 1) Contare il numero di picchi che corrispondono agli idrogeni fisicamente diversi nella molecola.
Informazioni che si possono ricavare da uno spettro protonico Per interpretare uno spettro 1 H NMR bisogna: 1) Contare il numero di picchi che corrispondono agli idrogeni fisicamente diversi nella molecola.
COMPOSTI AROMATICI. Formula C 6 H 6
 COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1
 REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
Introduzione alla Chimica Organica. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Alcheni e alchini. idrocarburi. Insaturi C-C doppi/tripli. alcani. Saturi C-C semplici cicloalcani. aromatici
 Alcheni e alchini alcani Saturi C-C semplici cicloalcani idrocarburi Insaturi C-C doppi/tripli aromatici 1 Alcheni e Alchini Alcheni e alchini sono idrocarburi che hanno rispettivamente un doppio legame
Alcheni e alchini alcani Saturi C-C semplici cicloalcani idrocarburi Insaturi C-C doppi/tripli aromatici 1 Alcheni e Alchini Alcheni e alchini sono idrocarburi che hanno rispettivamente un doppio legame
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
LEGAMI CHIMICI e GEOMETRIA MOLECOLARE
 DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
Reazioni degli epossidi
 12-04-2016 Reazioni degli epossidi Apertura dell anello acido-catalizzata, esempi Struttura intermedio: 3 forme limiti di risonanza H H a a O O b b H O CH 3 CH 3 CH 3 H H H H Struttura ibrido intermedio
12-04-2016 Reazioni degli epossidi Apertura dell anello acido-catalizzata, esempi Struttura intermedio: 3 forme limiti di risonanza H H a a O O b b H O CH 3 CH 3 CH 3 H H H H Struttura ibrido intermedio
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
 SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
Figura. Benzene e aromaticità
 Figura Benzene e aromaticità Benzene e composti aromatici dal carbone da ciliegie pesche mandorle dal balsamo di Tolu Benzene e composti aromatici ormone steroideo naturale analgesico naturale tranquillante
Figura Benzene e aromaticità Benzene e composti aromatici dal carbone da ciliegie pesche mandorle dal balsamo di Tolu Benzene e composti aromatici ormone steroideo naturale analgesico naturale tranquillante
CHIMICA ORGANICA. Gli alcheni
 1 2-ALENI IMIA ORGANIA ALENI Formula generale n 2n Desinenza -ene Gli alcheni La prima classe di idrocarburi insaturi è quella degli alcheni, detti anche olefine, che presentano lungo la catena uno o più
1 2-ALENI IMIA ORGANIA ALENI Formula generale n 2n Desinenza -ene Gli alcheni La prima classe di idrocarburi insaturi è quella degli alcheni, detti anche olefine, che presentano lungo la catena uno o più
Teorie Acido-Base. valutazione degli acidi
 Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
Lezione n. 20. Visibile. La spettroscopia UV/Visibile. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 20 Principi generali delle spettroscopie ottiche La spettroscopia UV/Visibile Visibile Antonino Polimeno 1 Spettroscopie ottiche (1) - Le tecniche di misura
Chimica Fisica Biotecnologie sanitarie Lezione n. 20 Principi generali delle spettroscopie ottiche La spettroscopia UV/Visibile Visibile Antonino Polimeno 1 Spettroscopie ottiche (1) - Le tecniche di misura
Isomeri. Unità didattica 5. Isomeri cis-trans. La stereochimica. I composti achirali hanno immagini speculari sovrapponibili
 Isomeri Composti non identici ma che hanno la stessa formula molecolare Unità didattica 5 La stereochimica La disposizione degli atomi nello spazio; La stereochimica delle reazioni di addizione Isomeri
Isomeri Composti non identici ma che hanno la stessa formula molecolare Unità didattica 5 La stereochimica La disposizione degli atomi nello spazio; La stereochimica delle reazioni di addizione Isomeri
Esteri degli acidi carbossilici
 Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
CAPITOLO 4 STRUTTURE MOLECOLARI
 APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
Isomeria nelle molecole organiche
 Isomeria nelle molecole organiche 3 Cis/Trans o Z/E 1 4 Regole di priorità negli alcheni: 1. Numero atomico maggiore=maggiore priorità; 2. Maggiore priorità all isotopo più pesante; 3. Se il primo atomo
Isomeria nelle molecole organiche 3 Cis/Trans o Z/E 1 4 Regole di priorità negli alcheni: 1. Numero atomico maggiore=maggiore priorità; 2. Maggiore priorità all isotopo più pesante; 3. Se il primo atomo
IDROCARBURI AROMATICI. Scaricato da Sunhope.it
 IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
REAZIONI DI ADDIZIONE AL DOPPIO LEGAME NEGLI ALCHENI
 REAZIONI DI ADDIZIONE AL DOPPIO LEGAME NEGLI ALCHENI Un meccanismo di reazione, descrive come si rompe e forma un legame,mostra l ordine con cui si susseguono i vari stadi di formazione e di rottura dei
REAZIONI DI ADDIZIONE AL DOPPIO LEGAME NEGLI ALCHENI Un meccanismo di reazione, descrive come si rompe e forma un legame,mostra l ordine con cui si susseguono i vari stadi di formazione e di rottura dei
Lezione n. 22. Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Alcani e cicloalcani. Nomenclatura e nomi comuni Struttura e proprietà Reazioni
 Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
Capitolo 7 Composti organici alogenati
 himica Organica Informazione Scientifica sul Farmaco apitolo 7 omposti organici alogenati Organic hemistry, 5 th Edition L. G. Wade, Jr. Introduzione I composti organici alogenati sono importanti per vari
himica Organica Informazione Scientifica sul Farmaco apitolo 7 omposti organici alogenati Organic hemistry, 5 th Edition L. G. Wade, Jr. Introduzione I composti organici alogenati sono importanti per vari
Cr Mn Fe Co Ni Cu Zn. Chimica Inorganica Biologica Vita ed Energia
 Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Sostituzione elttrofila aromatica. Avviene su tutti i substrati aromatici. Solo su substrati non disattivati. Soloo derivati attivati
 Sostituzione elttrofila aromatica Avviene su tutti i substrati aromatici Solo su substrati non disattivati. Soloo derivati attivati Le sostituzioni nucleofile possono esseree descritta da un unico meccanismo
Sostituzione elttrofila aromatica Avviene su tutti i substrati aromatici Solo su substrati non disattivati. Soloo derivati attivati Le sostituzioni nucleofile possono esseree descritta da un unico meccanismo
IDROCARBURI. Alcani Alcheni Alchini C-C C=C C C
 IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
DIENI CONIUGATI. ADDIZIONE DI HCl. addotto 1,2 80% 20%
 DIENI NIUGATI wwwpianetachimicait I dieni coniugati sono diversi dai dieni isolati perché hanno lunghezze anomale dei legami e perché sono più stabili termodinamicamente dato che liberano meno energia
DIENI NIUGATI wwwpianetachimicait I dieni coniugati sono diversi dai dieni isolati perché hanno lunghezze anomale dei legami e perché sono più stabili termodinamicamente dato che liberano meno energia
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
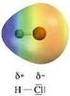
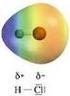 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
Dalla Chimica Generale
 RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Sostituzione nucleofila Addizione a gruppi carbonilici Addizione a doppi legami attivati
 himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
Leganti. Ossido di carbonio Fosfine, fosfiti Ossido di azoto Idruri Molecole organiche con sistemi Areni. Figura 5.1 Diversi tipi di leganti
 Leganti Ossido di carbonio Fosfine, fosfiti Ossido di azoto Idruri Molecole organiche con sistemi Areni Figura 5.1 Diversi tipi di leganti Leganti Figura 5.2 Le due componenti del legame metallo-carbonio
Leganti Ossido di carbonio Fosfine, fosfiti Ossido di azoto Idruri Molecole organiche con sistemi Areni Figura 5.1 Diversi tipi di leganti Leganti Figura 5.2 Le due componenti del legame metallo-carbonio
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
delle interazioni accoppiate dell intorno dei due atomi nell ambito della molecola.
 FATTORI CHE INFLUENZANO LA FREQUANZA DI ASSORBIMENTO Torniamo ora alla legge di Hooke: : abbiamo detto che questa relazione ci permette di conoscere la frequenza alla quale assorbirà un oscillatore di
FATTORI CHE INFLUENZANO LA FREQUANZA DI ASSORBIMENTO Torniamo ora alla legge di Hooke: : abbiamo detto che questa relazione ci permette di conoscere la frequenza alla quale assorbirà un oscillatore di
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
ASSORBIMENTO UV-VIS. Atomo
 ASSRBIMET UV-VIS 1 Atomo Molecola E 3 E 2 Livelli elettronici (interazioni UV) A Tipi di vibrazione molecolare: E 1 E 0 sottolivelli vibrazionali (interazioni IR) sottolivelli rotazionali (interazioni
ASSRBIMET UV-VIS 1 Atomo Molecola E 3 E 2 Livelli elettronici (interazioni UV) A Tipi di vibrazione molecolare: E 1 E 0 sottolivelli vibrazionali (interazioni IR) sottolivelli rotazionali (interazioni
Chimica Organica. Studio dei composti del CARBONIO
 Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
PROPRIETA FISICHE DEI COMPOSTI ORGANICI
 PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
Nome degli alcheni a catena lineare
 Gli alcheni sono idrocarboni insaturi. insaturi (almeno un doppio legame) idrocarboni (solo e ) n 2n 1-Esene 6 12 opyright 1999, Michael J. Wovkulich. All rights reserved. Nome degli alcheni a catena lineare
Gli alcheni sono idrocarboni insaturi. insaturi (almeno un doppio legame) idrocarboni (solo e ) n 2n 1-Esene 6 12 opyright 1999, Michael J. Wovkulich. All rights reserved. Nome degli alcheni a catena lineare
Unità didattica 7 (segue) Reattività del benzene. Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili
 Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Composti carbonilici: reazioni al carbonio in posizione a
 Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Aldeidi e chetoni. Struttura e proprietà Nomenclatura e nomi comuni Fonti Reazioni Principali aldeidi e chetoni
 Aldeidi e chetoni Struttura e proprietà Nomenclatura e nomi comuni Fonti Reazioni Principali aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Il legame = è costituito da un legame
Aldeidi e chetoni Struttura e proprietà Nomenclatura e nomi comuni Fonti Reazioni Principali aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Il legame = è costituito da un legame
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Gruppi funzionali. aldeidi
 Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
Composti Carbossilici. Acidi Carbossilici
 Composti Carbossilici Acidi Carbossilici ACIDI CARBSSILICI Gli acidi carbossilici sono caratterizzati dalla presenza del gruppo carbonilico legato ad un gruppo idrossilico R C Il gruppo carbossilico viene
Composti Carbossilici Acidi Carbossilici ACIDI CARBSSILICI Gli acidi carbossilici sono caratterizzati dalla presenza del gruppo carbonilico legato ad un gruppo idrossilico R C Il gruppo carbossilico viene
Gli Alcheni : struttura e nomenclatura
 Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
Composti carbonilici Acidi carbossilici
 Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
