Analisi strutturale Identificazione dei gruppi funzionali
|
|
|
- Gino Mori
- 5 anni fa
- Visualizzazioni
Transcript
1 Identificazione dei gruppi funzionali Riconoscimento di specifici raggruppamenti chimici (gruppi funzionali) presenti nella sostanza in esame. Reazioni chimiche che in determinate condizioni siano specifiche per quello specifico gruppo funzionale e che portino allo sviluppo di variazioni cromatiche rilevabili. Devono avere validità pressoché generale per tutte le sostanze con quello specifico gruppo funzionale ArOH + FeCl 3 [Fe(ArO) 6 ] 3- intensa colorazione (rossa) Reazioni di trasformazione in derivati cristallini di cui siano note le caratteristiche chimico-fisiche. Anche in questo caso le reazioni di derivatizzazione devono essere valide per tutti i composti di quella specifica classe Ar-NH 2 Ar-NH-SO 2 -Ph Analisi con tecniche di spettroscopia Infrarossa (IR), UV-Visibile e di risonanza magnetica nucleare (NMR)
2 Identificazione dei gruppi funzionali Criteri per la scelta dei derivati cristallini da preparare 1. Il derivato deve essere un solido con p.f. compreso tra 50 e 250 C 2. Il p.f. del derivato deve essere molto diverso da quello del composto di origine 3. Il p.f. del derivato deve essere il più possibile differente da quello di analoghi derivati di composti simili a quello di origine e con p.f. o p.e. simile Es. ho un ammina con p.e. 200 C contenente C, H, N; potrebbe essere o-toluidina (p.e. 200 C) CH 3 CH 3 m-toluidina (p.e. 203 C) NH 2 Dalla letteratura NH 2 benzensolfonamide di o-toluidina p.f. 124 C benzensolfonamide di m-toluidina p.f. 95 C p-toluensolfonamide di o-toluidina p.f. 108 C Maggior differenza nei p.f., si preparano i derivati benzensolfonamidici p-toluensolfonamide di o-toluidina p.f. 114 C
3 reattività Identificazione dei gruppi funzionali Analisi strutturale Criteri per la scelta dei derivati cristallini da preparare 4. La reazione di derivatizzazione deve essere specifica per il gruppo funzionale della sostanza in esame, deve avvenire con un decorso definito e senza reazioni secondarie, deve essere rapida e avvenire con rese elevate 5. Il derivato ottenuto deve essere stabile, facilmente isolabile e purificabile 6. Se la sostanza da derivatizzare contiene più gruppi funzionali, si sceglie un reattivo che reagisca selettivamente con un solo gruppo funzionale, possibilmente il più reattivo. Se un composto contiene un gruppo di classe A e uno di classe B, si prepara il derivato della classe A Se un composto contiene due gruppi di classe A si prepara il derivato del gruppo più reattivo (più in alto); similmente se sono presenti due gruppi di classe B Classe A (più reattivi) Aldeide o chetone Ammina primaria Ammina secondaria Acido carbossilico o anidride Acido solfonico fenolo Ammina terziaria Classe B (meno reattivi) Alcool Ammide o immide Estere Alogenuro alchilico Nitrile Nitroderivato Alogenuro arilico
4 Identificazione dei gruppi funzionali: Acidi carbossilici Gli acidi carbossilici sono caratterizzati dalla presenza della funzione COOH. Possono essere alifatici o aromatici. In base alla presenza di una o più funzioni si possono distinguere in acidi monocarbossilici, dicarbossilici e policarbossilici.
5 Identificazione dei gruppi funzionali: Acidi carbossilici Il gruppo COOH possiede le caratteristiche polari più marcate di qualunque altro gruppo funzionale organico e la capacità di formare legami idrogeno sia con molecole della stessa specie che di specie diversa. Tali proprietà si riflettono sulla solubilità, tensione di vapore e struttura cristallina. Stato fisico Serie alifatica liquidi altobollenti i termini fino a 10 atomi di C poi solidi HCOOH p.e. 100 C; CH 3 COOH p.e. 118 C Serie aromatica tutti solidi Solubilità PhCOOH p.f. 121 C Serie alifatica I primi quattro termini sono completamente miscibili con H 2 O, l acido valerianico (5 atomi di C) è parzialmente miscibile, quelli superiori sono immiscibili. Sono solubili in etere etilico Serie aromatica sono tutti insolubili in H 2 O e solubili in etere etilico
6 Identificazione dei gruppi funzionali: Acidi carbossilici Acidità della serie alifatica Sono acidi deboli RCOOH + H 2 O RCOO - + H 3 O + K a = RCOO H 3 O + RCOOH L acidità varia con il variare della natura di R. Gruppi elettron-attrattori stabilizzano l anione e fanno aumentare l acidità. Gruppi elettron-donatori destabilizzano l anione e fanno diminuire l acidità.
7 Identificazione dei gruppi funzionali: Acidi carbossilici Acidità della serie alifatica La presenza di alogeni fa aumentare l acidità, ed è direttamente proporzionale sia al numero di sostituenti che alla loro vicinanza al gruppo carbossilico. Cioè è dovuto all effetto induttivo elettron-attrattore che decresce all allontanarsi dal gruppo carbossilico. Acido K a CH 3 COOH 1.75x10-5 ClCH 2 COOH 1.36x10-3 Cl 2 CHCOOH 5.53x10-2 Cl 3 CCOOH 2.32x10-1 FCH 2 COOH 2.60x10-3 BrCH 2 COOH 1.25x10-5 ICH 2 COOH 6.7x10-4 F 3 CCOOH 0.56
8 Identificazione dei gruppi funzionali: Acidi carbossilici Acidità della serie aromatica A causa dell effetto elettron-attrattore dell anello aromatico, sono più acidi della serie alifatica. La presenza di sostituenti sull anello influenza l acidità: Sostituenti elettron-attrattori stabilizzano l anione e aumentano l acidità Sostituenti elettron-donatori destabilizzano l anione e diminuiscono l acidità Nei composti aromatici l effetto elettronico si realizza attraverso due componenti: Induttiva attrazione o rilascio elettronico legato all elettronegatività del sostituente. Si esercita indipendentemente dalla posizione orto, meta o para di sostituzione Mesomerica attrazione o rilascio elettronico per effetto della coniugazione. Si esercita in maniera esclusiva quando il sostituente è nelle posizioni orto o para al gruppo carbossilico Effetto orto in genere gli orto sostituiti sono più acidi dei corrispondenti meta e para sostituiti
9 Identificazione dei gruppi funzionali: Acidi carbossilici Acidità della serie aromatica Acido benzoico k a 6.3x10-5 Sostituente orto meta para -NO 2 6.7x x x10-4 -Cl 1.2x x x10-4 -CH 3 1.2x x x10-5 -OCH 3 8.2x x x10-5 -OH 1.0x x x10-5 -NH 2 1.6x x x10-5
10 Identificazione dei gruppi funzionali: Acidi carbossilici Riconoscimento: Ricerca del carattere acido Saggio di Angeli e Rimini Preparazione dei derivati cristallini
11 Identificazione dei gruppi funzionali: Acidi carbossilici Ricerca del carattere acido Si sfrutta il carattere acido del gruppo carbossilico per un riconoscimento preliminare di tali sostanze: 1. Acidi solubili in H 2 O si prepara una soluzione acquosa e si misura il ph (con cartina al tornasole), si osserva il ph che dipende dalla forza dell acido e dalla quantità di sostanza disciolta. 2. Acidi insolubili in H 2 O si prova la solubilità in una soluzione satura di NaHCO 3 In generale gli acidi carbossilici hanno k a maggiori del k a1 H 2 CO 3 (circa 10-7 ) quindi sono solubili in NaHCO 3 sol. satura con sviluppo di effervescenza RCOOH + NaHCO 3 RCOONa + H 2 O + CO 2
12 Identificazione dei gruppi funzionali: Acidi carbossilici Saggio di Angeli e Rimini E un saggio non specifico per gli ac. carbossilici. Con delle varianti viene dato anche da alcuni derivati degli ac. carbossilici (esteri, ammidi, anidridi) L acido viene trasformato nel corrispondente acido idrossammico che in presenza di ioni Fe 3+ dà una colorazione rosso-violetta (idrossammato ferrico). Esecuzione del saggio: 2-3 gocce del composto in esame (una punta di spatola) si pongono in provetta, si aggiungono 4 gocce di SOCl 2 e si scalda a bagnomaria per 4-5 minuti. Si aggiunge 1 ml di etanolo, si scalda ancora 1 minuto e si aggiunge 1 ml di H 2 O. Si aggiunge 1 ml di H 2 O contenente 25 mg di NH 2 OH. HCl e poi NaOH al 30% fino a ph 8. Si acidifica a ph 4 con HCl 2M e si aggiungono 2-3 gocce di FeCl 3 (1%). Colorazione rosso-violetta conferma acido carbossilico Necessario effettuare una prova in bianco direttamente sulla sostanza per verificare che essa non contenga gruppi funzionale capaci di interagire con FeCl 3 per dare complessi colorati (enoli, fenoli)
13 Identificazione dei gruppi funzionali: Acidi carbossilici Saggio di Angeli e Rimini Reattività dei derivati degli ac. carbossilici (RCOX) nella sostituzione nucleofila RCOCl > RCOOCOR > RCOOR > RCOOH > RCONH 2 > RCOONR 2 > RCOO - Spiegabile sulla base degli effetti induttivi e mesomerici del sostituente R E necessaria l attivazione del carbonile dell ac. carbossilico (poco reattivo). Il cloruro acido si prepara in genere a riflusso, in assenza di solvente, con SOCl 2 (p.e. 79 C) che può essere allontanato per distillazione se il cloruro preparato non è volatile, oppure lasciato nell ambiente di reazione e distrutto alla fine della successiva reazione.
14 Identificazione dei gruppi funzionali: Acidi carbossilici Saggio di Angeli e Rimini La fase successiva prevede la trasformazione del cloruro acido nel corrispondente estere etilico direttamente nell ambiente di reazione. Prima dell aggiunta di NH 2 OH. HCl si aggiunge H 2 O per distruggere l eccesso di SOCl 2 che reagirebbe con NH 2 OH L estere etilico viene trasformato nel corrispondente ac. idrossammico per trattamento con NH 2 OH. HCl. Per permettere la reazione si deve aggiungere NaOH al 30% per sbloccare il cloridrato ma non oltre ph 8 poiché a ph più alcalino l acido idrossammico può subire la trasposizione di Lossen.
15 Identificazione dei gruppi funzionali: Acidi carbossilici Saggio di Angeli e Rimini Si acidifica con HCl prima di aggiungere FeCl 3 per evitare la precipitazione di idrossido ferrico Si sviluppa una colorazione per formazione di idrossammato ferrico R N OH OH HCl (ph < 2) FeCl 3 R N O O H 3 Fe
16 Identificazione dei gruppi funzionali: Acidi carbossilici Preparazione dei derivati cristallini Preparazione dei cloruri (intermedi reattivi di acidi carbossilici). L acido carbossilico viene trattato con cloruro di tionile (SOCl 2 ), o con pentacloruro di fosforo (PCl 5 ) o con ossicloruro di fosforo o cloruro di fosforile (POCl 3 ). RCOOH + SOCl 2 -> RCOCl + SO 2 + HCl RCOOH + PCl 5 -> RCOCl + POCl 3 + HCl 3 RCOOH + POCl 3 -> 3 RCOCl + H 3 PO 3 Una volta ottenuto il cloruro acido si possono preparare i derivati cristallini che sono: Ammidi, Anilidi, p-bromo-anilidi, p-toluididi, 2-Alchil-Benzimidazoli, Esteri, Sali di S- benzil-isotiuronio.
17 Identificazione dei gruppi funzionali: Acidi carbossilici Preparazione dei derivati cristallini Ammidi Il cloruro dell acido viene aggiunto sotto cappa goccia a goccia ed agitando, a 5 cc. di NH 3 conc. ghiacciata. Si lascia 10 in bagno a ghiaccio, si filtra, si lava con H 2 O e si cristalizza da acqua o da miscela idroalcoolica. RCOCl + NH 3 -> HCl + RCONH 2 Anilidi RCOCl + H 2 N-C 6 H 5 -> + RCONH-C 6 H 5 + HCl p-bromo-anilidi p-toluididi RCOCl + H 2 N-C 6 H 5 Br -> + RCONH-C 6 H 5 Br + HCl RCOCl + H 2 N-C 6 H 5 CH 3 -> + RCONH-C 6 H 5 CH 3 + HCl
18 Identificazione dei gruppi funzionali: Acidi carbossilici Preparazione dei derivati cristallini 2-Alchil-Benzimidazoli Si ottengono per reazione fra acido e o-fenilen-diammina a caldo in ambiente acido (HCl) e si precipita il derivato, dopo raffreddamento, con NH 3.
19 Identificazione dei gruppi funzionali: Acidi carbossilici Preparazione dei derivati cristallini Esteri Gli esteri sono derivati molto utili per quegli acidi che danno difficilmente il cloruro. Questi, infatti reagiscono con gli alcoli (più facilmente alcoli primari, quali metanolo o etanolo) in presenza di tracce di un acido minerale (H 2 SO 4 ) per formare a temperature abbastanza moderate gli esteri. L estere presenta il punto di fusione più basso di quello dell acido corrispondente e talora è un liquido.
20 Identificazione dei gruppi funzionali: Acidi carbossilici Preparazione dei derivati cristallini Sali di S-benzil-isotiuronio Il cloruro di benzile viene trattato con tiourea in lieve difetto, in presenza di metanolo a T bollente (95 C), e si ottiene il cloruro di S-benzil-isotiouronio che è in grado di reagire con l acido per formare il sale di S-benzilisotiouronio. Se la tiourea viene usata in eccesso si otterrebbe la S- benzilisotiourea che non è in grado di reagire con l acido.
21 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Anidridi R R O O O O O O H 5 C 6 H 5 C 6 O O O R = alchile o arile p.e. = 140 C p.f. = 42 C Sono composti neutri molto reattivi (acilanti) Anidridi alifatiche - liquidi i primi termini, poi solide Anidridi aromatiche - solide Sono solubili in Et 2 O e scarsamente o per niente solubili in H 2 O (decresce all aumentare del P.M.). In H 2 O si idrolizzano al corrispondente acido carbossilico: l anidride acetica lentamente anche a freddo, i termini alifatici superiori a caldo quelle aromatiche sono ancora più stabili.
22 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Anidridi Saggio di Angeli e Rimini In questo caso non è necessario preparare il cloruro acido. L anidride viene trattata con etanolo a caldo per ottenere l estere e poi si prosegue come per gli ac. carbossilici.
23 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Esteri R O O R 1 R, R 1 = alchile o arile Sono composti neutri, più volatili degli acidi corrispondenti anche se hanno P.M.> (non presenta legami intermolecolari) Esteri di acidi carbossilici alifatici - liquidi i primi termini, poi liquidi molto viscosi o solidi spesso a consistenza cerosa Esteri di acidi carbossilici aromatici - liquidi altobollenti o solidi Sono solubili in Et 2 O - sono tutti insolubili in H 2 O (non formano legami H), eccetto formiato di metile e di etile e acetato di etile che sono parzialmente miscibili. Riconoscimento 1. Saggio di Angeli e Rimini 2. Idrolisi e ricerca della componente acida e di quella alcolica o fenolica
24 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Esteri Saggio di Angeli e Rimini In questo caso si fa reagire direttamente l estere con NH 2 OH. HCl a ph 8. Poi si acidifica con HCl 2M e si aggiunge FeCl 3. Idrolisi dell estere e identificazione di ac. carbossilico e alcool (o fenolo) A. Idrolisi acida E una reazione reversibile di equilibrio, quindi non completa. Si effettua quando l estere contiene gruppi sensibili all ambiente eccessivamente alcalino. In genere si effettua con HCl acquoso 4-6 M a riflusso.
25 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Esteri Idrolisi dell estere B. Idrolisi basica E una reazione irreversibile quindi completa e si utilizza preferibilmente. Per gli esteri alifatici a basso PM si effettua con una soluzione acquosa diluita (10-20% di KOH o NaOH) la reazione in genere è completa in minuti. Gli esteri alifatici ad alto PM o aromatici (più difficilmente idrolizzabili vengono trattati con KOH (10-20%) in MeOH o EtOH e la reazione procede a completezza in 1-2 ore. Gli esteri più difficilmente idrolizzabili vengono trattati con KOH disciolta in glicol etilenico (p.e. 198 C) o in glicerina (290 C)
26 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Esteri Idrolisi basica dell estere Isolamento dell alcool - se l idrolisi è stata fatta in sol. acquosa l alcool si può separare direttamente dalla soluzione alcalina: a) per filtrazione se solido insolubile in H 2 O; b) per estrazione se è liquido poco miscibile o immiscibile con H 2 O; c) per distillazione frazionata se è liquido e miscibile con H 2 O. Se l idrolisi è stata effettuata in MeOH (EtOH) si può separare l alcool per distillazione, ugualmente se si è usata glicerina o glicole etilenico. Isolamento dell acido carbossilico - se l idrolisi è stata fatta in sol. acquosa, dopo aver allontanato l alcool si acidifica e se l acido è insolubile in H 2 O si separa per filtrazione se solido o per estrazione con Et 2 O o AcOEt se liquido. Se è solubile in H 2 O l acido si separa per distillazione frazionata. Se l idrolisi è stata effettuata in MeOH (EtOH), dopo aver allontanato l alcool si elimina il solvente per distillazione, si riprende il residuo con una soluzione acida e si isola l ac. carbossilico per filtrazione o estrazione. Se l idrolisi è stata effettuata in glicerina o glicole etilenico, si diluisce con H 2 O, si acidifica e si recupera l acido carbossilico per filtrazione o estrazione.
27 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Esteri Idrolisi basica dell estere Isolamento del fenolo - se l estere di partenza deriva da un fenolo, dopo l idrolisi acquosa sia l ac. carbossilico che il fenolo sono in forma ionizzata come sali di Na + o K + (carbossilato e fenato). Possono essere isolati insieme in forma indissociata tramite acidificazione e successiva filtrazione o estrazione con Et 2 O o AcOEt e poi separati in base alla loro differenza di acidità. Se ottenuti per filtrazione si sciolgono in Et 2 O o AcOEt e si estrae con una sol. satura di NaHCO 3. L ac. carbossilico passa nella fase acquosa e il fenolo rimane in quella organica. Dalla fase acquosa si isola l ac. carbossilico per acidificazione. Se sono stati ottenuti per estrazione con Et 2 O o AcOEt, questa fase organica si estrae con una sol. satura di NaHCO 3. L ac. carbossilico passa nella fase acquosa e il fenolo rimane in quella organica. Dalla fase acquosa si isola l ac. carbossilico per acidificazione.
28 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Ammidi Sono neutre Allo stato solido hanno punti di ebollizione elevati perché formano legami H intermolecolari molto forti. All aumentare del numero di sostituzioni sull N, si abbassa p.f. I primi termini delle ammidi primarie (fino a 5 atomi di C) sono solubili in H 2 O e poco solubili in Et 2 O; all aumentare del PM diminuisce la solubilità in H 2 O e aumenta quella in Et 2 O R H O N H R H O N R 1 R O N R 1 R 2 ammide primaria ammide secondaria ammide terziaria estesa rete di leg H intermolecolari Formammide (l) Acetammide (s) p.e. 210 C p.f. 82 C minor numero di leg H intermolecolari assenza di leg H N-metil-Formammide (l) p.e. 197 C N,N-dimetil-Formammide (l) p.e. 177 C N-metil-Acetammide p.f. 28 C N,N-dimetil-Acetammide (l) p.e. 165 C (s) N-etil-Acetammide (l) p.e. 205 C N,N-dietil-Acetammide (l) p.e. 185 C
29 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Ammidi Riconoscimento ammidi primarie 1. Idrolisi basica con sviluppo di NH 3 2. Saggio di Angeli e Rimini Riconoscimento ammidi secondarie e terziarie Non esistono saggi specifici e generali per questo gruppo funzionale. Si effettua l idrolisi, vengono separati e riconosciuti i prodotti ottenuti: ac. carbossilico, ammina alifatica o aromatica.
30 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Ammidi Riconoscimento ammidi primarie Idrolisi basica con sviluppo di NH mg di sostanza in provetta si addizionano di NaOH 2M e si scaldano in bagnomaria bollente. Si valuta lo sviluppo di NH 3 dal viraggio verso l alcalino di una cartina indicatrice universale inumidita, posta all imboccatura della provetta. Interferiscono: a) metilammidi e etilammidi che per idrolisi sviluppano metilammina ed etilammina, volatili e basiche ma di caratteristico odore sgradevole; b) nitrili ; c) immidi (queste a differenza delle ammidi sono acide)
31 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Ammidi Riconoscimento ammidi primarie Reazione di Angeli e Rimini - La reazione viene effettuata in soluzione etanolica e direttamente sull ammide con NH 2 OH. HCl e NaOH. L acido idrossammico ottenuto viene trattato con FeCl 3. Per le ammidi meno reattive (aromatiche) la reazione si effettua in glicol propilenico (p.e. 188 C)
32 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Ammidi Riconoscimento ammidi secondarie e terziarie per idrolisi Le condizioni vengono scelte in base alla reattività dell ammide e alla sensibilità dei prodotti di idrolisi in ambiente acido o basico. Le ammidi alifatiche a basso PM (più reattive) vengono trattate in H 2 O con NaOH 10% o H 2 SO 4 al 10% o HCl 6M; le ammidi aromatiche e ad alto PM con NaOH al 20% in glicerina o H 2 SO 4 al 70%. Idrolisi acida Idrolisi basica
33 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Nitrili Alifatici - liquidi bassobollenti i primi termini poi liquidi altobollenti i termini superiori e solidi bassofondenti quelli ad alto PM Acetonitrile CH 3 CN p.e. = 82 C; nitrile dell acido stearico CH 3 -(CH 2 ) 16 -CN p.f. = 41 C Aromatici - i primi termini sono liquidi altobollenti poi solidi bassofondenti Benzonitrile C 6 H 5 CN p.e. = 191 C Sono solubili in etere e insolubili in H 2 O ad eccezione dei primi due termini alifatici (acetonitrile e propionitrile) che sono miscibili con H 2 O
34 Identificazione dei gruppi funzionali: Derivati degli acidi carbossilici -> Nitrili Riconoscimento Idrolisi basica con sviluppo di ammoniaca Reazione di Angeli e Rimini
Identificazione degli alcoli
 Identificazione degli alcoli R-OH Stato fisico Gli alcoli sono sostanze neutre caratterizzate dalla presenza di un gruppo ossidrilico legato ad un atomo di carbonio alifatico. I primi termini degli alcoli
Identificazione degli alcoli R-OH Stato fisico Gli alcoli sono sostanze neutre caratterizzate dalla presenza di un gruppo ossidrilico legato ad un atomo di carbonio alifatico. I primi termini degli alcoli
IDENTIFICAZIONE DEGLI ACIDI CARBOSSILICI
 IDENTIFICAZIONE DEGLI ACIDI CARBOSSILICI Acidi carbossilici Stato fisico alifatici il primo termine degli ac. carbossilici alifatici è l'acido formico, che avendo un p.e. di 100,5 C, è liquido a temperatura
IDENTIFICAZIONE DEGLI ACIDI CARBOSSILICI Acidi carbossilici Stato fisico alifatici il primo termine degli ac. carbossilici alifatici è l'acido formico, che avendo un p.e. di 100,5 C, è liquido a temperatura
Esteri degli acidi carbossilici
 Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
RICERCA DELLA FUNZIONE CARBOSSILICA
 RICERCA DELLA FUNZIONE CARBOSSILICA IMPORTANTI ACIDI DI USO COMUNE ALCUNI IMPORTANTI ACIDI ALCUNI IMPORTANTI ACIDI NUMERO DI OSSIDAZIONE Preparazione degli Acidi Carbossilici Riconoscimento
RICERCA DELLA FUNZIONE CARBOSSILICA IMPORTANTI ACIDI DI USO COMUNE ALCUNI IMPORTANTI ACIDI ALCUNI IMPORTANTI ACIDI NUMERO DI OSSIDAZIONE Preparazione degli Acidi Carbossilici Riconoscimento
FENOLI: nomenclatura IUPAC
 FENOLI, AMMINE ed ENAMMINE FENOLI: nomenclatura IUPAC I fenoli sono composti la cui caratteristica strutturale è quella di possedere un gruppo idrossile ( OH) legato a un anello benzenico. Il sistema it
FENOLI, AMMINE ed ENAMMINE FENOLI: nomenclatura IUPAC I fenoli sono composti la cui caratteristica strutturale è quella di possedere un gruppo idrossile ( OH) legato a un anello benzenico. Il sistema it
Smistamento sistematico H. Staudinger
 Smistamento sistematico H. Staudinger Consente mediante procedimenti sistematici lo smistamento in gruppi di una miscela incognita sulla base delle diverse caratteristiche chimico-fisiche dei componenti.
Smistamento sistematico H. Staudinger Consente mediante procedimenti sistematici lo smistamento in gruppi di una miscela incognita sulla base delle diverse caratteristiche chimico-fisiche dei componenti.
Composti carbonilici Acidi carbossilici
 Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Acidi carbossilici: nomenclatura. alcano -> acido alcanoico
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Si trovano generalmente come dimeri ciclici a causa dei legami a idrogeno
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
ACIDI E BASI ORGANICI: pka e ph
 Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Capitolo 8 Alcoli e Fenoli
 Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
ANALISI E SEPARAZIONE DI SOSTANZE ORGANICHE TRAMITE LA SOLUBILITÀ. Prof. Antonio Lavecchia
 ANALISI E SEPARAZIONE DI SOSTANZE ORGANICHE TRAMITE LA SOLUBILITÀ Prof. Antonio Lavecchia Solubilità in Acqua Solubilità in Acqua B: + H-OH B + -H + OH - base R-COOH + H 2 O R-COO - + H 3 O + acido Solubilità
ANALISI E SEPARAZIONE DI SOSTANZE ORGANICHE TRAMITE LA SOLUBILITÀ Prof. Antonio Lavecchia Solubilità in Acqua Solubilità in Acqua B: + H-OH B + -H + OH - base R-COOH + H 2 O R-COO - + H 3 O + acido Solubilità
Ammine R N + H. ammina terziaria ammina secondaria ammina primaria sale di ammonio quaternario
 AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
Smistamento sistema+co H. Staudinger
 Smistamento sistema+co H. Staudinger onsente mediante procedimen+ sistema+ci lo smistamento in gruppi di una miscela incognita sulla base delle diverse cara8eris+che chimico-fisiche dei componen+ Frazione
Smistamento sistema+co H. Staudinger onsente mediante procedimen+ sistema+ci lo smistamento in gruppi di una miscela incognita sulla base delle diverse cara8eris+che chimico-fisiche dei componen+ Frazione
Alcoli e Tioli. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcoli e Tioli Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcoli e Tioli Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
p p s sp sp sp s p p 1
 p p s sp p sp sp p s 1 alcheni 63 kcal/mol alchini 2 nd 54 kcal/mol 2 Come per gli alcheni, gli alchini interni sostituiti sono più stabili di quelli esterni More stable Etino (acetilene) C 2 H 2 +O 2
p p s sp p sp sp p s 1 alcheni 63 kcal/mol alchini 2 nd 54 kcal/mol 2 Come per gli alcheni, gli alchini interni sostituiti sono più stabili di quelli esterni More stable Etino (acetilene) C 2 H 2 +O 2
Capitolo 24 Dai gruppi funzionali ai polimeri
 Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
SOSTANZE DA IDENTIFICARE ORGANO-METALLICHE ORGANICHE ORGANICHE AZOTATE ORGANICHE NON AZOTATE ORGANICHE AZOTATE NON REAGISCONO CON I REATTIVI
 Il riconoscimento dei gruppi funzionali presenti in un composto organico incognito è utilissimo per la determinazione della struttura del campione in esame. Il riconoscimento viene effettuato attraverso
Il riconoscimento dei gruppi funzionali presenti in un composto organico incognito è utilissimo per la determinazione della struttura del campione in esame. Il riconoscimento viene effettuato attraverso
Sostanze organiche: determinazioni qualitative
 Acido acetilsalicilico (European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (143 C) Aggiungere 4 ml di NaOH soluzione dil. a 0,2 gr della sostanza in esame e bollire per 3 minuti.
Acido acetilsalicilico (European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (143 C) Aggiungere 4 ml di NaOH soluzione dil. a 0,2 gr della sostanza in esame e bollire per 3 minuti.
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Nitrocomposti OH R R CH N
 Nitrocomposti I nitrocomposti sono caratterizzati dalla presenza di un nitrogruppo legato ad un atomo di carbonio. I nitrocomposti alifatici sono liquidi stabili, poco solubili in H 2 e molto solubili
Nitrocomposti I nitrocomposti sono caratterizzati dalla presenza di un nitrogruppo legato ad un atomo di carbonio. I nitrocomposti alifatici sono liquidi stabili, poco solubili in H 2 e molto solubili
Capitolo 24 Le famiglie dei composti organici
 Capitolo 24 Le famiglie dei composti organici DOMANDE ED ESERCIZI (versione integrale) 24.1 I composti organici sono raggruppati in famiglie 1. Che cosa si intende per gruppo funzionale? Scrivi le formule
Capitolo 24 Le famiglie dei composti organici DOMANDE ED ESERCIZI (versione integrale) 24.1 I composti organici sono raggruppati in famiglie 1. Che cosa si intende per gruppo funzionale? Scrivi le formule
TERZA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 TERZA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Terza Esperienza di Laboratorio Prove di solubilità Riconoscimento della funzione carbossilica Ricerca del Carattere Acido Saggio di Angeli e Rimini
TERZA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Terza Esperienza di Laboratorio Prove di solubilità Riconoscimento della funzione carbossilica Ricerca del Carattere Acido Saggio di Angeli e Rimini
QUINTA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 QUINTA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Quinta Esperienza di Laboratorio Prove di solubilità Riconoscimento dei fenoli Reazione di Reimer-Tiemann Saggio con FeCl 3 Riconoscimento della
QUINTA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Quinta Esperienza di Laboratorio Prove di solubilità Riconoscimento dei fenoli Reazione di Reimer-Tiemann Saggio con FeCl 3 Riconoscimento della
 Carboidrati I carboidrati (poliidrossialdeidi e poliidrossi chetoni) non hanno proprietà uniformemente riconosciute. Sono solidi bianchi o liquidi sciropposi, con sapore dolce, hanno carattere neutro e
Carboidrati I carboidrati (poliidrossialdeidi e poliidrossi chetoni) non hanno proprietà uniformemente riconosciute. Sono solidi bianchi o liquidi sciropposi, con sapore dolce, hanno carattere neutro e
IDENTIFICAZIONE DEI COMPOSTI CARBONILICI C O
 IDENTIFIAZINE DEI MPSTI ABNILII Generalità Il gruppo carbonilico, caratteristico delle aldeidi e dei chetoni è polare, in quanto la nube elettronica del legame è attirata dall'atomo di ossigeno più elettronegativo.
IDENTIFIAZINE DEI MPSTI ABNILII Generalità Il gruppo carbonilico, caratteristico delle aldeidi e dei chetoni è polare, in quanto la nube elettronica del legame è attirata dall'atomo di ossigeno più elettronegativo.
ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione
![ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione](/thumbs/57/40353116.jpg) ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
Gruppi funzionali. aldeidi
 Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
SAGGI SPECIFICI ACIDI CARBOSSILICI
 SAGGI SPECIFICI ACIDI CARBOSSILICI Acido Acetilsalicilico: - Per riscaldamento a secco con Ca(OH) 2 sviluppa acetone i cui vapori, a contatto con una cartina imbevuta di o-nitrobenzaldeide, la colorano
SAGGI SPECIFICI ACIDI CARBOSSILICI Acido Acetilsalicilico: - Per riscaldamento a secco con Ca(OH) 2 sviluppa acetone i cui vapori, a contatto con una cartina imbevuta di o-nitrobenzaldeide, la colorano
Capitolo 8 Acidi Carbossilici e Derivati
 Chimica rganica Scienze della Terra, dell Ambiente e del Territorio Capitolo 8 Acidi Carbossilici e Derivati rganic Chemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic Chemistry, 3 rd Edition
Chimica rganica Scienze della Terra, dell Ambiente e del Territorio Capitolo 8 Acidi Carbossilici e Derivati rganic Chemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic Chemistry, 3 rd Edition
ESAME DI ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO + LABORATORIO DI ANALISI QUALITATIVA. Nome e cognome: Numero di matricola:..
 ESAME DI ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO + LABORATORIO DI ANALISI QUALITATIVA Nome e cognome: Numero di matricola:.. 1) Indicare, motivando la risposta, il ph di una soluzione
ESAME DI ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO + LABORATORIO DI ANALISI QUALITATIVA Nome e cognome: Numero di matricola:.. 1) Indicare, motivando la risposta, il ph di una soluzione
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Classi di composti: derivati carbonilici
 Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 59 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 59 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici
 Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 62 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 62 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
DAI GRUPPI FUNZIONALI AI POLIMERI
 DAI GRUPPI FUNZIONALI AI POLIMERI 1. I GRUPPI FUNZIONALI 2. DERIVATI OSSIGENATI DEGLI IDROCARBURI : ALCOLI, FENOLI, ETERI, ALDEIDI E CHETONI, ACIDI CARBOSSILICI E LORO DERIVATI 3. DERIVATI AZOTATI DEGLI
DAI GRUPPI FUNZIONALI AI POLIMERI 1. I GRUPPI FUNZIONALI 2. DERIVATI OSSIGENATI DEGLI IDROCARBURI : ALCOLI, FENOLI, ETERI, ALDEIDI E CHETONI, ACIDI CARBOSSILICI E LORO DERIVATI 3. DERIVATI AZOTATI DEGLI
PON C4 "LE SCIENZE IN GARA!"
 PON C4 "LE SCIENZE IN GARA!" Approfondimenti di Chimica e Biologia: ph, poh, soluzioni tampone, acidi monoprotici e poliprotici, acido acetico, acetati, ammine, ammidi. prof. Ciro Formica Calcolo della
PON C4 "LE SCIENZE IN GARA!" Approfondimenti di Chimica e Biologia: ph, poh, soluzioni tampone, acidi monoprotici e poliprotici, acido acetico, acetati, ammine, ammidi. prof. Ciro Formica Calcolo della
14/11/2018. Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile.
 Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
SAGGI DI RICONOSCIMENTO DEI FENOLI
 SAGGI DI RICONOSCIMENTO DEI FENOLI pka = 9,89 OH OH OH Cl Cl OH OH Cl Cl Cl SAGGI DI RICONOSCIMENTO ADOPERATI: 1- Saggio con FeCl 3 2- Saggio con Acqua di Bromo 3- Formazione coloranti Azoici 4- Saggio
SAGGI DI RICONOSCIMENTO DEI FENOLI pka = 9,89 OH OH OH Cl Cl OH OH Cl Cl Cl SAGGI DI RICONOSCIMENTO ADOPERATI: 1- Saggio con FeCl 3 2- Saggio con Acqua di Bromo 3- Formazione coloranti Azoici 4- Saggio
Acidi carbossilici e derivati
 Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
DERIVATI DEGLI ACIDI CARBOSSILICI gruppo acile
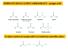 DERIVATI DEGLI ACIDI CARBOSSILICI gruppo acile Acido carbossilico, Alogenuro acilico, Anidride, Estere, Ammide, Tioestere, Fosfato acilico La tipica reazione dei gruppi acilici è la sostituzione nucleofila
DERIVATI DEGLI ACIDI CARBOSSILICI gruppo acile Acido carbossilico, Alogenuro acilico, Anidride, Estere, Ammide, Tioestere, Fosfato acilico La tipica reazione dei gruppi acilici è la sostituzione nucleofila
Acidi carbossilici. IUPAC catena più lunga contenente il gruppo -COOH al quale si dà il nome dell'alcano in cui la desinenza -o è sostituita con -oico
 Acidi carbossilici caratterizzati dal gruppo carbossilico - R alifatici Ar aromatici IUPA catena più lunga contenente il gruppo - al quale si dà il nome dell'alcano in cui la desinenza -o è sostituita
Acidi carbossilici caratterizzati dal gruppo carbossilico - R alifatici Ar aromatici IUPA catena più lunga contenente il gruppo - al quale si dà il nome dell'alcano in cui la desinenza -o è sostituita
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Derivati degli acidi carbossilici
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Derivati degli acidi carbossilici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Derivati degli acidi carbossilici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze
ACETILAZIONE DELL ACIDO SALICILICO (Sintesi dell Aspirina acido acetilsalicilico) H 2 SO 4. Quantità: Acido salicilico 5.0 g (PM = 138.
 ACETILAZIONE DELL ACIDO SALICILICO (Sintesi dell Aspirina acido acetilsalicilico) COOH COOH OH OAc + Ac 2 O H 2 SO 4 ac. 2-idrossibenzoico ac. 2-acetossibenzoico Quantità: Acido salicilico 5.0 g (PM =
ACETILAZIONE DELL ACIDO SALICILICO (Sintesi dell Aspirina acido acetilsalicilico) COOH COOH OH OAc + Ac 2 O H 2 SO 4 ac. 2-idrossibenzoico ac. 2-acetossibenzoico Quantità: Acido salicilico 5.0 g (PM =
ESTRAZIONE CON SOLVENTE
 ESTRAZIONE CON SOLVENTE TECNICA DI SEPARAZIONE BASATA SUL TRASFERIMENTO SELETTIVO DI UNO O PIÙ COMPONENTI DI UNA MISCELA SOLIDA, LIQUIDA O GASSOSA DA UN SOLVENTE AD UN ALTRO SOLVENTE IMMISCIBILE CON IL
ESTRAZIONE CON SOLVENTE TECNICA DI SEPARAZIONE BASATA SUL TRASFERIMENTO SELETTIVO DI UNO O PIÙ COMPONENTI DI UNA MISCELA SOLIDA, LIQUIDA O GASSOSA DA UN SOLVENTE AD UN ALTRO SOLVENTE IMMISCIBILE CON IL
PRIMA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida e Via Secca) Ricerca dei Cationi Calcio, Magnesio,
PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida e Via Secca) Ricerca dei Cationi Calcio, Magnesio,
Acidi e basi di Lewis
 Gli acidi e le basi Acidi e basi di Lewis Acidi di Lewis= specie che possono accettare in compartecipazione una coppia di elettroni da un altra specie. Base di Lewis = specie che può cedere in compartecipazione
Gli acidi e le basi Acidi e basi di Lewis Acidi di Lewis= specie che possono accettare in compartecipazione una coppia di elettroni da un altra specie. Base di Lewis = specie che può cedere in compartecipazione
ACIDI CARBOSSILICI Gli acidi carbossilici presentano tre bande caratteristiche dovute al gruppo funzionale COOH
 ACIDI CABOSSILICI Gli acidi carbossilici presentano tre bande caratteristiche dovute al gruppo funzionale COOH OH C O Presenta infatti le bande di assorbimento caratteristiche dei due gruppi: C=O e OH
ACIDI CABOSSILICI Gli acidi carbossilici presentano tre bande caratteristiche dovute al gruppo funzionale COOH OH C O Presenta infatti le bande di assorbimento caratteristiche dei due gruppi: C=O e OH
QUARTA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 QUARTA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Quarta Esperienza di Laboratorio Prove di solubilità Riconoscimento della funzione carbonilica Formazione di 2,4-dinitrofenilidrazoni (reazione
QUARTA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Quarta Esperienza di Laboratorio Prove di solubilità Riconoscimento della funzione carbonilica Formazione di 2,4-dinitrofenilidrazoni (reazione
Acidi Carbossilici CH 3. Caratterizzati dalla presenza di un gruppo carbossilico. Acido etanoico (Acido Acetico) Acido metanoico (Acido Formico)
 Acidi Carbossilici Caratterizzati dalla presenza di un gruppo carbossilico CH 3 H Acido etanoico (Acido Acetico) Acido metanoico (Acido Formico) Struttura del gruppo carbossilico δ- CH 3 δ+ Il legame è
Acidi Carbossilici Caratterizzati dalla presenza di un gruppo carbossilico CH 3 H Acido etanoico (Acido Acetico) Acido metanoico (Acido Formico) Struttura del gruppo carbossilico δ- CH 3 δ+ Il legame è
CORSO DI CHIMICA PER L AMBIENTE. Lezione del 5 Maggio 2016
 CORSO DI CHIMICA PER L AMBIENTE Lezione del 5 Maggio 2016 Sali Acidi o Basici La neutralità acido-base dell acqua può essere alterata anche dal discioglimento di alcuni sali. Prendiamo ad esempio NH 4
CORSO DI CHIMICA PER L AMBIENTE Lezione del 5 Maggio 2016 Sali Acidi o Basici La neutralità acido-base dell acqua può essere alterata anche dal discioglimento di alcuni sali. Prendiamo ad esempio NH 4
SAGGI DI RICONOSCIMENTO DEI FENOLI
 SAGGI DI RICONOSCIMENTO DEI FENOLI SAGGI DI RICONOSCIMENTO ADOPERATI: 1- Saggio con FeCl 3 2- Saggio con Acqua di Bromo 3- Formazione coloranti Azoici 4- Saggio di Liebermann (Indofenolo) 5- Saggio
SAGGI DI RICONOSCIMENTO DEI FENOLI SAGGI DI RICONOSCIMENTO ADOPERATI: 1- Saggio con FeCl 3 2- Saggio con Acqua di Bromo 3- Formazione coloranti Azoici 4- Saggio di Liebermann (Indofenolo) 5- Saggio
Gruppo carbonilico. Il gruppo carbonilico è caratterizzato dalla presenza C=O ed i composti che lo contengono vengono definiti composti carbonilici.
 Gruppo carbonilico Il gruppo carbonilico è caratterizzato dalla presenza C= ed i composti che lo contengono vengono definiti composti carbonilici. H R R R R H R R aldeidi chetoni acidi carbossilici ac.
Gruppo carbonilico Il gruppo carbonilico è caratterizzato dalla presenza C= ed i composti che lo contengono vengono definiti composti carbonilici. H R R R R H R R aldeidi chetoni acidi carbossilici ac.
Leggere attentamente il file sulla sicurezza prima di accedere al laboratorio
 Didattica della Chimica organica (2 CFU, 16h) PAS/TFA A012/A013 16 ore: 4 ore Lezioni frontali: Lunedì 9 febbraio 2015, ore 15.00-16.30 mercoledì 11 febbraio 2015, ore 15.00-16.30 Aula A1 III piano edificio
Didattica della Chimica organica (2 CFU, 16h) PAS/TFA A012/A013 16 ore: 4 ore Lezioni frontali: Lunedì 9 febbraio 2015, ore 15.00-16.30 mercoledì 11 febbraio 2015, ore 15.00-16.30 Aula A1 III piano edificio
Ammine. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Sintesi dell acetanilide
 Sintesi dell acetanilide N 2 Cl N + + C 3 benzenammina anidride etanoica N - fenilacetammide acido etanoico (anilina) (anidride acetica) (acetanilide) (acido acetico) d = 1,02 g/ml d = 1,08 g/ml PM = 135
Sintesi dell acetanilide N 2 Cl N + + C 3 benzenammina anidride etanoica N - fenilacetammide acido etanoico (anilina) (anidride acetica) (acetanilide) (acido acetico) d = 1,02 g/ml d = 1,08 g/ml PM = 135
Assorbimenti di alcani (stretching. Corso Metodi Fisici in Chimica Organica Prof. Renzo LUISI Uniba. vietata la vendita
 Assorbimenti di alcani (stretching C-H) Corso Metodi Fisici in Chimica rganica Prof. Renzo LUISI Uniba. vietata la vendita Analisi di spettri: ALCANI (C-H) 4000 3500 3000 2500 2000 1500 1300 1000 700 500
Assorbimenti di alcani (stretching C-H) Corso Metodi Fisici in Chimica rganica Prof. Renzo LUISI Uniba. vietata la vendita Analisi di spettri: ALCANI (C-H) 4000 3500 3000 2500 2000 1500 1300 1000 700 500
Mg-C. Δel = 1.3 C.I. = 34%
 Mg-C Δel = 1.3 C.I. = 34% COMPOSTI ORGANOMETALLICI Sono composti che contengono un legame C-Metallo (R-M) dove R è un residuo organico e M un metallo monovalente (Na, Li) o bivalente (Mg). In genere il
Mg-C Δel = 1.3 C.I. = 34% COMPOSTI ORGANOMETALLICI Sono composti che contengono un legame C-Metallo (R-M) dove R è un residuo organico e M un metallo monovalente (Na, Li) o bivalente (Mg). In genere il
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
PROPRIETA FISICHE DEI COMPOSTI ORGANICI
 PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
SECONDA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 SECONDA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Seconda Esperienza di Laboratorio Riconoscimento del doppio legame Saggio con KMnO 4 (Baeyer) Riconoscimento della struttura aromatica Saggio di
SECONDA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Seconda Esperienza di Laboratorio Riconoscimento del doppio legame Saggio con KMnO 4 (Baeyer) Riconoscimento della struttura aromatica Saggio di
Teorie Acido-Base. valutazione degli acidi
 Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
ACIDI e BASI: evoluzione del concetto
 ACIDI E BASI ACIDI e BASI: evoluzione del concetto Acidi e basi di Arrhenius Gli acidi sono composti che, in soluzione acquosa, si dissociano liberando ioni H +. Esempi: HCl, H 2 SO 4, HI, H 3 PO 4 Le
ACIDI E BASI ACIDI e BASI: evoluzione del concetto Acidi e basi di Arrhenius Gli acidi sono composti che, in soluzione acquosa, si dissociano liberando ioni H +. Esempi: HCl, H 2 SO 4, HI, H 3 PO 4 Le
I gruppi funzionali: GLI ALCOLI, FENOLI E TIOLI
 I gruppi funzionali: GLI ALCOLI, FENOLI E TIOLI La struttura Un alcol può essere considerato come un idrocarburo (alifatico o aromatico) a cui è stato sostituito un gruppo (ossidrile) Il nome deriva dalla
I gruppi funzionali: GLI ALCOLI, FENOLI E TIOLI La struttura Un alcol può essere considerato come un idrocarburo (alifatico o aromatico) a cui è stato sostituito un gruppo (ossidrile) Il nome deriva dalla
REATTIVITÀ DI R-XR M + R
 ... X.. M. M. M. M. M 2e- trasferiti dalla superficie metallica in 1 o 2 stadi EATTIVITÀ DI -X... X. -.. Ṙ.. - M + M + δ- δ+ -M nucleofilo -X elettrofilo 1) EAZIONE DI WUTZ -X + - Na + - + Na + X - 2)
... X.. M. M. M. M. M 2e- trasferiti dalla superficie metallica in 1 o 2 stadi EATTIVITÀ DI -X... X. -.. Ṙ.. - M + M + δ- δ+ -M nucleofilo -X elettrofilo 1) EAZIONE DI WUTZ -X + - Na + - + Na + X - 2)
Esercitazione 3. Tipi di soluzioni. Cristallizzazione. Ricristallizzazione. Preparazione del nitrato di potassio
 Esercitazione 3 Preparazione del nitrato di potassio Tipi di soluzioni!la sostanza che si scioglie è detta SOLUTO!La sostanza che scioglie è detta SOLVENTE Soluzione non satura: soluzione che contiene
Esercitazione 3 Preparazione del nitrato di potassio Tipi di soluzioni!la sostanza che si scioglie è detta SOLUTO!La sostanza che scioglie è detta SOLVENTE Soluzione non satura: soluzione che contiene
I composti organici. Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H)
 I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
ACIDO ACETILSALICILICO. Fenomeni visibili con FeCl 3 dopo idrolisi
 ACID ACETILSALICILIC Fenomeni visibili con FeCl 3 dopo idrolisi AC. ACETILSALICILIC (PF 141-144 C) C CC 3 Aspirina. Attività antinfiammatoria, analgesica e antipiretica (FANS). Utilizzato a basso dosaggio
ACID ACETILSALICILIC Fenomeni visibili con FeCl 3 dopo idrolisi AC. ACETILSALICILIC (PF 141-144 C) C CC 3 Aspirina. Attività antinfiammatoria, analgesica e antipiretica (FANS). Utilizzato a basso dosaggio
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1
 CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
AMMINE. Ammine aromatiche: I sostituenti con effetto +I aumentano la basicità, mentre quelli con carattere I la diminuiscono.
 AMMIE Le ammine possono essere classificate in ammine alifatiche ed aromatiche. Tra le prime quelle a basso peso molecolare sono volatili e riconoscibili dall odore ammoniacale. Le primarie e le secondarie
AMMIE Le ammine possono essere classificate in ammine alifatiche ed aromatiche. Tra le prime quelle a basso peso molecolare sono volatili e riconoscibili dall odore ammoniacale. Le primarie e le secondarie
Saggi di riconoscimento dei gruppi funzionali e preparazione dei derivati cristallini
 Saggi di riconoscimento dei gruppi funzionali e preparazione dei derivati cristallini F. rtuso - Analisi dei Medicinali II Derivati cristallini Il riconoscimento dei gruppi funzionali presenti in un composto
Saggi di riconoscimento dei gruppi funzionali e preparazione dei derivati cristallini F. rtuso - Analisi dei Medicinali II Derivati cristallini Il riconoscimento dei gruppi funzionali presenti in un composto
Marco Bonechi Allievo dell I.T.S. T. Buzzi - Prato. ESERCIZI SUL ph 3 0,002 0, Completa la seguente tabella relativa a acidi o basi deboli.
 ESERCIZI SUL ph Livello difficoltà 1 (dalla concentrazione, calcolare il valore del ph) 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2.
ESERCIZI SUL ph Livello difficoltà 1 (dalla concentrazione, calcolare il valore del ph) 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2.
COMPORTAMENTO DI SALI CONTENENTI PARTICOLARI CATIONI IN SEGUITO A TRATTAMENTO CON COMPLESSANTI, BASI ED ACIDI
 COMPORTAMENTO DI SALI CONTENENTI PARTICOLARI CATIONI IN SEGUITO A TRATTAMENTO CON COMPLESSANTI, BASI ED ACIDI Perché le soluzioni dei cationi metallici di partenza sono acide. Una volta sciolto un sale
COMPORTAMENTO DI SALI CONTENENTI PARTICOLARI CATIONI IN SEGUITO A TRATTAMENTO CON COMPLESSANTI, BASI ED ACIDI Perché le soluzioni dei cationi metallici di partenza sono acide. Una volta sciolto un sale
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Reazioni degli Alogenuri Alchilici. Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici.
 Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Reazioni degli alcoli
 Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Soluzioni RAGIONAMENTO LOGICO E CULTURA GENERALE. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta.
 Soluzioni 1 A 2 B 3 B 4 E 5 D 6 E 7 B 8 D 9 C 10 B 11 D 12 B 13 E 14 D 15 C 16 C 17 B 18 D 19 A 20 C 21 D 22 C 23 D 24 C 25 E 26 C 27 D 28 C 29 B 30 B 31 D 32 E 33 B 34 C 35 E 36 A 37 D 38 B 39 C 40 D
Soluzioni 1 A 2 B 3 B 4 E 5 D 6 E 7 B 8 D 9 C 10 B 11 D 12 B 13 E 14 D 15 C 16 C 17 B 18 D 19 A 20 C 21 D 22 C 23 D 24 C 25 E 26 C 27 D 28 C 29 B 30 B 31 D 32 E 33 B 34 C 35 E 36 A 37 D 38 B 39 C 40 D
TITOLAZIONE DI PRECIPITAZIONE
 TITOLAZIONE DI PRECIPITAZIONE Nelle titolazioni di precipitazione si ha la formazione di un sale poco solubile. Il K ps sostituisce il K w dell acqua ed il pme o il px sostituiscono rispettivamente il
TITOLAZIONE DI PRECIPITAZIONE Nelle titolazioni di precipitazione si ha la formazione di un sale poco solubile. Il K ps sostituisce il K w dell acqua ed il pme o il px sostituiscono rispettivamente il
Introduzione alla Chimica Organica V Ed.
 William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
Composti carbonilici: Aldeidi Chetoni Acidi carbossilici Alogenuri acilici Esteri Ammidi Anidridi Nitrili
 Composti carbonilici: Aldeidi Chetoni Acidi carbossilici Alogenuri acilici Esteri Ammidi Anidridi Nitrili Struttura di composti carbonilici sp 2 sp 2 C = C H 3 C CH3 Il carbonile è un raggruppamento atomico
Composti carbonilici: Aldeidi Chetoni Acidi carbossilici Alogenuri acilici Esteri Ammidi Anidridi Nitrili Struttura di composti carbonilici sp 2 sp 2 C = C H 3 C CH3 Il carbonile è un raggruppamento atomico
ACIDI CARBOSSILICI. ac. formico ac. acetico ac. benzoico
 ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche I primi termini della serie sono liquidi incolori
ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche I primi termini della serie sono liquidi incolori
 2NH3(g) Pa(Ag)=108 Pa(I)=127 pf(agi)=235 -> S(g/l) =S(m/l) pf = 9.2 10-9 235 =2162 10-9 = 2.16 10-6 (g/l) Effetto del ph Anche il ph può influenzare la solubilità di un sale poco solubile. E ciò
2NH3(g) Pa(Ag)=108 Pa(I)=127 pf(agi)=235 -> S(g/l) =S(m/l) pf = 9.2 10-9 235 =2162 10-9 = 2.16 10-6 (g/l) Effetto del ph Anche il ph può influenzare la solubilità di un sale poco solubile. E ciò
Aldeidi e chetoni. 1) Rottura α 2) Rottura i. Più pronunciate nei chetoni. 3) Rottura β con trasposizione di H in γ (McLafferty)
 Aldeidi e chetoni Hanno potenziale di ionizzazione inferiore a quello degli alcooli dunque lo ione molecolare è più intenso e più facilmente osservabile anche in aldeidi e chetoni superiori. 1) Rottura
Aldeidi e chetoni Hanno potenziale di ionizzazione inferiore a quello degli alcooli dunque lo ione molecolare è più intenso e più facilmente osservabile anche in aldeidi e chetoni superiori. 1) Rottura
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
 SLUBILITA SLUBILITA IN ACQUA MLECLE DI ACQUA SLUBILITA Rappresenta un parametro di estrema importanza che molto spesso consente non solo di capire la natura della sostanza in esame ma può condurre
SLUBILITA SLUBILITA IN ACQUA MLECLE DI ACQUA SLUBILITA Rappresenta un parametro di estrema importanza che molto spesso consente non solo di capire la natura della sostanza in esame ma può condurre
Soluzioni, elettroliti e non
 Soluzioni, elettroliti e non Il processo di solubilizzazione è un processo complesso, per interpretarlo occorre conoscere la natura ei legami chimici coinvolti COSA CONSIDERARE? 1) Interazioni soluto -
Soluzioni, elettroliti e non Il processo di solubilizzazione è un processo complesso, per interpretarlo occorre conoscere la natura ei legami chimici coinvolti COSA CONSIDERARE? 1) Interazioni soluto -
Chimica Analitica e Laboratorio 2. Modulo di Spettroscopia Analitica
 Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Determinazione della costante di dissociazione di un acido debole 2 Metodi di determinazione del pk d Potenziometria K d = + [ H ][ A
Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Determinazione della costante di dissociazione di un acido debole 2 Metodi di determinazione del pk d Potenziometria K d = + [ H ][ A
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
Esperienza n. 1 PREVISIONE E RICONOSCIMENTO DI ALCUNE REAZIONI DI METATESI.
 Corso di Laboratorio di Chimica Generale Esperienza n. 1 PREVISIONE E RICONOSCIMENTO DI ALCUNE REAZIONI DI METATESI. REAZIONI IN SOLUZIONE 1 Alcuni tipi di reazioni ioniche, che non implichino processi
Corso di Laboratorio di Chimica Generale Esperienza n. 1 PREVISIONE E RICONOSCIMENTO DI ALCUNE REAZIONI DI METATESI. REAZIONI IN SOLUZIONE 1 Alcuni tipi di reazioni ioniche, che non implichino processi
Reattività degli alogenuri alchilici
 Reattività degli alogenuri alchilici 1 3 Meccanismo della Reazione di Sostituzione Nucleofila 4 5 Meccanismo unimolecolare: sostituzione nucleofila unimolecolare (SN1) Un alogenuro che reagisca con questo
Reattività degli alogenuri alchilici 1 3 Meccanismo della Reazione di Sostituzione Nucleofila 4 5 Meccanismo unimolecolare: sostituzione nucleofila unimolecolare (SN1) Un alogenuro che reagisca con questo
Sostanze organiche: determinazioni qualitative
 Fenolo ((European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (41-42 C) Identificazione A. REAZIONE con acqua di Bromo. N.B. Si lavora sotto cappa! Aggiungere a 1 ml della soluzione
Fenolo ((European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (41-42 C) Identificazione A. REAZIONE con acqua di Bromo. N.B. Si lavora sotto cappa! Aggiungere a 1 ml della soluzione
Reattività degli acidi carbossilici e loro derivati. La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica
 Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Aromaticità. Addizione elettrofila alcheni
 Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Le definizioni di acido e di base Un percorso storico
 Le definizioni di acido e di base Un percorso storico Corpaci Ivana Teoria degli acidi e delle basi w Cos è un acido?! Una sostanza corrosiva, chimicamente molto attiva, che colora di rosso la cartina
Le definizioni di acido e di base Un percorso storico Corpaci Ivana Teoria degli acidi e delle basi w Cos è un acido?! Una sostanza corrosiva, chimicamente molto attiva, che colora di rosso la cartina
Composti Carbossilici. Reattività
 omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
