ACIDI CARBOSSILCI e DERIVATI
|
|
|
- Elvira Giglio
- 5 anni fa
- Visualizzazioni
Transcript
1 AIDI ABSSILI e DEIVATI aratteristica strutturale di acidi carbossilici e derivati aratteristiche Spettrali Spettrometria di massa Acidi carbossilici Lo ione molecolare di solito è spesso debole. La rottura α (αcleavage), lascia il carbocatione acilio (stabilizzato per risonanza):.. Può essere perso il gruppo.. m/z 45 Anche con gli altri gruppi funzionali è favorita la scissione dello ione molecolare che porta al carbocatione acilio Le ammidi non sostituite sull hanno un picco caratteristico a m/z 44.. m/z 44 acido butanoico, PM 88 acetato di etile, PM 88 M M 1
2 propanammide, PM 7 m/z 44 cloruro di butanoile, PM 106 M M l anidride benzencarbossilica, PM 6 UVvisibile Analogo a quello di aldeidi e chetoni I AIDI ABSSILII stretching stretching = stretching banda molto larga a 400 cm 1, spesso sovrapposta alle bande a circa cm 1, spostato verso valori più bassi dalla coniugazione tra 10 e 110 cm 1 acido butanoico
3 I ESTEI stretching = stretching a circa 175 cm 1, spostato verso valori più bassi dalla coniugazione con. La coniugazione con sposta l assorbimento verso valori più alti. due o più bande tra 100 e 1000 cm 1 acetato di etile I AMMIDI stretching = a circa cm 1. stretching cm 1 ( hanno due bande) propanammide
4 I stretching = LUI AILII a circa 1800 cm 1, spostato verso valori più bassi dalla coniugazione. cloruro di butanoile cloruro di benzoile I AIDIDI stretching = sempre due bande tra 180 a 1800 cm 1 e tra 1775 e 1740, spostato verso valori più bassi dalla coniugazione con. stretching tra 100 e 900 cm 1 anidride propanoica 4
5 I stretching ITILI a circa 50 cm 1, spostato verso valori più bassi dalla coniugazione con. propanonitrile benzenecarbonitrile 1 M L effetto I dell ed il campo magnetico generato dagli elettroni π diminuiscono la densità elettronica attorno al nucleo del 1 : molto deschermato δ X ppm acetato di etile acido butanoico anidride propanoica propanammide 5
6 1 M L effetto I dell diminuisce la densità elettronica attorno al nucleo del 1 sul adiacente: deschermato da,0,5 ( ) fino a (, ) δ (negli acidi arbossilici) fortemente deschermato: 1015 δ; protone mobile, scambia con D (nelli ammidi) deschermato e molto allargato: 67 δ; protone mobile, scambia con D acido butanoico acido benzencarbossilico acetato di etile propanammide metiletanammide anidride benzoica 6
7 AIDI ABSSILI e DEIVATI sp δ δ acido aratteristiche: acido u: Acidità del legame Il del carbossile subisce attacco da parte dei nucleofili I protoni in α al carbossile sono relativamente acidi e possono essere sostituiti sp gruppo uscente Y δ δ aratteristiche: sull' del carbonile (o sull' del nitrile) si ha protonazione I protoni in α al carbonile sono relativamente acidi e possono essere strappati con basi forti Qualche reazione caratteristica delle ammidi avviene sull' acido u: eazione caratteristica SSTITUZIE ULEFILA sp δ δ (la sostituzione nucleofila può avvenire con meccanismo base o acidocatalizzato) acido u: 7
8 Meccanismo: u: u lento Y Y sp sp (trigonale planare) (tetraedrico) u sp (trigonale planare) SSTITUZIE ULEFILA AL ABI AILI Principali nucleofili: :u =,,,,, S, u: =,, < < < < ' S' l reattività crescente Questo ordine di reattività è il risultto di più fattori Basicità del gruppo uscente meno basico: miglior gruppo uscente Basicità: < < () < l capacità come gruppo uscente isonanza l S' l S' ' ' 8
9 il contributo della struttura di risonanza a separazione di carica diminuisce la bontà del gruppo uscente ed è tanto maggiore quanto migliore è la sovrapposizione degli orbitali (cioè con gli elementi della stessa riga). Effetto induttivo Maggiore è l effetto ad attrazione elettronica, più positivo è il carbonilico EATTIVITA ESETE l ' più facile è l attacco del nucleofilo oppure EATTIVITA ESETE l " " ' EATTIVITA ESETE l ' 9
10 1. EAZIE u = a) Alogenuri acilici l : lento l l Sostituenti ad attrazione elettronica su FAILITA l'attacco del nucleofilo b) Esteri Gli esteri sono meno reattivi degli alogenuri acilici: l acqua da sola non reagisce), oppure, In ambiente basico u = lento : ' ' ' reazione acidobase ' L'ultimo passaggio rende IEVESIBILE l'intero processo Sostituenti ad attrazione elettronica su FAILITA l'attacco del nucleofilo In ambiente acido u = ' ' ' lento ' : ' ' ' Processo EVESIBILE Questo significa che in ambiente acido si può idrolizzare un estere ad acido carbossilico L'idrolisi acida degli esteri è praticamente insensibile agli effetti elettronici dei sostituenti; è invece sensibile agli effetti sterici ATTEZIE Questa insensibilità agli effetti elettronici (induttivo e coniugativo) dei sostituenti è una caratteristica SL dell IDLISI AIDA degli ESTEI è il risultato di effetti opposti, praticamente uguali 10
11 Lo stadio lento è l attacco del nucleofilo sull estere protonato: dipende quindi dalla sua concentrazione, che, a sua volta, dipende dalla basicità dell estere K = [()' ] [ '][ ] [()'] = K [ '][ ] v = k[()' ] = kk [ '][ ] La reattività dipende dalla costante di velocità dello stadio lento (k) E dalla costante di equilibrio acidobase preliminare (K) k K l'attacco del nucleofilo è favorito dai sostituenti ad attrazione elettronica la protonazione di una base è sfavorita dai sostituenti ad attrazione elettronica Solo nel caso dell'idrolisi acida degli esteri gli effetti hanno valori molto simili, cioè la sensibilità della protonazione e dell'attacco nucleofilo all'effetto dei sostituenti è praticamente la stessa. Essendo di segno opposto, gli effetti si annullano. c) Ammidi Le ammidi sono ancora meno reattive: l acqua da sola non reagisce), oppure, In ambiente basico u = : lento i sono solo ATTIVI gruppi uscenti, e, ma è più AID di : reazione acidobase L'ultimo passaggio rende IEVESIBILE l'intero processo Sostituenti ad attrazione elettronica su FAILITA l'attacco del nucleofilo 11
12 In ambiente acido u = lento : 4 L'ultimo passaggio rende IEVESIBILE l'intero processo Sostituenti ad attrazione elettronica su FAILITA l'attacco del nucleofilo d) Anidridi u = Le anidridi sono più reattive di esteri ed ammidi: basta l acqua da sola : e) itrili L'ultimo passaggio rende IEVESIBILE l'intero processo Sostituenti ad attrazione elettronica su FAILITA l'attacco del nucleofilo I nitrili sono poco reattivi (meno delle ammidi): l acqua da sola non reagisce), oppure, 1
13 In ambiente acido u = : lento : tautomeria PSEGUE con l'idrolisi acida delle ammidi : 4 L'ultimo passaggio rende IEVESIBILE l'intero processo Sostituenti ad attrazione elettronica su FAILITA l'attacco del nucleofilo. EAZIE ALLI a) Acidi carbossilici In ambiente acido u = lento : ' ' ' ' ' ' La reazione intramolecolare è facile, se si formano anelli stabili (5 e 6 termini) : γ γlattone 1
14 : δ δlattone se l' è più vicino al carbossile, ci sono altri percorsi di reazione, più facili della chiusura di un anello teso β βeliminazione α lattide se l' è più lontano dal carbossile, il prodotto dipende dalle condizioni di reazione in soluzione molto diluita: in soluzione concentrata: n ( ) n n b) Alogenuri acilici l.. ' lento l ' l E opportuno effettuare la reazione in presenza di una base (per l) 14
15 es.: l l c) Anidridi.. ' ' ' ' ' d) Esteri TASESTEIFIAZIE In ambiente basico u = ' :" lento " ' " ' In ambiente acido u = ' " ' ' lento : " ' " ' " " " ' " 15
16 e) Ammidi Essendo meno reattive, richiedono condizioni di reazione troppo energiche per essere utili. EAZIE AMMIAA ED AMMIE a) Acidi carbossilici con : 4 reazione acidobase Scaldando il carbossilato di ammonio solido: 4 (solido) Meccanismo: 4 : con ammine primarie (solido) Meccanismo: 16
17 con ammine secondarie : (solido) Meccanismo: : Se si ha un amminoacido con il gruppo amminico in γ o δ al carbossile, la reazione è intramolecolare (si formano anelli a 5 o a 6 termini) γ γlattame δ δlattame se l è più vicino al carbossile, ci sono altri percorsi di reazione, più facili della chiusura di un anello teso β βeliminazione 17
18 b) Alogenuri acilici Meccanismo: l : lento l l l l : 4 l ' ' l ' l '" '" l ' " c) Anidridi : 4 18
19 ' ' 4 " ' '" Le anidridi cicliche danno immidi.. 4 anidride ftalica ftalimmide base debole, acido 4.. :B B d) Esteri lento : ' ' ' ' Gli esteri sono meno reattivi di alogenuri acilici e anidridi e perciòbisogna scaldare ' " " ' ' " ''' ' " ''' 19
20 4. EAZIE AIDI ABSSILII E ABSSILATI on questi nucleofili possono reagire solo I derivati acilici più reattivi a) Alogenuri acilici l l l l es: l l l neutralizzato con una base man mano che si forma l b) Acidi carbossilici (SL con acidi bicarbossilici in grado di formare anelli stabili). EAZIE TILI a) Alogenuri acilici ' S l l ' S l es: S l S l S' 0
21 6. EAZIE MPSTI GAMETALLII a) Esteri ' " con reattivi di Grignard e litioorganici MgX δ δ MgX ' " ' "MgX da qui prosegue la reazione dei chetoni MgX δ δ, ' MgX ' ' i chetoni sono più reattivi degli esteri e perciò si arriva all'alcool terziario es.: MgBr, MgBr ' " δ Li δ Li ' " ' "Li da qui prosegue la reazione dei chetoni δ Li δ, ' Li ' b) loruri acilici MgX δ δ ' l MgX ' l ' ' MgXl con accorgimenti sperimentali, è possibile fermare la reazione alla formazione del chetone, altrimenti, si arriva ad alcool terziario δ MgX δ, ' MgX ' ' 1
22 ' l Li δ Li δ ' l ' Lil ' Li δ δ, Li ' ' con cadmioorganici e cuprati organici Per fermare la reazione a chetone si devono usare: composti organometallici meno reattivi solo con i cloruri acilici MgX dl d Mgl MgX ( =, alchile primario, fenile) esempio: MgBr dl d d l l ' l δ δ uli ' l ' es.: l ( ) uli l ( ) uli 78 (feromone delle formiche) 9%
23 IDUZII a) on idruro LiAl 4 LiAl 4 l ' LiAl 4 LiAl 4 LiAl 4 Meccanismo: Al (Li ) (Li ) Al Y = l, ', Al : Y Y : Y Y = Y :
24 : : : Diminuendo la reattività dell'idruro è possibile fermare ad aldeide la riduzione dei LUI AILII [( Li ) ] Al l es.: l [( Li ) ] Al b) on idrogeno e catalizzatore, Pt on catalizzatore disattivato è possibile fermare ad aldeide la riduzione degli ALGEUI AILII Pd, BaS 4 l Pd, chinolina es.: l Pd 4
25 EAZII SPEIFIE DELLE SIGLE LASSI DI GUPPI FUZIALI 1. Acidi carbossilici (a) trasformazione del gruppo in buon gruppo uscente cattivo gruppo uscente Per trasformarlo in buon gruppo uscente si possono utilizzare i reagenti che trasformano in l on agenti alogenanti l Sl l S l Pl 5 l Pl l Pl P() esempi: l S l l l S Pl 5 l l Pl Pl l P() Meccanismo con Sl : l S l S l l S l l S S l on diazometano:.. : : : reazione acidobase u sp ottimo gruppo uscente 5
26 on diazometano si formano esteri metilici on dicicloesilcarbodiimmide, D u.. ' ' Addizione nucleofila buon gruppo uscente ' ' reazione acidobase dicicloesilurea La D permette di ottenere ammidi dagli acidi carbossilici in condizioni molto blande b) reazione in posizione α PBr, Br oppure P Br Br αalogenazione eazione VZ (ellvolhardzelinski) Meccanismo:.. PBr Br Br gli alogenuri acilici enolizzano più facilmente degli acidi carbossilici Il = addiziona Br 6
27 Br Br Br Br Br Br Br Br Br Br Quando si lavora la reazione (aggiunta di acqua), il bromuro acilico è più reattivo di quello alchilico. ppure si possono aggiungere nucleofili Br Br Br, Br Br. Esteri on alcossido (condensazione di laisen) a L alcossido DEVE essere identico al gruppo dell estere Meccanismo: (a ) a E reazione acidobase : (equilibrio spostato a sinistra) u (equilibrio spostato a sinistra) 7
28 più acidi di quelli dell estere di partenza (equilibrio spostato a destra) (a ) E' possibile la condensazione incrociata, quando un solo estere ha in α: 1. a. qualsiasi carbanione è in grado di dare condensazione a ( ) (a ) ( ) ( ). Ammidi on anidride fosforica, P 5 on con Br a (Trasposizione di ofmann) Br 4 a abr a (oppure abr, ) meccanismo Br Br Br Br bromoammide 8
29 Br Br Br.. nitrene.... isocianato Br DEABSSILAZIE a) da carbossilati di metalli pesanti (reazione di unsdiecker) Ag Ag g g ) Pb( ) 4 Pb 4 ) 4 Ag Br (o I ) Br ( I) 9
30 meccanismo: Br Br Br acil ipobromito inizio Br.. : : :... : Br radicale carbossilato : :.. propagazione..... Br Br..... b) da βchetoacidi # in ambiente basico: 0
31 b) da acidi βdicarbossilici # la decarbossilazione è favorita da sostituenti ad attrazione elettronica SITESI "AETAETIA" Sfrutta l'acidità degli in mezzo a due e la facile decarbossilazione dei βchetoacidi : ecc. a " (a " " ) c'è ancora un acido (meno di prima ) ( ) K : (K ) " sostituzione nucleofila 1 X al saturo, 1 " idrolisi " basica 1 X sostituzione nucleofila al saturo, " idrolisi " basica neutralizzazione (acidobase) " decarbossilazione 1.. " 1 " 1
32 Scegliendo opportunamente il reagente X, si possono ottenere chetoni con un altro gruppo funzionale X = αalogenoesteri : Br β β 1. a,. α γ γchetoacido X = αalogenochetoni : 1. a, Br. α β γdichetone X = alogenuri acilici on si può usare come base a in, perché l'alogenuro acilico è molto reattivo (e reagisce con l etossido ed anche con l'etanolo)
33 a : l 1. a,. βdichetone on una base molto forte (ammide di sodio o di potassio) si possono strappare due protoni. Il dianione può essere fatto reagire con un equivalente di alogenuro alchilico K : K : 4 l X.. per la neutralizzazione conviene usare l'acido coniugato del solvente il βchetoestere con catena allungata può essere utilizzato in tutte le reazioni viste in precedenza SITESI "MALIA" Sfrutta l'acidità del metilene tra due funzioni esteree e la facile decarbossilazione degli acidi βdicarbossilici : propandioato dietilico (malonato dietilico) "estere malonico" : X 1., X. acido acetico αsostituito
34 ( ) K : ' X 1., '.., ' acido acetico α,αdisostituito La reazione si può effettuare con tutti gli alogeno derivati utilizzati con il ossobutanoato di etile (estere acetoacetico) alogenuri alchilici, alogenuri acilici, αalogenochetoni, αalogenoesteri altri esempi (che si possono usare anche nella sintesi acetoacetica: X = α,ωdialogenoalcani a a : ( ) K : ' X 1., '.., ' acido acetico α,αdisostituito La reazione si può effettuare con tutti gli alogeno derivati utilizzati con il ossobutanoato di etile (estere acetoacetico) alogenuri alchilici, alogenuri acilici, αalogenochetoni, αalogenoesteri altri esempi (che si possono usare anche nella sintesi acetoacetica: X = α,ωdialogenoalcani a a : 4
35 a) in eccesso di estere : Br ( ) : n Br ( ) n 1), ( ) ( ) n n ) acido bicarbossilico b) in quantità equimolari : Br ( ) n Br ( ) n Br : ( ) n Br ( ) 1) n, ( ) ( n ) n ) n =,,4,5 acidi cicloalcancarbossilici 5
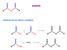
anidridi C R PREPARAZIONE DELLE ANIDRIDI + R C O - C Cl C R + P 2 O 5 C R C OH
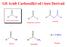
 anidridi PEPAAZINE DELLE ANIDIDI l P 2 5 Nu = 2 Le anidridi sono più reattive di esteri ed ammidi: basta l acqua da sola : 2 2 2 2 EAZINI DELLE ANIDIDI: con acqua '.. ' ' ' ' EAZINI DELLE ANIDIDI: con
anidridi PEPAAZINE DELLE ANIDIDI l P 2 5 Nu = 2 Le anidridi sono più reattive di esteri ed ammidi: basta l acqua da sola : 2 2 2 2 EAZINI DELLE ANIDIDI: con acqua '.. ' ' ' ' EAZINI DELLE ANIDIDI: con
Composti Carbossilici. Reattività
 omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
Reattività degli acidi carbossilici e loro derivati. La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica
 Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
COMPOSTI AROMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti.
 MPSTI AMATII L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. aratteristiche Spettrali La maggior parte dei composti aromatici Spettrometria
MPSTI AMATII L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. aratteristiche Spettrali La maggior parte dei composti aromatici Spettrometria
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1
 CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
Gli Acidi Carbossilici ed i loro Derivati
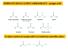
 Gli Acidi arbossilici ed i loro Derivati Acido carbossilico X Alogenuro acilico Anidride ' ' N 2 N Estere Ammide Nitrile Nomenclatura degli Acidi arbossilici 3 3 2 3 2 1 Acido propanoico 3 2 2 5 4 3 2
Gli Acidi arbossilici ed i loro Derivati Acido carbossilico X Alogenuro acilico Anidride ' ' N 2 N Estere Ammide Nitrile Nomenclatura degli Acidi arbossilici 3 3 2 3 2 1 Acido propanoico 3 2 2 5 4 3 2
Idrogeni in α a un carbonile
 Enoli e Enolati 1 Idrogeni in α a un carbonile Solo gli idrogeni α sono acidi Gli idrogeni β, γ e δ non sono acidi non possono essere rimossi da una base acido non acidi α β γ δ 2 Enoli Tutti i composti
Enoli e Enolati 1 Idrogeni in α a un carbonile Solo gli idrogeni α sono acidi Gli idrogeni β, γ e δ non sono acidi non possono essere rimossi da una base acido non acidi α β γ δ 2 Enoli Tutti i composti
Reazioni degli Alogenuri Alchilici. Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici.
 Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Acidi carbossilici e derivati
 Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
ALDEIDI e CHETONI. O sp 2 legato a C sp 2
 aratteristica strutturale di aldeidi e chetoni ALDEIDI e ETI sp legato a sp = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che con i chetoni.
aratteristica strutturale di aldeidi e chetoni ALDEIDI e ETI sp legato a sp = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che con i chetoni.
I composti acilici sono tutti quei composti che contengono il gruppo:
 omposti acilici I composti acilici sono tutti quei composti che contengono il gruppo: X in cui, contrariamente a quello che si ha nei composti carbonilici, X è un atomo o gruppo più elettronegativo di.
omposti acilici I composti acilici sono tutti quei composti che contengono il gruppo: X in cui, contrariamente a quello che si ha nei composti carbonilici, X è un atomo o gruppo più elettronegativo di.
Composti carbonilici
 Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Addizioni nucleofile. Addizioni a C=O
 Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Assorbimenti di alcani (stretching. Corso Metodi Fisici in Chimica Organica Prof. Renzo LUISI Uniba. vietata la vendita
 Assorbimenti di alcani (stretching C-H) Corso Metodi Fisici in Chimica rganica Prof. Renzo LUISI Uniba. vietata la vendita Analisi di spettri: ALCANI (C-H) 4000 3500 3000 2500 2000 1500 1300 1000 700 500
Assorbimenti di alcani (stretching C-H) Corso Metodi Fisici in Chimica rganica Prof. Renzo LUISI Uniba. vietata la vendita Analisi di spettri: ALCANI (C-H) 4000 3500 3000 2500 2000 1500 1300 1000 700 500
Esteri degli acidi carbossilici
 Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
ACIDI CARBOSSILICI e derivati
 ACIDI CABSSILICI e derivati Il nome sistematico di un acido carbossilico alchilico si fa derivare dal nome dell idrocarburo con lo stesso numero di atomi di carbonio, sostituendo la o finale con la desinenza
ACIDI CABSSILICI e derivati Il nome sistematico di un acido carbossilico alchilico si fa derivare dal nome dell idrocarburo con lo stesso numero di atomi di carbonio, sostituendo la o finale con la desinenza
Sostituzione nucleofila Addizione a gruppi carbonilici Addizione a doppi legami attivati
 himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
Composti carbonilici Acidi carbossilici
 Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
ACIDI CARBOSSILICI. ac. formico ac. acetico ac. benzoico
 ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche I primi termini della serie sono liquidi incolori
ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche I primi termini della serie sono liquidi incolori
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici. Componente principale dell aceto. Principio attivo di molti farmaci. Resina per abbigliamento
 Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
AMMINE R'' H H C 2 H 5 C H C H C H NH 2 H H. azoto. alifatici o aliciclici. ammina primaria ammina secondaria ammina terziaria N CH 3
 AMMIE Si chiamano primarie le ammine che hanno un solo gruppo alchilico o aromatico legato all azoto azoto. Sono secondarie e terziarie le ammine al cui atomo di azoto sono legate, rispettivamente,, due
AMMIE Si chiamano primarie le ammine che hanno un solo gruppo alchilico o aromatico legato all azoto azoto. Sono secondarie e terziarie le ammine al cui atomo di azoto sono legate, rispettivamente,, due
Acidi carbossilici: nomenclatura. alcano -> acido alcanoico
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
La condensazione di Claisen
 La condensazione di Claisen Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione
La condensazione di Claisen Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione
Si trovano generalmente come dimeri ciclici a causa dei legami a idrogeno
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Esercitazione n Reazioni e meccanismi di aldeidi e chetoni.
 19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
Aldeidi e chetoni. 1) Rottura α 2) Rottura i. Più pronunciate nei chetoni. 3) Rottura β con trasposizione di H in γ (McLafferty)
 Aldeidi e chetoni Hanno potenziale di ionizzazione inferiore a quello degli alcooli dunque lo ione molecolare è più intenso e più facilmente osservabile anche in aldeidi e chetoni superiori. 1) Rottura
Aldeidi e chetoni Hanno potenziale di ionizzazione inferiore a quello degli alcooli dunque lo ione molecolare è più intenso e più facilmente osservabile anche in aldeidi e chetoni superiori. 1) Rottura
Composti carbonilici. Composti carbonilici. Componente principale dell aceto. Principio attivo di molti farmaci. Resina per abbigliamento
 Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Composti carbonilici. Componente principale dell aceto. Principio attivo di molti farmaci. Resina per abbigliamento
 Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico
 Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico Legami idrogeno. Il legame carbonio-ossigeno è un legame polare, con una
Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico Legami idrogeno. Il legame carbonio-ossigeno è un legame polare, con una
Esercitazione n Reazioni e meccanismi di acidi carbossilici e derivati.
 Esercitazione n. 16 Reazioni e meccanismi di acidi carbossilici e derivati. 1. Scrivere i prodotti (specificandone il nome) che si ottengono quando l'acido butanoico viene fatto reagire con ciascuno dei
Esercitazione n. 16 Reazioni e meccanismi di acidi carbossilici e derivati. 1. Scrivere i prodotti (specificandone il nome) che si ottengono quando l'acido butanoico viene fatto reagire con ciascuno dei
DERIVATI DEGLI ACIDI CARBOSSILICI gruppo acile
 DERIVATI DEGLI ACIDI CARBOSSILICI gruppo acile Acido carbossilico, Alogenuro acilico, Anidride, Estere, Ammide, Tioestere, Fosfato acilico La tipica reazione dei gruppi acilici è la sostituzione nucleofila
DERIVATI DEGLI ACIDI CARBOSSILICI gruppo acile Acido carbossilico, Alogenuro acilico, Anidride, Estere, Ammide, Tioestere, Fosfato acilico La tipica reazione dei gruppi acilici è la sostituzione nucleofila
Derivati degli acidi carbossilici
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Derivati degli acidi carbossilici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Derivati degli acidi carbossilici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
p p s sp sp sp s p p 1
 p p s sp p sp sp p s 1 alcheni 63 kcal/mol alchini 2 nd 54 kcal/mol 2 Come per gli alcheni, gli alchini interni sostituiti sono più stabili di quelli esterni More stable Etino (acetilene) C 2 H 2 +O 2
p p s sp p sp sp p s 1 alcheni 63 kcal/mol alchini 2 nd 54 kcal/mol 2 Come per gli alcheni, gli alchini interni sostituiti sono più stabili di quelli esterni More stable Etino (acetilene) C 2 H 2 +O 2
Gruppi funzionali. aldeidi
 Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Acidi carbossilici. IUPAC catena più lunga contenente il gruppo -COOH al quale si dà il nome dell'alcano in cui la desinenza -o è sostituita con -oico
 Acidi carbossilici caratterizzati dal gruppo carbossilico - R alifatici Ar aromatici IUPA catena più lunga contenente il gruppo - al quale si dà il nome dell'alcano in cui la desinenza -o è sostituita
Acidi carbossilici caratterizzati dal gruppo carbossilico - R alifatici Ar aromatici IUPA catena più lunga contenente il gruppo - al quale si dà il nome dell'alcano in cui la desinenza -o è sostituita
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Alcani. Idrogenazione degli alcheni. Riduzione degli areni H 2. /Pt H 3. Ni + 3 H C, 180 atm
 Sintesi Alcani Idrogenazione degli alcheni 2 /Pt 2 /Pt 3 3 iduzione degli areni Ni + 3 2 175, 180 atm Alcheni Deidroalogenazione degli alogenuri alchilici 3 α 3 X β 3 Disidratazione degli alcoli Idrogenazione
Sintesi Alcani Idrogenazione degli alcheni 2 /Pt 2 /Pt 3 3 iduzione degli areni Ni + 3 2 175, 180 atm Alcheni Deidroalogenazione degli alogenuri alchilici 3 α 3 X β 3 Disidratazione degli alcoli Idrogenazione
ALDEIDI e CHETONI. Nu: sp 2. δ+ δ- C O C E + H acido ADDIZIONE NUCLEOFILA. Reazione caratteristica
 ALDEIDI e ETNI Nu: sp 2 δ δ E acido eazione caratteristica ADDIZINE NULEFILA himica rganica e Laboratorio Meccanismo: 1. Nu: Nu lento sp 2 (trigonale planare) sp 3 (tetraedrico) E Nu E generalmente E =
ALDEIDI e ETNI Nu: sp 2 δ δ E acido eazione caratteristica ADDIZINE NULEFILA himica rganica e Laboratorio Meccanismo: 1. Nu: Nu lento sp 2 (trigonale planare) sp 3 (tetraedrico) E Nu E generalmente E =
14/11/2018. Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile.
 Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Unità Didattica 10. I composti carbonilici. Struttura, nomenclatura e reattività
 I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni Il gruppo funzionale è il doppio legame C=O Il carbonile ha geometria planare (il carbonio è sp 2 ) Unità Didattica 10 I composti
I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni Il gruppo funzionale è il doppio legame C=O Il carbonile ha geometria planare (il carbonio è sp 2 ) Unità Didattica 10 I composti
Alcoli e Tioli. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcoli e Tioli Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcoli e Tioli Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Gli Alogenuri Alchilici
 Gli Alogenuri Alchilici l l F Br F F l F F l l 1,2-Dicloroetano (solvente) Aloetano (anestetico) Freon 12 (fluido refrigerante) egole IUPA per la Nomenclatura degli Alogenuri Alchilici 1.Trovare e nominare
Gli Alogenuri Alchilici l l F Br F F l F F l l 1,2-Dicloroetano (solvente) Aloetano (anestetico) Freon 12 (fluido refrigerante) egole IUPA per la Nomenclatura degli Alogenuri Alchilici 1.Trovare e nominare
Composti carbonilici: reazioni al carbonio in posizione a
 Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
ALDEIDI e CHETONI. O sp 2 legato a C sp 2. Lo ione molecolare di solito è osservabile, sia con le aldeidi che con i chetoni.
 19/05/014 aratteristica strutturale di aldeidi e chetoni ALDEIDI e ETI sp legato a sp = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che
19/05/014 aratteristica strutturale di aldeidi e chetoni ALDEIDI e ETI sp legato a sp = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
ALDEIDI e CHETONI. Lo ione molecolare di solito è osservabile, sia con le aldeidi che con i chetoni.
 ALDEIDI e ETNI aratteristica strutturale di aldeidi e chetoni sp 2 legato a sp 2 = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che con
ALDEIDI e ETNI aratteristica strutturale di aldeidi e chetoni sp 2 legato a sp 2 = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che con
Aldeidi e Chetoni. Proprietà Chimico Fisiche Sostanze Polari L ossigeno carbonilico forma forti legami H Bassi pesi molecolari sono solubili in acqua
 Aldeidi e hetoni ' Gruppo carbonilico Aldeide hetone Proprietà himico Fisiche Sostanze Polari L ossigeno carbonilico forma forti legami Bassi pesi molecolari sono solubili in acqua Nomenclatura IUPA :
Aldeidi e hetoni ' Gruppo carbonilico Aldeide hetone Proprietà himico Fisiche Sostanze Polari L ossigeno carbonilico forma forti legami Bassi pesi molecolari sono solubili in acqua Nomenclatura IUPA :
Acidi Carbossilici CH 3. Caratterizzati dalla presenza di un gruppo carbossilico. Acido etanoico (Acido Acetico) Acido metanoico (Acido Formico)
 Acidi Carbossilici Caratterizzati dalla presenza di un gruppo carbossilico CH 3 H Acido etanoico (Acido Acetico) Acido metanoico (Acido Formico) Struttura del gruppo carbossilico δ- CH 3 δ+ Il legame è
Acidi Carbossilici Caratterizzati dalla presenza di un gruppo carbossilico CH 3 H Acido etanoico (Acido Acetico) Acido metanoico (Acido Formico) Struttura del gruppo carbossilico δ- CH 3 δ+ Il legame è
Unità didattica 7 (segue) Reattività del benzene. Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili
 Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
R-X ALOGENURI ALCHILICI. F Cl Br I. Nomenclatura. In genere si indicano con. + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo
 ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
Alfa-alogenazionialogenazioni (sintesi aloformio)
 CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Acidità: Acidità di acidi, ammidi, ammine. Effetti induttivi e di risonanza. Acidità CH Enoli/enolati Tautomeria cheto enolica (acido o base catalizzata) (isomerizzazioni
CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Acidità: Acidità di acidi, ammidi, ammine. Effetti induttivi e di risonanza. Acidità CH Enoli/enolati Tautomeria cheto enolica (acido o base catalizzata) (isomerizzazioni
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Acidi carbossilici. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Acidi carbossilici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Acidi carbossilici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Lezione: aldeidi e chetoni
 Lezione: aldeidi e chetoni Il gruppo funzionale carbonilico Nomenclatura Proprietà fisiche Principali reazioni eazioni con N eazioni con alcoli eazioni con tioli eazioni con ammine Tautomeria cheto-enolica
Lezione: aldeidi e chetoni Il gruppo funzionale carbonilico Nomenclatura Proprietà fisiche Principali reazioni eazioni con N eazioni con alcoli eazioni con tioli eazioni con ammine Tautomeria cheto-enolica
1
 1 2 3 4 5 ANSWERS 6 7 8 9 Fattori che determinano la forza acida Regola generale: Qualsiasi cosa che stabilizzi una base coniugata A: - rende l acido di partenza, H-A, più acido. Quattro fattori: [1] Effetti
1 2 3 4 5 ANSWERS 6 7 8 9 Fattori che determinano la forza acida Regola generale: Qualsiasi cosa che stabilizzi una base coniugata A: - rende l acido di partenza, H-A, più acido. Quattro fattori: [1] Effetti
Capitolo 8 Acidi Carbossilici e Derivati
 Chimica rganica Scienze della Terra, dell Ambiente e del Territorio Capitolo 8 Acidi Carbossilici e Derivati rganic Chemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic Chemistry, 3 rd Edition
Chimica rganica Scienze della Terra, dell Ambiente e del Territorio Capitolo 8 Acidi Carbossilici e Derivati rganic Chemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic Chemistry, 3 rd Edition
REATTIVITÀ DI R-XR M + R
 ... X.. M. M. M. M. M 2e- trasferiti dalla superficie metallica in 1 o 2 stadi EATTIVITÀ DI -X... X. -.. Ṙ.. - M + M + δ- δ+ -M nucleofilo -X elettrofilo 1) EAZIONE DI WUTZ -X + - Na + - + Na + X - 2)
... X.. M. M. M. M. M 2e- trasferiti dalla superficie metallica in 1 o 2 stadi EATTIVITÀ DI -X... X. -.. Ṙ.. - M + M + δ- δ+ -M nucleofilo -X elettrofilo 1) EAZIONE DI WUTZ -X + - Na + - + Na + X - 2)
H H. R R δ+ R H. δ Cl
 Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
Aromaticità. Addizione elettrofila alcheni
 Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Capitolo 13 Acidi Carbossilici e Derivati
 himica rganica Informazione Scientifica sul Farmaco apitolo 13 Acidi arbossilici e Derivati rganic hemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic hemistry, 3 rd Edition Paula Y. Bruice, Prentice
himica rganica Informazione Scientifica sul Farmaco apitolo 13 Acidi arbossilici e Derivati rganic hemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic hemistry, 3 rd Edition Paula Y. Bruice, Prentice
Acidi carbossilici e derivati Composti organici che contengono legami doppi C=O e legami singoli C-eteroatomo (oppure il gruppo CN)
 himica rganica Acidi carbossilici e derivati omposti organici che contengono legami doppi = e legami singoli -eteroatomo (oppure il gruppo N) H Acido carbossilico X Alogenuro acilico Anidride ' N Estere
himica rganica Acidi carbossilici e derivati omposti organici che contengono legami doppi = e legami singoli -eteroatomo (oppure il gruppo N) H Acido carbossilico X Alogenuro acilico Anidride ' N Estere
Reazioni degli alcoli
 Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Classi di composti: derivati carbonilici
 Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 59 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 59 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici
 Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 62 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 62 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
1.23 A 1.36 A. Punti di ebollizione elevati, (HCOOH; acido formico PM 46, P.e 101 ), dovuto alla formazione di legami Ponte H
 Molti alimenti, dal sapore agro, brusco e prodotti naturali in genere, contengono uno o più acidi carbossilici: l aceto contiene l acido acetico e il limone l acido citrico, il sapore agro delle mele è
Molti alimenti, dal sapore agro, brusco e prodotti naturali in genere, contengono uno o più acidi carbossilici: l aceto contiene l acido acetico e il limone l acido citrico, il sapore agro delle mele è
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio.
 La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione
 Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Capitolo 4 Reazioni degli alcheni
 himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri)
 CHIMICA ACIDO BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri) Che altra reazione può avvenire al centro carbonilico
CHIMICA ACIDO BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri) Che altra reazione può avvenire al centro carbonilico
Acido maleico anidride maleica acido ftalico andidride ftalica
 Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
ALCOLI. Tabella dei valori di pka compresi tra 10 e estere acetacetico. pka CH HC. acetilene COOEt 24.0.
 ALLI Indice: intesi degli alcossidi 2 intesi di Williamson degli eteri 2 intesi degli alogenuri alchilici 3 intesi degli esteri 6 Disidratazione degli alcoli ad eteri 7 Disidratazione degli alcoli ad alcheni
ALLI Indice: intesi degli alcossidi 2 intesi di Williamson degli eteri 2 intesi degli alogenuri alchilici 3 intesi degli esteri 6 Disidratazione degli alcoli ad eteri 7 Disidratazione degli alcoli ad alcheni
ALCOOLI R-O-H C H. ... a. alcossido H C O - BASE H C O H + H C X. alcheni. a,d. ossidazione. aldeidi e chetoni. b b,c
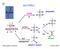 ALLI.. --.. BASE a - alcossido c d b.... a himica rganica e Laboratorio AID a,d ossidazione aldeidi e chetoni b b,c X alcheni ottura del legame SSTITUZINE NULEFILA Br Br 2 Br - 2 ELIMINAZINE 2 S 4 Δ 2
ALLI.. --.. BASE a - alcossido c d b.... a himica rganica e Laboratorio AID a,d ossidazione aldeidi e chetoni b b,c X alcheni ottura del legame SSTITUZINE NULEFILA Br Br 2 Br - 2 ELIMINAZINE 2 S 4 Δ 2
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1
 REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Capitoli 18-20: reazione di addizione nucleofilo al gruppo carbonilico
 Capitoli 18-20: reazione di addizione nucleofilo al gruppo carbonilico Addizioni Nucleofile di Enolati a Composti Carbonilici L addizione di nucleofili come ossigeno, azoto, zolfo a composti carbonilici
Capitoli 18-20: reazione di addizione nucleofilo al gruppo carbonilico Addizioni Nucleofile di Enolati a Composti Carbonilici L addizione di nucleofili come ossigeno, azoto, zolfo a composti carbonilici
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di:
 Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
Domanda 4 Dal punto di vista della reattività, il doppio legame si comporta spesso da:
 Tema svolto Domanda 1 Al punto isoelettrico la solubilità di una amminoacido in acqua è: 1. intermedia (-1) 2. doppia rispetto ad un ph più acido e dimezzata rispetto ad un ph più basico (-1) 3. la più
Tema svolto Domanda 1 Al punto isoelettrico la solubilità di una amminoacido in acqua è: 1. intermedia (-1) 2. doppia rispetto ad un ph più acido e dimezzata rispetto ad un ph più basico (-1) 3. la più
INTERPRETAZIONE DEGLI SPETTRI IR
 INTERPRETAZIONE DEGLI SPETTRI IR Anche se non esistono gruppi di regole per la interpretazione completa degli spettri infrarossi, si è trovato che possono essere utili alcune linee-guida generali. 1. Cominciare
INTERPRETAZIONE DEGLI SPETTRI IR Anche se non esistono gruppi di regole per la interpretazione completa degli spettri infrarossi, si è trovato che possono essere utili alcune linee-guida generali. 1. Cominciare
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
ESERCIZI SPETTROMETRIA DI MASSA
 ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica
 aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Composti carbonilici: Aldeidi Chetoni Acidi carbossilici Alogenuri acilici Esteri Ammidi Anidridi Nitrili
 Composti carbonilici: Aldeidi Chetoni Acidi carbossilici Alogenuri acilici Esteri Ammidi Anidridi Nitrili Struttura di composti carbonilici sp 2 sp 2 C = C H 3 C CH3 Il carbonile è un raggruppamento atomico
Composti carbonilici: Aldeidi Chetoni Acidi carbossilici Alogenuri acilici Esteri Ammidi Anidridi Nitrili Struttura di composti carbonilici sp 2 sp 2 C = C H 3 C CH3 Il carbonile è un raggruppamento atomico
Reattività degli alogenuri alchilici
 Reattività degli alogenuri alchilici 1 3 Meccanismo della Reazione di Sostituzione Nucleofila 4 5 Meccanismo unimolecolare: sostituzione nucleofila unimolecolare (SN1) Un alogenuro che reagisca con questo
Reattività degli alogenuri alchilici 1 3 Meccanismo della Reazione di Sostituzione Nucleofila 4 5 Meccanismo unimolecolare: sostituzione nucleofila unimolecolare (SN1) Un alogenuro che reagisca con questo
Composti Carbossilici. Acidi Carbossilici
 Composti Carbossilici Acidi Carbossilici ACIDI CARBSSILICI Gli acidi carbossilici sono caratterizzati dalla presenza del gruppo carbonilico legato ad un gruppo idrossilico R C Il gruppo carbossilico viene
Composti Carbossilici Acidi Carbossilici ACIDI CARBSSILICI Gli acidi carbossilici sono caratterizzati dalla presenza del gruppo carbonilico legato ad un gruppo idrossilico R C Il gruppo carbossilico viene
+ + H 2 O NH 3 + H 3 2) NH 4 O + O + + CH 3 3) H 2 H H 3 O + CH 3. Esercitazione n Reazioni acido-base. ACIDO ACIDO ACIDO O + H H 2
 Esercitazione n. 10 Reazioni acidobase. 3. Nelle seguenti reazioni acidobase individuare l'acido e la base: 1) N : 3 2 N 4 2 2) N 4 2 N 3 3 3) 2 2 3 2 BASE 4) BASE AID AID AID BASE N N BASE AID 2 6) 5)
Esercitazione n. 10 Reazioni acidobase. 3. Nelle seguenti reazioni acidobase individuare l'acido e la base: 1) N : 3 2 N 4 2 2) N 4 2 N 3 3 3) 2 2 3 2 BASE 4) BASE AID AID AID BASE N N BASE AID 2 6) 5)
Enoli e Enolati. Reazioni di sostituzione nucleofila al carbonio a
 Enoli e Enolati Reazioni di sostituzione nucleofila al carbonio a Idrogeni in α ad un carbonile Perché vi è una reattività al carbonio in posizione a ad un carbonile? Perché solo gli idrogeni α sono acidi
Enoli e Enolati Reazioni di sostituzione nucleofila al carbonio a Idrogeni in α ad un carbonile Perché vi è una reattività al carbonio in posizione a ad un carbonile? Perché solo gli idrogeni α sono acidi
AMMINE. con acidi RNH 2. con O come elettrofilo RNH 2 + H + + R NH 3 NESSUNA REAZIONE. atomo basico, atomo nucleofilo
 AMME : 2 1. come atomo basico o nucleofilo atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE con acidi 2 con come elettrofilo SL con ammine terziarie 2 2
AMME : 2 1. come atomo basico o nucleofilo atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE con acidi 2 con come elettrofilo SL con ammine terziarie 2 2
PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento
 PIRIDINE LEZIONE 6 PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento basico (pka=5.2) Nucleo della piridina
PIRIDINE LEZIONE 6 PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento basico (pka=5.2) Nucleo della piridina
Gruppo carbonilico. Il gruppo carbonilico è caratterizzato dalla presenza C=O ed i composti che lo contengono vengono definiti composti carbonilici.
 Gruppo carbonilico Il gruppo carbonilico è caratterizzato dalla presenza C= ed i composti che lo contengono vengono definiti composti carbonilici. H R R R R H R R aldeidi chetoni acidi carbossilici ac.
Gruppo carbonilico Il gruppo carbonilico è caratterizzato dalla presenza C= ed i composti che lo contengono vengono definiti composti carbonilici. H R R R R H R R aldeidi chetoni acidi carbossilici ac.
