+ H 2 O N 2 + X X N N:.. -
|
|
|
- Vanessa Gagliardi
- 6 anni fa
- Visualizzazioni
Transcript
1 meccanismo: N N lento N 2 H 2 O veloce H ρ I <0 sia in meta che in para è in accordo con la formazione di una carica positiva negli intermedi r.. N N:.. - N N: ρ R <0 in meta si spiega con il fatto che il sostituente a rilascio elettronico stabilizza r, perché la carica negativa finisce vicino a quella positiva.. - : Trattamento di Swain-Lupton delle costanti del sostituente Swain e Lupton hanno tentato di descrivere gli effetti elettronici dei sostituenti con due soli parametri. f r La costante del sostituente, σ, si esprime come combinazione lineare di F ("costante di campo", che caratterizza l'effetto induttivo o "polare" e R, che caratterizza l'effetto di risonanza o coniugativo σ = ff rr fattore di campo fattore di risonanza Determinazione di F dai pk a di acidi biciclo[2.2.2]ottancarbossilici sostituiti in 4 F = (pk 0 a - pk a altri valori sono stati ricavati dalla relazione F = 2.186σ m σ p Determinazione di R se σ = σ p r = 1 l'equazione diventa σ = ff R Per il gruppo -NMe 3 σ p = 0.82 e F =
2 Questo gruppo viene preso come riferimento, assumendo che non abbia contributo coniugativo (R = 0.00 e permette di determinare f f = 0.56 conosciuto f, il valore di R per un qualsiasi sostituente si ricava dal suo valore di σ p R = σ p F Swain e Lupton hanno messo in relazione F ed R con altre costanti del sostituente σ m = 0.60F 0.27R 0.00 (r = 1.00 σ p = 0.56F 1.00R 0.00 (r = 1.00 σ 0 p = 0.60F 0.70R 0.01 (r = σ p = 0.51F 1.58R (r = σ - p = 0.75F 1.52R 0.09 (r = Le correlazioni con σ m e σ p con F e R sono perfette per via della definizione; con σ 0 la correlazione è ancora buona, con σ e σ - la correlazione è scarsa I valori originali di F sono stati corretti, dividendo i ΔpK a ottenuti dagli acidi biciclo[2.2.2]ottancarbossilici per la costante della reazione (ρ = 1.65 I valori di F e di R sono stati espressi in funzione delle costanti di Hammett F = σ m σ p R = σ p F Le costanti di Swain e Lupton (F e R sono state usate per correlare misure NMR e IR, equilibri acido-base, velocità di reazioni elettrofile e nucleofile ed anche attività bioiche successo variabile Critiche: 1. la maggior parte dei valori di F non è stata ottenuta da misure dirette di pk a 2. R è stato basato sull'assunzione che NMe 3 non abbia contributo di risonanza. Però σ m > σ p NMe 3 ha un piccolo effetto elettronico a rilascio perciò i valori di R non sono validi 3. E' discutibile che un solo insieme di R sia soddisfacente per tutti i tipi di risonanza 2
3 - Equazione di Drago-Dadmun (1993 Per correlare le misure chimico-fisiche Drago e Dadmun hanno usato l'equazione: Δχ - Δχ H = d E ΔE d C ΔC ΔE ΔC d E d C costante elettrostatica del sostituente costante covalente del sostituente costante elettrostatica della reazione costante covalente della reazione Δχ simbolo dei dati chimico-fisici Si può applicare a reazioni di un elettrofilo con vari nucleofili o di un nucleofilo con vari elettrofili Il nuovo insieme di valori ΔE e ΔC descrive in modo soddisfacente fenomeni con diversi tipi di contributi di risonanza SEPRZIONE DEGLI EFFETTI ELETTRONICI E STERICI - Equazione di Taft Visto il successo dell'equazione di Hammett per i composti aromatici, sembrò ragionevole cercare una correlazione anaa sostituente-reattività per i composti alifatici problemi problemi sterici (i sostituenti sono più vicini ai siti di reazione Per determinare le costanti del sostituente in sistemi alifatici, Taft ha usato l'idrolisi di esteri alifatici, sulla base delle seguenti assunzioni. 1. Nei composti alifatici l'effetto coniugativo è trascurabile 2. Nel caso dell'idrolisi acido-catalizzata, l'effetto elettronico è trascurabile e la costante di velocità dipende dall'effetto sterico di R in RCO 2 Et 3. La reazione base-catalizzata è influenzata dall'effetto elettronico e dall'effetto sterico. La grandezza dell'effetto sterico è la stessa dell'idrolisi acido-catalizzata ssunzione 1 non richiede giustificazioni, se il sostituente non ha doppi legami che possano coniugare con il sito di reazione 3
4 ssunzione 2 per giustificarla bisogna conoscere il meccanismo O H 3 O K 1 O H R C veloce OEt H 2 O O H R C OEt H 2 O 2 lento 2 prodotti utilizzando l'approssimazione del pre-equilibrio exp = K 1 2 ρ exp = ρ 1 ρ 2 ρ 1 < 0, ρ 2 > 0 ρ exp ~ 0 se ρ 1 ~ ρ 2 Questo ragionamento trova sostegno nel valore prossimo a zero di ρ per l'idrolisi acido-catalizzata dei benzoati di etile meta e para sostituiti Nel caso dell'idrolisi acida degli esteri, il aritmo del rapporto delle costanti di velocità si pone uguale al requisito sterico di R ( = E S E S costante sterica del sostituente ssunzione 3 si basa sull'esame delle differenze strutturali degli intermedi dell'idrolisi in ambiente acido e basico 2 intermedio della idrolisi acida O - intermedio della idrolisi basica le due strutture differiscono per due soli protoni Lo stadio rate-determining dell'idrolisi basica è il primo stadio 4
5 O HO - 1 lento O- prodotti exp B = 1 Questa costante di velocità ( B exp è influenzata sia dagli effetti elettronici che da quelli sterici ( B B 0 = ρ*σ* E S ( B B 0 - elettronico sterico ( = ρ*σ* σ* misura l'effetto elettronico induttivo del sostituente ρ* costante della reazione, che misura la sensibilità della velocità all'effetto elettronico induttivo del sostituente e B sono misurati con l'acetato di etile CH 3 CO 2 Et per definizione σ* Me = 0 B e sono misurati con acetati di etile sostituiti reazione di riferimento CH 2 CO 2 Et per questa reazione Taft ha scelto arbitrariamente ρ* = 2.46 (in modo da avere σ* ~ σ di Hammett σ* = B B ( In seguito è stata stabilita una relazione tra i valori σ I di ed i valori σ* dei gruppi CH 2 - ( σ I ( = 0.45 σ*(ch 2 Tabella. Costanti induttive del sostituente di Taft Gruppo σ* Gruppo σ* Me 0.00 CH Et CH 2 OMe 0.52 Pr CH 2 F 1.10 Bu CH 2 Cl 1.05 i-pr CH 2 Br 1.00 t-bu CH 2 I 0.85 Ph 0.60 CH 2 NO PhCH CH 2 CN 1.30 PhCH2CH CH 2 CF OMe CH 2 COCH
6 La costante sterica, E S, si può determinare dall'equazione ( = E S 0 I valori E S misurano il requisito sterico del sostituente rispetto al metile E S (Me = 0 Se R è più piccolo di Me E S > 0 Se R è più grande di Me E S < 0 Taft ha suggerito, per descrivere gli effetti elettronici induttivi dei sostituenti su reazioni di composti alifatici, l'equazione: = ρ*σ* ( In molti casi l'equazione dà risultati soddisfacenti RCO 2 Et - RCO 2 - Et ρ* = 2.48 RCO 2 H H 2 O RCO 2 - H3 O ρ* = 1.72 RCH 2 Br PhS - RCH 2 SPh Br - ρ* = RR'R"CCl Et RR'R"COEt HCl ρ* = In altri casi, per ottenere una buona correlazione si è dovuta includere la costante sterica del sostituente, E S, insieme alla costante sterica della reazione, δ. = ρ*σ* ( δe S La validità delle costanti σ* ed E S è stata criticata da molti ricercatori CRITICHE: Il metodo non separa in modo appropriato gli effetti induttivo e sterico: E S contiene ancora un effetto induttivo residuo e, soprattutto, σ* contiene un effetto sterico residuo vengono preferiti i σ I FVORE: è stato dimostrato che i valori E S sono proporzionali ai raggi di van der Waals dei sostituenti Più recentemente i valori E S originali (relativi a Me sono stati sostituiti con una serie di E S modificati, relativi all'h E S (H = 0 6
7 equazione di Taft modificata ( = ρ I σ I ρ S E S ρ I ρ S costante induttiva della reazione costante sterica della reazione EFFETTO orto Un sostituente in orto può esercitare sulla reazione più di un effetto - effetto di campo (polarizzazione diretta del centro di reazione attraverso lo spazio - effetto di impedimento sterico di risonanza (può non essere coplanare con il benzene e quindi non dare coniugazione completa - effetto sterico (può ostacolare l'avvicinamento del reagente al centro di reazione o la formazione del guscio di solvatazione - possibilità di legame idrogeno - possibilità di effetto del gruppo adiacente difficile da trattare quantitativamente Taft ha determinato valori σ o * e E S dall'idrolisi acida e basica di esteri benzoici sostituiti in orto Le costanti steriche sono state chiamate E S, anche se numericamente sono diverse dalle E S alifatiche Il riferimento per σ o * è stato Me, ma con l'aiuto di σ p (Me è stato riscalato ad H come sostituente di riferimento ( = ρ δe o σ o S 0 Costanti del sostituente di Taft, per sostituenti orto gruppo σ 0 * σ 0 E S H OMe Me F Cl Br I NO successo molto limitato 7
8 CRITICHE: - un solo insieme di valori σ o non è soddisfacente per rappresentare una varietà di effetti elettronici - E S contiene ancora un piccolo contributo di effetti coniugativi - Equazione di Charton Per l'interpretazione dell'effetto orto, Charton ha introdotto l'equazione: ( = ασ I βσ R ψυ h σ I σ R υ costante induttiva del sostituente costante coniugativa del sostituente costante sterica del sostituente α sensibilità della reazione all'effetto induttivo β sensibilità della reazione all'effetto coniugativo ψ sensibilità della reazione all'effetto sterico Come σ I e σ R sono stati presi i valori calcolati in precedenza Per sostituenti simmetrici, υ è stata determinata dai raggi di van der Waals υ = r Per sostituenti non simmetrici, Charton ha calcolato υ da misure cinetiche υ e E S sono in buona correlazione Charton ha applicato la sua equazione con successo per interpretare molte reazioni. in molti casi ha ottenuto valori di ψ molto piccoli (impedimento sterico molto piccolo - Equazione di Fujita-Nishioa Fujita e Nishioa nella descrizione dell'effetto orto hanno considerato tre effetti - effetto polare (induttivo e coniugativo ordinario - effetto di campo di prossimità - effetto sterico dei sostituenti orto per l'effetto elettronico normale hanno usato le costanti di Hammett, con l'assunzione che σ orto = σ para per la descrizione dell'effetto polare attraverso lo spazio dei sostituenti orto hanno usato i parametri F di Swain-Lupton 8
9 per la caratterizzazione degli effetti sterici hanno usato i valori E S di Taft In questo modo la reattività di composti orto, meta e para sostituiti si può racchiudere in una sola equazione o,m,p = ρ σ o,m,p δe S ff c ρ δ f sensibilità della reazione agli effetti elettronici sensibilità della reazione all'effetto sterico sensibilità della reazione all'effetto campo Con sostituenti in meta e para δe S e ff vanno a zero e l'equazione diventa quella di Hammett Per σ bisogna scegliere sempre la scala più adatta (σ, σ 0, σ, σ - CRITICHE: - Le costanti del sostituente non sono in grado di descrivere l'effetto del legame idrogeno o l'effetto di partecipazione del gruppo adiacente - non necessariamente σ orto = σ para 9
CORRELAZIONI LINEARI DI ENERGIA LIBERA
 RRELAZINI LINEARI DI ENERGIA LIERA Una serie di variazioni nelle condizioni di reazione (per esempio l'elettronegatività dei sostituenti del substrato o il potere ionizzante del solvente) quasi sempre
RRELAZINI LINEARI DI ENERGIA LIERA Una serie di variazioni nelle condizioni di reazione (per esempio l'elettronegatività dei sostituenti del substrato o il potere ionizzante del solvente) quasi sempre
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1
 REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Complementi di Chimica Organica. Composti Aromatici: Benzene C 6 H 6 (1825) (1865) Friedrich August Kekulé
 Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Composti carbonilici Acidi carbossilici
 Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Teorie Acido-Base. valutazione degli acidi
 Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
Acidi carbossilici: nomenclatura. alcano -> acido alcanoico
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Si trovano generalmente come dimeri ciclici a causa dei legami a idrogeno
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
COMPOSTI AROMATICI. Formula C 6 H 6
 COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Unità didattica 7 (segue) Reattività del benzene. Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili
 Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Aromaticità. Addizione elettrofila alcheni
 Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Aspetti salienti. 1.Problema di sensibilità 2.Accoppiamenti diretti 1 J e 2 J C(H) 3.Disaccoppiamento 4.Chemical shift
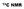 13 C NMR Aspetti salienti 1.Problema di sensibilità 2.Accoppiamenti diretti 1 J e 2 J C(H) 3.Disaccoppiamento 4.Chemical shift 1. PROBLEMA DELLA SENSIBILITA 12 C non è NMR-attivo: I = 0 13 C possiede spin,
13 C NMR Aspetti salienti 1.Problema di sensibilità 2.Accoppiamenti diretti 1 J e 2 J C(H) 3.Disaccoppiamento 4.Chemical shift 1. PROBLEMA DELLA SENSIBILITA 12 C non è NMR-attivo: I = 0 13 C possiede spin,
Esteri degli acidi carbossilici
 Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
Reattività degli acidi carbossilici e loro derivati. La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica
 Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Laboratorio Chimica Bioorganica. Studio di meccanismi di reazione in Chimica Bioorganica. St. 344
 Laboratorio Chimica Bioorganica Studio di meccanismi di reazione in Chimica Bioorganica [email protected] St. 344 Laboratorio Chimica Bioorganica Idrolisi dell'aspirina (Tutti) Studio della reazione di deacilazione
Laboratorio Chimica Bioorganica Studio di meccanismi di reazione in Chimica Bioorganica [email protected] St. 344 Laboratorio Chimica Bioorganica Idrolisi dell'aspirina (Tutti) Studio della reazione di deacilazione
BENZENE E DERIVATI. Composto aromatico: termine usato per indicare il benzene ed i suoi derivati C 6 H 6. Arene: Idrocarburo aromatico
 BENZENE E DERIVATI Composto aromatico: termine usato per indicare il benzene ed i suoi derivati C 6 H 6 Arene: Idrocarburo aromatico Gruppo arilico: gruppo sostituente che deriva da un arene per rimozione
BENZENE E DERIVATI Composto aromatico: termine usato per indicare il benzene ed i suoi derivati C 6 H 6 Arene: Idrocarburo aromatico Gruppo arilico: gruppo sostituente che deriva da un arene per rimozione
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
COMPOSTI AROMATICI POLICICLICI
 CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
ALCHENI: Reazioni del doppio legame
 ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
FENOLI: nomenclatura IUPAC
 FENOLI, AMMINE ed ENAMMINE FENOLI: nomenclatura IUPAC I fenoli sono composti la cui caratteristica strutturale è quella di possedere un gruppo idrossile ( OH) legato a un anello benzenico. Il sistema it
FENOLI, AMMINE ed ENAMMINE FENOLI: nomenclatura IUPAC I fenoli sono composti la cui caratteristica strutturale è quella di possedere un gruppo idrossile ( OH) legato a un anello benzenico. Il sistema it
1. Per capire la chimica del gruppo carbonile bisogna ricordarsi che il legame C=O è polarizzato
 1. Per capire la chimica del gruppo carbonile bisogna ricordarsi che il legame C= è polarizzato elettrofili protoni, acidi di Lewis X Y X Y nucleofili Scrivere le formule di risonanza per acetaldeide,
1. Per capire la chimica del gruppo carbonile bisogna ricordarsi che il legame C= è polarizzato elettrofili protoni, acidi di Lewis X Y X Y nucleofili Scrivere le formule di risonanza per acetaldeide,
Introduzione alla Chimica Organica V Ed.
 William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
R-X ALOGENURI ALCHILICI. F Cl Br I. Nomenclatura. In genere si indicano con. + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo
 ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
Assorbimenti di alcani (stretching. Corso Metodi Fisici in Chimica Organica Prof. Renzo LUISI Uniba. vietata la vendita
 Assorbimenti di alcani (stretching C-H) Corso Metodi Fisici in Chimica rganica Prof. Renzo LUISI Uniba. vietata la vendita Analisi di spettri: ALCANI (C-H) 4000 3500 3000 2500 2000 1500 1300 1000 700 500
Assorbimenti di alcani (stretching C-H) Corso Metodi Fisici in Chimica rganica Prof. Renzo LUISI Uniba. vietata la vendita Analisi di spettri: ALCANI (C-H) 4000 3500 3000 2500 2000 1500 1300 1000 700 500
Cinetica Chimica. Cinetica chimica
 Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Gli Alogenuri Alchilici
 Gli Alogenuri Alchilici l l F Br F F l F F l l 1,2-Dicloroetano (solvente) Aloetano (anestetico) Freon 12 (fluido refrigerante) egole IUPA per la Nomenclatura degli Alogenuri Alchilici 1.Trovare e nominare
Gli Alogenuri Alchilici l l F Br F F l F F l l 1,2-Dicloroetano (solvente) Aloetano (anestetico) Freon 12 (fluido refrigerante) egole IUPA per la Nomenclatura degli Alogenuri Alchilici 1.Trovare e nominare
Esistono reazioni energeticamente favorite (ΔH<0) che non avvengono.es. C(diamante) à C(grafite)
 CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
Sostituzione nucleofila Addizione a gruppi carbonilici Addizione a doppi legami attivati
 himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
ESERCIZI ESERCIZI. 3) Data la reazione chimica: H 2
 ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
Esercitazione n Reazioni e meccanismi dei composti aromatici.
 sercitazione n. 1 Reazioni e meccanismi dei composti aromatici.. Scrivere il meccanismo della clorurazione del benzene, mettendo in evidenza il ruolo del catalizzatore. Fe Fe Fe Fe. Il pdimetilbenzene
sercitazione n. 1 Reazioni e meccanismi dei composti aromatici.. Scrivere il meccanismo della clorurazione del benzene, mettendo in evidenza il ruolo del catalizzatore. Fe Fe Fe Fe. Il pdimetilbenzene
REAZIONI E LORO MECCANISMI
 REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Il livello a cui verrà condotto l'esame sarà il livello con cui le materie vengono insegnate alle scuole superiori.
 Programma corso Chimica e metodologie d insegnamento, modulo Chimica Generale, Inorganica e Analitica. (1 cfu 8 ore CHIM/03) Claudia Dragonetti [email protected] -Configurazione elettronica,
Programma corso Chimica e metodologie d insegnamento, modulo Chimica Generale, Inorganica e Analitica. (1 cfu 8 ore CHIM/03) Claudia Dragonetti [email protected] -Configurazione elettronica,
EQUILIBRI IN SOLUZIONE ACQUOSA
 EQUILIBRI IN SOLUZIONE ACQUOSA Costante di equilibrio Si consideri la seguente reazione di equilibrio: aa + bb cc + dd La costante di equilibrio della reazione ad una data temperatura è definita come il
EQUILIBRI IN SOLUZIONE ACQUOSA Costante di equilibrio Si consideri la seguente reazione di equilibrio: aa + bb cc + dd La costante di equilibrio della reazione ad una data temperatura è definita come il
Benzene e Composti Aromatici
 Benzene e Composti Aromatici Contenuti della lezione: Il benzene e i requisiti per l aromaticità Nomenclatura di benzeni mono- e di-sostituiti Composti aromatici diversi dal benzene: IPA e eteroaromatici
Benzene e Composti Aromatici Contenuti della lezione: Il benzene e i requisiti per l aromaticità Nomenclatura di benzeni mono- e di-sostituiti Composti aromatici diversi dal benzene: IPA e eteroaromatici
Informazioni che si possono ricavare da uno spettro protonico
 Informazioni che si possono ricavare da uno spettro protonico Per interpretare uno spettro 1 H NMR bisogna: 1) Contare il numero di picchi che corrispondono agli idrogeni fisicamente diversi nella molecola.
Informazioni che si possono ricavare da uno spettro protonico Per interpretare uno spettro 1 H NMR bisogna: 1) Contare il numero di picchi che corrispondono agli idrogeni fisicamente diversi nella molecola.
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Stabilità del benzene (entalpie di idrogenazione) Energia di risonanza
 La chimica del benzene e dei suoi derivati I derivati del benzene vengono chiamati composti aromatici poiché inizialmente vennero isolati dal catrame nel 1800 ed erano caratterizzati da un odore aromatico.
La chimica del benzene e dei suoi derivati I derivati del benzene vengono chiamati composti aromatici poiché inizialmente vennero isolati dal catrame nel 1800 ed erano caratterizzati da un odore aromatico.
Cinetica chimica. Capitolo 13
 Cinetica chimica Capitolo 13 Cinetica chimica Termodinamica si verifica la reazione? Cinetica con che velocità si verifica la reazione? Velocità di reazione è la variazione di concentrazione di un reagente
Cinetica chimica Capitolo 13 Cinetica chimica Termodinamica si verifica la reazione? Cinetica con che velocità si verifica la reazione? Velocità di reazione è la variazione di concentrazione di un reagente
ACIDI E BASI ORGANICI: pka e ph
 Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Capitolo 8 Acidi Carbossilici e Derivati
 Chimica rganica Scienze della Terra, dell Ambiente e del Territorio Capitolo 8 Acidi Carbossilici e Derivati rganic Chemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic Chemistry, 3 rd Edition
Chimica rganica Scienze della Terra, dell Ambiente e del Territorio Capitolo 8 Acidi Carbossilici e Derivati rganic Chemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic Chemistry, 3 rd Edition
UNITA DIDATTICA. Disciplina: SCIENZE INTEGRATE: CHIMICA
 Disciplina: SCIENZE INTEGRATE: CHIMICA Disciplina: SCIENZE INTEGRATE: CHIMICA Titolo: La mole e il numero di Avogadro. Codice: D1-P-Tec-Gra Ore previste:10 Concetto di massa atomica: come si è arrivati
Disciplina: SCIENZE INTEGRATE: CHIMICA Disciplina: SCIENZE INTEGRATE: CHIMICA Titolo: La mole e il numero di Avogadro. Codice: D1-P-Tec-Gra Ore previste:10 Concetto di massa atomica: come si è arrivati
Reazioni Stereospecifiche e Stereoselettive
 Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Diagramma di Ramachandran
 Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1
 CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE
 Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
PROPRIETA FISICHE DEI COMPOSTI ORGANICI
 PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
