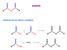
miscela di reazione Si lava (estrae) con una base Si lava (estrae) con un acido Si lava (estrae) con acqua
|
|
|
- Gustavo Giordano
- 5 anni fa
- Visualizzazioni
Transcript
1 1. Si purificano (se necessario) reagenti e solventi.. Si mescolano i reagenti nelle opportune condizioni di reazione.. Si segue l andamento della reazione. 4. Si lavora la reazione. 5. Si analizza il grezzo della reazione. 6. Si separano i prodotti. 7. Si controlla la purezza dei prodotti. 8. Si purificano (se necessario) i prodotti. Alla fine della reazione: miscela di reazione 1.Si tratta con acqua o acqua e ghiaccio.si aggiunge un solvente organico immiscibile e si agita soluzione organica con prodotto neutro fase acquosa (si scarta) Si lava (estrae) con una base soluzione organica con prodotto neutro Si lava (estrae) con un acido fase acquosa con impurezze acide (si scarta) soluzione organica con prodotto neutro Si lava (estrae) con acqua fase acquosa con impurezze basiche (si scarta) soluzione organica con prodotto neutro 1.Si secca.si evapora il solvente organico fase acquosa (si scarta) prodotto neutro 1
2 Se il prodotto è acido: miscela di reazione 1.Si tratta con acqua o acqua e ghiaccio.si aggiunge un solvente organico immiscibile e si agita soluzione organica con prodotto acido fase acquosa (si scarta) Si estrae con una base fase organica (si scarta) fase acquosa basica con prodotto acido 1.Si acidifica.si estrae un solvente organico soluzione organica con prodotto acido Si lava (estrae) con acqua fase acquosa (si scarta) soluzione organica con prodotto acido 1.Si secca.si evapora il solvente organico fase acquosa (si scarta) prodotto acido Se il prodotto è basico: miscela di reazione 1.Si tratta con acqua o acqua e ghiaccio.si aggiunge un solvente organico immiscibile e si agita soluzione organica con prodotto basico fase acquosa (si scarta) Si estrae con un acido fase organica (si scarta) fase acquosa acida con prodotto basico 1.Si alcalinizza.si estrae un solvente organico soluzione organica con prodotto basico Si lava (estrae) con acqua fase acquosa (si scarta) soluzione organica con prodotto basico 1.Si secca.si evapora il solvente organico fase acquosa (si scarta) prodotto acido
3 STAZIN IN NTINU Se si deve estrarre da un solido un composto relativamente poco solubile, l estrazione con solventi si può effettuare in modo efficiente con un apparecchio Soxhlet. SPAAZIN MDIANT DISTILLAZIN FAZINATA Se il grezzo di reazione è costituito di composti liquidi miscibili, questi si possono separare per distillazione Una coppia di liquidi miscibili, A e B, ha comportamento ideale se segue la legge di aoult, contribuendo alla pressione di vapore totale in funzione della composizione della miscela P totale = P A P B = x A P 0 A x B P 0 B x A e x B = frazione molare di A e B nella miscela P 0 A e P 0 B = pressione di vapore di A e B puri ad una data temperatura Se la differenza di temperatura di ebollizione dei due liquidi è > 50, si può effettuare una distillazione semplice, raccogliendo prima il liquido che bolle a temperatura più bassa e poi quello che bolle a temperatura più alta (se necessario, diminuendo la pressione) Per separare liquidi con punti di ebollizione più vicini: distillazione frazionata.
4 Mescolando quantità diverse di A e B, misurando la temperatura a cui la miscela bolle (a pressione atmosferica) ed esaminando la composizione del vapore, si ricava il diagramma dei punti di ebollizione in funzione della composizione Man mano che la distillazione procede, il punto di ebollizione sale gradualmente ed il distillato contiene una quantità minore del composto più volatile Questo significa salire nel diagramma da XY a, per esempio, X Y aratteristico della distillazione di una miscela di liquidi è: La composizione del liquido e del vapore non uguali Il p.e. del liquido sale gradualmente durante la distillazione. 4
5 p.e. Una miscela con, frazione molare di B L 1 si scalda e raggiunge la temperatura t di ebollizio i ne. Il vapore ha composizione V 1. Se il vapore condensa, dà un liquido di composizione L. Se L viene scaldato, raggiunge una temperatura di ebollizione (inferiore alla precedente), da cui si ottiene un vapore V, più ricco nel composto a p.e. più basso. ipetendo più volte la serie distillazionecondensazionedistillazione si arriva ad A puro Le distillazioni successive necessarie per la separazione costituiscono i piatti teorici In pratica le distillazioni successive si realizzano interponendo tra pallone e testa di distillazione una colonna di frazionamento olonna di Vigreux Denti di vetro r rientranti o olonna di Widmer iempimento a spirale iempimento con palline di vetro Un piatto teorico è l equivalente di una distillazione semplice. 5
6 Miscele non ideali possono non essere separabili se c è una composizione della micela in cui la composizione del vapore è uguale a quella del liquido (miscele azeotropiche). SPAAZIN MDIANT MATGAFIA SU LNNA I composti organici si possono separare con la cromatografia di adsorbimento, in quantità di grammi. La separazione si basa sullo stesso primcipio della TL Una colonna di vetro, con rubinetto, si riempie con la fase stazionaria bagnata con il solvente (per evitare la formazione di bolle d aria) In testa alla colonna si pone una soluzione dei composti da separare (minimo volume), che si fa adsorbire, facendola scendere (rubinetto aperto) Si eluisce con il solvente opportuno e si raccolgono le frazioni (attraverso il rubinetto) 6
7 Il solvente può evaporare, depositando cristalli sul gambo: lavare con solvente fresco 7
8 8
9 1. Si purificano (se necessario) reagenti e solventi.. Si mescolano i reagenti nelle opportune condizioni di reazione.. Si segue l andamento della reazione. 4. Si lavora la reazione. 5. Si analizza il grezzo della reazione. 6. Si separano i prodotti. 7. Si controlla la purezza dei prodotti. 8. Si purificano (se necessario) i prodotti. 7. La purezza dei prodotti si verifica con tecniche cromatografiche (TL, G) o spettrali ( 1 NM) 8. La purificazione dei prodotti si effettua con le stesse tecniche usate per i reagenti. 9
10 ALNI ILALNI AATTISTIA FUNZINAL: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico.. UVvisibile Un solo legami π: le transizioni π π* richiede λ = 190 nm (lontano UV): fuori dal comune intervallo. Però è una transizione permessa dalla simmetria (ε= per l etene) I stretching = a sinistra di 000 cm 1 stretching = cm 1 bending = (fuori dal piano) cm 1 = = = = metil1butene Se lo stretching del doppio legame = non modifica il momento di dipolo, non si ha assorbimento 10
11 1pentene cispentene transpentene 1 NM L anisotropia diamagnetica descherma il nucleo 1pentene 1 11
12 1 NM L anisotropia diamagnetica descherma il nucleo Spesso gli spettri non sono del primo ordine 1pentene vinilici { pentene vinilici { ALNI AATTISTIA FUNZINAL: legame π Più debole del legame σ, è il punto debole degli alcheni. la rottura del legame π porta a due valenze libere sui due atomi di, che vanno soddisfatte. ADDIZIN la nuvola elettronica del legame π ATTIA reagenti poveri di elettroni, SPING reagenti ricchi di elettroni. ADDIZIN LTTFILA 1
13 I reagenti elettrofili possono venire da una molecola di tipo XY o da una molecola di tipo XX δ δ X Y l,, I;, ; Il; l, (, ); B l,, I;, = B = atomo di B (orbitale vuoto) δ δ I l = I l l l l = l = MANISM 1. δ δ X Y X Processo in due stadi lento Y X X X Y δ X X δ δ X. Y Y δ X X Y coordinata di reazione 1
14 ATTIVITA I fattori che stabilizzano il carbocatione: abbassano l'energia dello stato di transizione diminuiscono l'energia di attivazione FAVISN LA AZIN ' PIU' ATTIV L'ALN che dà il ABATIN PIU STABIL INTAMNT Se da un alchene si possono formare due carbocationi di diversa stabilità, si forma SL IL ABATIN PIU' STABIL (orientamento secondo Markownikov) AZIN GISPIFIA SMPI con l l equazione l cloropropano meccanismo: l lento.. :l:.. l con equazione meccanismo: bromometilpropano.. :: lento.. 14
15 con I equazione I I iodometilpropano meccanismo:.. : I : lento.. I con, equazione metilpentanolo meccanismo: lento.... con Ιl equazione l I l I meccanismo:.. lento :l: l.. I l I I con l, equazione l l 1cloropropanolo meccanismo: l l l.... lento l l l l 15
16 con B IDBAZIN equazione B ( ) B B ottetto incompleto B 6 diborano B B B B orbitale vuoto B 6 B B l atomo di B è meccanismo: = B.... B complesso tra alchene e borano δ B δ /= δ /= B δ B anche gli altri legami B reagiscono allo stesso modo La reazione avviene in un unico stadio B eazione GISPIFIA Anche se non si forma un intermedio carbocationico, lo stato di transizione ha un carattere di parziale carbocatione (sul dove è più stabile) B coordinata di reazione 16
17 I trialchilborani sono utili non come tali, ma perché il B viene sostituito facilmente da un gruppo B ( ) B, In questo modo è possibile ottenere da un alchene un alcool isomero rispetto a quello della reazione con,. B : B propanolo 1propanolo MUIAZINSLVDMUIAZIN g( ) in solvente polare protico (,, ) g( ) g g lento g oppure g carbocatione ione mercurinio g Solv g Solv g Solv 17
18 INTAMNT si forma il (parziale) carbocatione più stabile : I composti mercurati si trasformano in composti organici per trattamento con idruro di boro e sodio (NaB 4 ) in ambiente basico g Solv DMUIAZIN IDUTTIVA Solv g precipita come mercurio metallico (grigio) Solv = mercuriazione i g( ) demercuriazione g g g alcool rispetto all'addizione di acqua acidocatalizzata, questo metodo ha il vantaggio di non passare attraverso un carbocatione libero e quindi di non correre il rischio della trasposizione. Solv = mercuriazione g( ) g demercuriazione g etere g esempi: g( ) g 1acetossimercuriometossipropano 18
19 NaB 4 g isopropil metil etere g( ) g g acetossimercurioetossipentano acetossimercurioetossipentano etossipentano NaB 4 g etossipentano Solv = () mercuriazione g( ) g demercuriazione g g estere acetato t di isopropile il 19
20 eazione con alogeni (, l ) Il legame (e ll) è covalente, con gli elettroni tra due atomi con la stessa elettronegatività (legame non polare). Il legame (e ll) l) può essere polarizzato per interazione donatoreaccettore con un legame π. La polarizzazione è favorita da solventi polari. dopo la polarizzazione SISSIN TLITIA vuoto ().... : δ.. δ ione BMNI ione bromuro.. () complesso π δ δ lento δ δ δ δ AZIN STSPIFIA π coordinata di reazione 0
21 ANDAMNT STIMI δ δ π δ δ # partendo da un isomero geometrico: δ δ π δ δ # (A) (B) (A) (B) = = (A) = (A) S = treo (A) S (A) treo on l l l, più piccolo di, sovrappone meno bene l'orbitale pieno con l'orbitale vuoto del e quindi non forma un vero legame, ma dà solo un'interazione accettoredonatore l δ l δ π l δ l δ # l l : : l l 1
22 l l l l l l prevalente minore quantità AZIN STSLTTIVA AZIN con in condizioni radicaliche Fatto sperimentale: l'addizione di agli alcheni dà il regioisomero diverso da quello atteso (orientamento antimarkownikov) meccanismo: Δ.... lento.. continuala reazione a catena AZIN GISPIFIA Si forma il radicale più stabile.... rientamento antimarkownikov Quella con in presenza di perossidi è la SLA addizione radicalica degli alcheni. on o l e hν o riscaldamento, hn alchene dà il ADIAL PIU STABIL, che è quello in posizione ALLILIA!!!!! hν
23 IDUZIN catalizzatore catalizzatore Pt, Pd, Ni superficie del catalizzatore insormontabile senza catalizzatore superabile con il catalizzatore enegia di attivazione abbassata coordinata di reazione AZIN STSPIFIA Pt enantiomeri cis
24 D D D = meso Pd D D D Pd D D (,) D (S,S) D In soluzione (catalisi omogenea) si riesce ad avere reazione stereospecifica con catalizzatori che hanno un legante chirale: N rodio.dip.l enzimi i cerebrali N (S)()DPA N dopammina cura del morbo di Parkinson (neurotrasmettitore) SSIDAZIN DGLI ALNI senza scissione del legame [] oppure con scissione del legame [] oppure oppure AGNT PDTT ssidazione senza scissione KMn 4, 1Di 1,Dioli s 4 e poi Na S 1,Dioli ssaciclopropani ssidazione con scissione KMn 4,, Δ Acidi e/o hetoni e poi, Acidi e/o hetoni e poi Zn, Aldeidi e/o hetoni 4
25 on KMn 4, KMn 4 5 Mn AZIN STSPIFIA Mn Mn Mn Mn δ Mn δ δ = = = (S,S) = Mn Mn (,) on s 4 s 4 5 AZIN STSPIFIA s δ s δ δ s Na S s Na S s (id (riducente) t ) s 5
26 = = (,S) meso s s = (,S) meso on peracidi meccanismo: acido peracetico acido performico (permetanoico) l acido mcloroperbenzoico 6
27 con scissione del legame KMn 4,, a caldo KMn 4, Δ [] [] [] con gli alcheni terminali si forma KMn 4, Δ ' [] ' acido metanoico [] acido carbonico.. ZN ( ).. :.. :.. : 1,,triossaciclopentano (4,4,5trimetil) meccanismo probabile: δ δ 1,,4triossaciclopentano (,,5trimetil) Instabile, non si isola 7
28 TATTAMNT IDUTTIV ad aldeide Zn, ad a chetone TATTAMNT SSIDATIV ad acido carbossilico ad a chetone Addizione di carbeni Molecole contenenti un BIVALNT sono rare in himica rganica. Si chiaano ABNI e possono essere di due tipi, a seconda della configurazione elettronica orbitale sp pieno orbitale p vuoto metilene singoletto : ( sp ) orbitale p (un e). orbitale p (un e) metilene tripletto.. ( sp) 8
29 Si formano per decomposizione fotochimica del diazometano: : N N N N diazometano : : N N : hν N N Il metilene attacca un legame π =, sia come singoletto che come tripletto con metilene singoletto con metilene tripletto : cis.. cis. cis. possibilità di rotazione AZIN STSPIFIA cis trans arbeni sostituiti con alogeni sono più stabili e si preparano più facilmente :l diclorocarbene ( ) l l ( ) l : l l :l l eazione di SimmonsSmith sempio: :l l l ( 5 ) I Zn(u) I ZnI carbenoide sempio: I Zn(u) ( 5 ) 9
30 AATTISTIA FUNZINAL: aratteristiche Spettrali Spettrometria di massa ALINI legame π Una frammentazione importante dà un valore m/z = 9, che corrisponde al carbocatione propargilico.. 1ottino 4ottino M I stretching = a circa 00 cm 1 stretching circa 150 cm 1 manca negli alchini simmetricamente disostituiti 1ottino 0
31 ottino 4ottino 1 NM L anisotropia diamagnetica scherma il nucleo sp δ 7090 ppm 4ottino 1ottino
32 1 NM L anisotropia diamagnetica scherma il nucleo δ ppm Danno le stesse reazioni degli alcheni (legame π), con lo stesso meccanismo L'addizione del primo equivalente lascia ancora un legame π, che perciò può dare ulteriore addizione X X Y X Y Y X Y il prodotto della reazione dipende perciò dal numero di equivalenti del reagente elettrofilo esempi: l l trans AZIN STSPIFIA
33 con (addizione elettrofila) (carbocatione.. ::.. più stabile) (carbocatione più stabile).. ::.. con (addizione radicalica) Δ..... (radicale più stabile). continua la catena... (radicale più stabile) continua la catena con, servono anche sali di g come catalizzatori g meccanismo: : carbocatione più stabile
34 enolo TAUTMIA ssidazione con KMn 4 anche a temperatura ambiente si ha scissione del legame KMn 4 ' ', 5 ' IDUZIN Pt La riduzione catalitica arriva ad ALAN, se non si usano catalizzatori speciali Pt Per fermarsi ad alchene è necessario che il catalizzatore sia meno attivo Pd "avvelenato" disattivato cis AZIN STSPIFIA Per ridurre alchini interni ad alcheni trans Na N trans con Na (K, Li ) in N liquida AZIN STSPIFIA 4
35 ATTNZIN!! GLI ALINI TMINALI DANN GLI ALINUI N Na : Na 1/ meccanismo:... Na Na anione radicale Na... N Na N radicale vinilico... Na Na anione vinilico... Na N Na N trans L'andamento stereochimico viene spiegato con la maggiore stabilità del radicale vinilico con i gruppi in trans, rispetto a quello con i gruppi in cis (repulsione per ingombro sterico).. AIDITA' del legame sp. I sali degli alchini terminali (alchinuri) si possono ottenere, oltre che con Na, con idrossidi di metalli di transizione Ag(N ) Ag N "Ag " legame covalente polare u(n ) u N "u " legame covalente polare 5
36 DINI AATTISTIA FUNZINAL: legame π aratteristiche Spettrali UVvisibile Analoghe a quelle dgli alcheni La coniugazione abbassa la differenza di energia MLUM (shift batocromico) A B metil1,4pentadiene = = ppm 11.1 ppm 6
37 1,4esadiene sp vinilici { { Stesse reazioni degli alcheni; il prodotto dipende dal numero di equivalenti del reagente (elettrofilo) l l l l l DINI NIUGATI Anche con un solo equivalente si ottengono più prodotti: l l l addizione addizione 1, 1,4 a bassa temperatura prevale addizione 1, a temperatura elevata prevale addizione 1,4 7
38 addizione 1, unico carbocatione DU siti positivi l l δ # δ δ # δ l addizione 1,4 1, a l l 1,4 coordinata di reazione 1, controllo cinetico 1,4 controllo termodinamico eazione di DielsAlder π * LUM Δ M π 1 Addotto di DielsAlder nuovi legami σ diene dienofilo nuovo legame π 8
39 La geometria del dienofilo si mantiene nell addotto dienofilo cis addotto cis dienofilo trans addotto trans Se il diene ed il dienofilo sono sostituiti non simmetricamente, si ottengono due addotti egola endo Quando il dienofilo contiene un legame π nel gruppo elettron attrattore, gli orbitali π in quel gruppo si avvicinano agli atomi centrali del diene. Questa sovrapposizione secondaria aiuta a stabilizzare lo stato di transizione della formazione dell addotto. Fenomeno osservato formando i prodotti biciclici dal ciclopentadiene eso eso endo endo e non e non 9
40 Sovrapposizione secondaria = = == = = = = MPSTI AMATII L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. aratteristiche Spettrali La maggior parte dei composti aromatici Spettrometria di massa presenta un picco dello ione molecolare molto intenso. Gli alchilbenzeni hanno una frammentazione molto facile con m/z 91. stato dimostrato che il carbocatione benzilico traspone a catione eptatrienilio... m/z 91 M (78) M m/z 91 (18) 40
41 UVvisibile Il benzene ha legami π coniugati Lo spettro di assorbimento elettronico è caratterizzato da due bande dette primarie e una banda detta secondaria o della struttura fine. λ = 184 nm (ε = ) λ = 0 nm (ε = 7 000) A struttura fine λ = 55 nm (ε = 0) È dovuta alle interazioni dei livelli elettronici con i modi vibrazionali nm 41
42 I stretching = a sinistra di 000 cm 1 bending = (fuori dal piano) cm 1 stretching = spesso in coppia a 1600 e 1475 cm 1 4
43 1 NM L anisotropia diamagnetica descherma il nucleo δ ppm 1 NM L anisotropia diamagnetica descherma il nucleo δ 78 ppm MPSTI AMATII I composti aromatici reagiscono MANTNND l aromaticità ADDIZIN SSTITUZIN possibili meccanismi? 1) meccanismo sincrono δ δ 4
44 ) meccanismo in due stadi videnze sperimentali D D D La reazione è stata eseguita sul deuterobenzene D D D il legame D è piu forte del legame : k / k = 1 D significa che nello stadio lento non c'e rottura del legame In alcuni casi si è riusciti ad isolare l'intermedio BF 4 SbF 6 MANISM IN DU STADI MANISM DLLA SSTITUZIN LTTFILA AMATIA primo stadio lento δ δ primo stato di transizione addotto sigma strutture di risonanza dell'intermedio 44
45 secondo stadio veloce δ δ secondo stato di transizione nergia in funzione della coordinata di reazione: 1 ST ST 10.8 kcal/mole coordinata di reazione Tutte le variazioni strutturali che abbassano l'energia dell'intermedio abbassano anche l'energia dello stato di transizione che porta all'addotto σ e quindi rendono più facile la reazione. SSTITUZINI LTTFIL AMATI principali reazioni di Sostituzione lettrofila N NITAZIN N S 4 SLFNAZIN S 4 S S ALGNAZIN X FeX X X 45
46 (X = l) (X = ) l Fel l l FeBt clorurazione bromurazione ALILAZIN X All X Alchilazione di Friedelrafts AILAZIN X All X Acilazione di Friedelrafts Queste reazioni permettono di introdurre nel benzene gruppi funzionali diversi, ma avvengono con lo STSS MANISM. ' perciò importante capire quale è il reagente elettrofilo e come si forma. Nitrazione N S 4 N S 4 N N catione NITNI S 4 S = 4 N S 4 N S 4 = N N N Solfonazione S S S S S S 46
47 Alogenazione l l Fel Fel 4 "l " l l Fel 4 l Fel l Fe Fe 4 " " Fe 4 Fe Alchilazione (di Friedelrafts) δ δ δ δ l All... l... All All 4 All " Acilazione (di Friedelrafts) l δ δ All All 4 : All All 4 All l All All si deve usare in quantità stechiometrica perché dà complesso di Lewis con il prodotto 47
48 Sostituzioni elettrofile aromatiche dei Benzeni SSTITUITI Tutte le posizioni del benzene sono equivalenti. Quando c'è un sostituente, le posizioni sono diverse: orto, meta e 1para se i prodotti si formassero solo su basi statistiche, si dovrebbe avere 40% di orto, 40% di meta e 0% di para a distribuzione dei prodotti osservata sperimentalmente non è MAI quella statistica questo significa che il sostituente presente sull'anello del benzene indirizza l'attacco dell'elettrofilo INTAMNT per esempio: l l Non è un effetto del sostituente sul substrato! INTAMNT Stadio lento: formazione dell addotto σ: più stabile è l'addotto sigma, minore è l'energia dello stato di transizione che porta all'addotto. 1. Si scrivono tutti i possibili addotti e le rispettive strutture di risonanza.. Si esamina se c'è una struttura con la carica positiva sul che lega il sostituente.. Si guarda se il sostituente stabilizza (o destabilizza) la carica positiva. 48
49 meta benzene orto,para coordinata di reazione La reattività del benzene sostituito rispetto a quella del benzene dipende dall'energia di attivazione dello stadio lento e si vede dalla stabilità dell'addotto σ più stabile (del benzene sostituito) rispetto a quella dell'addottodel benzene. l l l l l l l l l l 49
50 orto,para l l meta benzene l l o coordinata di reazione 50
51 meta benzene orto,para o coordinata di reazione N N N N N N N N N N 51
52 N N orto,para meta benzene N o N coordinata di reazione l l l l l l l l l l l l 5
53 l meta orto,para benzene l l o l coordinata di reazione è specie a difetto elettronico reagisce meglio con centri II di elettroni ATTIVITA Si deve considerare la densità elettronica delle PSIZINI ATTIV (orientamento) sempio: mettere i seguenti composti in ordine decrescente di reattività, nei confronti di un reagente elettrofilo N l 1. Si individua la posizione (o le posizioni) di attacco, cioè l'orientamento (sulla base della stabilità degli addotti σ).. Si considera l'effetto del sostituente SU QULLA PSIZIN.. Maggiore è la densità elettronica, maggiore è la reattività (a parità di elettrofilo). 5
54 Tutte le posizioni sono equivalenti. Non ci sono sostituenti, la densità elettronica è quella di riferimento. N rientamento in MTA. In questa posizione il gruppo N esercita solo l'effetto induttivo. I attrazione elettronica Le posizioni reattive del nitrobenzene sono più povere di elettroni (e quindi MN reattive) delle posizioni reattive del benzene rientamento in T PAA. In queste posizioni il gruppo esercita sia l'effetto induttivo che quello coniugativo. I, rilascio elettronico Le posizioni reattive del metossibenzene sono più ricche di elettroni (e quindi PIU reattive) delle posizioni reattive del benzene rientamento in T PAA. In queste posizioni il gruppo esercita solo l'effetto induttivo. I rilascio elettronico Le posizioni reattive del metilibenzene sono più ricche di elettroni (e quindi PIU reattive) delle posizioni reattive del benzene l rientamento in T PAA. In queste posizioni il gruppo esercita sia l'effetto induttivo che quello coniugativo. I, attrazione elettronica Le posizioni reattive del clorobenzene sono più povere di elettroni (e quindi MN reattive) delle posizioni reattive del benzene Il rilascio elettronico dovuto a risonanza è maggiore di quello induttivo (alchili) eattività: l N > > > > 54
55 Sostituzioni lettrofile sul NAFTALN A differenza del benzene, le posizioni del naftalene non sono tutte equivalenti: INTAMNT β β α α α α β β per conoscere l orientamento, basta confrontare gli addotti sigma nelle posizioni α e β L altro anello mantiene la completa aromaticità volte su nella risonanza dell addotto in α, solo 1 nella risonanza dell addotto in β e quindi è più stabile Le sostituzioni elettrofile aromatiche sul naftalene avvengono in α N S 4 N Un caso a parte è la solfonazione, in cui l orientamento dipende dalla temperatura S T<100 o S 4 S S 4, Δ T>150 o S coordinata di reazione α β a T<100 : controllo cinetico, a T>150 : controllo termodinamico S S 55
56 AZINI N LTTFILI DBLI Avvengono solo con aromatici MLT reattivi 1. eazione con i sali di benzendiazonio : N N X N N N N X 4idrossiazobenzene L elettrofilo (voluminoso) va in in orto solo se la posizione para è occupata eagiscono solo: benzenolo (=fenolo) e benzenammina (=anilina) (e analoghi del naftalene). eazione di carbossilazione (eazione di Kolbe) solo con fenolo Na Na Δ δ δ δ aspirina (acido acetilsalicilico) acido acetossibenzencarbossilico acido salicilico (acido idrossibenzencarbossilico) 56
57 . eazione di formilazione (reazione di eimertiemann) Na Na l K solo con fenolo l :l l :l lettrofilo :l l l l l l aldeide salicilica (idrossibenzencarbaldeide) 4. eazione di idrossimetilazione solo con fenolo ochinometano pchinometano 57
58 PPAAZIN ATTIVITA' DI SALI DI BNZNDIAZNI [] N N N (Fe, l) N NaN, l, N S 4 [] (F ), Δ N N l P l ul KI u un AgBF 4 N I NaN, N N u BF 4 F Δ N (solido) US DI SALI DI BNZNDIAZNI 1. Introduzione di gruppi che non si possono introdurre diversamente è nucleofilo da il benzene reagisce con gli elettrofili N S 4 N [] N NaN l, 0 N N N l. Introduzione di un secondo sostituente in una posizione diversa da quella possibile con una sostituzione elettrofila aromatica, sulla base dell'orientamento provocato dal primo sostituente N esempi? 58
59 PBLMI SLUZIN difficile introdurre N N orienta un elettrofilo in meta sali di benzendiazonio N ( ) N N All serve per ingombrare stericamente le posizioni orto ed avere solo la sostituzione in para e per diminuire la reattività altrimenti si avrebbero prodotti di polimetilazione, N NaN N N un l, 0 l N N PBLMA sia che orientano in orto, para SLUZIN sali di diazonio N N N ( > I ) Fe gruppo a rilascio elettronico più forte (preparato come prima) di N, N NaN S 4, 0 5 N N S 4 P 59
60 ? PBLMA orienta in orto, para Fe Fe Fe SLUZIN SALI DI DIAZNI N in queste condizioni reagiscono tutte le posizioni influenzate da N N NaN X, 0 5 N gli atomi di sono nella posizione relativa voluta: basta togliere il gruppo N N N X P 60
61 ATTIVITA' DI ANTAN FNANTN N I AGNTI LTTFILI L'aumento del numero di anelli condensati diminuisce l'aromaticità Fenantrene ed antracene (meno aromatici di benzene e fenantrene) dannoan AZINI DI ADDIZIN FNANTN il legame 910 ha caratteristiche di un doppio legame poco delocalizzato (Fel ) 9bromofenantrene 9,10dibromo9,10diidrofenantrene ATTNZIN!! nel nome del prodotto di addizione va indicata la presenza dei due : 9,10dibromofenantrene indica che in 9 e 10 ci sono due atomi di AL PST DI DU 9,10dibromofenantrene il fenantrene si comporta con X come un alchene l l 9cloro9,10diidrofenantrene L'addizione avviene al legame 910, perché in questo modo rimane intatta l'aromaticità degli altri due anelli benzenici ANTAN (Fel ) Si comporta anche come un diene coniugato, dando prodotti di addizione 1,4, oltre ai prodotti di sostituzione elettrofila aromatica (in posizione 9) 9bromoantracene 9,10dibromo9,10diidroantracene L antracene dà le caratteristiche reazioni dei dieni coniugati e perciò reagisce con elettrofili del tipo X e con i dienofili 61
62 X 9X9,10diidroantracene X addotto di DielsAlder eazioni in catena laterale I benzeni sostituiti possono reagire anche in catena laterale (cioè sul sostituente), se si usano condizioni opportune. l hν l Fel l l AZINI DI SSIDAZIN Monoalchilbenzeni Si ossidano a acido benzencarbossilico KMn 4, Δ 6
63 KMn 4, Δ ( ) n KMn 4, (n 1) Δ Anello benzenico molto resistente all'ossidazione, V Il naftalene è un po più facile da ossidare, V Un ossidazione meno drastica si può avere con r e gli aromatici con più anelli condensati r 1,4naftalenchinone (1,4naftochinone) r r 9,10fenantrenchinone 9,10antracenchinone benzendioli Si ossidano molto facilmente a chinoni Ag obenzochinone Ag pbenzochinone 6
64 AZINI DI IDUZIN on La riduzione catalitica richiede pressioni e temperature elevate per la prima addizione (perdita dell aromaticità), mentre le addizioni successive sono più facili., P, Δ on Na cat. (Pt, Pd, Ni, u, o h) iduzione di Birch Na (o Li) meccanismo: Na.. carbanione N liquida,.. Na anione radicale radicale.. Se la reazione si effettua su un benzene sostituito INTAMNT Si formano carbanioni stabilizzati da gruppi ad attrazione elettronica, destabilizzati da gruppi a rilascio elettronico Un carbonio che porta un gruppo ad attrazione elettronica viene ridotto Na (o Li) N liquida, intermedio stabilizzato Un carbonio che porta un gruppo a rilascio elettronico non viene ridotto Na (o Li) N liquida, intermedio destabilizzato Na (o Li) N liquida, intermedio destabilizzato 64
65 Il benzene non reagisce con i nucleofili Nu Però.. la sintesi industriale del fenolo parte dal clorobenzene l K, Δ, P Kl..e allora???? SSTITUZIN NULFILA AMATIA Perché i composti aromatici possano reagire con NULFILI, devono possedere i seguenti requisiti 1. BUN GUPP USNT. SSTITUNT/I A FT ATTAZIN LTTNIA (N ) In questo caso si ha: Meccanismo di ADDIZINLIMINAZIN La reazione avviene in due stadi, con formazione nello stadio lento di un intermedio (addotto σ negativo o complesso di Meisenheimer), stabilizzato per risonanza dal sostituente l l N lento N N l δ l δ X l X δ l δ X l N l N l N X Δ =/ X l coordinata di reazione N 65
66 videnze sperimentali: qualche complesso di Meisenheimer è stato isolato F il legame F è più forte di l, ma è più reattivo di l N N il legame con il gruppo uscente non si rompe nello stadio lento e F (più elettronegativo) favorisce l'attacco del nucleofilo, rendendo più positivo il a cui è legato Però.. la sintesi industriale del fenolo parte dal clorobenzene l K, Δ, P Kl..e allora???? Se manca il sostituente a forte attrazione elettronica, si può avere reazione con i nucleofili, purché vengano soddisfatti i seguenti requisiti: 1. BUN GUPP USNT. il nucleofilo è UNA BAS FT K (solida) NaN in N liquida In questo caso si ha: Meccanismo di LIMINAZINADDIZIN La base forte strappa un protone acido (in orto al gruppo uscente) e la base coniugata forma il benzino, che, essendo molto reattivo, addiziona l'acido coniugato della base l l.. l BNZIN l'addizione può avvenire in entrambi i modi videnze sperimentali: l * l * * * = 1 con un clorobenzene sostituito si hanno miscele di prodotti 66
67 N pmetilclorobenzene l N N N l.. l N N N l ometilclorobenzene l N N N N l ometilclorobenzene l l N N N N 67
68 aratteristica strutturale di aldeidi e chetoni ALDIDI e TNI sp legato a sp = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che con i chetoni. Una scissione molto facile è la rottura α (αcleavage), che lascia un carbocatione acilio (stabilizzato per risonanza):... '. '.. ' ' M M P.M = 106 m/z 105 m/z 105 P.M = 10 M 68
69 UVvisibile due transizioni: π π* a λ = 190 nm (lontano UV) permessa dalla simmetria (ε> ) n π* a λ = 8090 nm proibita dalla simmetria (ε 150) La transizione n π* può non vedersi se la soluzione è diluita La coniugazione con doppi legami sposta I massimi di assorbimento verso lunghezze d onda maggiori (shift batocromico) π π* a λ = 1 nm (ε = M 1 cm 1 ) n π* a λ = 1 nm (ε = 40 M 1 cm 1 ) I ALDIDI stretching = stretching (del ) a circa 175 cm 1, spostato verso valori più bassi dalla coniugazione deboli bande a 750 e 850 cm 1. metilbutanale benzencarbaldeide 69
70 I stretching = TNI a circa 1715 cm 1, spostato verso valori più bassi dalla coniugazione pentanone fenil metil chetone 1 NM L effetto I dell ed il campo magnetico generato dagli elettroni π diminuiscono la densità elettronica attorno al nucleo del 1 : molto deschermato δ ppm (aldeidi) 0190 ppm (chetoni) metilbutanale pentanone 70
71 1 NM ALDIDI L effetto I dell ed il campo magnetico generato dagli elettroni π diminuiscono la densità elettronica attorno al nucleo del 1 del : molto deschermato (9,510,5 δ) benzencarbaldeide metilbutanale 1 NM TNI L effetto I dell diminuisce la densità elettronica attorno al nucleo del 1 sul adiacente: deschermato da,0,5 ( ) fino a (, ) δ pentanone fenil metil chetone 71
72 ALDIDI e TNI sp Nu: δ δ acido eazione caratteristica ADDIZIN NULFILA Meccanismo: 1. Nu: Nu lento sp (trigonale sp planare) (tetraedrico) Nu generalmente =. sp (trigonale planare) :Nu lento Nu sp (tetraedrico) 7
73 Sono reazioni di equilibrio isentono dell'effetto sterico isentono degli effetti elettronici dei sostituenti Sostituenti ad attrazione elettronica NDN PIU' PSITIV il carbonilico FAVISN l'attacco del nucleofilo ATTIVITA' SNT TNI < MTILTNI < ALDIDI < MTANAL a. NULFILI ALL'SSIGN aldeide idrata chetone idrato Meccanismo: : lento 7
74 Meccanismo: : lento MIATAL esempi: La reazione può avvenire anche in modo intramolecolare: Se la reazione con alcool si fa in ambiente AID ANID, prosegue: (*) ' ' ' (*) () l (gas) ATAL (*) ' " ' ' " ATAL (TAL) (*) l (gas) Meccanismo: ' ' come già descritto 74
75 '.. ' ' '.. ' ' ' ' ' on I chetoni (meno reattivi delle aldeidi) l equilibrio è spostato verso sinistra I chetoni danno chetali con equilibrio spostato verso destra solo se il nucleofilo è un diolo (1, o 1,): la reazione è intramolecolare e si forma un anello stabile.. sempio di applicazione: come ottenere da? KMn 4 però, con KMn 4 : KMn 4 75
76 KMn 4, b. NULFILI ALL ZLF S : S lento S S MITIATAL esempi: S S S S anidro S Se la reazione con si fa in ambiente AID ANID, prosegue: S S TIATAL on ditioli la reazione è intramolecolare quando si possono formare anelli stabili (5 e 6 termini).grado di.. S S S S S S 76
77 S S S S S S S S TIATAL (TITAL) NaS eazione di Bertagnini solo con aldeidi : S S reazione acidobase S Serve per purificare le aldeidi: l addotto precipita, si filtra, si torna ad aldeide c. NULFILI ALL AZT con i nucleofili all'azoto i prodotti di addizione perdono una molecola diacqua ammoniaca ed ammine primarie N, N :N N N IMMINA (base di Schiff).. 'N N ' N ' IMMINA (base di Schiff) Meccanismo: veloce 77
78 .. N veloce lento N veloce veloce N N La velocità della reazione dipende dal p la velocità massima si ha a p 5 6 N N k.. N 5 6 p a p troppo acido manca il nucleofilo a p non abbastanza acido, la concentrazione di composto carbonilico protonato è troppo bassa ammine secondarie N '.. N ' N ' N NAMMINA Meccanismo:.. veloce N lento veloce N N N sempi: N N, N 78
79 ( ) N N N ammine terziarie N N N NSSUNA AZIN derivati dell'ammoniaca NX.. X = N IDSSILAMMINA veloce.. N lento N :N N N SSIMA sempio: N N N ossima della benzencarbaldeide N N N ossima del butanone 79
80 X = N.... N N IDAZINA veloce N.. N N :N N N lento N N N N IDAZN sempio: N N N N N N idrazone del propanale X = N 6 5 Nu.... N N FNILIDAZINA veloce.. N N lento N N N :N N N N N FNILIDAZN 80
81 sempio:.... N N N N fenilidrazone del fenil metil chetone Nu N N.... N N N fenilidrazone del butanale N N,4DINITFNILIDAZINA N.... N N N N N N N N,4DINITFNILIDAZN sempio: N N N N N N N N,4difenilfenilidrazone del del propanone 81
82 X = NN.. N N.. N SMIABAZID Nu.. N N.. N N N N SMIABAZN N meccanismo: d. NULFILI AL ABNI : N: N N ' N cianidrina ' N cianidrina lento :.. : : N: N: 8
83 Addizione di carbanioni (composti organometallici) MgX δ δ MgX δ δ MgX ( ) Mg()X sempi: Mg Mg MgI MgI MgI MgI Li esempio: δ δ δ δ Li Li Li Li ( ) Li() FSFAN AZIN DI WITTIG alogenoalcano trifenilfosfina base forte composto carbonilico ALN 8
84 1. Sostituzione nucleofila.. P S N P sale di FSFNI (bromuro di alchiltrifenilfosfonio). eazione acidobase base.. P( 6 5 ) P( 6 5 ) P( 6 5 ) FSFAN o ILID (yilide) Nu: BAS butillitio ( Li) oppure idruro di sodio (Na) IL FSF PU' SPAND L'TTTT: stabilizza il carbanione. Addizione nucleofila.. P( 6 5 ) ' " P( 6 5 ) BTAINA " ' o FSFTAN " ' P( 6 5 ) fosfinossido "driving force (forza trainante) Il legame P è più forte del legame P sempio: 1. :PPh. Na Na.. :PPh PPh PPh PPh.. PPh =PPh 84
85 sempio: 1. :PPh. 4 9 Li PPh.. PPh NDNSAZIN ALDLIA 10% Na in ALDL meccanismo: 1. reazione acidobase genera il nucleofilo α. addizione nucleofila. reazione acidobase la sua concentrazione non cambia 85
86 l'aldolo, sottoposto a riscaldamento, perde una molecola di acqua Δ doppio legame coniugato perché la condensazione aldolica possa avvenire, è necessario che l'aldeide abbia almeno un in α al carbonile per esempio: non reagiscono aldeidi con più dell'etanale, comunque danno il carbanione in α al carbonile α δ δ NDNSAZIN ALDLIA MISTA La reazione con due aldeidi, entrambe con in α, dà una miscela di prodotti 86
87 la condensazione aldolica mista (o incrociata) diventa utile quando una sola delle aldeidi ha un in α (precursore del nucleofilo). nucleofilo la coniugazione con l'anello benzenico facilita la disidratazione ATTNZIN! la condensazione aldolica in ambiente basico con i chetoni non avviene equilibrio spostato a sinistra i chetoni possono essere utilizzati come fonti di carbanioni in condensazioni miste con aldeidi senza in α AZIN DI LAISNSMIDT nucleofilo 87
88 meccanismo: spontanea la coniugazione con l'anello benzenico facilita la disidratazione esempio: In questo caso, per avere disidratazione occorre SALDA (meglio se in ambiente acido) Δ AZIN DI ANNIZZA Le aldeidi SNZA in α al carbonile possono reagire con Na, in condizioni più drastiche di quelle della condensazione aldolica (concentrazione più elevata di base, temperatura elevata) Δ eazione di disproporzione (un si ossida e un altro di riduce) meccanismo: 1. attacco nucleofilo al carbonilico δ δ annizzaro ( ) Questo QUILIBI si ha anche nel caso della condensazione aldolica, ma in quel caso c è un altra strada (attraverso la base coniugata) che porta a prodotti e quindi questo equiibrio è come se non ci fosse. 88
89 . trasferimento di idruro ( con gli elettroni di legame) δ δ. reazione acidobase Danno la reazione di annizzaro tutte le aldeidi SNZA AIDI Di solito gli acidi sono in α al carbonile, ma NN NSSAIAMNT esempio: ma:? acido! ecc. Nucleofilo condensazione aldolica 89
90 TAUTMIA L'equilibrio tautomerico è catalizzato da acidi e da basi meccanismo in ambiente basico:.. reazione acidobase ione enolato reazione acidobase enolo l'equilibrio è spostato verso la forma carbonilica 99.99% 0.01% 99.90% 0.10% 99.4% 0.06% l'equilibrio è spostato verso la forma enolica se ci sono fattori particolari che la stabilizzano 0% 80% meccanismo in ambiente acido:..... stabilizzazione per legame idrogeno : reazione acidobase reazione acidobase 90
91 Un chirale in α al carbonile in ambiente acido o basico racemizza * (S) oppure * (S) * () IDUZIN, cat. idruro (a) oppure (b) [] N idruro = NaB 4, LiAl 4 N (b) N N,, Δ WolffKischner (a) Zn(g), l lemmensen meccanismi: NaB 4 ADDIZIN NULFILA Nu: = B B.. N N ADDIZIN NULFILA Nu: = NN.. N N N N Δ N N N.. ADDIZIN NULFILA Nu: = :N.. N N Ni N idrogenazione catalitica 91
92 SSIDAZIN [] [] [] NSSUNA AZIN ' tutti gli ossidanti già visti con gli alcooli Saggio di Tollens Ag(N ) Ag specchio d'argento gli αidrossichetoni possono dare un saggio positivo: Gottfried Tollens ' [] Ag(N ) Ag ' AZINI IN ATNA LATAL αalgnazin I chetoni vengono alogenati in α al carbonile. La reazione è promossa da basi oppure acidocatalizzata (Le aldeidi vengono ossidate dagli alogeni). promossa da basi: la base si consuma acidocatalizzata 9
93 l'acido non si consuma La velocità dell'αalogenazione (sia in ambiente basico che in ambiente acido) NN dipende dalla concentrazione di alogeno. meccanismo della reazione promossa da basi: lento meccanismo della reazione acido catalizzata: lento : 9
94 on i metilchetoni reazione dell'aloformio con eccesso di alogeno e Na in acqua, I I iodoformio solido giallo meccanismo: I I I I I I I Acidità maggiore di quella del metile I I I atomi di iodio (elettronegativi) I I :I I Si separa; giallo ATTNZIN!!! i possono essere falsi positivi I ossidante anche composti diversi dai metilchetoni possono dare lo iodoformio (falsi positivi) se la molecola può essere ossidata dallo iodio a metilchetone I I I I I I 94
95 MPSTI ABNILI α,βinsatui centro nucleofilo centro elettrofilo on reagenti elettrofili Addizione 1, e 1,4 Addizione 1, Addizione 1,4 l l l l on reagenti nucleofili Addizione 1, e 1,4 N N N N meccanismo: 14 1,4 N N N N N N N 1, N N N N N con nucleofili basi più forti è preferita l'addizione 1, (al =) 95
96 Mg MgI con nucleofili basi più deboli è preferita l'addizione 1,4 N N IDUZIN di composti carbonilici contenenti = il prodotto dipende dal catalizzatore e dalle condizioni di reazione, Ni si riduce = 5, Ni, Δ si riducono entrambi 1. NaB 4. si riduce = AIDI ABSSILI e DIVATI aratteristica strutturale di acidi carbossilici e derivati Y aratteristiche Spettrali Spettrometria di massa Acidi carbossilici Lo ione molecolare di solito è spesso debole. La rottura α (αcleavage), lascia il carbocatione acilio (stabilizzato per risonanza):.. Può essere perso il gruppo.. m/z 45 96
97 Anche con gli altri gruppi funzionali è favorita la scissione dello ione molecolare che porta al carbocatione acilio Le ammidi non sostituite sull N hanno un picco caratteristico a m/z 44. N. N m/z 44 acido butanoico, PM 88 acetato di etile, PM 88 M M propanammide, PM 7 N m/z 44 cloruro di butanoile, PM 106 M M l anidride benzencarbossilica, PM 6 97
98 UVvisibile Analogo a quello di aldeidi e chetoni I AIDI ABSSILII stretching stretching = banda molto larga a 400 cm 1, spesso sovrapposta alle bande a circa cm 1, spostato verso valori più bassi dalla coniugazione stretching tra 10 e 110 cm 1 acido butanoico I STI stretching = a circa 175 cm 1, spostato verso valori più bassi dalla coniugazione con. La coniugazione con sposta l assorbimento verso valori più alti. stretching due o più bande tra 100 e 1000 cm 1 acetato di etile 98
99 I AMMIDI stretching = a circa cm 1. stretching N cm 1 (N hanno due bande) propanammide N I stretching = LUI AILII a circa 1800 cm 1, spostato verso valori più bassi dalla coniugazione. cloruro di butanoile cloruro di benzoile 99
100 I ANIDIDI stretching = sempre due bande tra 180 a 1800 cm 1 e tra 1775 e 1740, spostato verso valori più bassi dalla coniugazione con. stretching tra 100 e 900 cm 1 anidride propanoica I stretching N NITILI a circa 50 cm 1, spostato verso valori più bassi dalla coniugazione con. propanonitrile benzenecarbonitrile 100
101 1 NM L effetto I dell ed il campo magnetico generato dagli elettroni π diminuiscono la densità elettronica attorno al nucleo del 1 : molto deschermato δ X ppm acetato di etile acido butanoico anidride propanoica propanammide 1 NM L effetto I dell diminuisce la densità elettronica attorno al nucleo del 1 sul adiacente: deschermato da,0,5 ( ) fino a (, ) δ (negli acidi arbossilici) fortemente deschermato: 1015 δ; protone mobile, scambia con D N (nelli ammidi) deschermato e molto allargato: 67 δ; protone mobile, scambia con D acido butanoico acido benzencarbossilico 101
102 acetato di etile propanammide N Nmetiletanammide anidride benzoica N AIDI ABSSILI e DIVATI sp δ δ acido acido Nu: aratteristiche: Acidità del legame Il del carbossile subisce attacco da parte dei nucleofili I protoni in α al carbossile sono relativamente acidi e possono essere sostituiti 10
103 sp gruppo uscente Y δ δ aratteristiche: sull' del carbonile (o sull'n del nitrile) si ha protonazione I protoni in α al carbonile sono relativamente acidi e possono essere strappati con basi forti Qualche reazione caratteristica delle ammidi avviene sull'n acido Nu: eazione caratteristica SSTITUZIN NULFILA sp δ δ N (la sostituzione nucleofila può avvenire con meccanismo base o acidocatalizzato) acido Nu: Meccanismo: Nu: Nu lento Y Y sp sp (trigonale planare) (tetraedrico) Nu sp (trigonale planare) SSTITUZIN NULFILA AL ABNI AILI Principali nucleofili: :Nu =,, N, N, N, S, Nu: =,, N < < < < ' S' l reattività crescente Questo ordine di reattività è il risultto di più fattori 10
104 Basicità del gruppo uscente meno basico: miglior gruppo uscente Basicità: N < < () < l capacità come gruppo uscente isonanza l l S' S' ' ' N N il contributo della struttura di risonanza a separazione di carica diminuisce la bontà del gruppo uscente ed è tanto maggiore quanto migliore è la sovrapposizione degli orbitali (cioè con gli elementi della stessa riga). ffetto induttivo Maggiore è l effetto ad attrazione elettronica, più positivo è il carbonilico ATTIVITA SNT l ' N più facile è l attacco del nucleofilo oppure N 104
105 ATTIVITA SNT l " " ' ATTIVITA SNT l N N ' 1. AZIN N Nu = a) Alogenuri acilici l : lento l l Sostituenti ad attrazione elettronica su FAILITAN l'attacco del nucleofilo b) steri Gli esteri sono meno reattivi degli alogenuri acilici: l acqua da sola non reagisce), oppure, In ambiente basico Nu = lento : ' ' ' reazione acidobase ' L'ultimo passaggio rende IVSIBIL l'intero processo Sostituenti ad attrazione elettronica su FAILITAN l'attacco del nucleofilo 105
106 In ambiente acido Nu = ' ' ' lento ' : ' ' ' Processo VSIBIL Questo significa che in ambiente acido si può idrolizzare un estere ad acido carbossilico L'idrolisi acida degli esteri è praticamente insensibile agli effetti elettronici dei sostituenti; è invece sensibile agli effetti sterici ATTNZIN Questa insensibilità agli effetti elettronici (induttivo e coniugativo) dei sostituenti è una caratteristica SL dell IDLISI AIDA degli STI è il risultato di effetti opposti, praticamente uguali Lo stadio lento è l attacco del nucleofilo sull estere protonato: dipende quindi dalla sua concentrazione, che, a sua volta, dipende dalla basicità dell estere K = [()' ] [ '][ ] [()'] = K [ '][ ] v = k[()' ] = kk [ '][ ] La reattività dipende dalla costante di velocità dello stadio lento (k) dalla costante di equilibrio acidobase preliminare (K) k K l'attacco del nucleofilo è favorito dai sostituenti ad attrazione elettronica la protonazione di una base è sfavorita dai sostituenti ad attrazione elettronica Solo nel caso dell'idrolisi acida degli esteri gli effetti hanno valori molto simili, cioè la sensibilità della protonazione e dell'attacco nucleofilo all'effetto dei sostituenti è praticamente la stessa. ssendo di segno opposto, gli effetti si annullano. 106
107 c) Ammidi Le ammidi sono ancora meno reattive: l acqua da sola non reagisce), oppure, In ambiente basico Nu = N : lento N i sono solo ATTIVI gruppi uscenti, e N, ma è più AID di N N : N N reazione acidobase N L'ultimo passaggio rende IVSIBIL l'intero processo Sostituenti ad attrazione elettronica su FAILITAN l'attacco del nucleofilo In ambiente acido Nu = N N N lento : N N N N N4 L'ultimo passaggio rende IVSIBIL l'intero processo Sostituenti ad attrazione elettronica su FAILITAN l'attacco del nucleofilo 107
108 d) Anidridi Nu = Le anidridi sono più reattive di esteri ed ammidi: basta l acqua da sola : e) Nitrili L'ultimo passaggio rende IVSIBIL l'intero processo Sostituenti ad attrazione elettronica su FAILITAN l'attacco del nucleofilo I nitrili sono poco reattivi (meno delle ammidi): l acqua da sola non reagisce), oppure, In ambiente acido Nu = : lento N: N N N N tautomeria PSGU con l'idrolisi N acida delle ammidi N N N N N N : N N 4 L'ultimo passaggio rende IVSIBIL l'intero processo Sostituenti ad attrazione elettronica su FAILITAN l'attacco del nucleofilo 108
109 . AZIN N ALLI a) Acidi carbossilici In ambiente acido Nu = lento : ' ' ' ' ' ' La reazione intramolecolare è facile, se si formano anelli stabili (5 e 6 termini) : γ Δ γlattone : δ Δ δlattone se l' è più vicino al carbossile, ci sono altri percorsi di reazione, più facili della chiusura di un anello teso β Δ βeliminazione α Δ lattide 109
110 se l' è più lontano dal carbossile, il prodotto dipende dalle condizioni di reazione in soluzione molto diluita: in soluzione concentrata: Δ Δ n ( ) n n b) Alogenuri acilici l.. ' lento l ' l opportuno effettuare la reazione in presenza di una base (per l) es.: l N N l c) Anidridi.. ' ' ' ' ' 110
111 d) steri TANSSTIFIAZIN In ambiente basico Nu = ' :" lento " ' " ' In ambiente acido Nu = ' ' ' " lento ' : " " ' " " " ' " e) Ammidi ssendo meno reattive, richiedono condizioni di reazione troppo energiche per essere utili. AZIN N AMMNIAA D AMMIN a) Acidi carbossilici con N :N N 4 reazione acidobase Scaldando il carbossilato di ammonio solido: N 4 Δ (solido) N Meccanismo: :N N N N4 N 111
112 con ammine primarie N N N (solido) Δ N Meccanismo: N N N N N con ammine secondarie :N N N Δ (solido) N Meccanismo: N N :N N N 11
113 Se si ha un amminoacido con il gruppo amminico in γ o δ al carbossile, la reazione è intramolecolare (si formano anelli a 5 o a 6 termini) N γ Δ N γlattame N Δ δ N δlattame se l N è più vicino i al carbossile, ci sono altri percorsi di reazione, più facili della chiusura di un anello teso N β N Δ βeliminazione N b) Alogenuri acilici Meccanismo: l :N lento l N l N l l :N N N 4 l 'N 'N l N ' l '"N '"N l N ' " 11
114 c) Anidridi :N N N N N N N N N4 N ' 'N N N4 " N N ' '"N N4 Le anidridi cicliche danno immidi N.. N N 4 anidride ftalica Δ N.. N N ftalimmide :B N base debole, acido B N 114
115 d) steri lento :N ' ' N N ' ' N Gli esteri sono meno reattivi di alogenuri acilici e anidridi e perciòbisogna scaldare ' Δ N " N " ' ' N " ''' Δ ' N " ''' 4. AZIN N AIDI ABSSILII ABSSILATI on questi nucleofili possono reagire solo I derivati acilici più reattivi a) Alogenuri acilici l l l l l l neutralizzato con una base man mano che si forma es: N l N l 115
116 b) Acidi carbossilici (SL con acidi bicarbossilici in grado di formare anelli stabili) Δ. AZIN N TILI a) Alogenuri acilici ' S l l ' S l es: N S l S N l S' 6. AZIN N MPSTI GANMTALLII con reattivi di Grignard e litioorganici a) steri MgX δ δ ' " MgX ' " ' "MgX da qui prosegue la reazione dei chetoni MgX δ δ, ' MgX ' ' i chetoni sono più reattivi degli esteri e perciò si arriva all'alcool terziario es.: Mg, Mg 116
117 ' " δ Li δ Li ' " ' "Li da qui prosegue la reazione dei chetoni δ Li δ, ' Li ' ' b) loruri acilici MgX δ δ ' l MgX ' l ' MgXl con accorgimenti sperimentali, è possibile fermare la reazione alla formazione del chetone, altrimenti, si arriva ad alcool terziario δ MgX δ, ' MgX ' ' ' l Li δ Li δ ' l ' Lil ' Li δ δ, Li ' ' con cadmioorganici e cuprati organici Per fermare la reazione a chetone si devono usare: composti organometallici meno reattivi solo con i cloruri acilici MgX dl d Mgl MgX ( =, alchile primario, fenile) esempio: Mg dl d 117
118 d l l δ δ ' l ' l ' uli es.: l ( ) uli l ( ) uli 78 (feromone delle formiche) 9% IDUZINI a) on idruro LiAl 4 LiAl 4 l ' LiAl 4 LiAl 4 N N LiAl 4 N N 118
119 Meccanismo: Al (Li ) (Li ) Al Y = l, ', Al Y : Y : Y Y = N Y : N N N N : N N : N N : N : N N Diminuendo la reattività dell'idruro è possibile fermare ad aldeide la riduzione dei LUI AILII [( Li ) ] Al l es.: l [( Li ) ] Al 119
120 b) on idrogeno e catalizzatore, Pt N N on catalizzatore disattivato è possibile fermare ad aldeide la riduzione degli ALGNUI AILII Pd, BaS 4 l Pd, chinolina N es.: l Pd N AZINI SPIFI DLL SINGL LASSI DI GUPPI FUNZINALI 1. Acidi carbossilici (a) trasformazione del gruppo in buon gruppo uscente cattivo gruppo uscente Per trasformarlo in buon gruppo uscente si possono utilizzare i reagenti che trasformano in l on agenti alogenanti l Sl l S l Pl 5 l Pl l Pl P() esempi: l S l l l S 10
ALDEIDI e CHETONI. Nu: sp 2. δ+ δ- C O C E + H acido ADDIZIONE NUCLEOFILA. Reazione caratteristica
 ALDEIDI e ETNI Nu: sp 2 δ δ E acido eazione caratteristica ADDIZINE NULEFILA himica rganica e Laboratorio Meccanismo: 1. Nu: Nu lento sp 2 (trigonale planare) sp 3 (tetraedrico) E Nu E generalmente E =
ALDEIDI e ETNI Nu: sp 2 δ δ E acido eazione caratteristica ADDIZINE NULEFILA himica rganica e Laboratorio Meccanismo: 1. Nu: Nu lento sp 2 (trigonale planare) sp 3 (tetraedrico) E Nu E generalmente E =
ALCHINI. legame π. Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico +. + R. +
 AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 9, che corrisponde al carbocatione propargilico.. 2 2 2 1-ottino 4-ottino
AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 9, che corrisponde al carbocatione propargilico.. 2 2 2 1-ottino 4-ottino
ALCHINI. Spettrometria di massa C CH 2 R. + CARATTERISTICA FUNZIONALE: legame π. Caratteristiche Spettrali
 AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico 2 +. +. + + 2 2 2
AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico 2 +. +. + + 2 2 2
CICLOALCHENI. legame π C. Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico +. + R CH + CH 2 CH CH 2
 ALENI ILALENI ARATTERISTIA FUNZINALE: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R 2 2 2
ALENI ILALENI ARATTERISTIA FUNZINALE: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R 2 2 2
ALDEIDI e CHETONI. Lo ione molecolare di solito è osservabile, sia con le aldeidi che con i chetoni.
 ALDEIDI e ETNI aratteristica strutturale di aldeidi e chetoni sp 2 legato a sp 2 = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che con
ALDEIDI e ETNI aratteristica strutturale di aldeidi e chetoni sp 2 legato a sp 2 = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che con
ALCHENI CICLOALCHENI. Spettrometria di massa. UV-visibile CH CH CH 2 CH CH 2 R CH + CH 2 CARATTERISTICA FUNZIONALE: legame π C
 ALENI ILALENI ARATTERISTIA FUNZINALE: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R 2 2 2
ALENI ILALENI ARATTERISTIA FUNZINALE: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R 2 2 2
COMPOSTI AROMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti.
 CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. Caratteristiche Spettrali Spettrometria di massa La maggior parte
CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. Caratteristiche Spettrali Spettrometria di massa La maggior parte
COMPOSTI AROMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti.
 CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. Caratteristiche Spettrali Spettrometria di massa La maggior parte
CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. Caratteristiche Spettrali Spettrometria di massa La maggior parte
COMPOSTI AROMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti.
 MPSTI ARMATII L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. aratteristiche Spettrali La maggior parte dei composti aromatici Spettrometria
MPSTI ARMATII L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. aratteristiche Spettrali La maggior parte dei composti aromatici Spettrometria
COMPOSTI AROMATICI. L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti.
 CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. UVvisibile Il benzene ha legami π coniugati Lo spettro di assorbimento
CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. UVvisibile Il benzene ha legami π coniugati Lo spettro di assorbimento
ALDEIDI e CHETONI. O sp 2 legato a C sp 2
 aratteristica strutturale di aldeidi e chetoni ALDEIDI e ETI sp legato a sp = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che con i chetoni.
aratteristica strutturale di aldeidi e chetoni ALDEIDI e ETI sp legato a sp = aratteristiche Spettrali Spettrometria di massa Lo ione molecolare di solito è osservabile, sia con le aldeidi che con i chetoni.
ALCHENI ALCHINI, ALCADIENI, CICLOALCHENI, CICLOALCADIENI ADDIZIONE
 ALNI ALINI, ALADINI, ILALNI, ILALADINI ARATTRISTIA FUNZINAL: legame π Più debole del legame σ, è il punto debole degli alcheni. la rottura del legame π porta a due valenze libere sui due atomi di, che
ALNI ALINI, ALADINI, ILALNI, ILALADINI ARATTRISTIA FUNZINAL: legame π Più debole del legame σ, è il punto debole degli alcheni. la rottura del legame π porta a due valenze libere sui due atomi di, che
anidridi C R PREPARAZIONE DELLE ANIDRIDI + R C O - C Cl C R + P 2 O 5 C R C OH
 anidridi PEPAAZINE DELLE ANIDIDI l P 2 5 Nu = 2 Le anidridi sono più reattive di esteri ed ammidi: basta l acqua da sola : 2 2 2 2 EAZINI DELLE ANIDIDI: con acqua '.. ' ' ' ' EAZINI DELLE ANIDIDI: con
anidridi PEPAAZINE DELLE ANIDIDI l P 2 5 Nu = 2 Le anidridi sono più reattive di esteri ed ammidi: basta l acqua da sola : 2 2 2 2 EAZINI DELLE ANIDIDI: con acqua '.. ' ' ' ' EAZINI DELLE ANIDIDI: con
Addizioni nucleofile. Addizioni a C=O
 Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
ACIDI CARBOSSILCI e DERIVATI
 AIDI ABSSILI e DEIVATI aratteristica strutturale di acidi carbossilici e derivati aratteristiche Spettrali Spettrometria di massa Acidi carbossilici Lo ione molecolare di solito è spesso debole. La rottura
AIDI ABSSILI e DEIVATI aratteristica strutturale di acidi carbossilici e derivati aratteristiche Spettrali Spettrometria di massa Acidi carbossilici Lo ione molecolare di solito è spesso debole. La rottura
CLASSIFICAZIONE DEI TIPI DI REATTIVITA'
 riepilogo delle reazioni organiche LASSIFIAZIN DI TIPI DI ATTIVITA' UNA AZIN IMIA MPTA LA TTUA / LA FMAZIN DI LGAMI La scissione di un legame covalente può avvenire in due modi diversi: 1. LA PPIA DI LTTNI
riepilogo delle reazioni organiche LASSIFIAZIN DI TIPI DI ATTIVITA' UNA AZIN IMIA MPTA LA TTUA / LA FMAZIN DI LGAMI La scissione di un legame covalente può avvenire in due modi diversi: 1. LA PPIA DI LTTNI
COMPOSTI AROMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti.
 MPSTI AMATII L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. aratteristiche Spettrali La maggior parte dei composti aromatici Spettrometria
MPSTI AMATII L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. aratteristiche Spettrali La maggior parte dei composti aromatici Spettrometria
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Composti Carbossilici. Reattività
 omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
Aromaticità. Addizione elettrofila alcheni
 Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Unità didattica 7 (segue) Reattività del benzene. Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili
 Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
M i n i s t e r o d e l l I s t r u z i o n e, d e l l U n i v e r s i t à e d e l l a R i c e r c a
 PROGRAMMA SVOLTO DOCENTE: Campani Maria Varini Simone A.S: 2018/2019 DISCIPLINA: Chimica organica e biochimica CLASSE: 3^A CHI MAT Per ogni Tema svolto vengono indicati i relativi contenuti. LEGAME CHIMICO
PROGRAMMA SVOLTO DOCENTE: Campani Maria Varini Simone A.S: 2018/2019 DISCIPLINA: Chimica organica e biochimica CLASSE: 3^A CHI MAT Per ogni Tema svolto vengono indicati i relativi contenuti. LEGAME CHIMICO
Lezione: aldeidi e chetoni
 Lezione: aldeidi e chetoni Il gruppo funzionale carbonilico Nomenclatura Proprietà fisiche Principali reazioni eazioni con N eazioni con alcoli eazioni con tioli eazioni con ammine Tautomeria cheto-enolica
Lezione: aldeidi e chetoni Il gruppo funzionale carbonilico Nomenclatura Proprietà fisiche Principali reazioni eazioni con N eazioni con alcoli eazioni con tioli eazioni con ammine Tautomeria cheto-enolica
REGISTRO DELLE LEZIONI 2005/2006. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso, libri di testo esami e propedeuticità La struttura elettronica dell'atomo, gli orbitali, tipi di legami, regola dell'ottetto Ibridizzazione strutture di Lewis, carica formale,
Presentazione del corso, libri di testo esami e propedeuticità La struttura elettronica dell'atomo, gli orbitali, tipi di legami, regola dell'ottetto Ibridizzazione strutture di Lewis, carica formale,
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Sostituzione nucleofila Addizione a gruppi carbonilici Addizione a doppi legami attivati
 himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
Esercitazione n Reazioni e meccanismi di aldeidi e chetoni.
 19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
Gruppi funzionali. aldeidi
 Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Aldeidi e Chetoni. Proprietà Chimico Fisiche Sostanze Polari L ossigeno carbonilico forma forti legami H Bassi pesi molecolari sono solubili in acqua
 Aldeidi e hetoni ' Gruppo carbonilico Aldeide hetone Proprietà himico Fisiche Sostanze Polari L ossigeno carbonilico forma forti legami Bassi pesi molecolari sono solubili in acqua Nomenclatura IUPA :
Aldeidi e hetoni ' Gruppo carbonilico Aldeide hetone Proprietà himico Fisiche Sostanze Polari L ossigeno carbonilico forma forti legami Bassi pesi molecolari sono solubili in acqua Nomenclatura IUPA :
Composti carbonilici
 Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
Benzene e Composti Aromatici
 Benzene e Composti Aromatici Contenuti della lezione: Il benzene e i requisiti per l aromaticità Nomenclatura di benzeni mono- e di-sostituiti Composti aromatici diversi dal benzene: IPA e eteroaromatici
Benzene e Composti Aromatici Contenuti della lezione: Il benzene e i requisiti per l aromaticità Nomenclatura di benzeni mono- e di-sostituiti Composti aromatici diversi dal benzene: IPA e eteroaromatici
Reazioni degli Alogenuri Alchilici. Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici.
 Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1
 CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
DIENI CONIUGATI. ADDIZIONE DI HCl. addotto 1,2
 DIENI NIUGATI I dieni coniugati sono diversi dai dieni isolati perché hanno lunghezze anomale dei legami e perché sono più stabili termodinamicamente dato che liberano meno energia nella reazione di idrogenazione
DIENI NIUGATI I dieni coniugati sono diversi dai dieni isolati perché hanno lunghezze anomale dei legami e perché sono più stabili termodinamicamente dato che liberano meno energia nella reazione di idrogenazione
Complementi di Chimica Organica. Composti Aromatici: Benzene C 6 H 6 (1825) (1865) Friedrich August Kekulé
 Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
M: M +. + e. La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu.
 PIIPI DLLA SPTTMTIA DI MASSA A differenza delle altre tecniche analitiche (I, UVvis, M) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni invece di
PIIPI DLLA SPTTMTIA DI MASSA A differenza delle altre tecniche analitiche (I, UVvis, M) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni invece di
Unità didattica 6. Cosa è una sostutizione? Reazioni di Sostituzione degli Alogenuri Alchilici
 Cosa è una sostutizione? Unità didattica 6 Reazioni di Sostituzione degli Alogenuri Alchilici Capitolo 7 e 8 di Brown e Poon L atomo o il gruppo che è sostituito o eliminato in queste reazioni è detto
Cosa è una sostutizione? Unità didattica 6 Reazioni di Sostituzione degli Alogenuri Alchilici Capitolo 7 e 8 di Brown e Poon L atomo o il gruppo che è sostituito o eliminato in queste reazioni è detto
ALCHENI: Reazioni del doppio legame
 ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
IDROCARBURI INSATURI: GLI ALCHENI HANNO ALMENO UN DOPPIO LEGAME NELLA STRUTTURA NOMENCLATURA: RADICE COME NEGLI IDROCARBURI, DESINENZA -ENE
 IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
Acidi carbossilici e derivati
 Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Idrocarburi Saturi. Reazioni
 Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Reazioni Stereospecifiche e Stereoselettive
 Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Capitolo 4 Reazioni degli alcheni
 himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
COMPOSTI AROMATICI. Formula C 6 H 6
 COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
I.T.I.S. VOLTA - Perugia A. S. 2011/2012 CLASSE 3 a sez. AC MATERIA: Chimica Organica Bio-Org. delle Fermentazione e Lab.
 I.T.I.S. VOLTA - Perugia A. S. 2011/2012 CLASSE 3 a sez. AC MATERIA: Chimica Organica Bio-Org. delle Fermentazione e Lab. (Esercizi da svolgere durante il periodo estivo) Strumento da utilizzare: libro
I.T.I.S. VOLTA - Perugia A. S. 2011/2012 CLASSE 3 a sez. AC MATERIA: Chimica Organica Bio-Org. delle Fermentazione e Lab. (Esercizi da svolgere durante il periodo estivo) Strumento da utilizzare: libro
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Esercitazione n Reazioni e meccanismi dei composti aromatici.
 sercitazione n. 1 Reazioni e meccanismi dei composti aromatici.. Scrivere il meccanismo della clorurazione del benzene, mettendo in evidenza il ruolo del catalizzatore. Fe Fe Fe Fe. Il pdimetilbenzene
sercitazione n. 1 Reazioni e meccanismi dei composti aromatici.. Scrivere il meccanismo della clorurazione del benzene, mettendo in evidenza il ruolo del catalizzatore. Fe Fe Fe Fe. Il pdimetilbenzene
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Domanda 4 Dal punto di vista della reattività, il doppio legame si comporta spesso da:
 Tema svolto Domanda 1 Al punto isoelettrico la solubilità di una amminoacido in acqua è: 1. intermedia (-1) 2. doppia rispetto ad un ph più acido e dimezzata rispetto ad un ph più basico (-1) 3. la più
Tema svolto Domanda 1 Al punto isoelettrico la solubilità di una amminoacido in acqua è: 1. intermedia (-1) 2. doppia rispetto ad un ph più acido e dimezzata rispetto ad un ph più basico (-1) 3. la più
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione
 Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Idrogeni in α a un carbonile
 Enoli e Enolati 1 Idrogeni in α a un carbonile Solo gli idrogeni α sono acidi Gli idrogeni β, γ e δ non sono acidi non possono essere rimossi da una base acido non acidi α β γ δ 2 Enoli Tutti i composti
Enoli e Enolati 1 Idrogeni in α a un carbonile Solo gli idrogeni α sono acidi Gli idrogeni β, γ e δ non sono acidi non possono essere rimossi da una base acido non acidi α β γ δ 2 Enoli Tutti i composti
Reattività degli acidi carbossilici e loro derivati. La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica
 Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Composti carbonilici. Componente principale dell aceto. Principio attivo di molti farmaci. Resina per abbigliamento
 Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
COMPOSTI AROMATICI POLICICLICI
 CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
Alcani. Idrogenazione degli alcheni. Riduzione degli areni H 2. /Pt H 3. Ni + 3 H C, 180 atm
 Sintesi Alcani Idrogenazione degli alcheni 2 /Pt 2 /Pt 3 3 iduzione degli areni Ni + 3 2 175, 180 atm Alcheni Deidroalogenazione degli alogenuri alchilici 3 α 3 X β 3 Disidratazione degli alcoli Idrogenazione
Sintesi Alcani Idrogenazione degli alcheni 2 /Pt 2 /Pt 3 3 iduzione degli areni Ni + 3 2 175, 180 atm Alcheni Deidroalogenazione degli alogenuri alchilici 3 α 3 X β 3 Disidratazione degli alcoli Idrogenazione
Composti carbonilici: reazioni al carbonio in posizione a
 Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Assorbimenti di alcani (stretching. Corso Metodi Fisici in Chimica Organica Prof. Renzo LUISI Uniba. vietata la vendita
 Assorbimenti di alcani (stretching C-H) Corso Metodi Fisici in Chimica rganica Prof. Renzo LUISI Uniba. vietata la vendita Analisi di spettri: ALCANI (C-H) 4000 3500 3000 2500 2000 1500 1300 1000 700 500
Assorbimenti di alcani (stretching C-H) Corso Metodi Fisici in Chimica rganica Prof. Renzo LUISI Uniba. vietata la vendita Analisi di spettri: ALCANI (C-H) 4000 3500 3000 2500 2000 1500 1300 1000 700 500
ALCOOLI R-O-H C H. ... a. alcossido H C O - BASE H C O H + H C X. alcheni. a,d. ossidazione. aldeidi e chetoni. b b,c
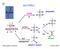 ALLI.. --.. BASE a - alcossido c d b.... a himica rganica e Laboratorio AID a,d ossidazione aldeidi e chetoni b b,c X alcheni ottura del legame SSTITUZINE NULEFILA Br Br 2 Br - 2 ELIMINAZINE 2 S 4 Δ 2
ALLI.. --.. BASE a - alcossido c d b.... a himica rganica e Laboratorio AID a,d ossidazione aldeidi e chetoni b b,c X alcheni ottura del legame SSTITUZINE NULEFILA Br Br 2 Br - 2 ELIMINAZINE 2 S 4 Δ 2
Stabilità. 1. più sostituito = più stabile. 2. trans più stabile del cis; E più stabile del Z. II. Relazione struttura-reattività R C R R R
 Alcheni 1 II. Relazione struttura-reattività 1. più sostituito = più stabile Stabilità R R R R R > > R R, R 2 2 > R 2 > R R 2 2 2. trans più stabile del cis; E più stabile del Z repulsione trans-2-butene
Alcheni 1 II. Relazione struttura-reattività 1. più sostituito = più stabile Stabilità R R R R R > > R R, R 2 2 > R 2 > R R 2 2 2. trans più stabile del cis; E più stabile del Z repulsione trans-2-butene
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Aldeidi e Chetoni. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Reazioni degli alcani
 Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio.
 La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Unità Didattica 10. I composti carbonilici. Struttura, nomenclatura e reattività
 I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni Il gruppo funzionale è il doppio legame C=O Il carbonile ha geometria planare (il carbonio è sp 2 ) Unità Didattica 10 I composti
I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni Il gruppo funzionale è il doppio legame C=O Il carbonile ha geometria planare (il carbonio è sp 2 ) Unità Didattica 10 I composti
È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica
 aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
H H. R R δ+ R H. δ Cl
 Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
R-X ALOGENURI ALCHILICI. F Cl Br I. Nomenclatura. In genere si indicano con. + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo
 ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
AMMINE. con acidi RNH 2. con O come elettrofilo RNH 2 + H + + R NH 3 NESSUNA REAZIONE. atomo basico, atomo nucleofilo
 AMME : 2 1. come atomo basico o nucleofilo atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE con acidi 2 con come elettrofilo SL con ammine terziarie 2 2
AMME : 2 1. come atomo basico o nucleofilo atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE con acidi 2 con come elettrofilo SL con ammine terziarie 2 2
14/11/2018. Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile.
 Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Esteri degli acidi carbossilici
 Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
Classi di composti: derivati carbonilici
 Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 59 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 59 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici
 Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 62 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 62 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Figura. Alogenuri alchilici
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni Alogenuri alchilici: nomenclatura Alogenuri
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni Alogenuri alchilici: nomenclatura Alogenuri
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati 1 Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni 2 Alogenuri alchilici: nomenclatura Alogenuri
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati 1 Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni 2 Alogenuri alchilici: nomenclatura Alogenuri
AMMINE R'' H H C 2 H 5 C H C H C H NH 2 H H. azoto. alifatici o aliciclici. ammina primaria ammina secondaria ammina terziaria N CH 3
 AMMIE Si chiamano primarie le ammine che hanno un solo gruppo alchilico o aromatico legato all azoto azoto. Sono secondarie e terziarie le ammine al cui atomo di azoto sono legate, rispettivamente,, due
AMMIE Si chiamano primarie le ammine che hanno un solo gruppo alchilico o aromatico legato all azoto azoto. Sono secondarie e terziarie le ammine al cui atomo di azoto sono legate, rispettivamente,, due
1. COS È LA CHIMICA ORGANICA?
 Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
PIANO DELLE UDA Quarto Anno
 ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica e biochimica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Quarto Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Titolo:
ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica e biochimica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Quarto Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Titolo:
BENZENE E DERIVATI. Composto aromatico: termine usato per indicare il benzene ed i suoi derivati C 6 H 6. Arene: Idrocarburo aromatico
 BENZENE E DERIVATI Composto aromatico: termine usato per indicare il benzene ed i suoi derivati C 6 H 6 Arene: Idrocarburo aromatico Gruppo arilico: gruppo sostituente che deriva da un arene per rimozione
BENZENE E DERIVATI Composto aromatico: termine usato per indicare il benzene ed i suoi derivati C 6 H 6 Arene: Idrocarburo aromatico Gruppo arilico: gruppo sostituente che deriva da un arene per rimozione
p p s sp sp sp s p p 1
 p p s sp p sp sp p s 1 alcheni 63 kcal/mol alchini 2 nd 54 kcal/mol 2 Come per gli alcheni, gli alchini interni sostituiti sono più stabili di quelli esterni More stable Etino (acetilene) C 2 H 2 +O 2
p p s sp p sp sp p s 1 alcheni 63 kcal/mol alchini 2 nd 54 kcal/mol 2 Come per gli alcheni, gli alchini interni sostituiti sono più stabili di quelli esterni More stable Etino (acetilene) C 2 H 2 +O 2
Ammine. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni
 Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni δ - X δ X = F, l, o I Dato il carattere elettrofilo del carbonio alogeno sostituito, buona parte della chimica degli
Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni δ - X δ X = F, l, o I Dato il carattere elettrofilo del carbonio alogeno sostituito, buona parte della chimica degli
La condensazione di Claisen
 La condensazione di Claisen Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione
La condensazione di Claisen Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione
Stabilità del benzene (entalpie di idrogenazione) Energia di risonanza
 La chimica del benzene e dei suoi derivati I derivati del benzene vengono chiamati composti aromatici poiché inizialmente vennero isolati dal catrame nel 1800 ed erano caratterizzati da un odore aromatico.
La chimica del benzene e dei suoi derivati I derivati del benzene vengono chiamati composti aromatici poiché inizialmente vennero isolati dal catrame nel 1800 ed erano caratterizzati da un odore aromatico.
PROGRAMMA SVOLTO ANNO SCOLASTICO 2018/2019
 Nome docenti Materia insegnata Classe Testi adottati Dispense e materiali forniti dal docente Stefano BOTTIGLIENGO, Giuseppe SURANO CHIMICA ORGANICA E BIOCHIMICA 4EI (Istituto: Tecnico - Settore: Tecnologico
Nome docenti Materia insegnata Classe Testi adottati Dispense e materiali forniti dal docente Stefano BOTTIGLIENGO, Giuseppe SURANO CHIMICA ORGANICA E BIOCHIMICA 4EI (Istituto: Tecnico - Settore: Tecnologico
Idrocarburi AROMATICI
 Idrocarburi AROMATICI Composti aromatici Gli idrocarburi aromatici costituiscono una particolare classe di composti che contengono 2n 1 doppi legami coniugati in una struttura ciclica, strutturalmente
Idrocarburi AROMATICI Composti aromatici Gli idrocarburi aromatici costituiscono una particolare classe di composti che contengono 2n 1 doppi legami coniugati in una struttura ciclica, strutturalmente
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Corso di Laurea Triennale in Biotecnologie, AA 2016/17, Esame di Chimica Organica, Nominativo.Matricola
 Corso di Laurea Triennale in Biotecnologie, AA 2016/17, Esame di Chimica Organica, 19-06-2017 Nominativo.Matricola Esercizio 1a. Il cis-2-pentene viene trattato con Br 2 in diclorometano. a) Descrivere
Corso di Laurea Triennale in Biotecnologie, AA 2016/17, Esame di Chimica Organica, 19-06-2017 Nominativo.Matricola Esercizio 1a. Il cis-2-pentene viene trattato con Br 2 in diclorometano. a) Descrivere
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
PIANO DI STUDIO DELLA DISCIPLINA
 ISIS C. Facchinetti Sede: via Azimonti, 5-21053 Castellanza Tel. 0331 635718 fax 0331 679586 info@isisfacchinetti.gov.it Rev. 1.1 del 26/07/17 https://isisfacchinetti.gov.it CHIMICA ORGANICA PIANO DELLE
ISIS C. Facchinetti Sede: via Azimonti, 5-21053 Castellanza Tel. 0331 635718 fax 0331 679586 info@isisfacchinetti.gov.it Rev. 1.1 del 26/07/17 https://isisfacchinetti.gov.it CHIMICA ORGANICA PIANO DELLE
Composti carbonilici. Composti carbonilici. Componente principale dell aceto. Principio attivo di molti farmaci. Resina per abbigliamento
 Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Composti carbonilici. Componente principale dell aceto. Principio attivo di molti farmaci. Resina per abbigliamento
 Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci Resina per abbigliamento
2. LA STRUTTURA DEI COMPOSTI ORGANICI E LE CARATTERISTICHE CHIMICO- FISICHE
 Università degli Studi di Bari Facoltà di Farmacia Corso di Laurea in Tecniche Erboristiche A.A. 2011-2012 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del corso è quello di evidenziare
Università degli Studi di Bari Facoltà di Farmacia Corso di Laurea in Tecniche Erboristiche A.A. 2011-2012 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del corso è quello di evidenziare
