Le interazioni non covalenti si possono classificare in: Energie di legame associate alle principali interazioni non covalenti:
|
|
|
- Veronica Capasso
- 7 anni fa
- Visualizzazioni
Transcript
1 Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle interazioni covalenti (poche kcal/mol rispetto ad esempio a 83 kcal/mol per un legame C C). Questi legami deboli possono formarsi sia fra parti diverse della stessa macromolecola, sia fra parti di macromolecole diverse. Essi giocano un ruolo fondamentale in molti processi biologici, fra cui la fedele replicazione del DNA, il folding delle proteine, il riconoscimento specifico di substrati da parte di enzimi, il riconoscimento di molecole segnale. Le interazioni non covalenti si possono classificare in: - interazioni elettrostatiche - legami idrogeno - interazioni di van der Waals - effetto idrofobico 1 Energie di legame associate alle principali interazioni non covalenti: Tipo di interazione non covalente Energia di legame (kcal/mole) Interazioni elettrostatiche Legame idrogeno Interazioni di van der Waals Nel considerare i vari contributi energetici che stabilizzano una proteina non si può prescindere dal fatto che la proteina è immersa in un solvente, che è costituito principalmente da acqua. Le proprietà fisiche del solvente sono estremamente importanti per la stabilità della proteina. 2
2 Le interazioni elettrostatiche, i legami idrogeno e le interazioni di van der Waals tra due molecole in un ambiente acquoso non sono particolarmente favorevoli dal punto di vista energetico, perché sono in competizione con interazioni di analoga intensità fra le molecole e l acqua che le circonda. Infatti, l acqua è una molecola polare, con una grande capacità di formare legami idrogeno. Inoltre l acqua indebolisce fortemente le interazioni elettrostatiche e i legami idrogeno fra molecole polari: - l acqua diminuisce l intensità delle interazioni elettrostatiche di un fattore di circa 80 (costante dielettrica) rispetto alle stesse interazioni nel vuoto; - l acqua può competere con gruppi della proteine nella formazione di legami idrogeno. 3 Due gruppi elettrostaticamente carichi si attraggono o si respingono con una forza:! F = 1 q 1 q 2 4"# r 2 ˆ r forza di Coulomb dove q 1 e q 2 sono le cariche (Coulomb) dei due gruppi r è la distanza tra q 1 e q 2,! è la costante dielettrica del mezzo in cui si trovano le cariche. L interazione è maggiore nel vuoto, minore in un mezzo come l acqua (! = 80). Non è facile misurare! per una proteina: in genere viene assegnato un valore di
3 Interazioni elettrostatiche di ordine superiore - carica dipolo (l energia va come 1/R 2 ) - dipolo dipolo (1/R 3 ) - carica dipolo indotto (1/R 4 ) - dipolo dipolo indotto (1/R 6 ) = van der Waals Lisina, Arginina e Istidina Sono tre aminoacidi basici, carichi positivamente a ph fisiologico. Acido aspartico e Acido glutammico Sono due aminoacidi acidi, carichi negativamente sopra ph = 4 5 Esempio di ponte salino (o legame ionico): Interazione elettrostatica tra l acido glutammico che porta una carica di 1, e la istidina che ha carica +1. I ponti salini sono poco numerosi nelle proteine e si concentrano prevalentemente sulla superficie proteica. Ponti salini in zone meno accessibili delle proteine si realizzano se gli aminoacidi carichi sono coinvolti nel meccanismo catalitico di un enzima (per es. la triade catalitica Asp-His-Ser delle proteasi a serina). 6
4 Sono interazioni aspecifiche fra molecole non cariche, che giocano un ruolo quando gli atomi distano tra loro 3-4 Å. Esprimono il fatto che esiste una mutua attrazione fra molecole od atomi anche uguali fra loro e con distribuzione di carica simmetrica. Tale simmetria è però presente solo da un punto di vista statistico e l origine di queste forze attrattive è dovuta all effetto di fluttuazioni temporane di distribuzione elettronica che generano dipoli transienti nell atomo o nella molecola considerata. A loro volta tali dipoli transienti inducono dei dipoli transienti (detti dipoli indotti) nelle molecole più vicine e quindi forze attrattive di natura elettrostatica. 7 Le interazioni di van der Waals possono essere rappresentate da un energia potenziale E(r), funzione della distanza r, che include sia una componente attrattiva, sia una componente repulsiva a corto raggio. Questa energia è rappresentata dal potenziale di Lennard-Jones: E(r) = B r 12 " A r 6 E(r) "1/r 12 r Termine repulsivo Termine attrattivo "1/r 6 A e B sono delle costanti che possono essere determinate empiricamente 8
5 Per una coppia di atomi la distanza in corrispondenza della quale si ha un minimo del potenziale, corrisponde alla somma dei rispettivi raggi di van der Waals. Il raggio di van der Waals si estrapola dalla minima distanza di contatto fra due atomi adiacenti, non legati covalentemente. E(r) "1/r 12 "1/r 6 r La forza attrattiva fra due atomi aumenta quando essi si avvicinano, fino a quando raggiungono la distanza di van der Waals di contatto. A distanze inferiori a quella di contatto diventano predominanti forti forze repulsive, perché le nuvole elettroniche più esterne tendono a sovrapporsi Il legame idrogeno può essere formato sia tra molecole non cariche che cariche. In un legame idrogeno un atomo di idrogeno viene condiviso da due atomi. L atomo di idrogeno è legato covalentemente a uno dei due atomi, chiamato donatore (D) di idrogeno, ed interagisce con l altro atomo, chiamato accettore (A) di idrogeno. Una molecola non carica può essere polarizzata, cioè i suoi orbitali elettronici possono essere distribuiti in modo tale che una parte della molecola ha meno elettroni (quindi porta una carica positiva) mentre un altra parte ha un eccesso di elettroni (quindi porta una carica negativa). In una molecola nella quale uno o più atomi di H sono legati covalentemente ad un elemento più elettronegativo (O, S, N), si genera un dipolo in cui l atomo/gli atomi di H rappresentano la parte positiva 10
6 H-F (# + ) (# - ) H (# + ) (# - ) H O H H -N H (# + ) (# - ) Se l atomo a cui è legato l idrogeno è elettronegativo (S, O, N) l atomo H si carica positivamente e puo legare un altro atomo carico negativamente. Le piccole dimensioni dell atomo di H e la presenza in esso di un solo elettrone (assenza di elettroni di schermo) rendono particolarmente intenso il campo elettrostatico di H che puo dunque legarsi con un altro atomo che disponga di un doppietto elettronico libero (lone pair, orbitale atomico completo con 2 elettroni). 11 Se sia D che A sono elettronegativi, allora la nuvola elettronica relativa a D-H è polarizzata verso D, cioè si ha un eccesso # - di carica negativa su D. A ha una parziale carica negativa # - che attrae l atomo di idrogeno. In questo senso, il legame idrogeno si può pensare come un intermedio nel trasferimento di un protone da un acido ad una base. acido base D H A # - # + # - - interazione elettrostatica di # - e # + - deformazione degli orbitali molecolari - depauperamento di elettroni nell orbitale di H $ avvicinamento fra H ed A 12
7 Nelle proteine il donatore in un legame idrogeno è un atomo di ossigeno o azoto (o zolfo nella Cys) che ha un atomo di idrogeno legato covalentemente. L accettore può essere sia un atomo di ossigeno che di azoto. - la lunghezza di un legame idrogeno è intermedia tra quella di un legame covalente e di un interazione di van der Waals. Di solito la distanza tra atomo H e accettore A è 10-25% inferiore della somma dei corrispondenti raggi di van der Waals. - i legami idrogeno sono altamente direzionali. I legami idrogeno più intensi si hanno quando A e D sono collineari Dist. tra il primo e l ultimo atomo 13 In generale, le energie in gioco nel legame idrogeno sono dell ordine di qualche kcal/mol. In realtà, se consideriamo il legame idrogeno che si può formare tra due gruppi in una proteina, l energia associata è minore, circa kcal/mole. Si deve pure tenere conto del fatto che una proteina non si trova nel vuoto ma in una soluzione acquosa: affinché si formi un legame idrogeno fra due gruppi appartenenti alla proteina, si devono prima rompere i legami idrogeno che ciascun gruppo fa con una molecola d acqua. Tenendo conto dell energia che si spende per rompere tali legami idrogeno, si arriva ai valori di kcal/mole. 14
8 Ibridizzazione Ibridizzazione = combinazione lineare di orbitali atomici s+p = orbitale sp 2 orb. molecolari s+2 orbitali p = sp 2 3 orb. molecolari s+3 orbitali p = sp 3 4 orb. molecolari planare H 2 O 15 # - # + # - Una variante del legame idrogeno particolarmente forte si ha in presenza di gruppi carichi. 16
9 17 I legami idrogeno sono fondamentali nelle strutture proteiche. La capacità dell ossigeno carbonilico della catena principale di formare legami idrogeno con i gruppi amminici della catena principale promuove la formazione delle strutture secondarie come %-eliche e foglietti &. %-elica foglietto & 18
10 Dinamica molecolare cos è? metodologia per descrivere alcune proprietà dinamiche di un sistema come funziona? legge che mette in relazione forze e proprietà cinematiche nel sistema: MQ, MC F i = m i a i applicazione allo studio di una proteina: si parte dalla struttura della proteina: N { r i } i=1 si sceglie un force field modello delle interazioni tra gli atomi della proteina Force field V (r) = V legame + V non"legame F i = " #V #r i = "! $ i V V legame = V l + V " + V # +...= N legami 1 $ b i (l i % l i0 ) i=1 N legami 1 $ a i (" i %" i0 ) 2 + $ d i (1+ cos(n# i %# i0 )) 2 i=1 N legami i=1 dist. di legame angoli di legame rot. attorno ai legami V l l 0 =1 l 0 =1 l
11 Interazioni di non legame 12 # A & V non"legame = V vdw + V e = ij % $ r ( " B 6 0 ) # &, + ij. + % ij ' $ r ( * ij '. + i/ j - 0 i/ j q i q j 412r ij V vdw V e Evoluzione del sistema nel tempo r i (t + "t) = r i (t) + #r i #t "t + 1 # 2 r i 2 #t "t 2 + o("t 3 ) 2 r i (t " #t) = r i (t) " $r i $t #t + 1 $ 2 r i 2 $t #t 2 " o(#t 3 ) 2 Serie di Taylor algoritmo di Verlet r i (t + "t) = 2r i (t) # r i (t # "t) + F i m i "t 2 + o("t 4 ) " r i (t = 0) # $ v i (t = 0) # r i ("t) $ % v i ("t) # r i (n"t) $ % v i (n"t) "t =10 #15 sec =1fs
12 Stima degli errori nella traiettoria 1 2 mv 2 = 1 2 kt v = kt m "10 Å/ps v = "r "t # "r = v"t =10 $10%3 =10 %2 Å errore di algoritmo su r " v # $t 4 "10 %11 Å errore su r = er. di alg. + er. di arrotondamento + er. di derivata + er. di cut off La traiettoria percorsa non è quella vera ma è formata da tante traiettorie possibili dato un force field (E) e delle condizioni al contorno (T,P). Schema operativo N { r i (t = 0) } i=1 Parametri del Force field (l, q, ) Definizione di un box attorno alla proteina (>10 Å): aggiunta di acqua, condizioni al contorno periodiche, neutralità della carica elettrica nel box R int "10 # 20 Å definizione di un range per le interazioni (R int ) di non legame: VdW e elettrostatiche
13 Minimizzazione Modificazione delle coordinate in accordo al force field: ricerca di una conformazione che minimizza l energia definita dal f.f. Termalizzazione Aumento graduale della temperatura fino alla temperatura di riferimento Equilibrazione Raggiungimento di uno stato di energia minima/cost. alla temperatura desiderata Evoluzione, NPT Controllo Analisi Controllo r.m.s.d. r.m.s.d 0,7 0,6 0,5 0,4 0,3 0,2 0, ps E (kj/mol) energia ps
14 Le interazioni fra acqua e molecole non polari non sono favorevoli: proprio come l olio disperso nell acqua tende a raccogliersi in un unica goccia, anche i gruppi non polari nelle proteine tendono ad aggregarsi, per ridurre la superficie apolare a contatto con l acqua. Questa preferenza di specie idrofobiche per ambienti non polari viene detta effetto idrofobico: esso è uno delle principali cause del folding delle proteine. L effetto idrofobico fa sì che sostanze non polari minimizzino il loro contatto con l acqua, e molecole anfipatiche (come per esempio i detergenti) formino micelle in soluzioni acquose. Il meccanismo fisico per cui entità non polari sono escluse da soluzioni acquose dipende dall entropia. 27 Le molecole d acqua allo stato liquido formano dinamicamente (in funzione della temperatura) un alto numero di legami idrogeno. L introduzione di una molecola non polare nell acqua crea una sorta di cavità nell acqua, che temporaneamente rompe alcuni legami idrogeno, (un gruppo non polare infatti non può formare legami idrogeno con le molecole d acqua) Le molecole d acqua spostate si riorientano per formare il maggior numero di nuovi legami idrogeno, creando una struttura ordinata, una specie di gabbia, detta clatrato, intorno alla molecola non polare. 28
15 Poiché il numero di modi con cui le molecole d acqua formano legami idrogeno intorno ad un gruppo non polare è inferiore a quello che farebbero in sua assenza si ha una diminuzione di entropia del sistema. Anche se, da un punto di vista entalpico, il sistema clatrato è più stabile ('H < 0, per una debole liberazione di energia dovuto alla formazione di legami idrogeno ed interazioni di van der Waals), globalmente: 'G = 'H T'S > 0 processo non spontaneo L aggregazione di gruppi non polari minimizza la superficie della cavità occupata dal gruppo apolare e quindi la perdita di entropia del sistema. acqua C 6 H 6 C 6 H 6 acqua 2xC 6 H 6 L effetto idrofobico rappresenta una interazione chiave per il folding delle proteine, in cui residui con catene laterali idrofobiche si ripiegano verso l interno della proteina lasciando esposti al solvente i residui polari. 29 La catena polipeptidica contiene sia gruppi polari che non polari, per cui si avrà un diverso comportamento dei residui nell acqua. Si osserva, infatti, che i gruppi apolari sono in gran parte raccolti nella parte interna (core) e idrofobica della proteina, mentre i residui polari sono esposti al solvente. Ribosoma Proteina estesa (unfolded) (U) Unfolded Molten globule () Proteina globulare (folded) Folded (F) 'G FOLDING = G F G U = 'H T'S < 0 processo spontaneo di folding > 0 processo non spontaneo 30
16 31 'H = variazione di entalpia fra stato finale ed iniziale (interazioni di van der Waals, elettrostatiche, legami idrogeno). 'H risulta << 0. T = temperatura assoluta (K) 'S = variazione di entropia (disordine del sistema) fra stato finale ed iniziale. Poiché S U >> S F ) 'S << 0 Nel 'G FOLDING il contributo T'S è positivo e sia 'H che T'S assumono valori grandi (migliaia di kcal/mol). Al contrario 'G FOLDING ha valori piccoli: 'G FOLDING = -10, -15 kcal/mol Quindi il processo di folding avviene grazie ad un minimo prevalere di 'H su T'S; è sufficiente un piccolo aumento di T per causare unfolding (e denaturazione) della proteina. 32
17 Responsabile della variazione di entropia è anche l effetto idrofobico. 'S FOLDING = S F S U = 'S CATENA + 'S SOLVENTE sempre < 0 Nel caso di un soluto apolare in un mezzo acquoso, le molecole d acqua che formano il clatrato attorno alla molecola apolare sono caratterizzate da una variazione di entropia negativa. Spontaneamente le molecole apolari si riuniscono in modo da minimizzare la variazione negativa di 'S SOLVENTE. Nel caso del folding proteico di proteine globulari solubili, si forma una zona interna, core idrofobico di molecole d acqua che, nella forma proteica unfolded erano coinvolte nella formazione dei clatrati con molecole d acqua ordinate attorno alle catene laterali degli aminoacidi idrofobici. 33 Superficie accessibile al solvente di una proteina La superficie proteica è definita dall insieme dei punti degli atomi esterni, ciascuno descritto come una sfera rigida avente come raggio il raggio di van der Waals (superficie di van der Waals). Le molecole d acqua sono considerate sfere con raggio di van der Waals pari a 1.4 Å. La superficie accessibile al solvente (ASA) è definita come l area descritta dal centro di una molecola d acqua che rotola sopra la superficie di van der Waals della proteina superficie di van der Waals 34
18 'G di trasferimento delle catene laterali degli aminoacidi E stato misurato il 'G di trasferimento di ciascun aminoacido dall acqua ad un solvente organico (per esempio etanolo o diossano). Per avere la misura del 'G di trasferimento della sola catena laterale, bisogna non considerare il contributo della catena principale (che falserebbe la misura, avendo sempre una carica negativa del gruppo carbossilico COO - e una positiva del gruppo amminico NH 3+ ). Ciò equivale a sottrarre dal valore di 'G di trasferimento di ciascun aminoacido il 'G di trasferimento della Gly. 'G cat.lat. = 'G aa - 'G Gly 35 Esiste una relazione lineare tra 'G di trasferimento (dall acqua ad un solvente apolare) e superficie accessibile al solvente per catene laterali completamente non polari. Nel caso di aminoacidi moderatamente polari (Thr, Ser, Met, Tyr e Trp) una relazione analoga è relativamente valida, applicando una diminuzione di circa 1.5 kcal/mole nel 'G di trasferimento. 36
19 Si può quindi dire che il 'G di trasferimento è proporzionale alla superficie non polare accessibile al solvente. La costante di proporzionalità (coefficiente angolare della retta) vale kcal/mole Å 2. Questo significa che si guadagnano kcal/mole (o equivalentemente 25 cal/mole) per ogni Å 2 di superficie non polare che si seppellisce nel cuore di una proteina. 37
Macromolecole Biologiche Interazioni non covalenti
 Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Interazioni non-covalenti
 BCP 3-4 Interazioni non-covalenti Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono
BCP 3-4 Interazioni non-covalenti Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono
Le interazioni deboli:
 Le interazioni deboli: sono legami non covalenti sono da 1 a 3 ordini di grandezza più deboli dei legami covalenti sono alcune volte maggiori della tendenza a dissociare dovuta all agitazione termica delle
Le interazioni deboli: sono legami non covalenti sono da 1 a 3 ordini di grandezza più deboli dei legami covalenti sono alcune volte maggiori della tendenza a dissociare dovuta all agitazione termica delle
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
Forze intermolecolari
 Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
Diagramma di Ramachandran
 Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
L acqua. Ci devono essere delle forze che tengono saldamente insieme le molecole d acqua
 L acqua Comparata a molecole con caratteristiche atomiche simili e di grandezza comparabile, l acqua presenta alcune caratteristiche peculiari Comparando l idruro dell ossigeno con gli idruri degli elementi
L acqua Comparata a molecole con caratteristiche atomiche simili e di grandezza comparabile, l acqua presenta alcune caratteristiche peculiari Comparando l idruro dell ossigeno con gli idruri degli elementi
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico
 gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
30/10/2015. Molte proteine sono. intrinsecamente disordinate. o destrutturate (IDP/IUP), cioè non hanno una struttura
 Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
L'energia media V di interazione fra uno ione avente carica q e un dipolo permanente ad una distanza r Ä
 Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
Idrogeno (H) Azoto (N) La materia è costituita da elementi chimici. In natura sono presenti 92 elementi
 Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
Come si costruiscono le molecole in natura ed in laboratorio. Giuseppe Macino
 Come si costruiscono le molecole in natura ed in laboratorio Giuseppe Macino E Dio creo la luce Cosa tiene insieme tutta la materia che forma la terra? Tutto questo e costituito da ELEMENTI Gli elementi
Come si costruiscono le molecole in natura ed in laboratorio Giuseppe Macino E Dio creo la luce Cosa tiene insieme tutta la materia che forma la terra? Tutto questo e costituito da ELEMENTI Gli elementi
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
Lezione n. 22. Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
ORBITA ORBIT LI ALI MOLECOLARI
 ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
Legame chimico e proprietà delle sostanze
 I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
Cristallizzazione di Macromolecole Biologiche A.A. 2009-2010
 di Macromolecole Biologiche A.A. 2009-2010 Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Cristalli proteici: molecola cella elementare unità asimmetrica elemento
di Macromolecole Biologiche A.A. 2009-2010 Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Cristalli proteici: molecola cella elementare unità asimmetrica elemento
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Tavola Periodica degli Elementi: Gruppi e Periodi
 La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
UNITÀ 1 LA CARICA ELETTRICA E L'ELETTRIZZAZIONE. I corpi possono acquisire (prendere) una proprietà che si chiama carica elettrica.
 UNITÀ 1 Prerequisiti: conoscere le caratteristiche del modello atomico conoscere e operare con le potenze: prodotto e divisione tra potenze con stessa base, potenze di 10, potenze ad esponente negativo
UNITÀ 1 Prerequisiti: conoscere le caratteristiche del modello atomico conoscere e operare con le potenze: prodotto e divisione tra potenze con stessa base, potenze di 10, potenze ad esponente negativo
Il Legame Ionico. Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B -
 Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
06/03/2012. Elementi in chimica organica
 CORSO DI LAUREA IN BIOINFORMATICA CHIMICA ORGANICA E DELLE MACROMOLECOLE BIOLOGICHE MICHAEL ASSFALG Lezione: 6 CFU = 48 ORE Lun 14:30-16:30, 16:30, Mer 8:30-10:30 PROVA FINALE: SCRITTO (+ ORALE) TESTI:
CORSO DI LAUREA IN BIOINFORMATICA CHIMICA ORGANICA E DELLE MACROMOLECOLE BIOLOGICHE MICHAEL ASSFALG Lezione: 6 CFU = 48 ORE Lun 14:30-16:30, 16:30, Mer 8:30-10:30 PROVA FINALE: SCRITTO (+ ORALE) TESTI:
Il legame tra le molecole
 1 Il legame tra le molecole Obiettivo L'obiettivo di questa lezione è piuttosto ambizioso. Partendo dal concetto di dipolo elettrico e passando per la forma delle molecole arriveremo a definire il concetto
1 Il legame tra le molecole Obiettivo L'obiettivo di questa lezione è piuttosto ambizioso. Partendo dal concetto di dipolo elettrico e passando per la forma delle molecole arriveremo a definire il concetto
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Tavola Periodica degli Elementi
 Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
30/10/2015 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE
 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Lezione 3 - Legame chimico
 Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
= Atomo di idrogeno (H) molecola dell idrogeno (H 2 )
 IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUAL VOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA
 Il Legame Chimico Per raggiungere configurazioni elettroniche stabili gli elementi tendono a reagire fra loro formando legami chimici. Configurazione stabile = situazione di minima energia Il legame chimico
Il Legame Chimico Per raggiungere configurazioni elettroniche stabili gli elementi tendono a reagire fra loro formando legami chimici. Configurazione stabile = situazione di minima energia Il legame chimico
Adenina Adenine H H N N N N N Z
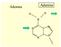 Adenina Adenine Z Guanina O GUAIA Z Citosina CITOSIA Z O Timina Thymine C3 O Z O Siti di attacco elettrofilo 3 Thymine Basi appaiate: Timina-Adenina Adenine C 3 O O 3.ooA Basi appaiate: Citosina-Guanina
Adenina Adenine Z Guanina O GUAIA Z Citosina CITOSIA Z O Timina Thymine C3 O Z O Siti di attacco elettrofilo 3 Thymine Basi appaiate: Timina-Adenina Adenine C 3 O O 3.ooA Basi appaiate: Citosina-Guanina
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
PROVA 1. Dati i composti con formula KBr e HClO 2 :
 PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Le proprietà periodiche degli elementi. Problema: ordinare gli elementi secondo un criterio logico e memorizzabile
 Le proprietà periodiche degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile Nei periodi gli elementi presentano numero atomico crescente e le proprietà chimiche
Le proprietà periodiche degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile Nei periodi gli elementi presentano numero atomico crescente e le proprietà chimiche
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
Teoria di Lewis. Un acido di Lewis è una specie chimica che può formare un legame covalente accettando una coppia di elettroni da un altra specie.
 Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
