Daniele Trovò allievo dell ITIS Natta di Padova Reazioni degli acidi carbossilici 1
|
|
|
- Bruno Parodi
- 9 anni fa
- Visualizzazioni
Transcript
1 Indice: Pagina Acidità degli acidi carbossilici 2 eattività degli acidi carbossilici 4 Preparazione dei cloruri 5 Preparazione delle anidridi 6 Preparazioni degli esteri 7 Preparazioni delle ammidi 8 Sintesi e idrolisi dei nitrili 10 iduzione di acidi carb. e derivati 11 eazioni con i composti organometallici 13 eazione di ellvolhardzelinsky 15 Decarbossilazione 16 Sintesi malonica 17 Sintesi dei βchetoesteri: la condensazione di laisen 18 Sintesi acetacetica 19 arbonatazione dei reattivi organometallici 20 arbonilazione 20 eazione con litio di isopropilammide 20 Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 1
2 Gli acidi carbossilici sono dei composti che hanno come gruppo funzionale il carbossile (). Il carbossile è formato da un carbonile (come quello di aldeidi e chetoni) legato anche ad un gruppo. I tre atomi del gruppo carbossilico (ossigeno, carbonio, ossigeno) hanno ibridazione sp 2 e questo permette ai loro elettroni π di essere delocalizzati in tutto il sistema. La teoria VB rappresenta il gruppo carbossilico con due forme limite di risonanza uguali tra loro. Forme limite di risonanza del carbossilato (indistinguibili) Acidità degli acidi carbossilici Gli acidi carbossilici sono la più acida classe di composti che contiene solo carboni, idrogeni e ossigeni. La costante di ionizzazione K a è dell ordine di 10 5 e quindi sono acidi deboli; per esempio una soluzione di acido acetico 0,1 M in acqua si dissocia solo l 1,3 %. L acidità è dovuta al fatto che l idrogeno che viene strappato in un acido ( ) è in posizione α rispetto al carbonio del carbonile e la carica negativa che si forma non è bloccata sull ossigeno (come in un alcol), ma è distribuita sui due ossigeni per risonanza. Le due forme limite di risonanza mostrate poche righe sopra hanno la particolarità di essere uguali. Quando sono tali, la teoria VB dice che l ibrido di risonanza, in questo caso il carbossilato, è una molecola particolarmente stabile. Anche un chetone, se gli viene strappato un idrogeno in α, ha la carica negativa che non è localizzata solo sul carbonio, ma è stabilizzata per risonanza. La differenza sostanziale sta nel fatto che mentre in un chetone la carica è delocalizzata su un ossigeno e su un carbonio, in un acido è delocalizzata su due ossigeni e l anione è quindi molto più stabile a) alcossido b) enolato (carica negativa ferma) (carica negativa delocalizzata su carbonio e ossigeno) 2 2 c) carbossilato (carica negativa delocalizzata sui due ossigeni) Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 2
3 La carica negativa del carbossilato inoltre è stabilizzata dall effetto induttivo. Il carbonio ha una parziale carica positiva δ e l ossigeno del carbonile ha un parziale δ. Il carbonio positivo attrae per effetto induttivo gli elettroni dell ossigeno carico negativamente rendendo l anione più stabile. δ δ L acidità degli acidi carbossilici è influenzata anche da altri fattori. I sostituenti che posseggono una certa elettronegatività, in particolare se sono legati al carbonio in α contribuiscono ad aumentare l acidità. Questo rafforzamento può essere visto come un effetto induttivo che i sostituenti trasmettono attraverso i legami sigma della molecola. Nell esempio seguente il cloro parzialmente negativo attrae gli elettroni di tutta la molecola stabilizzando in particolare l anione che si può formare. l 2 l l l l l Acido cloroacetico Acido dicloroacetico Acido tricloroacetico pk a = 2.9 pk a = 1.3 pk a = 0.9 Maggiore è il numero di sostituenti elettronegativi maggiore sarà l acidità. vviamente più questi sostituenti sono lontani dal carbossile minore sarà l acidità dell acido.. Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 3
4 EATTIVITA DEI DEIVATI DEGLI AIDI ABSSILII I derivati degli acidi carbossilici sono i cloruri, le anidridi, gli esteri e le ammidi. I derivati non posseggono la stessa reattività a causa dei diversi sostituenti presenti in ciascuno di essi. In una molecola generica gli elettroni donati da un sostituente stabilizzano il gruppo carbonilico e diminuisce il suo carattere elettrofilo. Questa delocalizzazione degli elettroni dipende dalle proprietà del sostituente. Generalmente minore è l elettronegatività di questo, migliore è la donazione di elettroni e la stabilità della molecola stessa. Per esempio i cloruri sono molto reattivi perché gli orbitali del cloro non si sovrappongono bene con quelli del carbonio a cui è legato e la delocalizzazione è molto scarsa. Il cloro tende quindi ad attrarre gli elettroni verso di sè rendendo il carbonio del carbonile molto positivo e facilmente attaccabile da nucleofili. l LU l l Debole risonanza Le anidridi sono un po meno reattive dei cloruri perché la delocalizzazione degli elettroni è migliore. La coppia degli elettroni dell ossigeno, presente tra i due carboni, da risonanza per metà verso un carbonile e per metà verso l altro carbonile. ANIDIDE Gli esteri sono più stabili delle anidridi. La coppia di elettroni dell ossigeno dell estere è condivisa verso un unico gruppo carbonilico e inoltre l ossigeno è in grado con la stessa facilità di prendere e donare elettroni. ESTEE Le ammidi sono i derivati più stabili. L azoto è meno elettronegativo dell ossigeno e non è in grado di attrarre con molta forza gli elettroni verso di sé. Il carbonio del carbonile non ha un carattere così positivo come in un cloruro acilico e subisce con più difficoltà gli attacchi nucleofili. N 2 AMMIDE N 2 : N 2 Ibrido molto stabile per risonanza Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 4
5 Preparazione dei cloruri Gli acidi carbossilici possono venire trasformati in cloruri acilici se trattati con cloruro di tionile, Sl 2. Questa reazione è un tipico esempio di sostituzione nucleofila; l intermedio che possiede un ossigeno negativo non si protona per dare un alcool, come accadrebbe in aldeidi e chetoni, ma espelle una piccola molecola, S 2. acido acetico Sl 2 S 2 l l acetil cloruro Il meccanismo di reazione è molto semplice. Durante la reazione il l entra nella molecola molto facilmente perché ne è richiesta una piccola quantità, altrimenti non sarebbe possibile procedere in questo modo. l S l S l : l S l : l S l l S l Questa reazione è perfettamente reversibile, cioè dal cloruro acilico in acqua è possibile ottenere l acido carbossilico corrispondente. La reazione è costituita da due fasi. In una prima fase una molecola d acqua attacca il cloruro e si forma un intermedio tetraedrico. Nella seconda fase invece avviene la dissociazione dell intermedio attraverso la deidrogenazione. Una seconda molecola d acqua strappa un da un gruppo presente nell intermedio ed esce l. ome risultato si ottiene l acido carbossilico. Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 5
6 Preparazione delle anidridi Dopo i cloruri le anidridi sono i derivati più reattivi degli acidi carbossilici. Il metodo migliore di preparazione delle anidridi è per sostituzione nucleofila di un cloruro acilico con l anione di un acido carbossilico. In questa reazione viene solitamente aggiunta una base organica debole, come la piridina; questa è utilizzata come catalizzatore e neutralizza l acido cloridrico che si forma spostando la reazione verso la formazione di prodotti. l Piridina l l 3 L idrolisi dell anidride porta all acido carbossilico iniziale in condizioni blande e senza sottoprodotti. Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 6
7 Preparazione degli esteri Gli esteri sono tra i composti più diffusi in natura. I metodi per la loro preparazione sono diversi, ma più frequentemente si ottengono a partire dagli acidi ( in questo caso si parla di esterificazione di Fisher ), dai cloruri, dalle anidridi o partire da esteri attivi. L esterificazione di Fisher è la condensazione di un alcool con un acido carbossilico. Il problema di questa reazione riguarda la resa che in condizioni normali non supera il 60 %. Per migliorare tale dato si può far reagire un eccesso di alcool o di acido, oppure rimuovere dall ambiente di reazione l acqua utilizzando benzene e distillando la miscela azeotropica. Per motivi di ingombro sterico vengono preferiti nella reazione alcoli primari. 2 Gli esteri si possono ottenere anche attraverso la reazione di un alcool con un cloruro acilico. La reazione è condotta in presenza di una base debole come piridina che reagisce con l acido cloridrico che si forma. l 2 l 2 Altro modo per ottenere gli esteri è far reagire un anidride con un alcool. Anche in questa reazione viene utilizzata piridina o in alternativa un acido per catalizzarla. Da notare nell esempio seguente che un solo gruppo acetilico dell anidride viene incorporato dall estere; l altro gruppo diventa una molecola di acido acetico Per ottenere un estere si può partire da un estere, ma per avere una buona resa sono necessari esteri attivi. on gli esteri normali si ottiene un equilibrio al 50 % e si ha un inutile spreco di reattivi. Gli esteri attivi al contrario permettono di ottenere rese molto elevate perché molto veloci a reagire in quanto hanno una struttura simile alle anidridi. Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 7
8 Esempio di preparazione di un estere attivo N 2 N 2 ESTEE ATTIV Nella reazione si verifica un particolare fenomeno chiamato assistenza anchimerica, cioè è la molecola stessa che permette il proseguimento del meccanismo attraverso un attacco in un suo punto. N 2 ESTEE ATTIV : N 2 ASSISTENZA ANIMEIA : 2 2 N 2 N 3 Idrolisi di un estere. In ambiente acido ( ma anche in ambiente basico ) un estere può idrolizzare. L obiettivo è far entrare acqua e uscire l alcool. La reazione non è molto veloce perché può facilmente tornare indietro; infatti l acqua dopo aver attaccato il carbonile, non è sicuro che si deprotoni subito, ma potrebbero scendere gli elettroni dell ossigeno e riformare l estere iniziale. La reazione continua solo quando l ossigeno dell alcool si protona e a quel punto è lui il miglior gruppo uscente. 2 : : 2 2 Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 8
9 Preparazione delle ammidi. Le ammidi possono essere preparate a partire dai derivati più reattivi e cioè dagli acidi, dalle anidridi e dagli esteri. Acido carbossilico con ammoniaca Nel primo passaggio della reazione l acido con l ammoniaca porta alla formazione del sale di ammonio corrispondente. Se si isola il sale riscaldando, si elimina l acqua ottenendo l ammide pura. N 3 3 N calore 4 N 2 2 N : 3 N 3 : N 2 2 N 2 loruro con ammoniaca La reazione è molto rapida e completa; normalmente si utilizza un eccesso di ammoniaca. l N N 3 N 2 l N Anidride con ammoniaca N 3 N 2 N 4 Estere con ammoniaca Al contrario della reazione tra un cloruro e l ammoniaca che risulta molto rapida, questa reazione è abbastanza lenta e raramente completa. p 5 N 3 3 ALE N 2 Un caso particolare si verifica con gli esteri attivi se reagiscono con ammoniaca. ome nella sintesi degli esteri ( anidride con alcool o estere attivo ) anche qui si ha il fenomeno dell assistenza anchimerica che influenza notevolmente la velocità di reazione. Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 9
10 Sintesi e idrolisi dei nitrili I nitrili possono venire sintetizzati attraverso una reazione di sostituzione nucleofila, cioè la sostituzione in un bromuro da parte di una molecola di cianuro, oppure con una via alternativa rappresentata di seguito. N 2 idrossilammina ossima N Sl2 N calore nitrile Di particolare interesse per lo studio degli acidi carbossilici è l idrolisi del nitrile. Il nitrile infatti, porta dopo una prima disidratazione alla formazione di un ammide e dopo una seconda sottrazione di acqua si ottiene il rispettivo acido carbossilico. atalisi acida. N 2 : : N TAUTMEIA N 2 N 2 AMMIDE N 2 : esce ammoniaca solo N 3 se c'è un eccesso di : 2 acqua 2 atalisi basica. N : N TAUTMEIA : N : N 2 AMMIDE N 2 : : N 2 amb basico Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 10
11 iduzione di acidi carbossilici e derivati Gli idruri metallici si addizionano agli acidi formando un nuovo legame carbonio idrogeno e si ottiene quindi il prodotto di riduzione. Anche se tutti e quattro gli idrogeni dell idruro sono disponibili per la riduzione, si preferisce utilizzare un eccesso di LiAl 4. L eccesso viene decomposto con acetato di etile e la soluzione dell alcool viene acidificata perché la reazione non possa procedere. Acido con LiAl 4 : Nella riduzione con litioallumioidruro l idrogeno acido reagisce per primo liberando 2 gassoso. Il gruppo carbonilico dello ione viene poi attaccato dallo ione Al 4 e viene ridotto ad alcool primario. Nella reazione si possono notare due passaggi riduttivi, il primo dei quali porta ad un aldeide e il secondo all alcool primario. Al 4 Li 2.. Al Al 3 PIM PASSAGGI IDUTTIV Li Li : Al 3 Al 3 INSTABILE Li : Al Li Al Li SEND PASSAGGI IDUTTIV Durante questa reazione può succedere che i sali formati inizialmente sono insolubili e precipitano. È perciò preferibile trasformare prima gli acidi in esteri, che vengono ridotti facilmente sempre con LiAl 4. Estere con LiAl 4 Anche in questa reazione il reagente viene prima ridotto ad aldeide e poi ad alcool primario. Al 4 Li Li Al 3 ALDEIDE ID 2 ALL Ammide con LiAl 4 Le ammidi derivate dall ammoniaca danno per riduzione con LiAl 4 le ammine primarie. Le ammidi derivanti da ammine primarie e secondarie portano rispettivamente ad ammine secondarie e terziarie. Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 11
12 N 2 LiAl 4 : N Al 3 Li Al Li Li Al 3 N Al 3 Li Li N Al 3 IMMINA Al Li Li Al Al 3 3 N 2 N 2 Li 2 AMMINA In tutti i casi sopra citati non è possibile fermare la riduzione quando la molecola si trova allo stato di aldeide. È stato così individuato un idruro più blando, il triterzbutossi alluminio. Questa molecola ha la particolarità di avere un solo idrogeno da strappare, perciò la riduzione avverrà solo una volta. l LU LiAl(tBu) 3 ALDEIDE Un metodo più vecchio consente di ottenere per riduzione l aldeide utilizzando l idrogenazione catalittica su un cloruro acilico, impiegando un catalizzatore parzialmente avvelenato. Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 12
13 eazioni con i composti organometallici I composti organometallici reagiscono con i derivati degli acidi carbossilici per attacco al gruppo carbonilico formando un nuovo legame carboniocarbonio. Il reagente più comune è quello di Grignard. La reazione tra un Grignard e un acido carbossilico non è possibile, in quanto si viene a formare un dimero insolubile che non permette il proseguimento della reazione. eattivo di Grignard con estere L estere iniziale subisce una duplice riduzione: prima viene ridotto a chetone e poi ad alcool terziario. È da ricordare che il primo prodotto intermedio non è stabile ed elimina e MgBr. Il chetone risultante reagisce molto più velocemente rispetto all estere di partenza. 1 MgBr : MgBr 2 2 Me 2 ETNE 2 MgBr MgBr ALL TEZIAI eattivo di Grignard con ammide A questa reazione non possono partecipare tutti i tipi di ammide. Infatti quelle che possiedono almeno un idrogeno sull atomo di azoto, formano un sale insolubile con il reattivo di Grignard e la reazione si ferma. Le ammidi N,Ndisostituite possono invece reagire portando ad un chetone come prodotto. MgBr MgBr 2 : N 2 2 N 2 N 2 ETNE Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 13
14 eattivo di Grignard con nitrile Altro metodo efficiente per sintetizzare un chetone coinvolge la reazione di un nitrile con il reattivo di Grignard. Il primo intermedio di addizione è molto stabile e con la sola aggiunta si acido si ottiene un chetone. N MgBr 2 N N MgBr ETNE Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 14
15 eazione di ellvolhardzelinsky Gli acidi carbossilici non sono enolizzabili e il primo idrogeno a venire strappato in una molecola è quello dell ( pka = 4 ). Se si vuole sottrarre l idrogeno in α, in ogni caso viene prima strappato quello acido e da un carbossilato, carico negativamente, è molto difficile togliere un. I cloruri al contrario sono debolmente enolizzati. Una quantità catalittica di fosforo rosso, che produce tracce di Pl 3, permette l alogenazione di un acido. L enolo del cloruro può essere alogenato in α. Viene così prodotto l α alogenato e l altro alogenuro dell acido che permette la continuazione della reazione stessa. Inizio: Propagazioni: Pl 3 TAE l LU 2 l TAUTMEIA : : 2 l l l ENL l 2 l TAE l 2 l : l 2 : l l 2 : l l 2 l NTINUA LA EAZINE L alogeno entrante può anche essere sostituito con molti altri reagenti come l ossidrile, gli alcolati, l ammoniaca e le ammine. Una sintesi molto interessante e utile per le prossime reazioni, è la sostituzione di un alogenuro in α con un cianuro, N. Quest ultimo è facilmente idrolizzabile e porta alla formazione dell acido malonico, se la molecola iniziale è acido acetico. l 2 : N N AID MALNI Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 15
16 Decarbossilazione Mentre gli acidi carbossilici ordinari sono stabili fino oltre i 200, gli acidi carbossilici che in β presentano un doppio legame rispetto al gruppo carbossilico, subiscono una perdita di anidride carbonica anche al di sotto dei 200 gradi. I βchetoacidi decarbossilano molto facilmente; il gruppo carbonilico in β accetta facilmente il protone che arriva da carbossile. La reazione avviene con un meccanismo ciclico che porta alla formazione di un enolo che immediatamente si converte in un acido. 2 AID MALNI : AID AETI Nel caso in cui in un acido carbossilico ci fosse un doppio legame con l ossigeno in posizione α, non è possibile decarbossilare scaldando semplicemente in ambiente acido. Infatti la molecola di 2 non avrebbe modo di uscire. Il problema è facilmente risolvibile utilizzando la vitamina B1 oppure semplicemente con una molecola di cianuro... N N 2 : N : N N Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 16
17 Sintesi malonica L estere malonico è utilizzato come prodotto di partenza di una serie di reazioni il cui scopo è quello di convertire un prodotto Br o l in 2. In pratica si aumenta la lunghezza globale della catena di atomi di carbonio di due atomi che termina con un gruppo carbossilico. Questa reazione non può essere condotta partendo da un semplice estere acetico; l idrogeno in alfa ha pka = 20, mentre la base utilizzata Et ha pka = 18. La reazione è perciò tutta spostata a sinistra in quanto si sta tentando di formare una base più forte di quella iniziale. L idrogeno in α dell estere malonico ha invece pka = 13 e la molecola è perciò adatta alla reazione... Et Et Et Et Et SN2 : Et l 2 2 Et Et 2 / ALE ESTEE MALNI 2 : 2.. TAUTMEIA 2 2 A. AETI ome si può osservare dal meccanismo di reazione, l anione che si forma dall estere malonico è molto stabile perché avendo una doppia risonanza la carica è distribuita in totale in tre posti differenti. L enolo è molto stabile ed effettua bene la reazione di sostituzione nucleofila. È possibile strappare entrambi gli idrogeni in alfa dell estere malonico, ma la reazione illustrata procede per un solo strappo. Il prodotto finale è costituito da una molecola di acido acetico e da un gruppo, in questo caso un etile del cloruro reagito. Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 17
18 Sintesi dei βchetoesteri: la condensazione di laisen Se si tratta l acetato di etile con etilato sodico, Et si ottiene con buone rese l estere acetaacetico. La scelta della base è molto importante. Lo ione alcolato riesce a strappare l idrogeno in alfa dell estere e in caso di attacco sul carbonile estereo il processo è perfettamente reversibile. L enolato intermedio stabilizzato per risonanza è un buon nucleofilo e può attaccare il carbonile di una nuova molecola di estere, che espellendo uno ione etossido porta al βchetoestere. Quest ultimo ha due idrogeni attivati da due gruppi carbossilici molto più acidi di quelli dell estere di partenza. L alcossido presente converte tutto il nuovo estere nel suo anione. 2 Et.. Et.. 2 Et 2 Et ENLAT Et.. 2 Et : 2 Et Et 2 Et Et.. Et Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 18
19 Sintesi acetacetica Il procedimento è di pari passo uguale a quello della sintesi malonica. Questa volta però viene usato come reagente una molecola che da una parte termina con un estere e dall altra è un chetone sul penultimo carbonio. Il risultato finale è un prodotto costituito da una molecola di acetone allungata di un gruppo, proveniente dal cloruro che ha subito la SN 2... Et Et Et Et SN2 : l Et 2 / ALE : TAUTMEIA AETNE Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 19
20 arbonatazione dei reattivi organometallici Un metodo importante per la preparazione degli acidi carbossilici è il trattamento di un composto organometallico con anidride carbonica. vviamente i reattivi organometallici vengono preparati da alogenuri per aggiunta di Mg. arbonilazione Il metodo di preparazione è molto semplice. Il carbocationi stabili possono venire bloccati con monossido di carbonio per dare ioni acilio, =, che per reazione con acqua danno i corrispondenti acidi carbossilici. Il modo più semplice per ottenere un carbocatione è il trattamento con acido solforico di un alchene o un alcool primario S MNSSID DI ABNI eazione con litio di isopropilammide Questa reazione viene utilizzata per strappare l idrogeno in alfa di un estere per permettere una successiva reazione di sostituzione nucleofila con un cloruro. In questo modo si ottiene un allungamento di catena. L LDA non interferisce affatto nella reazione attaccando il cloruro, ma lo lascia invariato. 2 Et LDA TF 2 Et l 2.. SN2 2 Et ESTEE 2 2 Et Daniele Trovò allievo dell ITIS Natta di Padova eazioni degli acidi carbossilici 20
L acidità del protone legato al carbonio in α compete con la. quanto accade con gli acidi carbossilici e le ammidi primarie e secondarie
 CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in a ad un gruppo carbonilico (aldeidi, chetoni, esteri) L acidità del protone legato al carbonio in α compete
CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in a ad un gruppo carbonilico (aldeidi, chetoni, esteri) L acidità del protone legato al carbonio in α compete
CHIMICA ORGANICA. Gli alcoli
 1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
ACIDI CARBOSSILICI E DERIVATI
 AIDI ARBSSILII E DERIVATI Indice degli argomenti: Pagina - Struttura degli acidi carbossilici 2 - Acidità degli acidi carbossilici 4 - Reattività di acidi carbossilici e derivati 6 - Preparazione dei cloruri
AIDI ARBSSILII E DERIVATI Indice degli argomenti: Pagina - Struttura degli acidi carbossilici 2 - Acidità degli acidi carbossilici 4 - Reattività di acidi carbossilici e derivati 6 - Preparazione dei cloruri
Sostituzioni sull anello aromatico
 Sostituzioni sull anello aromatico Criteri per stabilire l esistenza di carattere aromatico 1. Il composto deve essere ciclico, planare e deve avere una nuvola ininterrotta di elettroni π sopra e sotto
Sostituzioni sull anello aromatico Criteri per stabilire l esistenza di carattere aromatico 1. Il composto deve essere ciclico, planare e deve avere una nuvola ininterrotta di elettroni π sopra e sotto
I derivati del benzene e la loro chimica
 I derivati del benzene e la loro chimica Benzene: 6 e- π Questi composti sono chiamati aromatici è hanno 4N + 2 e- π in un anello planare (regola di Hückel). La delocalizzazione di questi e- π stabilizza
I derivati del benzene e la loro chimica Benzene: 6 e- π Questi composti sono chiamati aromatici è hanno 4N + 2 e- π in un anello planare (regola di Hückel). La delocalizzazione di questi e- π stabilizza
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Competizione tra reazioni di sostituzione e di eliminazione
 Competizione tra reazioni di sostituzione e di eliminazione C δ + δ - CH 2 G Centro elettrofilo δ + H Centro elettrofilo Potenziale buon gruppo uscente Si distinguono due principali meccanismi di eliminazione:
Competizione tra reazioni di sostituzione e di eliminazione C δ + δ - CH 2 G Centro elettrofilo δ + H Centro elettrofilo Potenziale buon gruppo uscente Si distinguono due principali meccanismi di eliminazione:
Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno
 Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Organic Chemistry. 4 th Edition Paula Yurkanis Bruice. Delocalizzazione degli elettroni e risonanza
 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
IDROCARBURI AROMATICI. Scaricato da Sunhope.it
 IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Dalla Chimica Generale
 RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
COMPOSTI ORGANICI DEL RAME
 PEPAAZINE MPSTI GANII DEL AME La chimica dei composti organici del rame inizia verso la metà degli anni 50, ma le prime informazioni sul meccanismo arrivano solo trenta anni dopo. ggi sono molto utilizzati
PEPAAZINE MPSTI GANII DEL AME La chimica dei composti organici del rame inizia verso la metà degli anni 50, ma le prime informazioni sul meccanismo arrivano solo trenta anni dopo. ggi sono molto utilizzati
Farmaci del sistema nervoso autonomo
 Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI Idrocarburi ciclici contenenti un sistema di elettroni delocalizzati su tutto il perimetro dell anello BENZENE C 6 H 6 sp 2 angoli 120 coplanarità struttura simmetrica ad esagono
IDROCARBURI AROMATICI Idrocarburi ciclici contenenti un sistema di elettroni delocalizzati su tutto il perimetro dell anello BENZENE C 6 H 6 sp 2 angoli 120 coplanarità struttura simmetrica ad esagono
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Gli alcool, i composti carbonilici e gli acidi carbossilici
 Gli alcool, i composti carbonilici e gli acidi carbossilici Con questa unità didattica inizieremo a prendere in considerazione dei composti della chimica organica caratterizzati dal contenere oltre ai
Gli alcool, i composti carbonilici e gli acidi carbossilici Con questa unità didattica inizieremo a prendere in considerazione dei composti della chimica organica caratterizzati dal contenere oltre ai
PROVA STRUTTURATA DI CHIMICA ORGANICA
 1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Composti Carbossilici. Reattività
 omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
Βeta ossidazione degli acidi grassi BETA OSSIDAZIONE DEGLI ACIDI GRASSI 13/12/2013 SEMINARIO. Acidi grassi (2)
 Acidi grassi (1) Mitocondri SEMINARIO BETA OSSIDAZIONE DEGLI ACIDI GRASSI Sono le principali fonti di energia per alcuni tessuti (es. muscolo cardiaco). Si genera molto più energia dall ossidazione degli
Acidi grassi (1) Mitocondri SEMINARIO BETA OSSIDAZIONE DEGLI ACIDI GRASSI Sono le principali fonti di energia per alcuni tessuti (es. muscolo cardiaco). Si genera molto più energia dall ossidazione degli
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
www.andreatorinesi.it
 La lunghezza focale Lunghezza focale Si definisce lunghezza focale la distanza tra il centro ottico dell'obiettivo (a infinito ) e il piano su cui si forma l'immagine (nel caso del digitale, il sensore).
La lunghezza focale Lunghezza focale Si definisce lunghezza focale la distanza tra il centro ottico dell'obiettivo (a infinito ) e il piano su cui si forma l'immagine (nel caso del digitale, il sensore).
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Saggi di riconoscimento dei gruppi funzionali e preparazione dei derivati cristallini
 Saggi di riconoscimento dei gruppi funzionali e preparazione dei derivati cristallini F. rtuso - Analisi dei Medicinali II Derivati cristallini Il riconoscimento dei gruppi funzionali presenti in un composto
Saggi di riconoscimento dei gruppi funzionali e preparazione dei derivati cristallini F. rtuso - Analisi dei Medicinali II Derivati cristallini Il riconoscimento dei gruppi funzionali presenti in un composto
352&(662',&20%867,21(
 352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Laboratorio di Tecniche Microscopiche AA 2007-2008 Lezione 12 Marzo 2008 Ore 15-16
 Laboratorio di Tecniche Microscopiche AA 2007-2008 Lezione 12 Marzo 2008 Ore 15-16 L'immunoistochimica e' una tecnica ampiamente utilizzata per l'identificazione e la localizzazione di costituenti cellulari
Laboratorio di Tecniche Microscopiche AA 2007-2008 Lezione 12 Marzo 2008 Ore 15-16 L'immunoistochimica e' una tecnica ampiamente utilizzata per l'identificazione e la localizzazione di costituenti cellulari
CORRENTE E TENSIONE ELETTRICA LA CORRENTE ELETTRICA
 CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
Formule di Struttura delle Molecole Organiche
 Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
Siamo così arrivati all aritmetica modulare, ma anche a individuare alcuni aspetti di come funziona l aritmetica del calcolatore come vedremo.
 DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
La nomenclatura dei composti organici polifunzionali. Appendice
 Appendice A La nomenclatura dei composti organici polifunzionali on oltre 37 milioni di composti organici già conosciuti e le molte migliaia in più che si creano quotidianamente, assegnare un nome a ciascun
Appendice A La nomenclatura dei composti organici polifunzionali on oltre 37 milioni di composti organici già conosciuti e le molte migliaia in più che si creano quotidianamente, assegnare un nome a ciascun
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]
![Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ] Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]](/thumbs/34/16945364.jpg) La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
APPUNTI DI MATEMATICA LE FRAZIONI ALGEBRICHE ALESSANDRO BOCCONI
 APPUNTI DI MATEMATICA LE FRAZIONI ALGEBRICHE ALESSANDRO BOCCONI Indice 1 Le frazioni algebriche 1.1 Il minimo comune multiplo e il Massimo Comun Divisore fra polinomi........ 1. Le frazioni algebriche....................................
APPUNTI DI MATEMATICA LE FRAZIONI ALGEBRICHE ALESSANDRO BOCCONI Indice 1 Le frazioni algebriche 1.1 Il minimo comune multiplo e il Massimo Comun Divisore fra polinomi........ 1. Le frazioni algebriche....................................
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Gruppi funzionali. La maggior parte delle molecole organiche oltre ai legami C-C e C-H possiedono: - Eteroatomi (O, N, Alogeni);
 --- himica rganica - SG --- --- himica rganica - SG --- Gruppi funzionali Il carbonio forma sempre 4 legami, con l eccezione di intermedi di reazione, che possono avere 3 legami, e dei carbeni, che hanno
--- himica rganica - SG --- --- himica rganica - SG --- Gruppi funzionali Il carbonio forma sempre 4 legami, con l eccezione di intermedi di reazione, che possono avere 3 legami, e dei carbeni, che hanno
I documenti di www.mistermanager.it. Gli ingredienti per l allenamento per la corsa LE RIPETUTE
 I documenti di www.mistermanager.it Gli ingredienti per l allenamento per la corsa LE RIPETUTE Le Ripetute sono una delle forme di allenamento che caratterizzano i corridori più evoluti, in quanto partono
I documenti di www.mistermanager.it Gli ingredienti per l allenamento per la corsa LE RIPETUTE Le Ripetute sono una delle forme di allenamento che caratterizzano i corridori più evoluti, in quanto partono
I semiconduttori Semiconduttori intrinseci
 I semiconduttori Semiconduttori intrinseci I semiconduttori naturali usati per la produzione di dispositivi elettronici sono stati per molti anni il silicio e il germanio. Il germanio è andato, con il
I semiconduttori Semiconduttori intrinseci I semiconduttori naturali usati per la produzione di dispositivi elettronici sono stati per molti anni il silicio e il germanio. Il germanio è andato, con il
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
ESEMPIO 1: eseguire il complemento a 10 di 765
 COMPLEMENTO A 10 DI UN NUMERO DECIMALE Sia dato un numero N 10 in base 10 di n cifre. Il complemento a 10 di tale numero (N ) si ottiene sottraendo il numero stesso a 10 n. ESEMPIO 1: eseguire il complemento
COMPLEMENTO A 10 DI UN NUMERO DECIMALE Sia dato un numero N 10 in base 10 di n cifre. Il complemento a 10 di tale numero (N ) si ottiene sottraendo il numero stesso a 10 n. ESEMPIO 1: eseguire il complemento
anidridi C R PREPARAZIONE DELLE ANIDRIDI + R C O - C Cl C R + P 2 O 5 C R C OH
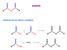 anidridi PEPAAZINE DELLE ANIDIDI l P 2 5 Nu = 2 Le anidridi sono più reattive di esteri ed ammidi: basta l acqua da sola : 2 2 2 2 EAZINI DELLE ANIDIDI: con acqua '.. ' ' ' ' EAZINI DELLE ANIDIDI: con
anidridi PEPAAZINE DELLE ANIDIDI l P 2 5 Nu = 2 Le anidridi sono più reattive di esteri ed ammidi: basta l acqua da sola : 2 2 2 2 EAZINI DELLE ANIDIDI: con acqua '.. ' ' ' ' EAZINI DELLE ANIDIDI: con
MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA
 MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità
MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità
SDD - Seconde Equilibrio e ph. Equilibrio e ph. Obiettivo
 1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
Il concetto di valore medio in generale
 Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca
 INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
9. Urti e conservazione della quantità di moto.
 9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni
 Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Dimensione di uno Spazio vettoriale
 Capitolo 4 Dimensione di uno Spazio vettoriale 4.1 Introduzione Dedichiamo questo capitolo ad un concetto fondamentale in algebra lineare: la dimensione di uno spazio vettoriale. Daremo una definizione
Capitolo 4 Dimensione di uno Spazio vettoriale 4.1 Introduzione Dedichiamo questo capitolo ad un concetto fondamentale in algebra lineare: la dimensione di uno spazio vettoriale. Daremo una definizione
( x) ( x) 0. Equazioni irrazionali
 Equazioni irrazionali Definizione: si definisce equazione irrazionale un equazione in cui compaiono uno o più radicali contenenti l incognita. Esempio 7 Ricordiamo quanto visto sulle condizioni di esistenza
Equazioni irrazionali Definizione: si definisce equazione irrazionale un equazione in cui compaiono uno o più radicali contenenti l incognita. Esempio 7 Ricordiamo quanto visto sulle condizioni di esistenza
B9. Equazioni di grado superiore al secondo
 B9. Equazioni di grado superiore al secondo Le equazioni di terzo grado hanno una, due o tre soluzioni, risolvibili algebricamente con formule molto più complesse di quelle dell equazione di secondo grado.
B9. Equazioni di grado superiore al secondo Le equazioni di terzo grado hanno una, due o tre soluzioni, risolvibili algebricamente con formule molto più complesse di quelle dell equazione di secondo grado.
Metalli in medicina. L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il
 Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Alessandro Pellegrini
 Esercitazione sulle Rappresentazioni Numeriche Esistono 1 tipi di persone al mondo: quelli che conoscono il codice binario e quelli che non lo conoscono Alessandro Pellegrini Cosa studiare prima Conversione
Esercitazione sulle Rappresentazioni Numeriche Esistono 1 tipi di persone al mondo: quelli che conoscono il codice binario e quelli che non lo conoscono Alessandro Pellegrini Cosa studiare prima Conversione
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di
 La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1
 LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1 I CODICI 1 IL CODICE BCD 1 Somma in BCD 2 Sottrazione BCD 5 IL CODICE ECCESSO 3 20 La trasmissione delle informazioni Quarta Parte I codici Il codice BCD
LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1 I CODICI 1 IL CODICE BCD 1 Somma in BCD 2 Sottrazione BCD 5 IL CODICE ECCESSO 3 20 La trasmissione delle informazioni Quarta Parte I codici Il codice BCD
SISTEMI DI NUMERAZIONE E CODICI
 SISTEMI DI NUMERAZIONE E CODICI Il Sistema di Numerazione Decimale Il sistema decimale o sistema di numerazione a base dieci usa dieci cifre, dette cifre decimali, da O a 9. Il sistema decimale è un sistema
SISTEMI DI NUMERAZIONE E CODICI Il Sistema di Numerazione Decimale Il sistema decimale o sistema di numerazione a base dieci usa dieci cifre, dette cifre decimali, da O a 9. Il sistema decimale è un sistema
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Consideriamo due polinomi
 Capitolo 3 Il luogo delle radici Consideriamo due polinomi N(z) = (z z 1 )(z z 2 )... (z z m ) D(z) = (z p 1 )(z p 2 )... (z p n ) della variabile complessa z con m < n. Nelle problematiche connesse al
Capitolo 3 Il luogo delle radici Consideriamo due polinomi N(z) = (z z 1 )(z z 2 )... (z z m ) D(z) = (z p 1 )(z p 2 )... (z p n ) della variabile complessa z con m < n. Nelle problematiche connesse al
Traduzione e adattamento a cura di Gylas per Giochi Rari
 Traduzione e adattamento a cura di Gylas per Giochi Rari Versione 1.0 Luglio 2001 NOTA. La presente traduzione non sostituisce in alcun modo il regolamento originale del gioco; il presente documento è
Traduzione e adattamento a cura di Gylas per Giochi Rari Versione 1.0 Luglio 2001 NOTA. La presente traduzione non sostituisce in alcun modo il regolamento originale del gioco; il presente documento è
Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas
 1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
La combustione. Docente: prof.ssa Lobello Carmela
 La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
Forza. Forza. Esempi di forze. Caratteristiche della forza. Forze fondamentali CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA
 Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Come visto precedentemente l equazione integro differenziale rappresentativa dell equilibrio elettrico di un circuito RLC è la seguente: 1 = (1)
 Transitori Analisi nel dominio del tempo Ricordiamo che si definisce transitorio il periodo di tempo che intercorre nel passaggio, di un sistema, da uno stato energetico ad un altro, non è comunque sempre
Transitori Analisi nel dominio del tempo Ricordiamo che si definisce transitorio il periodo di tempo che intercorre nel passaggio, di un sistema, da uno stato energetico ad un altro, non è comunque sempre
19 Il campo elettrico - 3. Le linee del campo elettrico
 Moto di una carica in un campo elettrico uniforme Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice se il campo elettrico è uniforme,
Moto di una carica in un campo elettrico uniforme Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice se il campo elettrico è uniforme,
Appunti sulla Macchina di Turing. Macchina di Turing
 Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Tesina di scienze. L Elettricità. Le forze elettriche
 Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
da 2 a 5 giocatori, dai 10 anni in su, durata 30 minuti
 da 2 a 5 giocatori, dai 10 anni in su, durata 30 minuti OBIETTIVO Il vincitore è colui che, dopo due round di gioco, delle sue 11 ordinazioni, ne ha consegnate il maggior numero. CONTENUTO DELLA SCATOLA
da 2 a 5 giocatori, dai 10 anni in su, durata 30 minuti OBIETTIVO Il vincitore è colui che, dopo due round di gioco, delle sue 11 ordinazioni, ne ha consegnate il maggior numero. CONTENUTO DELLA SCATOLA
APPUNTI SU PROBLEMI CON CALCOLO PERCENTUALE
 APPUNTI SU PROBLEMI CON CALCOLO PERCENTUALE 1. Proporzionalità diretta e proporzionalità inversa Analizziamo le seguenti formule Peso Lordo = Peso Netto + Tara Ricavo = Utile + Costo Rata = Importo + Interesse
APPUNTI SU PROBLEMI CON CALCOLO PERCENTUALE 1. Proporzionalità diretta e proporzionalità inversa Analizziamo le seguenti formule Peso Lordo = Peso Netto + Tara Ricavo = Utile + Costo Rata = Importo + Interesse
COMPONENTI TERMODINAMICI APERTI
 CAPITOLO NONO COMPONENTI TERMODINAMICI APERTI Esempi applicativi Vengono di seguito esaminati alcuni componenti di macchine termiche che possono essere considerati come sistemi aperti A) Macchina termica
CAPITOLO NONO COMPONENTI TERMODINAMICI APERTI Esempi applicativi Vengono di seguito esaminati alcuni componenti di macchine termiche che possono essere considerati come sistemi aperti A) Macchina termica
Indice. 1 La disoccupazione ---------------------------------------------------------------------------------------- 3. 2 di 6
 INEGNAMENO DI EONOMIA OLIIA LEZIONE VIII IL EORE DELL OUAZIONE ROF. ALDO VAOLA Economia olitica Indice 1 La disoccupazione ----------------------------------------------------------------------------------------
INEGNAMENO DI EONOMIA OLIIA LEZIONE VIII IL EORE DELL OUAZIONE ROF. ALDO VAOLA Economia olitica Indice 1 La disoccupazione ----------------------------------------------------------------------------------------
Temperatura e Calore
 Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
SISTEMA BINARIO DI DUE LIQUIDI VOLATILI TOTALMENTE MISCIBILI che seguono Raoult
 SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
Domande a scelta multipla 1
 Domande a scelta multipla Domande a scelta multipla 1 Rispondete alle domande seguenti, scegliendo tra le alternative proposte. Cercate di consultare i suggerimenti solo in caso di difficoltà. Dopo l elenco
Domande a scelta multipla Domande a scelta multipla 1 Rispondete alle domande seguenti, scegliendo tra le alternative proposte. Cercate di consultare i suggerimenti solo in caso di difficoltà. Dopo l elenco
UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA
 UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA Tutti gli anni, affrontando l argomento della divisibilità, trovavo utile far lavorare gli alunni sul Crivello di Eratostene. Presentavo ai ragazzi una
UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA Tutti gli anni, affrontando l argomento della divisibilità, trovavo utile far lavorare gli alunni sul Crivello di Eratostene. Presentavo ai ragazzi una
Ricerca Operativa Esercizi sul metodo del simplesso. Luigi De Giovanni, Laura Brentegani
 Ricerca Operativa Esercizi sul metodo del simplesso Luigi De Giovanni, Laura Brentegani 1 1) Risolvere il seguente problema di programmazione lineare. ma + + 3 s.t. 2 + + 2 + 2 + 3 5 2 + 2 + 6,, 0 Soluzione.
Ricerca Operativa Esercizi sul metodo del simplesso Luigi De Giovanni, Laura Brentegani 1 1) Risolvere il seguente problema di programmazione lineare. ma + + 3 s.t. 2 + + 2 + 2 + 3 5 2 + 2 + 6,, 0 Soluzione.
CALCOLO COMBINATORIO
 CALCOLO COMBINATORIO 1 Modi di formare gruppi di k oggetti presi da n dati 11 disposizioni semplici, permutazioni Dati n oggetti distinti a 1,, a n si chiamano disposizioni semplici di questi oggetti,
CALCOLO COMBINATORIO 1 Modi di formare gruppi di k oggetti presi da n dati 11 disposizioni semplici, permutazioni Dati n oggetti distinti a 1,, a n si chiamano disposizioni semplici di questi oggetti,
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Teoria dei Giochi. Anna Torre
 Teoria dei Giochi Anna Torre Almo Collegio Borromeo 26 marzo 2015 email: anna.torre@unipv.it sito web del corso:www-dimat.unipv.it/atorre/borromeo2015.html COOPERAZIONE Esempio: strategie correlate e problema
Teoria dei Giochi Anna Torre Almo Collegio Borromeo 26 marzo 2015 email: anna.torre@unipv.it sito web del corso:www-dimat.unipv.it/atorre/borromeo2015.html COOPERAZIONE Esempio: strategie correlate e problema
Progetto macchina con tetto fotovoltaico
 ITIS A.PACINOTTI Via Montaione 15 Progetto macchina con tetto fotovoltaico Classe 2 C Informatica Docente referente: Prof.ssa Leccesi Progetto: Educarsi al futuro Premessa Motivazione per la partecipazione
ITIS A.PACINOTTI Via Montaione 15 Progetto macchina con tetto fotovoltaico Classe 2 C Informatica Docente referente: Prof.ssa Leccesi Progetto: Educarsi al futuro Premessa Motivazione per la partecipazione
Concetti fondamentali su acidità e basicità delle soluzioni acquose
 Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Esponenziali elogaritmi
 Esponenziali elogaritmi Potenze ad esponente reale Ricordiamo che per un qualsiasi numero razionale m n prendere n>0) si pone a m n = n a m (in cui si può sempre a patto che a sia un numero reale positivo.
Esponenziali elogaritmi Potenze ad esponente reale Ricordiamo che per un qualsiasi numero razionale m n prendere n>0) si pone a m n = n a m (in cui si può sempre a patto che a sia un numero reale positivo.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LE SUCCESSIONI 1. COS E UNA SUCCESSIONE
 LE SUCCESSIONI 1. COS E UNA SUCCESSIONE La sequenza costituisce un esempio di SUCCESSIONE. Ecco un altro esempio di successione: Una successione è dunque una sequenza infinita di numeri reali (ma potrebbe
LE SUCCESSIONI 1. COS E UNA SUCCESSIONE La sequenza costituisce un esempio di SUCCESSIONE. Ecco un altro esempio di successione: Una successione è dunque una sequenza infinita di numeri reali (ma potrebbe
Elettricità e magnetismo
 E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
Capitolo 25: Lo scambio nel mercato delle assicurazioni
 Capitolo 25: Lo scambio nel mercato delle assicurazioni 25.1: Introduzione In questo capitolo la teoria economica discussa nei capitoli 23 e 24 viene applicata all analisi dello scambio del rischio nel
Capitolo 25: Lo scambio nel mercato delle assicurazioni 25.1: Introduzione In questo capitolo la teoria economica discussa nei capitoli 23 e 24 viene applicata all analisi dello scambio del rischio nel
