2) Primo principio della Termodinamica
|
|
|
- Carmelo Gianmaria Patti
- 4 anni fa
- Visualizzazioni
Transcript
1 2) Primo rinciio della Termodinamica Anteatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica delle molecole + energia di interazione tra le molecole (calcolabile noto lo stato di tutte le molecole) Sistema isolato: l energia si conserva =costante Sistema interagente con l ambiente: scambio/lusso di energia Considerando (sistema + ambiente) come un sistema isolato: + = costante = Come alicare il rinciio di conservazione dell energia alla descrizione macroscoica del sistema, cioè utilizzando le grandezze di stato descrittive dello stato termodinamico di equilibrio? 1
2 Si considerano solo trasormazioni di un sistema chiuso tra due stati di equilibrio raresentabili ad esemio come due unti nel diagramma di stato (,) Trasormazioni irreversibili (o sontanee): trasormazioni ordinarie dove il sistema assa attraverso stati di non-equilibrio (non raresentabili nel diagramma di stato) T Stato iniziale trasormazione Irreversibile (uori del iano) Trasormazioni reversibili (o quasi statiche): quando anche gli stati intermedi sono stati di equilibrio (sono raresentabili nel diagramma di stato) trasormazione reversibile Stato inale P 2
3 Le trasormazioni reversibili sono un caso limite delle trasormazioni reali: incrementi ininitesimi dei arametri esterni che controllano la deviazione risetto alla condizione di equilibrio (con la direzione della trasormazione invertibile cambiando il segno degli incrementi). Comressioni/esansioni (ad esemio un gas in un cilindro con istone): data la condizione di equilibrio meccanico ( =), la comressione Irreversibile (sontanea) si realizza con un incremento inito della ressione esterna =+ mentre la comressione reversibile si realizza nel limite 0in modo da non distruggere lo stato di equilibrio. Invertendo il segno di si ha la trasormazione oosta (esansione). 3
4 Sistema a temeratura a contatto con un coro esterno a temeratura Condizione di equilibrio termico: =, Riscaldamento irreversibile (sontaneo) del sistema si realizza se =+ con >0 Riscaldamento reversibile nel limite 0 Rareddamento se < 0 4
5 Enunciato del 1 rinciio della termodinamica : Per ogni sistema chiuso esiste una unzione di stato U detta energia Interna le cui variazioni in una trasormazione sono date come q w U = q + w dove e sono risettivamente il calore assorbito dal sistema ed il lavoro atto sul sistema. Annotazioni 1) Convenzione sui segni di q e w: valori ositivi corrisondono ad incrementi energetici del sistema. 2) Si iotizza che il sistema sia immobile, altrimenti bisognerebbe tener conto dell energia cinetica del sistema stesso. 3) Il 1 rinciio è alicabile solo a trasormazioni tra stati di equilibrio er i quali sono deinite le grandezze di stato (quale l energia interna) 4) L'energia interna U è una rorietà estensiva. U U 5) Sono determinabili solo variazioni di energia interna (attraverso di misure di calore e lavoro), e quindi non è determinabile in assoluto. 5
6 L'aermazione che è una grandezza di stato costituisce il ostulato del 1 rinciio. Interretazione molecolare di : energia totale dell insieme delle molecole del sistema (comrensiva dei contributi di energia cinetica e di energia di Interazione intermolecolare) Il calore ed il lavoro non sono grandezze di stato, ma energia scambiata! L'unità di misura S.I. dell'energia è il Joule (J) J = Newton metro = kg m 2 / s 2 6
7 Diverse orme di lavoro a seconda del tio di interazione con il sistema, in articolare: 1) lavoro meccanico: orza meccanica che roduce il moto di una suericie di searazione tra il sistema e l ambiente; 2) lavoro elettrico: dierenza di otenziale imosta dall'esterno che genera una corrente nel sistema. Modalità di esecuzione del lavoro meccanico: 1) lavoro uramente dissiativo (sregamento, agitazione di una soluzione) che non rovocano variazioni di volume (se non a seguito del conseguente aumento di temeratura); 2) lavoro di volume: la orza esterna è utilizzata er modiicare il volume del sistema. Esemio (semlice) di lavoro di volume: comressione con = costante agente su un istone di suericie senza attrito:,!"# $ ( %, % ) & '() =* + = + = + Trasormazione irreversibile! 7
8 Lavoro di volume in condizioni isoterme: = costante Come realizzare la condizione isoterma? Sistema a contatto con un termostato. Termostato: sistema in grado di scambiare eicientemente calore senza cambiare la sua temeratura (esemio: miscela di acqua e ghiaccio). = ( T, ) : equazione di stato er la ressione i / : Comressione a volume iniziale/inale = ext = ( T, ) costante ext = ext = = ( T, ) i = ( T, ) i ( T, ) ext wvol = = i i 8
9 Sequenza di - =4 comressioni a =costante w vol N = w k= 1 vol, k w = ( T, ) vol, k k k = k k k = = 2 0 i 1 k = 4 k = 3 k = 2 k =1 ( T, ) = = 0 i Comressione reversibile: - = d 0 w = dw 0 dierenziali! vol dw = ( T, ) d w = dw = ( T, ) d vol vol vol vol nel caso di gas ideali:, =01/ d wvol = nrt = nrt ln / i ( ) i 1 2 x x 1 2 i dx x x 2 = ln x2 ln x1 = ln x 1 9
10 Esemio di calcolo del lavoro di volume 1 litro di gas a 25 C ( T=298.15K) ed alla ressione di 1 bar viene comresso in condizioni isoterme con una ressione costante di 2 bar Stato iniziale: Stato inale: 1 = 1 bar 1 = 2 = 2bar 2 = 1 litro 0.5 litri = 1 1 = nrt 22 & '() = = ( Pa) : 9 =100 J Comressione isoterma reversibile tra gli stessi stati iniziale e inale 01 = =(10 5 Pa) : 9 =100 J & '() =01<0 % =100 ln 2 J =69.3 J < & '() 10
11 Lavoro elettrico er lo sostamento di una carica q sotto una dierenza di otenziale : = q w el Lavoro elettrico determinato dal assaggio di una corrente i er un temo t in seguito all alicazione di una dierenza di otenziale ad una resistenza R (legge di Ohm: = Ri ): 2 q = it wel = it = t / R 11
12 Il calore caratterizza il lusso di energia termica che si stabilisce tra: 1) due cori a temeratura dierente e 2) searati da una suericie diatermica (cioè conduttrice di calore). Suerici adiabatiche: non consentono il lusso di calore Processi adiabatici: trasormazioni in assenza di lusso di calore ( q = 0 ). Il 1 rinciio ornisce anche il criterio di misura del calore. Suoniamo di eettuare una trasormazione tra due stati senza eettuare lavoro: U = q Si esegua la trasormazione tra gli stessi due stati senza ornire calore e misurando il lavoro necessario: U = w Dall uguaglianza di U nei due casi in quanto l energia interna è una unzione di stato: q = w La quantità di calore è determinabile sulla base di misure di lavoro! 12
13 Eserimenti di Joule (circa 1830): determinazione della kilocaloria deinita come quantità di calore nel riscaldamento a ressione costante del sistema: 1 kg H 2 O (1 Atm, 14.5 C) 1 kg H 2 O (1 Atm, 15.5 C) La stessa trasormazione uò essere realizzata eettuando un lavoro di kj (ad esemio acendo assare er un temo oortuno una corrente attraverso una resistenza immersa nell acqua) Quindi 1 kcal = kj Nello scambio di calore tra due cori, il calore assorbito da un coro è l oosto del calore assorbito dall altro coro (cioè è uguale al calore erso dal secondo coro) U = q U 2 = q 2 Se nei due cori non viene eseguito alcun lavoro q 1 q U = U1 + U2 = q1 + q2 = 0 q = q
2) Primo principio della Termodinamica
 2) Primo principio della Termodinamica Antefatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica
2) Primo principio della Termodinamica Antefatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica
termodinamica: 2. il Primo Principio
 termodinamica: 2. il Primo Principio 28 Primo Principio della Termodinamica Antefatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale
termodinamica: 2. il Primo Principio 28 Primo Principio della Termodinamica Antefatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale
BIOLOGIA A. A CHIMICA
 Laurea triennale in BIOLOGIA A. A. 03-4 4 CHIMICA Lezioni di Chimica Fisica rof. Antonio Toffoletti Conversione di una grandezza tra unità di misura differenti Uno scienziato ha misurato la pressione atmosferica
Laurea triennale in BIOLOGIA A. A. 03-4 4 CHIMICA Lezioni di Chimica Fisica rof. Antonio Toffoletti Conversione di una grandezza tra unità di misura differenti Uno scienziato ha misurato la pressione atmosferica
Calcolare in quanto tempo uno scaldabagno da 60 litri porta il suo contenuto
 lcuni esemi. Un coro di massa m1kg assorbe una quantità di calore 30cal aumentando la sua temeratura di 10 C. uale sarà il suo calore secifico? uale sarà la sua caacità termica? Calcolare in quanto temo
lcuni esemi. Un coro di massa m1kg assorbe una quantità di calore 30cal aumentando la sua temeratura di 10 C. uale sarà il suo calore secifico? uale sarà la sua caacità termica? Calcolare in quanto temo
Lezione Trasformazioni termodinamiche
 Lezione rasformazioni termodinamiche Adiabatica; Isocora; Isobara; Isoterma; Energia interna costante; Adiabatica Consideriamo una trasformazione che orti il sistema dallo stato di equilibrio 1 allo stato
Lezione rasformazioni termodinamiche Adiabatica; Isocora; Isobara; Isoterma; Energia interna costante; Adiabatica Consideriamo una trasformazione che orti il sistema dallo stato di equilibrio 1 allo stato
Il primo principio della termodinamica
 Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
UNIVERSITÀ DEGLI STUDI DI TERAMO
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di : FISICA MEDICA A.A. 015 /016 Docente: Dott. Chiucchi Riccardo mail:rchiucchi@unite.it Medicina Veterinaria: CFU
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di : FISICA MEDICA A.A. 015 /016 Docente: Dott. Chiucchi Riccardo mail:rchiucchi@unite.it Medicina Veterinaria: CFU
5. Energia libera e potenziale chimico
 5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
Complementi di Termologia. III parte
 Prof. Michele Giugliano (Dicembre 00) Comlementi di Termologia. III arte N. 3. - Lavoro nelle trasformazioni. In generale se un gas, soggetto ad una variazione della ressione, varia il volume, esso comie
Prof. Michele Giugliano (Dicembre 00) Comlementi di Termologia. III arte N. 3. - Lavoro nelle trasformazioni. In generale se un gas, soggetto ad una variazione della ressione, varia il volume, esso comie
Fisica Generale A estensione principio di conservazione dell energia energia termica teoria cinetica dei gas 14. I Principio della Termodinamica
 Fisica Generale A 4. I Princiio della ermodinamica htt://camus.cib.unibo.it/2434/ December 3, 2 Primo Princiio e Moti Molecolari Il rimo rinciio della termodinamica è l estensione del rinciio di conservazione
Fisica Generale A 4. I Princiio della ermodinamica htt://camus.cib.unibo.it/2434/ December 3, 2 Primo Princiio e Moti Molecolari Il rimo rinciio della termodinamica è l estensione del rinciio di conservazione
SISTEMA TERMODINAMICO STATO TERMODINAMICO
 SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
LAVORO DI UN GAS. Espansione di un gas a pressione costante V A V B
 LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
Entropia e secondo principio della termodinamica
 Entroia e secondo rinciio della terodinaica Oltre alla conservazione dell'energia, le trasforazioni irreversibili hanno un ulteriore vincolo derivante dalla sontaneità secondo la freccia teorale. L inverso
Entroia e secondo rinciio della terodinaica Oltre alla conservazione dell'energia, le trasforazioni irreversibili hanno un ulteriore vincolo derivante dalla sontaneità secondo la freccia teorale. L inverso
Lezione 10 Termodinamica
 rgomenti della lezione: relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot Lezione 0 ermodinamica secondo riiio della termodinamica Gas ideali Un gas
rgomenti della lezione: relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot Lezione 0 ermodinamica secondo riiio della termodinamica Gas ideali Un gas
= 20 C, dopo aver rappresentato il ciclo nel diagramma di Clapeyron, il lavoro L
 Partendo dallo stato iniziale, un gas erfetto monoatomico comie il ciclo raggiungendo successivamente gli stati intermedi, e e tornando oi dallo stato nello stato iniziale. Il ciclo è costituito da: un
Partendo dallo stato iniziale, un gas erfetto monoatomico comie il ciclo raggiungendo successivamente gli stati intermedi, e e tornando oi dallo stato nello stato iniziale. Il ciclo è costituito da: un
Lezione 10 Termodinamica
 rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
e la forza di Archimede è uguale al peso del fluido occupato: A = M b)il corpo scende di h, cui corrisponde una variazione di energia potenziale
 ) Meccanica Un sistema è comosto da un coro omogeneo di massa M e densità ρ e da una data quantità di luido (di densità minore ρ ) in cui il coro è immerso. Inizialmente (stato i) il coro è ermo, quindi
) Meccanica Un sistema è comosto da un coro omogeneo di massa M e densità ρ e da una data quantità di luido (di densità minore ρ ) in cui il coro è immerso. Inizialmente (stato i) il coro è ermo, quindi
SISTEMA TERMODINAMICO STATO TERMODINAMICO
 SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
Dipartimento di Scienze Chimiche. Ambiente. Sistema
 Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
Calorimetria. Principio zero Trasformazioni termodinamiche Lavoro termodinamico
 Calorimetria Princiio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una articella è definito quando siano note, in un certo istante, la osizione
Calorimetria Princiio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una articella è definito quando siano note, in un certo istante, la osizione
C- CALORE / LAVORO / PRIMO PRINCIPIO
 C- CALORE / LAVORO / PRIMO PRINCIPIO SISTEMA TERMODINAMICO SISTEMA IL CUI COMPORTAMENTO PUO' ESSERE DETERMINATO E DESCRITTO PER MEZZO DI POCHE GRANDEZZE GLOBALI (PRESSIONE, TEMPERATURA, ECC.), SENZA CONOSCERE
C- CALORE / LAVORO / PRIMO PRINCIPIO SISTEMA TERMODINAMICO SISTEMA IL CUI COMPORTAMENTO PUO' ESSERE DETERMINATO E DESCRITTO PER MEZZO DI POCHE GRANDEZZE GLOBALI (PRESSIONE, TEMPERATURA, ECC.), SENZA CONOSCERE
Lezione n. 4. Lavoro e calore Misura di lavoro e calore Energia interna. 04/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 4 Lavoro e calore Misura di lavoro e calore Energia interna 04/03/2008 Antonino Polimeno 1 Sommario (1) - Un sistema termodinamico è una porzione
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 4 Lavoro e calore Misura di lavoro e calore Energia interna 04/03/2008 Antonino Polimeno 1 Sommario (1) - Un sistema termodinamico è una porzione
Termologia. Paolo Bagnaia - CTF Esercizi di termologia e termodinamica 1
 ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
La Pressione (1) La Pressione è una grandezza scalare ed in un fluido rappresenta una proprietà meccanica dello stesso.
 La Pressione (1) Trasformazioni termodamiche del Gas Ideale - 1 ds La Pressione è una grandezza scalare ed un fluido raresenta una rorietà meccanica dello stesso. d n F df ds = 1 = mg h (1) = ds ds n π
La Pressione (1) Trasformazioni termodamiche del Gas Ideale - 1 ds La Pressione è una grandezza scalare ed un fluido raresenta una rorietà meccanica dello stesso. d n F df ds = 1 = mg h (1) = ds ds n π
Introduzione alle macchine termiche
 1 Introduzione alle macchine termiche In questa nota 1 introduciamo il concetto di macchina termica che oera con trasformazioni cicliche er trasformare calore in lavoro. In generale questo argomento viene
1 Introduzione alle macchine termiche In questa nota 1 introduciamo il concetto di macchina termica che oera con trasformazioni cicliche er trasformare calore in lavoro. In generale questo argomento viene
Termodinamica. studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro.
 Termodinamica studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro. La termodinamica parte da osservazioni sperimentali e quindi si esprime
Termodinamica studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro. La termodinamica parte da osservazioni sperimentali e quindi si esprime
Prova scritta del 27 novembre 2018
 Prova scritta del 27 novembre 2018 1 Un reciiente della caacità di 1.00 L e contenente un gas A alla ressione di 10.0 kpa viene connesso ad un altro reciiente avente il volume di 3.00 L con all interno
Prova scritta del 27 novembre 2018 1 Un reciiente della caacità di 1.00 L e contenente un gas A alla ressione di 10.0 kpa viene connesso ad un altro reciiente avente il volume di 3.00 L con all interno
La termochimica. Energia in movimento
 La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
Entalpia. L'entalpia è una funzione di stato ed è una grandezza estensiva. dh=du+pdv+vdp --> du+pdv = dh - Vdp
 Entalpia Si definisce entalpia la grandezza H ( 1 H = U + pv L'entalpia è una funzione di stato ed è una grandezza estensiva. Differenziando la (1) si ha dh=du+pdv+vdp --> du+pdv = dh - Vdp In una generica
Entalpia Si definisce entalpia la grandezza H ( 1 H = U + pv L'entalpia è una funzione di stato ed è una grandezza estensiva. Differenziando la (1) si ha dh=du+pdv+vdp --> du+pdv = dh - Vdp In una generica
FISICA. V [10 3 m 3 ]
![FISICA. V [10 3 m 3 ] FISICA. V [10 3 m 3 ]](/thumbs/24/2838543.jpg) Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Tre tipi di Sistema Un richiamo
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: nrt
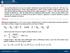
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du δ δl () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du δ δl () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che
( 160 mol) ( 8,31 J/(mol K) ) = 600 K
 6** T A nr Trasormazione isocora: ( 10 5 Pa) ( m ) ( 160 mol) ( 8,1 J/(mol K) ) 00 K P (10 5 Pa) 4 B A 1 1 4 5 V (m ) Trasormazione isobara: P (10 5 Pa) 4 A B 1 1 4 5 V (m ) Sì, poiché i due stati B e
6** T A nr Trasormazione isocora: ( 10 5 Pa) ( m ) ( 160 mol) ( 8,1 J/(mol K) ) 00 K P (10 5 Pa) 4 B A 1 1 4 5 V (m ) Trasormazione isobara: P (10 5 Pa) 4 A B 1 1 4 5 V (m ) Sì, poiché i due stati B e
Sommario delle lezioni precedenti (1)
 I principio Lavoro e calore Misura di lavoro e calore Energia interna Entalpia Calorimetria a volume costante Calorimetria a pressione costante Calorimetria differenziale Sommario delle lezioni precedenti
I principio Lavoro e calore Misura di lavoro e calore Energia interna Entalpia Calorimetria a volume costante Calorimetria a pressione costante Calorimetria differenziale Sommario delle lezioni precedenti
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: dv dp. dv dt. nrt dt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
TEORIA CINETICA DEI GAS
 TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire.
 Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire. Molte reazioni procedono in modo incompleto; è importante quindi determinare
Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire. Molte reazioni procedono in modo incompleto; è importante quindi determinare
A1. Soluzione. Ilcalore Q per unita di massa e negativo (ceduto all esterno) e vale:
 A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
Idraulica e Idrologia: Lezione 12 Agenda del giorno
 Idraulica e Idrologia: Lezione genda del giorno Idrostatica: fluidi in quiete - Unità di misura er la ressione di un fluido - Pressione e rofondità - Princiio di rchimede: cori in un fluido Pg Fluido Cosa
Idraulica e Idrologia: Lezione genda del giorno Idrostatica: fluidi in quiete - Unità di misura er la ressione di un fluido - Pressione e rofondità - Princiio di rchimede: cori in un fluido Pg Fluido Cosa
FACOLTÀ DI INGEGNERIA. 2. Termodinamica Applicata alle Macchine. Roberto Lensi
 Roberto Lensi 2. Termodinamica Applicata alle Macchine pag. 1 UNIVERSITÀ DEGLI STUDI DI PISA FACOLTÀ DI INGEGNERIA 2. Termodinamica Applicata alle Macchine Roberto Lensi DIPARTIMENTO DI ENERGETICA Anno
Roberto Lensi 2. Termodinamica Applicata alle Macchine pag. 1 UNIVERSITÀ DEGLI STUDI DI PISA FACOLTÀ DI INGEGNERIA 2. Termodinamica Applicata alle Macchine Roberto Lensi DIPARTIMENTO DI ENERGETICA Anno
Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più
 I Fluidi Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più comunemente forze di coesione) che caratterizzano
I Fluidi Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più comunemente forze di coesione) che caratterizzano
2. ENERGIA INTERNA ED ENTALPIA.
 G. Moro Ott. 99 2. ENERGIA INTERNA ED ENTALPIA. Nel seguito si considerano trasformazioni di un sistema chiuso tra due ben definiti stati di equilibrio. Solo con questo vincolo le variazioni delle proprietà
G. Moro Ott. 99 2. ENERGIA INTERNA ED ENTALPIA. Nel seguito si considerano trasformazioni di un sistema chiuso tra due ben definiti stati di equilibrio. Solo con questo vincolo le variazioni delle proprietà
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica Mod. 2 CHIMICA FISICA. Lezione 3 TRASFORMAZIONI DEL SISTEMA
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. CHIMICA FISICA Lezione 3 Anno Accademico 00-0 Docente: Dimitrios Fessas RASFORMAZIONI DEL SISEMA i. RASFORMAZIONI
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. CHIMICA FISICA Lezione 3 Anno Accademico 00-0 Docente: Dimitrios Fessas RASFORMAZIONI DEL SISEMA i. RASFORMAZIONI
È quella parte della termologia che studia le trasformazioni di calore in lavoro e viceversa.
 EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
TERMODINAMICA. Studia le trasformazioni dei sistemi in relazione agli scambi di calore e lavoro. GENERALITÀ SUI SISTEMI TERMODINAMICI
 TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
INTRODUZIONE ALLA TERMODINAMICA. Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta
 INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
Fisica 1 Anno Accademico 2011/2012
 Matteo Luca Ruggiero DISAT@Politecnico di Torino Anno Accademico 2011/2012 (4 Giugno - 8 Giugno 2012) Sintesi Abbiamo formulato il primo principio della termodinamica che regola gli scambi di calore, la
Matteo Luca Ruggiero DISAT@Politecnico di Torino Anno Accademico 2011/2012 (4 Giugno - 8 Giugno 2012) Sintesi Abbiamo formulato il primo principio della termodinamica che regola gli scambi di calore, la
Termodinamica (3) Trasformazioni termodinamiche Lezione 14, 20/11/2018, JW
 Termodinamica (3) Trasformazioni termodinamiche Lezione 14, 20/11/2018, JW 17.2-17.4 1 2. Il primo principio della termodinamica Il primo principio della termodinamica è un affermazione della conservazione
Termodinamica (3) Trasformazioni termodinamiche Lezione 14, 20/11/2018, JW 17.2-17.4 1 2. Il primo principio della termodinamica Il primo principio della termodinamica è un affermazione della conservazione
Introduzione al primo principio della termodinamica. Liceo scientifico M. Curie Savignano s R.
 Introduzione al primo principio della termodinamica Liceo scientifico M. Curie Savignano s R. La termodinamica si basa sul concetto di sistema macroscopico (o sistema termodinamico). Lo stato di un sistema
Introduzione al primo principio della termodinamica Liceo scientifico M. Curie Savignano s R. La termodinamica si basa sul concetto di sistema macroscopico (o sistema termodinamico). Lo stato di un sistema
I principi della termodinamica
 I principi della termodinamica dalla pratica alla teoria di Ettore Limoli Convenzione sui segni di Q e di L Calore assorbito dal sistema: Q > 0 Calore ceduto dal sistema: Q < 0 Lavoro fatto dal sistema:
I principi della termodinamica dalla pratica alla teoria di Ettore Limoli Convenzione sui segni di Q e di L Calore assorbito dal sistema: Q > 0 Calore ceduto dal sistema: Q < 0 Lavoro fatto dal sistema:
Termodinamica: studio dei trasferimenti di energia
 Termodinamica: studio dei trasferimenti di energia Termodinamica chimica: 1. variazione di energia associata ad una trasformazione 2. spontaneità di una trasformazione Si basa su tre principi (leggi) e
Termodinamica: studio dei trasferimenti di energia Termodinamica chimica: 1. variazione di energia associata ad una trasformazione 2. spontaneità di una trasformazione Si basa su tre principi (leggi) e
Il secondo principio della Termodinamica
 Il secondo principio della ermodinamica non tutte le trasformazioni sono possibili (es.: passaggio di calore, cascata, attrito, espansione libera) le trasformazioni naturali sono irreversibili ed avvengono
Il secondo principio della ermodinamica non tutte le trasformazioni sono possibili (es.: passaggio di calore, cascata, attrito, espansione libera) le trasformazioni naturali sono irreversibili ed avvengono
lavoro termodinamico quando si ha un si ha scambio di energia mediante macroscopico della configurazione di un sistema meccanico cambiamento
 Lavoro termodinamico si ha scambio di energia mediante lavoro termodinamico quando si ha un cambiamento macroscopico della configurazione di un sistema meccanico Nota bene: in termodinamica non e una singola
Lavoro termodinamico si ha scambio di energia mediante lavoro termodinamico quando si ha un cambiamento macroscopico della configurazione di un sistema meccanico Nota bene: in termodinamica non e una singola
Esercitazione 8. Soluzione Il rendimento di una macchina di Carnot in funzione delle temperature è: η = 1 T 2 T 1 = = 60%
 Esercitazione 8 Esercizio 1 - Macchina di arnot Una macchina di arnot assorbe una certa quantità di calore Q 1 da una sorgente a temperatura T 1 e cede calore Q 2 ad una seconda sorgente a temperatura
Esercitazione 8 Esercizio 1 - Macchina di arnot Una macchina di arnot assorbe una certa quantità di calore Q 1 da una sorgente a temperatura T 1 e cede calore Q 2 ad una seconda sorgente a temperatura
E la componente della forza parallella allo spostamento che compie lavoro.
 Lavoro ed energia Lavoro di una forza Energia cinetica teorema dell energia cinetica orze conservative e energia otenziale orze non conservative ed energia totale Conservazione dell energia Il lavoro di
Lavoro ed energia Lavoro di una forza Energia cinetica teorema dell energia cinetica orze conservative e energia otenziale orze non conservative ed energia totale Conservazione dell energia Il lavoro di
Energia e Sviluppo Sostenibile
 Termodinamica Applicata: Introduzione A. Servida - servida@unige.it Introduzione alla Termodinamica (1) La meccanica analizza solo una parte del principio di conservazione dell'energia: la conservazione
Termodinamica Applicata: Introduzione A. Servida - servida@unige.it Introduzione alla Termodinamica (1) La meccanica analizza solo una parte del principio di conservazione dell'energia: la conservazione
TERMODINAMICA. G. Pugliese 1
 TERMODINAMICA G. Pugliese 1 Meccanica: La termodinamica Forze conservative, principio di conservazione dell energia meccanica. Forze non conservative: l energia meccanica totale, varia: ΔE = W nc Nei casi
TERMODINAMICA G. Pugliese 1 Meccanica: La termodinamica Forze conservative, principio di conservazione dell energia meccanica. Forze non conservative: l energia meccanica totale, varia: ΔE = W nc Nei casi
1) Si deve progettare un auto reattore per un missile che vola a M 1 := 1.8. Supponendo che
 Esercizi di Esame 1.mcd (1/9) 1) Si deve rogettare un auto reattore er un missile che vola a M 1 : 1.8. Suonendo che T 1 : 73.15 K, 1 : 0.7 atm, A : 0.0347 m, A 3 /A 1.34 e che la combustione roduce 196.7kJ/kg.
Esercizi di Esame 1.mcd (1/9) 1) Si deve rogettare un auto reattore er un missile che vola a M 1 : 1.8. Suonendo che T 1 : 73.15 K, 1 : 0.7 atm, A : 0.0347 m, A 3 /A 1.34 e che la combustione roduce 196.7kJ/kg.
FISICA GENERALE (A) I Prova A.A Cognome Nome n. matricola
 FISICA GENERALE (A) I Prova A.A. 8-9 3.4.9 Cognome Nome n. matricola Corso di Studi Docente Voto 5 Crediti Crediti Esercizio n. Un anello di massa m uò scorrere senza attrito su una guida circolare orizzontale
FISICA GENERALE (A) I Prova A.A. 8-9 3.4.9 Cognome Nome n. matricola Corso di Studi Docente Voto 5 Crediti Crediti Esercizio n. Un anello di massa m uò scorrere senza attrito su una guida circolare orizzontale
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
delle temperature iniziale e finale analogia con l energia potenziale in meccanica la funzione U e detta energia interna
 Lavoro adiabatico e calore, esperimenti di Joule si puo innalzare la temperatura dell acqua in un calorimetro anche effettuando lavoro senza scambiare calore ( lavoro adiabatico ) i risultati sperimentali
Lavoro adiabatico e calore, esperimenti di Joule si puo innalzare la temperatura dell acqua in un calorimetro anche effettuando lavoro senza scambiare calore ( lavoro adiabatico ) i risultati sperimentali
Tonzig La fisica del calore
 4 onzig La fisica del calore batiche si trova 2 / = / 4, il che vuol dire che la [F] si riduce alla [E]. Ne deriva che, nello secifico caso di un gas erfetto, il rendimento di un ciclo di Carnot è [G]
4 onzig La fisica del calore batiche si trova 2 / = / 4, il che vuol dire che la [F] si riduce alla [E]. Ne deriva che, nello secifico caso di un gas erfetto, il rendimento di un ciclo di Carnot è [G]
Tonzig La fisica del calore
 0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
Il primo principio della termodinamica Argomenti
 Il primo principio della termodinamica Termodinamica (generalità) 1 principio della termodinamica Argomenti Definizione di sistema termodinamico Funzioni di stato (generalità) Esercizi Obiettivi Conoscere
Il primo principio della termodinamica Termodinamica (generalità) 1 principio della termodinamica Argomenti Definizione di sistema termodinamico Funzioni di stato (generalità) Esercizi Obiettivi Conoscere
2. Applichiamo il primo principio al sistema considerato, nella forma in cui figura il lavoro eseguito dal sistema: E Q L
 apitolo Soluzioni. pplichiamo il primo principio al sistema considerato, nella orma in cui igura il lavoro eseguito dal sistema: Q L dai dati del problema risulta 800J 0J 0J quindi l energia erna aumenta.
apitolo Soluzioni. pplichiamo il primo principio al sistema considerato, nella orma in cui igura il lavoro eseguito dal sistema: Q L dai dati del problema risulta 800J 0J 0J quindi l energia erna aumenta.
Termodinamica Chimica
 Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Energia e Lavoro dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Energia e Lavoro dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
TERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la
 ERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la circonda e può influenzarne il comportamento ( ambiente
ERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la circonda e può influenzarne il comportamento ( ambiente
Il I principio della termodinamica. Calore, lavoro ed energia interna
 Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
LA TERMODINAMICA. di Giuseppe Frangiamore con la collaborazione di Roberto Nocera
 LA TERMODINAMICA di Giuseppe Frangiamore con la collaborazione di Roberto Nocera La Termodinamica è una scienza sperimentale basata su pochi principi derivanti da generalizzazioni dall'esperienza sperimentale.
LA TERMODINAMICA di Giuseppe Frangiamore con la collaborazione di Roberto Nocera La Termodinamica è una scienza sperimentale basata su pochi principi derivanti da generalizzazioni dall'esperienza sperimentale.
Esercizi svolti di termodinamica applicata
 0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
ESERCIZI di TERMODINAMICA. Considerare una mole di gas ideale. [Risultato: q=- 17 kj]
![ESERCIZI di TERMODINAMICA. Considerare una mole di gas ideale. [Risultato: q=- 17 kj] ESERCIZI di TERMODINAMICA. Considerare una mole di gas ideale. [Risultato: q=- 17 kj]](/thumbs/101/149803015.jpg) ESERCIZI di TERMODINAMICA 1 Suggerimenti: specificare le condizioni iniziali e finali; ricordarsi che la trasformazione è reversibile; è necessario il valore della capacità termica a volume costante che
ESERCIZI di TERMODINAMICA 1 Suggerimenti: specificare le condizioni iniziali e finali; ricordarsi che la trasformazione è reversibile; è necessario il valore della capacità termica a volume costante che
1 bar = 10 Pa = 10 barie PRESSIONE PRESSIONE. N 10 dyn dyn. m 10 cm cm. Solido. Liquido. Gassoso. (pascal) m. kg 1000.
 STATI DI AGGREGAZIONE DELLA MATERIA Solido Liquido Gassoso Il coro ha volume e forma ben definiti Il coro ha volume ben definito, ma assume la forma del reciiente che lo contiene Il coro occua tutto lo
STATI DI AGGREGAZIONE DELLA MATERIA Solido Liquido Gassoso Il coro ha volume e forma ben definiti Il coro ha volume ben definito, ma assume la forma del reciiente che lo contiene Il coro occua tutto lo
Sia dato un corpo su cui agisce una forza. Supponiamo che inizialmente il corpo sia fermo, dalla relazione
 Lavoro ed energia Sia dato un coro su cui agisce una forza. Suoniamo che inizialmente il coro sia fermo, dalla relazione F = ma doo un certo intervallo di temo in cui la forza agisce sull oggetto, il coro
Lavoro ed energia Sia dato un coro su cui agisce una forza. Suoniamo che inizialmente il coro sia fermo, dalla relazione F = ma doo un certo intervallo di temo in cui la forza agisce sull oggetto, il coro
- velocità dell auto v = 80 km/h; - g = accelerazione di gravità = 9,81 m/s 2-1h = 3600 s - E c = ½ m v 2 - E p = m g h ES. 1
 Da quale altezza dovrebbe cadere un auto (in assenza di attrito) per acquistare un energia cinetica uguale a quella che avrebbe se viaggiasse alla velocità di 80 km/h? - velocità dell auto v = 80 km/h;
Da quale altezza dovrebbe cadere un auto (in assenza di attrito) per acquistare un energia cinetica uguale a quella che avrebbe se viaggiasse alla velocità di 80 km/h? - velocità dell auto v = 80 km/h;
Per quanto detto prima il fenomeno di svuotamento termina quando la pressione di ristagno è pari a:
 Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante.
 All origine di tutto c è il teorema di conservazione dell energia totale meccanica: Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante. Il teorema è tipicamente
All origine di tutto c è il teorema di conservazione dell energia totale meccanica: Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante. Il teorema è tipicamente
Esercitazione 7. Soluzione. Il sistema è isolato, quindi l energia totale si conserva. Applicando il primo principio della termodinamica si ottiene:
 Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
Enunciato di Kelvin-Plank
 ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
Chimica Fisica. Libro di testo consigliato P.W. Atkins, Chimica Fisica, Ed. Zanichelli
 Chimica Fisica Corso di laurea in Chimica e Tecnologia Farmaceutiche Anno Accademico 2017/2018 Prof. Giovanna Fronzoni Dipartimento di Scienze Chimiche e Farmaceutiche (edificio C11) e-mail: fronzoni@units.it
Chimica Fisica Corso di laurea in Chimica e Tecnologia Farmaceutiche Anno Accademico 2017/2018 Prof. Giovanna Fronzoni Dipartimento di Scienze Chimiche e Farmaceutiche (edificio C11) e-mail: fronzoni@units.it
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
TERMODINAMICA DELL ATMOSFERA
 TERMODINAMICA DELL ATMOSFERA GAS IDEALE Un gas ideale è un modello ideale di gas nel quale le molecole sono untiformi e indistinguibili, non interagenti, in moto casuale e nel quale si conserva l energia
TERMODINAMICA DELL ATMOSFERA GAS IDEALE Un gas ideale è un modello ideale di gas nel quale le molecole sono untiformi e indistinguibili, non interagenti, in moto casuale e nel quale si conserva l energia
Termodinamica. by R. Pizzoferrato
 ermodinamica Comletiamo il quadro dei fenomeni fisici: cambiamenti di stato? dove finisce l energia ersa in meccanica? nuove grandezze fisiche: emeratura, Calore, ecc Definiamo Sistema ermodinamico: arte
ermodinamica Comletiamo il quadro dei fenomeni fisici: cambiamenti di stato? dove finisce l energia ersa in meccanica? nuove grandezze fisiche: emeratura, Calore, ecc Definiamo Sistema ermodinamico: arte
Calore, lavoro e trasformazioni termodinamiche (1)
 Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
Lez 15 22/11/2016. Lezioni in didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617
 Lez 15 22/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Energia interna di un gas ideale E. Fiandrini Fis. Sper. e 2 Energia
Lez 15 22/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Energia interna di un gas ideale E. Fiandrini Fis. Sper. e 2 Energia
Dotto Formazione a tutto tondo Rapid Training 2018 Corso di Fisica. Argomento 11 Termodinamica
 Dotto Formazione a tutto tondo Rapid Training 2018 Corso di Fisica Argomento 11 Termodinamica 2 L energia interna dei gas L energia totale di tutte le molecole del sistema: e. cinetica traslazionale e.
Dotto Formazione a tutto tondo Rapid Training 2018 Corso di Fisica Argomento 11 Termodinamica 2 L energia interna dei gas L energia totale di tutte le molecole del sistema: e. cinetica traslazionale e.
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
CONVENZIONE SUI SEGNI
 CONVENZIONE SUI SEGNI Si stabilisce una convenzione sui segni sia per gli scambi di calore che per il lavoro che il sistema compie o subisce L>0: LAVORO COMPIUTO DAL SISTEMA Q>0: CALORE ASSORBITO SISTEMA
CONVENZIONE SUI SEGNI Si stabilisce una convenzione sui segni sia per gli scambi di calore che per il lavoro che il sistema compie o subisce L>0: LAVORO COMPIUTO DAL SISTEMA Q>0: CALORE ASSORBITO SISTEMA
TERMODINAMICA 28/10/2015 SISTEMA TERMODINAMICO
 TERMODINAMICA Studia quale è la forza propulsiva delle reazioni chimiche valutando le proprietà macroscopiche di un sistema. Si può in tale modo sapere se una reazione procede spontaneamente. Si occupa
TERMODINAMICA Studia quale è la forza propulsiva delle reazioni chimiche valutando le proprietà macroscopiche di un sistema. Si può in tale modo sapere se una reazione procede spontaneamente. Si occupa
Applicazione del principio di conservazione dell energia a sistemi aventi un gran numero di particelle.
 PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
Secondo principio della termodinamica: perché????
 Secondo principio della termodinamica: perché???? Primo principio: bilancio degli scambi energetici con l ambiente, ma non dà nessuna spiegazione del fatto che in natura alcune trasformazioni procedono
Secondo principio della termodinamica: perché???? Primo principio: bilancio degli scambi energetici con l ambiente, ma non dà nessuna spiegazione del fatto che in natura alcune trasformazioni procedono
