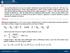
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: nrt
|
|
|
- Regina Palmisano
- 4 anni fa
- Visualizzazioni
Transcript
1 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du δ δl () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino da uno stato A a due stati B e C caratterizzati dalla stessa temeratura. Lungo le due trasformazioni si avrà la stessa variazione di energia interna: du d du d Lungo la trasformazione si ha du δ δ L d 0 du δ c () d d A B C Per la trasformazione si ha: du d δ d δl dt δ d d dt (3) Per quanto riguarda l ultimo termine, esrimendo in funzione di e si ha: d d d d d d ( ) d d + d d, L equazione di stato dei gas erfetti è: e sostituendo nella (3) si ha P nr nr d d nr du d c R c R (4) Confrontando infine la () e la (4) si ottiene allora la relazione di Mayer: c c R o c c R
2 IL CICLO DI CARNO Il ciclo di Carnot è un ciclo reversibile costituito da due trasformazioni isoterme e da due adiabatiche. Se viene usato un gas erfetto il diagramma nel iano, è mostrato in figura. Il ciclo uò essere realizzato come nello schema: esansione isoterma esansione adiabatica comressione isoterma comressione adiabatica Per qualunque ciclo si ha du0 e quindi L Durante un ciclo di Carnot (diretto) viene assorbita la quantità di calore ( >0) durante la isoterma a temeratura, e viene ceduta la quantità di calore ( <0) durante la isoterma a temeratura. Il calore comlessivamente scambiato è + Il lavoro fatto nel ciclo è ositivo e ari all area racchiusa dal ciclo. Definiamo il rendimento del ciclo di Carnot (diretto) il raorto tra il lavoro comiuto e la quantità di calore assorbita: L + η () +
3 Il rendimento è semre minore di, cioè non è ossibile realizzare un ciclo in cui l unico risultato sia quello di trasformare in lavoro tutto il calore assorbito dall ambiente esterno. Il ciclo di Carnot uò essere ercorso in senso inverso: la quantità di calore viene assorbita dalla sorgente a temeratura iù bassa ( >0), la quantità di calore viene ceduta alla sorgente a temeratura iù alta ( <0) e il lavoro fatto dal sistema è negativo, ovvero deve essere fornito dall ambiente (macchina frigorifera). Il coefficiente di restazione della macchina frigorifera è: K L + CICLO DI CARNO PER UN GAS PERFEO Nelle isoterme U0, er cui L e L. Si ha inoltre: ( ) 0 nr ln > () ( ) 0 nr ln 4 3 < (3) γ 3 γ γ 4 4 Moltilicando queste relazioni membro a membro e dividendo er 3 4 : γ γ γ γ da cui, dividendo er 3 4 si ottiene: che inserite nelle () e (3) danno γ γ ( 4 ) ( 3 ) Il rendimento della macchina di Carnot er un gas erfetto diviene quindi: η + 4 γ 0 3
4 EOREMA DI CARNO utte le macchine reversibili oeranti tra due medesime temerature hanno lo stesso rendimento, indiendentemente dalla sostanza termodinamica usata e dalle caratteristiche dei cicli; tutte le macchine irreversibili che oerino tra le stesse temerature hanno rendimento non maggiore di quello delle rime. I due cicli tratteggiati in rosso e in nero hanno lo stesso rendimento. Dimostriamo successivamente le due tesi. La dimostrazione è er assurdo: si fa una iotesi e si dimostra che orta a un risultato assurdo, il che imlica che la iotesi deve essere falsa. Siano R ed R due macchine reversibili oeranti tra due sorgenti a temerature e. Siano,, e le quantità di calore scambiate, risettivamente, da R ed R con le sorgenti; le due macchine siano inoltre regolate siano registrate in modo che LL, ovvero I rendimenti delle due macchine sono: ' ' () η ' + ' + ' η ' ' ' ' Suoniamo ora η > η', ovvero > ' ' ' () 4
5 > Per vedere come questa iotesi sia falsa facciamo oerare la macchina R in senso inverso ed R in senso diretto. Poichè i R L L R numeratori della () sono i lavori, uguali er iotesi, si ha: > < ' (3) ' Sostituendo nella () si ha ' ' > ' Esaminando il rimo e l ultimo membro si ottiene > ', cioè < ' (4) Dalla (3) si vede quindi che la sorgente a temeratura acquista una quantità di calore ', mentre la sorgente a temeratura cede una quantità di calore '. L insieme delle due macchine R+R costituisce dunque una macchina termica che releva una quantità di calore da una sorgente a temeratura inferiore e la trasferisce ad una sorgente a temeratura sueriore senza che sia stato comiuto del lavoro. iene così violato il ostulato di Clausius, er cui η > η' è falsa e si conclude che η η' (5) Se entrambe le macchine sono reversibili si uò rietere lo stesso ragionamento facendo oerare R in senso inverso e R in senso diretto. Si erviene alla conclusione oosta, ovvero che η η' (6) er cui l unica relazione che soddisfa contemoraneamente la (5) e la (6) è η η' (7) Per dimostrare la seconda tesi, se una delle due macchine è irreversibile non uò funzionare in modo inverso e l unica conclusione che si uò trarre è η irr η rev (8) 5
6 La definizione di rendimento, valida er qualsiasi macchina, è Si è visto che nel caso di un gas erfetto si ha: η + (9) η + (0) e oichè tutte le macchine reversibili hanno lo stesso rendimento si ha η rev () Dalla (9) e dalla (0) si ottiene allora er un ciclo reversibile: + 0 () mentre er un ciclo irreversibile, combinando la (9), la () e ricordando il teorema di Carnot si ha: + 0 (3) < Le due relazioni () e (3) ossono essere riunite nella + 0 (4) che è valida er qualsiasi macchina termica oerante tra le temerature e. 6
7 IL SECONDO PRINCIPIO DELLA ERMODINAMICA A Enunciato di Kelvin: non è ossibile realizzare una trasformazione termodinamica il cui unico risultato sia la trasformazione in lavoro di calore reso da una unica sorgente a una fissata temeratura. B Enunciato di Clausius: non è ossibile realizzare una trasformazione termodinamica il cui unico risultato sia il assaggio di calore da una sorgente a una fissata temeratura ad un altra sorgente a temeratura maggiore della rima. I due enunciati sono equivalenti: A B 7
8 A B : > L -L iolazione dell enunciato di Kelvin I FR I: macchina termica ideale che trasforma il calore, assorbito da un unica sorgente a temeratura nel lavoro L. FR: macchina frigorifera reale che assorbe il calore dalla sorgente a temeratura, e sfruttando il lavoro L cede il calore alla sorgente a temratura >. Comlessivamente: Lavoro LO L + (-L) 0 Calore a : O + Calore a : e quindi viene violato l enunciato di Clausius in quanto il calore +, assorbito dalla sorgente a temeratura, viene ortato come calore alla sorgente a temeratura > 8
9 B A FI: macchina frigorifera ideale che assorbe il calore da > una sorgente a temeratura e violando FI R l enunciato di L iolazione Clausius dell enunciato di cede il calore a una Clausius sorgente a temeratura >. R: macchina termica reale che assorbe il calore dalla sorgente a temratura, cede calore dalla sorgente a temeratura comiendo il lavoro L. Comlessivamente, se : Sorgente : O + 0 Sorgente : O + e quindi le due macchine formano comlessivamente una unica macchina termica che assorbe il calore O + da un unica sorgente a temeratura e comie il lavoro L, violando così l enunciato di Kelvin. 9
10 La relazione ENROPIA + 0 () uò essere generalizzata al caso di trasformazioni cicliche realizzate scambiando calore con iù sorgenti. Consideriamo una macchina termica M che oera tra n diverse sorgenti; indichiamo con i la temeratura della generica sorgente, e con i il calore che M scambia con la sorgente i-esima. Consideriamo quindi n macchine reversibili, ciascuna delle quali funzionante tra una nuova sorgente a temeratura 0,con la quale scambi il calore i0, e una delle sorgenti a temeratura i, con la condizione che il calore scambiato con quest ultima sia oosto a quello scambiato da M con la stessa sorgente, ovvero sia i. Per la i-esima macchina ausiliaria vale la relazione i0 0 ( ) + 0 () Sommando membro a membro tutte le n relazioni delle n macchine ausiliarie si ha n i0 i 0 i i n i i i La macchina M e le n macchine costituiscono, assieme, una macchina termica che oera scambiando calore con una sola sorgente, in quanto le n sorgenti hanno comlessivamente scambiato un calore nullo. Per non violare il rinciio della termodinamica, in corrisondenza ad un lavoro fornito dall esterno, la quantità di calore scambiata con tale sorgente non uò essere ositiva, ovvero (3) 0
11 n i i0 dove il segno di uguaglianza vale solo se la macchina M è reversibile. Dalle (3) e (4) quindi otteniamo: n i dove il segno di uguaglianza vale solo se la macchina considerata è reversibile. Se consideriamo di avere un numero infinito di sorgenti la sommatoria va i 0 sostituita da un integrale (ciclico) e la (5) viene sostituita da δ 0 (6) che rende il nome di disuguaglianza di Clausius. Nella (6), al solito, il segno di uguaglianza vale solo se il ciclo è reversibile. Consideriamo ora il ciclo reversibile ABCDA. Si ha δ 0 (7) Sezziamo ora il ciclo nei due ercorsi ABC + CDA. ovvero δ ABC δ + CDA δ ABC δ ABC δ i ADC Data l arbitrarietà delle trasformazioni scelte si vede quindi che er 0 δ ADC 0 δ trasformazioni reversibili l integrale della funzione (4) (5) δ non diende dal articolare ercorso seguito, ma solo dagli estremi. Se ne deduce che è un differenziale esatto, cioè esiste una funzione S delle variabili di stato tale che δ
12 ovvero B δ rev ds δ ds S(B) A rev B A S(A) Le (8) e (9) sono le definizioni della funzione di stato entroia (8) (9)
13 GAS REALI Un gas reale arossima un gas erfetto sotto le condizioni di bassa ressione e alta temeratura. L equazione di stato dei gas erfetti è nr In una trasformazione a costante, er un gas erfetto, vale la legge di Boyle: cost. Per un gas reale, aumentando la ressione con una comressione isoterma si hanno deviazioni dalla legge dei gas erfetti. Dal grafico nel iano di Amagat si vede che a bassa ressione N, O, CO sono iù comrimibili di un gas erfetto. CO : le deviazioni aumentano al diminuire della temeratura. Alla temeratura critica c 3. C la isoterma ha un flesso verticale (isoterma critica). Ogni isoterma ha un unto di Boyle dove il suo andamento arossima quello del gas erfetto. Nel iano, l isoterma critica ha tangente orizzontale in un unto C critico. Per < c si hanno fasi liquida o gassosa (vaore) o coesistenza delle due. Al di sora di c le isoterme arossimano quelle di un gas erfetto; il gas non uò essere liquefatto. ale la legge degli stati corrisondenti: se si Isoterme di CO nel iano di Amagat Isoterme di CO nel iano di Claeyron tracciano le isoterme in funzione di / C e / C er l unità di massa, esse coincidono er i vari gas reali. PC C Flesso a tang. orizzontale 3
14 EUAZIONE DI AN DER WAALS L equazione di stato dei gas erfetti si uò alicare solo arossimativamente ai gas reali, er > C e ressioni non elevate. Per un gas reale la legge valida in generale è una serie di otenze: B C D nr () v v v dove v/n è il volume occuato da una mole. L esressione () si chiama sviluo del viriale. Il raorto /nr si chiama fattore di comressibilità. Molte equazioni sono state rooste come equazioni di stato arossimate er gas reali. La iù usata è l equazione di an der Waals: a + ( v - b) r ( n ) () v dove a, b ed r sono costanti ositive variabili da gas a gas. Il termine b è il volume delle molecole contenute in una mole, er cui ( - b) v è il volume disonibile. Il termine a v invece tiene conto del fatto che er distanze non troo iccole le molecole si attraggono: la risultante delle forze che si esercitano su di una molecola da arte di quelle circostanti, distribuite uniformemente, fa sì che la molecola sia attratta in maniera uguale in tutte le direzioni. Per le molecole sulla suerficie del reciiente tale forza è diretta solo l interno del gas. Per molecole su una suerficie S la forza F è roorzionale a ρ roorzionale a /v. Si one quindi (vedi figura), er cui è anche F S a v e la ρ ρ F S ρ ressione sentita dal gas è + a v 4
15 5 Le isoterme () riortate nel iano, sono mostrate in figura. Sotto C le curve resentano un massimo e un minimo relativo. La differenza delle ascisse corrisondenti (P e ) va aumentando al diminuire della temeratura. Per C i due unti di massimo e minimo vengono a coincidere e la curva resenta un flesso a tangente orizzontale. Nel unto di flesso (C) si ha: 0 0 Si ha quindi: ( ) ( ) + 0 6a b r 0 a b r v v v v v che assieme alla () forniscono: C 3 C a v 3 b v C C C C 3 8 r v La determinazione delle variabili termodinamiche del unto critico ermette quindi di dedurre le tre costanti a, b ed r.
16 EUAZIONE DI CLAUSIUS-CLAPEYRON Consideriamo un sistema costituito da due fasi di una sostanza in equilibrio tra loro (ad esemio liquido e vaore). Sia λ il calore latente alla temeratura e λ+dλ quello alla temeratura +d. Comiamo il ciclo ABB A. Comressione A B a temeratura. Il sistema cede il calore - mλ. rasformazione infinitesima B B a volume costante B ; temeratura (+d) e ressione (+d). 3 rasformazione isoterma B A a temeratura +d; il calore assorbito è m(λ +d λ). rasformazione infinitesima A A a volume costante A. C +d B A B A B A C +d Se durante BB e A A il sistema non scambia calore il ciclo è equivalente a un ciclo di Carnot; il rendimento è quindi dl η ass + d Il lavoro comiuto durante il ciclo è dato dall area del traezio ABB A, ed è (a meno di infinitesimi di ordine sueriore) che risulta essere dl ( ) d A B ( A B) d ( A B) d m( λ + dλ) mλ d Indicando con v/m il volume dell unità di massa, si ottiene la relazione 6
17 d λ v ( A vb) d conosciuta come equazione di Clausius-Claeyron. 7
18 8 POENZIALI ERMODINAMICI Esistono delle funzioni termodinamiche che consentono di ricavare mediante oerazioni di derivazione tutte le informazioni termodinamiche relative al sistema. Esse sono, suonendo che gli scambi di energia non termica siano costituiti solo da lavoro di ressioni: Energia interna: P S U () Entalia: S P U H + () Energia libera di Helmoltz: S U F (3) Funzione di Gibbs: P F S P U S H G + + (4) Dalla () si ottiene: P U S U S (5) Derivando la rima delle (5) risetto a e la seconda risetto a S si ottiene: S S P (6) che è una delle equazioni di Maxwell. Le altre si ricavano in modo analogo: P S S P (7) P S (8) P P S (9)
19 Per mezzo dei P si ossono esrimere le condizioni di equilibrio di un sistema soggetto alle iù imortanti trasformazioni. La disuguaglianza di Clausius è: ds δ (0) a) rasformazioni con e U costanti cos t δl 0 Per iotesi U0; dal I rinciio D segue: δ du + δl 0 quindi la trasformazione è anche adiabatica e ds0 o ds>0. Se lo stato del sistema è quello di entroia massima non è ossibile alcuna trasformazione comatibile con e U costanti. b) rasformazioni con e costanti Essendo costante, si ha che sostituito nella (0) da δ L Pd 0 δ du ds du ovvero, essendo costante e quindi d0 d 0 ( U S) df 0 Lo stato di equilibrio er un sistema soggetto a trasformazioni isoterme e isocore è quello er il quale l energia libera di Helmoltz assume valore minimo. 9
20 c) rasformazioni con e P costanti Dal I rinciio D si ha: δ du + δl du + Pd Sostituendo nella (0) ds Pd + du ovvero du ds + Pd 0 Essendo e P costanti si hanno d e dp nulli, e quindi l esressione sora diventa d ( U S + P) dg 0 Lo stato di equilibrio er un sistema soggetto a trasformazioni isoterme e isobare è quello er il quale la funzione di Gibbs assume valore minimo. 0
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: dv dp. dv dt. nrt dt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
Lezione 10 Termodinamica
 rgomenti della lezione: relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot Lezione 0 ermodinamica secondo riiio della termodinamica Gas ideali Un gas
rgomenti della lezione: relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot Lezione 0 ermodinamica secondo riiio della termodinamica Gas ideali Un gas
Lezione 10 Termodinamica
 rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
Lezione Trasformazioni termodinamiche
 Lezione rasformazioni termodinamiche Adiabatica; Isocora; Isobara; Isoterma; Energia interna costante; Adiabatica Consideriamo una trasformazione che orti il sistema dallo stato di equilibrio 1 allo stato
Lezione rasformazioni termodinamiche Adiabatica; Isocora; Isobara; Isoterma; Energia interna costante; Adiabatica Consideriamo una trasformazione che orti il sistema dallo stato di equilibrio 1 allo stato
Esercizi svolti di termodinamica applicata
 0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica Mod. 2 CHIMICA FISICA. Lezione 3 TRASFORMAZIONI DEL SISTEMA
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. CHIMICA FISICA Lezione 3 Anno Accademico 00-0 Docente: Dimitrios Fessas RASFORMAZIONI DEL SISEMA i. RASFORMAZIONI
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. CHIMICA FISICA Lezione 3 Anno Accademico 00-0 Docente: Dimitrios Fessas RASFORMAZIONI DEL SISEMA i. RASFORMAZIONI
Complementi di Termologia. III parte
 Prof. Michele Giugliano (Dicembre 00) Comlementi di Termologia. III arte N. 3. - Lavoro nelle trasformazioni. In generale se un gas, soggetto ad una variazione della ressione, varia il volume, esso comie
Prof. Michele Giugliano (Dicembre 00) Comlementi di Termologia. III arte N. 3. - Lavoro nelle trasformazioni. In generale se un gas, soggetto ad una variazione della ressione, varia il volume, esso comie
= 20 C, dopo aver rappresentato il ciclo nel diagramma di Clapeyron, il lavoro L
 Partendo dallo stato iniziale, un gas erfetto monoatomico comie il ciclo raggiungendo successivamente gli stati intermedi, e e tornando oi dallo stato nello stato iniziale. Il ciclo è costituito da: un
Partendo dallo stato iniziale, un gas erfetto monoatomico comie il ciclo raggiungendo successivamente gli stati intermedi, e e tornando oi dallo stato nello stato iniziale. Il ciclo è costituito da: un
Macchina termica ideale (di Carnot)
 Macchina termica ideale (di Carnot) La macchina di Carnot è formata da un ciclo in un gas perfetto, costituito da due trasformazioni isoterme (ab e dc in figura) e due adiabatiche (bc e da in figura).
Macchina termica ideale (di Carnot) La macchina di Carnot è formata da un ciclo in un gas perfetto, costituito da due trasformazioni isoterme (ab e dc in figura) e due adiabatiche (bc e da in figura).
Termologia. Paolo Bagnaia - CTF Esercizi di termologia e termodinamica 1
 ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
Calcolare in quanto tempo uno scaldabagno da 60 litri porta il suo contenuto
 lcuni esemi. Un coro di massa m1kg assorbe una quantità di calore 30cal aumentando la sua temeratura di 10 C. uale sarà il suo calore secifico? uale sarà la sua caacità termica? Calcolare in quanto temo
lcuni esemi. Un coro di massa m1kg assorbe una quantità di calore 30cal aumentando la sua temeratura di 10 C. uale sarà il suo calore secifico? uale sarà la sua caacità termica? Calcolare in quanto temo
IL CICLO DI CARNOT. Scambi di energia durante il ciclo
 IL CICLO DI CNO Consideriamo un gas ideale, contenuto nel solito cilindro, che compie un ciclo di 4 trasformazioni reversibili (2 isoterme + 2 adiabatiche) rappresentate nel piano -p come in figura. cambi
IL CICLO DI CNO Consideriamo un gas ideale, contenuto nel solito cilindro, che compie un ciclo di 4 trasformazioni reversibili (2 isoterme + 2 adiabatiche) rappresentate nel piano -p come in figura. cambi
Il secondo principio della Termodinamica
 Il secondo principio della ermodinamica non tutte le trasformazioni sono possibili (es.: passaggio di calore, cascata, attrito, espansione libera) le trasformazioni naturali sono irreversibili ed avvengono
Il secondo principio della ermodinamica non tutte le trasformazioni sono possibili (es.: passaggio di calore, cascata, attrito, espansione libera) le trasformazioni naturali sono irreversibili ed avvengono
LAVORO DI UN GAS. Espansione di un gas a pressione costante V A V B
 LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
Figura 1 Trasformazione proibita dal Secondo Principio
 ENUNCIATO DEL SECONDO PRINCIPIO DELLA TERMODINAMICA Si dice sorgente di calore o serbatoio di calore alla temperatura θ un corpo che si trovi uniformemente alla temperatura θ e sia in condizioni di scambiare
ENUNCIATO DEL SECONDO PRINCIPIO DELLA TERMODINAMICA Si dice sorgente di calore o serbatoio di calore alla temperatura θ un corpo che si trovi uniformemente alla temperatura θ e sia in condizioni di scambiare
Entalpia. L'entalpia è una funzione di stato ed è una grandezza estensiva. dh=du+pdv+vdp --> du+pdv = dh - Vdp
 Entalpia Si definisce entalpia la grandezza H ( 1 H = U + pv L'entalpia è una funzione di stato ed è una grandezza estensiva. Differenziando la (1) si ha dh=du+pdv+vdp --> du+pdv = dh - Vdp In una generica
Entalpia Si definisce entalpia la grandezza H ( 1 H = U + pv L'entalpia è una funzione di stato ed è una grandezza estensiva. Differenziando la (1) si ha dh=du+pdv+vdp --> du+pdv = dh - Vdp In una generica
Trasformazione isobara
 Trasformazione isobara Q DU Il calore immesso diventa: - avoro - Aumento di temperatura Si mantiene costante: egge: Calore: avoro: a pressione 1 a legge di Gay-ussac: V/T=cost Q = c p n DT = p DV Grafico
Trasformazione isobara Q DU Il calore immesso diventa: - avoro - Aumento di temperatura Si mantiene costante: egge: Calore: avoro: a pressione 1 a legge di Gay-ussac: V/T=cost Q = c p n DT = p DV Grafico
Approfondimenti. Rinaldo Rui. ultima revisione: 29 maggio Secondo Principio della Termodinamica
 Approfondimenti Rinaldo Rui ultima revisione: 29 maggio 209 3 Secondo Principio della Termodinamica 3.5 Lezione #3 3.5.3 Enunciato di Caratheodory (909) e Curve Isoentropiche La trattazione completa e
Approfondimenti Rinaldo Rui ultima revisione: 29 maggio 209 3 Secondo Principio della Termodinamica 3.5 Lezione #3 3.5.3 Enunciato di Caratheodory (909) e Curve Isoentropiche La trattazione completa e
Prova scritta del 27 novembre 2018
 Prova scritta del 27 novembre 2018 1 Un reciiente della caacità di 1.00 L e contenente un gas A alla ressione di 10.0 kpa viene connesso ad un altro reciiente avente il volume di 3.00 L con all interno
Prova scritta del 27 novembre 2018 1 Un reciiente della caacità di 1.00 L e contenente un gas A alla ressione di 10.0 kpa viene connesso ad un altro reciiente avente il volume di 3.00 L con all interno
Macchine termiche: ciclo di Carnot
 Macchine termiche: ciclo di Carnot Una macchina termica (o motore termico) è un dispositivo che scambia calore con l ambiente (attraverso un fluido motore) producendo lavoro in modo continuo, tramite un
Macchine termiche: ciclo di Carnot Una macchina termica (o motore termico) è un dispositivo che scambia calore con l ambiente (attraverso un fluido motore) producendo lavoro in modo continuo, tramite un
Termodinamica. by R. Pizzoferrato
 ermodinamica Comletiamo il quadro dei fenomeni fisici: cambiamenti di stato? dove finisce l energia ersa in meccanica? nuove grandezze fisiche: emeratura, Calore, ecc Definiamo Sistema ermodinamico: arte
ermodinamica Comletiamo il quadro dei fenomeni fisici: cambiamenti di stato? dove finisce l energia ersa in meccanica? nuove grandezze fisiche: emeratura, Calore, ecc Definiamo Sistema ermodinamico: arte
Esercitazione 8. Soluzione Il rendimento di una macchina di Carnot in funzione delle temperature è: η = 1 T 2 T 1 = = 60%
 Esercitazione 8 Esercizio 1 - Macchina di arnot Una macchina di arnot assorbe una certa quantità di calore Q 1 da una sorgente a temperatura T 1 e cede calore Q 2 ad una seconda sorgente a temperatura
Esercitazione 8 Esercizio 1 - Macchina di arnot Una macchina di arnot assorbe una certa quantità di calore Q 1 da una sorgente a temperatura T 1 e cede calore Q 2 ad una seconda sorgente a temperatura
Macchine termiche: ciclo di Carnot
 Macchine termiche: ciclo di Carnot Una macchina termica (o motore termico) è un dispositivo che scambia calore con l ambiente (attraverso un fluido motore) producendo lavoro in modo continuo, tramite un
Macchine termiche: ciclo di Carnot Una macchina termica (o motore termico) è un dispositivo che scambia calore con l ambiente (attraverso un fluido motore) producendo lavoro in modo continuo, tramite un
Il primo principio della termodinamica
 Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Secondo principio della termodinamica
 Secondo principio della termodinamica Enunciato di Kelvin-Planck E impossibile realizzare una macchina termica ciclica che riesca a sollevare un peso, scambiando calore con un solo termostato, senza altri
Secondo principio della termodinamica Enunciato di Kelvin-Planck E impossibile realizzare una macchina termica ciclica che riesca a sollevare un peso, scambiando calore con un solo termostato, senza altri
Introduzione alle macchine termiche
 1 Introduzione alle macchine termiche In questa nota 1 introduciamo il concetto di macchina termica che oera con trasformazioni cicliche er trasformare calore in lavoro. In generale questo argomento viene
1 Introduzione alle macchine termiche In questa nota 1 introduciamo il concetto di macchina termica che oera con trasformazioni cicliche er trasformare calore in lavoro. In generale questo argomento viene
Significato microscopico della temperatura
 Significato microscopico della temperatura La temperatura è una misura dell energia cinetica traslazionale media delle molecole del gas, o, il che è lo stesso, della loro velocità quadratica media La velocità
Significato microscopico della temperatura La temperatura è una misura dell energia cinetica traslazionale media delle molecole del gas, o, il che è lo stesso, della loro velocità quadratica media La velocità
Il secondo principio della Termodinamica
 Il secondo principio della ermodinamica non tutte le trasformazioni sono possibili (es.: passaggio di calore, cascata, attrito, espansione libera) le trasformazioni naturali sono irreversibili ed avvengono
Il secondo principio della ermodinamica non tutte le trasformazioni sono possibili (es.: passaggio di calore, cascata, attrito, espansione libera) le trasformazioni naturali sono irreversibili ed avvengono
Fisica Generale A estensione principio di conservazione dell energia energia termica teoria cinetica dei gas 14. I Principio della Termodinamica
 Fisica Generale A 4. I Princiio della ermodinamica htt://camus.cib.unibo.it/2434/ December 3, 2 Primo Princiio e Moti Molecolari Il rimo rinciio della termodinamica è l estensione del rinciio di conservazione
Fisica Generale A 4. I Princiio della ermodinamica htt://camus.cib.unibo.it/2434/ December 3, 2 Primo Princiio e Moti Molecolari Il rimo rinciio della termodinamica è l estensione del rinciio di conservazione
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
SECONDO PRINCIPIO DELLA TERMODINAMICA I DUE ENUNCIATI DEL SECONDO PRINCIPIO DELLA TERMODINAMICA
 SECONDO PRINCIPIO DELLA TERMODINAMICA I DUE ENUNCIATI DEL SECONDO PRINCIPIO DELLA TERMODINAMICA Enunciato di Clausius: È impossibile realizzare una trasformazione il cui unico risultato sia quello di fare
SECONDO PRINCIPIO DELLA TERMODINAMICA I DUE ENUNCIATI DEL SECONDO PRINCIPIO DELLA TERMODINAMICA Enunciato di Clausius: È impossibile realizzare una trasformazione il cui unico risultato sia quello di fare
Cap 21- Entropia e II Legge della Termodinamica. Entropia
 N.Giglietto A.A. 2005/06- Entropia nell espansione libera - 1 Cap 21- Entropia e II Legge della Termodinamica Ci sono diversi modi di esprimere la II Legge della Termodinamica. Tutte stabiliscono una limitazione
N.Giglietto A.A. 2005/06- Entropia nell espansione libera - 1 Cap 21- Entropia e II Legge della Termodinamica Ci sono diversi modi di esprimere la II Legge della Termodinamica. Tutte stabiliscono una limitazione
Termodinamica classica e termodinamica chimica
 Termodinamica classica e termodinamica chimica Matteo Bonfanti 23 marzo 2015 Indice 1. Definizioni 3 1.1. Il sistema termodinamico........................... 3 1.2. Lo stato del sistema e le trasformazioni
Termodinamica classica e termodinamica chimica Matteo Bonfanti 23 marzo 2015 Indice 1. Definizioni 3 1.1. Il sistema termodinamico........................... 3 1.2. Lo stato del sistema e le trasformazioni
Secondo principio della termodinamica: perché????
 Secondo principio della termodinamica: perché???? Primo principio: bilancio degli scambi energetici con l ambiente, ma non dà nessuna spiegazione del fatto che in natura alcune trasformazioni procedono
Secondo principio della termodinamica: perché???? Primo principio: bilancio degli scambi energetici con l ambiente, ma non dà nessuna spiegazione del fatto che in natura alcune trasformazioni procedono
dz dx + dy y x x y se z e una funzione di due generiche variabili x ed y ossia se z= a prescindere dal fatto che le variabili x ed y
 Richiami matematici se z e una funzione di due generiche variabili x ed y ossia se z= zxy (, ) a rescindere dal fatto che le variabili x ed y siamo indiendenti o siano diendenti da altre variabili il differenziale
Richiami matematici se z e una funzione di due generiche variabili x ed y ossia se z= zxy (, ) a rescindere dal fatto che le variabili x ed y siamo indiendenti o siano diendenti da altre variabili il differenziale
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
IX ESERCITAZIONE - 16 Dicembre 2013
 IX ESERCITAZIONE - 16 Dicembre 2013 I. RENDIMENTO Un gas perfetto monoatomico compie il ciclo schematicamente mostrato in figura, attraverso trasformazioni reversibili. I valori di pressione e volume sono
IX ESERCITAZIONE - 16 Dicembre 2013 I. RENDIMENTO Un gas perfetto monoatomico compie il ciclo schematicamente mostrato in figura, attraverso trasformazioni reversibili. I valori di pressione e volume sono
Macchine termiche e frigoriferi
 Macchine termiche e frigoriferi Una macchina termica grazie ad una sequenza di trasformazioni termodinamiche di una data sostanza, produce lavoro utilizzabile. Una macchina lavora su di un ciclo di trasformazioni
Macchine termiche e frigoriferi Una macchina termica grazie ad una sequenza di trasformazioni termodinamiche di una data sostanza, produce lavoro utilizzabile. Una macchina lavora su di un ciclo di trasformazioni
La Pressione (1) La Pressione è una grandezza scalare ed in un fluido rappresenta una proprietà meccanica dello stesso.
 La Pressione (1) Trasformazioni termodamiche del Gas Ideale - 1 ds La Pressione è una grandezza scalare ed un fluido raresenta una rorietà meccanica dello stesso. d n F df ds = 1 = mg h (1) = ds ds n π
La Pressione (1) Trasformazioni termodamiche del Gas Ideale - 1 ds La Pressione è una grandezza scalare ed un fluido raresenta una rorietà meccanica dello stesso. d n F df ds = 1 = mg h (1) = ds ds n π
Applicazione del principio di conservazione dell energia a sistemi aventi un gran numero di particelle.
 PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
Dotto Formazione a tutto tondo Rapid Training 2018 Corso di Fisica. Argomento 11 Termodinamica
 Dotto Formazione a tutto tondo Rapid Training 2018 Corso di Fisica Argomento 11 Termodinamica 2 L energia interna dei gas L energia totale di tutte le molecole del sistema: e. cinetica traslazionale e.
Dotto Formazione a tutto tondo Rapid Training 2018 Corso di Fisica Argomento 11 Termodinamica 2 L energia interna dei gas L energia totale di tutte le molecole del sistema: e. cinetica traslazionale e.
Conseguenze del teorema di Carnot
 Conseguenze del teorema di Carnot Tutte le macchine reversibili che lavorano tra le stesse sorgenti alle temperature T 1 e T 2 hanno rendimento uguale; qualsiasi altra macchina che lavori tra le stesse
Conseguenze del teorema di Carnot Tutte le macchine reversibili che lavorano tra le stesse sorgenti alle temperature T 1 e T 2 hanno rendimento uguale; qualsiasi altra macchina che lavori tra le stesse
EQUILIBRIO TERMODINAMICO
 LA TERMODINAMICA EQUILIBRIO TERMODINAMICO TRASFORMAZIONI QUASISTATICHE Le trasformazioni quasistatiche Le trasformazioni termodinamiche si possono rappresentare sul piano pressione-volume ogni punto del
LA TERMODINAMICA EQUILIBRIO TERMODINAMICO TRASFORMAZIONI QUASISTATICHE Le trasformazioni quasistatiche Le trasformazioni termodinamiche si possono rappresentare sul piano pressione-volume ogni punto del
l entropia è una proprietà termostatica l entropia è definita per trasformazioni reversibili come:
 LIMII DEL PRIMO PRINCIPIO DELLA ERMODINAMICA:. non viene indicato il verso delle trasformazioni: tutte le trasformazioni che rispettino il primo principio non sono in realtà egualmente possibili, come
LIMII DEL PRIMO PRINCIPIO DELLA ERMODINAMICA:. non viene indicato il verso delle trasformazioni: tutte le trasformazioni che rispettino il primo principio non sono in realtà egualmente possibili, come
La funzione energia interna nei gas ideali. dv =( V p ) dp+( V. T ) p
 La funzione energia interna nei gas ideali Si vuole dimostrare che er quei gas i cui stati sono descritti dall'equazione =nr l' energia interna è funzione solo della temeratura. In altri termini si verificherà
La funzione energia interna nei gas ideali Si vuole dimostrare che er quei gas i cui stati sono descritti dall'equazione =nr l' energia interna è funzione solo della temeratura. In altri termini si verificherà
La macchina termica. Marina Cobal - Dipt.di Fisica - Universita' di Udine 1
 La macchina termica Universita' di Udine 1 La macchina termica Un insieme di trasformazioni che parta da uno stato e vi ritorni costituisce una macchina termica un ciclo termodinamico Universita' di Udine
La macchina termica Universita' di Udine 1 La macchina termica Un insieme di trasformazioni che parta da uno stato e vi ritorni costituisce una macchina termica un ciclo termodinamico Universita' di Udine
Tonzig La fisica del calore
 0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
Lezione 4: Termodinamica. Seminario didattico
 Lezione 4: Termodinamica Seminario didattico Esercizio n 1 Un gas all interno di una camera percorre il ciclo mostrato in figura. Si determini il calore totale fornito al sistema durante la trasformazione
Lezione 4: Termodinamica Seminario didattico Esercizio n 1 Un gas all interno di una camera percorre il ciclo mostrato in figura. Si determini il calore totale fornito al sistema durante la trasformazione
A1. Soluzione. Ilcalore Q per unita di massa e negativo (ceduto all esterno) e vale:
 A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
Fisica Generale B 15. II Principio della Termodinamica
 Fisica Generale 15. II Principio della ermodinamica http://campus.cib.unibo.it/2435/ February 28, 2017 Irreversibilità Il I principio della termodinamica non dà informazioni sul verso in cui procedono
Fisica Generale 15. II Principio della ermodinamica http://campus.cib.unibo.it/2435/ February 28, 2017 Irreversibilità Il I principio della termodinamica non dà informazioni sul verso in cui procedono
Processi reversibili e irreversibili
 Processi reversibili e irreversibili Trasformazioni reversibili: la direzione della trasformazione può essere invertita, cambiando di poco le condizioni esterne. Esempio: gas compresso da un pistone. Trasformazioni
Processi reversibili e irreversibili Trasformazioni reversibili: la direzione della trasformazione può essere invertita, cambiando di poco le condizioni esterne. Esempio: gas compresso da un pistone. Trasformazioni
Deduzione della legge dell azione di massa per via cinetica
 L equilibrio chimico Reazioni reversibili o di equilibrio: reazioni che ossono avvenire sia in senso diretto che in senso inverso Deduzione della legge dell azione di massa er via cinetica A + B C + D
L equilibrio chimico Reazioni reversibili o di equilibrio: reazioni che ossono avvenire sia in senso diretto che in senso inverso Deduzione della legge dell azione di massa er via cinetica A + B C + D
Proprietà matematiche. Relazioni differenziali Quadrato termodinamico Esempi E ancora esempi
 Prorietà matematiche Relazioni differenziali Quadrato termodinamico Esemi E ancora esemi 1 Relazioni differenziali (1) Sommario delle rorietà matematiche di una generica funzione variabili z( x, ) di due
Prorietà matematiche Relazioni differenziali Quadrato termodinamico Esemi E ancora esemi 1 Relazioni differenziali (1) Sommario delle rorietà matematiche di una generica funzione variabili z( x, ) di due
Termodinamica. Ireneo Kikic. DICAMP - SFLAB - University of Trieste
 ermodinamica Ireneo Kikic DIAM - FLAB - University of rieste IRENEO.KIKI@DIAM.UNI.I rimo principio della termodinamica alore e lavoro solo quando sono trasferiti tra i corpi Energia uò essere convertita
ermodinamica Ireneo Kikic DIAM - FLAB - University of rieste IRENEO.KIKI@DIAM.UNI.I rimo principio della termodinamica alore e lavoro solo quando sono trasferiti tra i corpi Energia uò essere convertita
Macchine Termiche: Guida schematica agli argomenti trattati a lezione
 Macchine Termiche: Guida schematica agli argomenti trattati a lezione Dott. Corso Fisica I per Chimica Industriale a.a. 2014-2015 Testo di riferimento: (FLMP) Ferrari, Luci, Mariani, Pellissetto, Fisica
Macchine Termiche: Guida schematica agli argomenti trattati a lezione Dott. Corso Fisica I per Chimica Industriale a.a. 2014-2015 Testo di riferimento: (FLMP) Ferrari, Luci, Mariani, Pellissetto, Fisica
Enunciato di Kelvin-Plank
 ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
Lezione VII - 11/03/2003 ora 14:30-16:30 - Entropia, trasformazione isoentropica, pompe di calore - Originale di Unetti Matteo
 Lezione VII - /03/003 ora 4:30-6:30 - Entroia, trasformazione isoentroica, ome di calore - Originale di Unetti Matteo Entroia Si uò introdurre una nuoa funzione di stato, l Entroia, definita così come
Lezione VII - /03/003 ora 4:30-6:30 - Entroia, trasformazione isoentroica, ome di calore - Originale di Unetti Matteo Entroia Si uò introdurre una nuoa funzione di stato, l Entroia, definita così come
Il secondo principio della termodinamica
 Il secondo principio della termodinamica 1 Il secondo principio Il primo principio della termodinamica introduce la funzione energia interna, U, che ci permette di dire se una certa trasformazione è possibile:
Il secondo principio della termodinamica 1 Il secondo principio Il primo principio della termodinamica introduce la funzione energia interna, U, che ci permette di dire se una certa trasformazione è possibile:
Lezione 5: Termodinamica. Seminario didattico
 Lezione 5: Termodinamica Seminario didattico Esercizio n 1 Ad una mole di gas monoatomico viene fatto percorrere il ciclo mostrato in figura il processo bc è una espansione adiabatica; p B =1.03 bar, V
Lezione 5: Termodinamica Seminario didattico Esercizio n 1 Ad una mole di gas monoatomico viene fatto percorrere il ciclo mostrato in figura il processo bc è una espansione adiabatica; p B =1.03 bar, V
ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA
 ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA Esercizio : Scelta ottimale di un monoolista e imoste Si consideri un monoolista con la seguente funzione di costo totale: C ( ) = 400 + + 0 0 La domanda
ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA Esercizio : Scelta ottimale di un monoolista e imoste Si consideri un monoolista con la seguente funzione di costo totale: C ( ) = 400 + + 0 0 La domanda
L entropia. Marina Cobal - Dipt.di Fisica - Universita' di Udine 1
 L entropia Universita' di Udine 1 L entropia secondo Clausius Prendiamo un ciclo reversibile qualunque ricopriamolo con una rete di adiabatiche i trattini del ciclo li sostituiamo con trattini di isoterme
L entropia Universita' di Udine 1 L entropia secondo Clausius Prendiamo un ciclo reversibile qualunque ricopriamolo con una rete di adiabatiche i trattini del ciclo li sostituiamo con trattini di isoterme
ESERCIZI DI TERMODINAMICA
 ESERCIZI DI TERMODINAMICA Un otore a cobustione eroga una otenza effettiva di k con un rendiento totale del 8% Il cobustibile utilizzato ha un otere calorifico inferiore di 000 k Calcolare la assa di cobustibile
ESERCIZI DI TERMODINAMICA Un otore a cobustione eroga una otenza effettiva di k con un rendiento totale del 8% Il cobustibile utilizzato ha un otere calorifico inferiore di 000 k Calcolare la assa di cobustibile
Tonzig La fisica del calore
 4 onzig La fisica del calore batiche si trova 2 / = / 4, il che vuol dire che la [F] si riduce alla [E]. Ne deriva che, nello secifico caso di un gas erfetto, il rendimento di un ciclo di Carnot è [G]
4 onzig La fisica del calore batiche si trova 2 / = / 4, il che vuol dire che la [F] si riduce alla [E]. Ne deriva che, nello secifico caso di un gas erfetto, il rendimento di un ciclo di Carnot è [G]
E' COSTITUITO, IN SUCCESSIONE CICLICA, DALLE SEGUENTI TRASFORMAZIONI:
 G - CICLO DI CARNOT CICLO DI CARNOT E' COSTITUITO, IN SUCCESSIONE CICLICA, DALLE SEGUENTI TRASFORMAZIONI: 1. ESPANSIONE ISOTERMA 2. ESPANSIONE ADIABATICA 3. COMPRESSIONE ISOTERMA 4. COMPRESSIONE ADIABATICA
G - CICLO DI CARNOT CICLO DI CARNOT E' COSTITUITO, IN SUCCESSIONE CICLICA, DALLE SEGUENTI TRASFORMAZIONI: 1. ESPANSIONE ISOTERMA 2. ESPANSIONE ADIABATICA 3. COMPRESSIONE ISOTERMA 4. COMPRESSIONE ADIABATICA
il ciclo di Ericsson (1853) caratterizzato da due isoterme e due isobare; il ciclo di Reitlinger (1873) con due isoterme e due politropiche.
 16 Il ciclo di Stirling Il coefficiente di effetto utile per il ciclo frigorifero di Carnot è, in base alla (2.9): T min ɛ =. (2.31) T max T min Il ciclo di Carnot è il ciclo termodinamico che dà il maggior
16 Il ciclo di Stirling Il coefficiente di effetto utile per il ciclo frigorifero di Carnot è, in base alla (2.9): T min ɛ =. (2.31) T max T min Il ciclo di Carnot è il ciclo termodinamico che dà il maggior
I principi della termodinamica
 I principi della termodinamica dalla pratica alla teoria di Ettore Limoli Convenzione sui segni di Q e di L Calore assorbito dal sistema: Q > 0 Calore ceduto dal sistema: Q < 0 Lavoro fatto dal sistema:
I principi della termodinamica dalla pratica alla teoria di Ettore Limoli Convenzione sui segni di Q e di L Calore assorbito dal sistema: Q > 0 Calore ceduto dal sistema: Q < 0 Lavoro fatto dal sistema:
2) Primo principio della Termodinamica
 2) Primo rinciio della Termodinamica Anteatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica delle
2) Primo rinciio della Termodinamica Anteatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica delle
PRIMI ELEMENTI DI TERMODINAMICA. La termodinamica studia le leggi con cui i sistemi scambiano (cedono e ricevono) energia con l ambiente.
 PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
FISICA. isoterma T f. T c. Considera il ciclo di Stirling, in cui il fluido (=sistema) è considerato un gas ideale.
 Serie 10: ermodinamica X FISICA II liceo Esercizio 1 Ciclo di Carnot Considera il ciclo di Carnot, in cui il fluido (=sistema) è considerato un gas ideale. Si considerano inoltre delle trasformazioni reversibili.
Serie 10: ermodinamica X FISICA II liceo Esercizio 1 Ciclo di Carnot Considera il ciclo di Carnot, in cui il fluido (=sistema) è considerato un gas ideale. Si considerano inoltre delle trasformazioni reversibili.
Fisica 1 Anno Accademico 2011/2012
 Matteo Luca Ruggiero DISAT@Politecnico di Torino Anno Accademico 2011/2012 (4 Giugno - 8 Giugno 2012) Sintesi Abbiamo formulato il primo principio della termodinamica che regola gli scambi di calore, la
Matteo Luca Ruggiero DISAT@Politecnico di Torino Anno Accademico 2011/2012 (4 Giugno - 8 Giugno 2012) Sintesi Abbiamo formulato il primo principio della termodinamica che regola gli scambi di calore, la
1 TERMODINAMICA DELLE TURBINE A GAS 1.1 INTRODUZIONE
 TERMODINAMICA DELLE TURBINE A GAS. INTRODUZIONE Il ciclo termodinamico su cui è imostato il funzionamento delle turbine a gas è il ciclo Bryton, la cui analisi orta alla determinazione di due arametri
TERMODINAMICA DELLE TURBINE A GAS. INTRODUZIONE Il ciclo termodinamico su cui è imostato il funzionamento delle turbine a gas è il ciclo Bryton, la cui analisi orta alla determinazione di due arametri
SISTEMA TERMODINAMICO STATO TERMODINAMICO
 SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
Legge del gas perfetto e termodinamica
 Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Sistema termodinamico: porzione di universo separata da tutto il resto del mondo. Ambiente esterno confini del sistema
 Termodinamica: concetti di base Sistema termodinamico: porzione di universo separata da tutto il resto del mondo Ambiente esterno confini del sistema sistema Stato del sistema: definito dal valore delle
Termodinamica: concetti di base Sistema termodinamico: porzione di universo separata da tutto il resto del mondo Ambiente esterno confini del sistema sistema Stato del sistema: definito dal valore delle
Corso di Impianti Dispense a cura di Simone Lugli Realizzate a favore degli allievi dell Istituto C. Ferrini di Verbania. 1. Il teorema di Bernoulli 2
 Indice 1. Il teorema di Bernoulli. Strumenti er misure su tubazioni: generalità e metodi di utilizzo 3.1. Il Tubo di Pitot 3.. Il venturimetro 4.3 Il boccaglio 5.4 Il diaframma 6.5. ltri strumenti er la
Indice 1. Il teorema di Bernoulli. Strumenti er misure su tubazioni: generalità e metodi di utilizzo 3.1. Il Tubo di Pitot 3.. Il venturimetro 4.3 Il boccaglio 5.4 Il diaframma 6.5. ltri strumenti er la
ma come si puo misurare una grandezza fisica della quale si postula l esistenza, ma di cui non si conosce nulla? chiaramente misurarla direttamente
 Princiio zero della termodinamica gli stati di equilibrio termico godono della articolare rorieta che i sistemi all equilibrio termico tra loro condividono una stessa grandezza fisica, detta temeratura
Princiio zero della termodinamica gli stati di equilibrio termico godono della articolare rorieta che i sistemi all equilibrio termico tra loro condividono una stessa grandezza fisica, detta temeratura
Trasformazioni reversibili e irreversibili:
 rasformazioni reversibili e irreversibili: Esempi di trasformazioni irreversibili: - un gas compresso si espande spontaneamente in uno spazio vuoto - la neve fonde al sole - un farmaco si scioglie nel
rasformazioni reversibili e irreversibili: Esempi di trasformazioni irreversibili: - un gas compresso si espande spontaneamente in uno spazio vuoto - la neve fonde al sole - un farmaco si scioglie nel
5. Energia libera e potenziale chimico
 5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
TEORIA CINETICA DEI GAS
 TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
I PRINCIPI DELLA TERMODINAMICA
 Il diagramma - I RINCII DLLA TRMODINAMICA Un sistema termodinamico è una quantità di materia racchiusa all interno di una superficie chiusa, che può scambiare energia con l ambiente esterno. Lo stato di
Il diagramma - I RINCII DLLA TRMODINAMICA Un sistema termodinamico è una quantità di materia racchiusa all interno di una superficie chiusa, che può scambiare energia con l ambiente esterno. Lo stato di
Soluzioni del problema adattato
 Soluzioni del problema 1412 adattato Tipo di problema fornito per la parte di termodinamica nella prova scritta Sommario Riportiamo tutte le possibili soluzioni del problema, anche con considerazioni didattiche
Soluzioni del problema 1412 adattato Tipo di problema fornito per la parte di termodinamica nella prova scritta Sommario Riportiamo tutte le possibili soluzioni del problema, anche con considerazioni didattiche
Temperatura e Calore (parte 3) 07/05/15 Macchine termiche e Secondo Principio della Termodinamica
 Temperatura e Calore (parte 3) 1 Macchine Termiche o Le prima macchine termiche (a vapore) furono inventate nel 17 secolo. o Intorno al 2000 la più recente innovazione sui motori termici: il COMMON RAIL
Temperatura e Calore (parte 3) 1 Macchine Termiche o Le prima macchine termiche (a vapore) furono inventate nel 17 secolo. o Intorno al 2000 la più recente innovazione sui motori termici: il COMMON RAIL
Appunti di Meccanica dei Fluidi M. Tregnaghi
 Aunti di Meccanica dei Fluidi 3. STATICA: PRESSIONE E LEE IDROSTATICA PRESSIONE IN UN PUNTO La ressione è il modulo della forza esercitata da un fluido er unità di suerficie che agisce in direzione normale
Aunti di Meccanica dei Fluidi 3. STATICA: PRESSIONE E LEE IDROSTATICA PRESSIONE IN UN PUNTO La ressione è il modulo della forza esercitata da un fluido er unità di suerficie che agisce in direzione normale
Fisica dell Atmosfera e del Clima
 Università degli studi di rento Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile, Ambientale e Meccanica Fisica dell Atmosfera e del
Università degli studi di rento Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile, Ambientale e Meccanica Fisica dell Atmosfera e del
Capacità termica e calore specifico
 Calori specifici Capacità termica e calore specifico Il calore si trasferisce da un corpo ad un altro fintanto che i corpi sono a temperature differenti. Potremo scrivere quindi: Q = C ΔT = C (T f T i
Calori specifici Capacità termica e calore specifico Il calore si trasferisce da un corpo ad un altro fintanto che i corpi sono a temperature differenti. Potremo scrivere quindi: Q = C ΔT = C (T f T i
È quella parte della termologia che studia le trasformazioni di calore in lavoro e viceversa.
 EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
Termodinamica. secondo principio. ovvero. principio della impossibilità
 ermodinamica secondo principio ovvero principio della impossibilità Il verso privilegiato delle trasformazioni di energia: non si crea energia dal nulla Il primo principio può essere enunciato sotto forma
ermodinamica secondo principio ovvero principio della impossibilità Il verso privilegiato delle trasformazioni di energia: non si crea energia dal nulla Il primo principio può essere enunciato sotto forma
Calore, lavoro e trasformazioni termodinamiche (1)
 Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
 La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
Formulazione quantitativa del secondo principio della termodinamica: R macchina di Carnot che lavora tra due sorgenti a temperature T 1 e T 2
 Formulazione quaniaiva del secondo principio della ermodinamica: EOREMA DI CARNO R macchina di Carno che lavora ra due sorgeni a emperaure e X macchina ermica che lavora ra le sesse sorgeni Dimosrazione
Formulazione quaniaiva del secondo principio della ermodinamica: EOREMA DI CARNO R macchina di Carno che lavora ra due sorgeni a emperaure e X macchina ermica che lavora ra le sesse sorgeni Dimosrazione
# STUDIO DELLA STABILITA COL CRITERIO DI NYQUIST#
 # STUIO ELLA STABILITA COL CRITERIO I NYQUIST# Sia il olinomio di variabile comlessa s : Q(s)=a n s n +a n-1 s n-1 + +a 1 s+a 0 (1) Tale olinomio si uo considerare, con riferimento al iano comlesso (iano
# STUIO ELLA STABILITA COL CRITERIO I NYQUIST# Sia il olinomio di variabile comlessa s : Q(s)=a n s n +a n-1 s n-1 + +a 1 s+a 0 (1) Tale olinomio si uo considerare, con riferimento al iano comlesso (iano
Quesiti di Fisica Generale
 Quesiti di Fisica Generale 2. Temodinamica prof. Domenico Galli, prof. Umberto Marconi 27 marzo 2012 I compiti scritti di esame del prof. D. Galli propongono 4 quesiti, sorteggiati individualmente per
Quesiti di Fisica Generale 2. Temodinamica prof. Domenico Galli, prof. Umberto Marconi 27 marzo 2012 I compiti scritti di esame del prof. D. Galli propongono 4 quesiti, sorteggiati individualmente per
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica Mod. 2 CHIMICA FISICA. Lezione 7
 Università egli stui i MILANO Facoltà i AGRARIA El. i Chimica e Chimica Fisica Mo. CHIMICA FIICA Lezione 7 Anno Accaemico 000-0 Docente: Dimitrios Fessas Prorietà i equilibrio ei sistemi a iù comonenti
Università egli stui i MILANO Facoltà i AGRARIA El. i Chimica e Chimica Fisica Mo. CHIMICA FIICA Lezione 7 Anno Accaemico 000-0 Docente: Dimitrios Fessas Prorietà i equilibrio ei sistemi a iù comonenti
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Secondo principio della termodinamica
 econdo principio della termodinamica Macchine termiche cicliche Macchine termiche: macchine che producono lavoro scambiando calore con opportune sorgenti i produce lavoro >0 che si ottiene a causa del
econdo principio della termodinamica Macchine termiche cicliche Macchine termiche: macchine che producono lavoro scambiando calore con opportune sorgenti i produce lavoro >0 che si ottiene a causa del
e la forza di Archimede è uguale al peso del fluido occupato: A = M b)il corpo scende di h, cui corrisponde una variazione di energia potenziale
 ) Meccanica Un sistema è comosto da un coro omogeneo di massa M e densità ρ e da una data quantità di luido (di densità minore ρ ) in cui il coro è immerso. Inizialmente (stato i) il coro è ermo, quindi
) Meccanica Un sistema è comosto da un coro omogeneo di massa M e densità ρ e da una data quantità di luido (di densità minore ρ ) in cui il coro è immerso. Inizialmente (stato i) il coro è ermo, quindi
CLASSI SECONDE Formulario (con esercizi) LEGGI DEI GAS
 CLASSI SECONDE Formulario con esercizi) LEGGI DEI GAS Germano D Abramo Versione 1.1 10/03/2016 N.B. Si invita a trovare errori e/o imrecisioni o a richiedere una stesura del testo iù semlice.) Trasformzioni
CLASSI SECONDE Formulario con esercizi) LEGGI DEI GAS Germano D Abramo Versione 1.1 10/03/2016 N.B. Si invita a trovare errori e/o imrecisioni o a richiedere una stesura del testo iù semlice.) Trasformzioni
Fisica dell Atmosfera e del Clima
 Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
