Spettroscopia di Risonanza Magnetica Nucleare (NMR)
|
|
|
- Feliciano Grande
- 6 anni fa
- Visualizzazioni
Transcript
1 È basata sulle interazioni tra la componente magnetica di una radiazione elettromagnetica, dell ordine delle radiofrequenze, con i nuclei delle molecole poste in un forte campo magnetico.
2 Permette di ottenere informazioni relative a: intorno del nucleo atomico (natura del gruppo funzionale) connettività tra gli atomi distanze tra gli atomi dinamica molecolare Principali applicazioni: determinazione strutturale dei composti organici (in fase gassosa, liquida, solida) studio della dinamica dei sistemi molecolari all'equilibrio diagnostica medica 2
3 Proprietà di spin dei nuclei atomici Caratteristiche nucleari: M = massa (protoni + neutroni) Z = numero atomico (protoni) I = numero quantico di spin (0, /2,, 3/2, 2.) Le particelle nucleari, protoni e neutroni, (come gli elettroni), sono dotate di spin. I nuclei che possiedono un numero dispari di protoni e un numero dispari di neutroni possiedono un momento angolare intrinseco p, o spin, che classicamente può essere associato alla rotazione del nucleo attorno a se stesso. P 3
4 Proprietà di spin dei nuclei atomici Il momento angolare p è quantizzato attraverso il numero quantico di spin nucleare I. Può avere valore intero o semintero (0, ½,, 3/2, 2.) a seconda dell isotopo ed è legato al numero di protoni e di neutroni che costituiscono il nucleo. Numero di protoni pari e numero di neutroni pari danno uno spin nucleare complessivo nullo ( I = 0 ) Alcuni nuclei con SPIN Nucleo Protoni non appaiati Z Neutroni non appaiati M (protoni + neutroni) Spin totale I H dispari 0 dispari /2 2 H dispari pari 3 P dispari 0 dispari /2 23 Na dispari 2 dispari 3/2 4 N dispari pari 3 C 0 pari dispari /2 9 F dispari 0 dispari /2 4
5 Analisi dei Medicinali I G. Poce Spettroscopia di Risonanza Magnetica Nucleare (NMR) Stati di spin nucleare Un nucleo con spin nucleare ( H, 3 C, 5 N, 9 F, 3 P, I = ½) è una carica che ruota sul proprio asse e per questo genera campi magnetici di debole intensità, comportandosi come un piccolo magnete. In assenza di perturbazioni esterne questi magneti si orientano in maniera casuale. 5
6 Stati di spin nucleare In presenza di un campo magnetico esterno (B 0 ) gli spin nucleari si allineano secondo due possibili orientazioni (stati di spin): parallela ed antiparallela. I=/2 B 0 /2 ħ z =/2 ħ mi =, 2 2 z = -/2 ħ Queste due orientazioni hanno diversa energia: orientazione parallela (α, I = +½) minore energia; orientazione antiparallela (β, I = -½) maggiore energia. In generale: un nucleo con spin nucleare (I 0), immerso in un campo magnetico esterno omogeneo, potrà assumere un numero di orientazioni (stati di spin) pari a 2I +. 6
7 Stati di spin nucleare La rotazione del nucleo produce un momento magnetico µ associato al momento angolare p tramite una costante di proporzionalità, γ (rapporto giromagnetico), che è caratteristica di ciascun nucleo: µ = γ p 7
8 energia Spettroscopia di Risonanza Magnetica Nucleare (NMR) Stati di spin nucleare I=/2, m I =/2, -/2 m I =-/2, B 0 In assenza di campo magnetico m I =/2, In presenza di campo magnetico La differenza di energia tra i due livelli energetici: h= costante di Plank ΔE = (hγ/2π) B 0 ΔE è proporzionale al campo magnetico
9 Stati di spin nucleare Una transizione dallo stato ad energia inferiore a quello ad energia superiore può essere promossa applicando una radiazione avente una frequenza esattamente uguale a quella richiesta per un dato campo magnetico applicato. Il valore di radiofrequenza è correlato con il campo magnetico secondo l equazione: = B 0 /2 Tale frequenza (frequenza di Larmor) dipende dal nucleo (attraverso il rapporto giromagnetico ) e dall intensità del campo magnetico applicato. 9
10 Risonanza Il protone possiede due livelli energetici (2I+=2). Si può fornire energia sottoforma di radiofrequenza (ν ) per promuovere la transizione tra questi 2 livelli energetici in un campo magnetico stazionario B 0 secondo l equazione: = B 0 /2 Fornendo al protone una frequenza di 00MHz in un campo magnetico B 0 di 2.35 tesla (T) esso risuona l energia viene assorbita dal protone che passa ad uno stato energetico superiore E m I = -/2, E E m I =/2, E 0 B 0 0
11 Risonanza Il protone possiede due livelli energetici (2I+=2). Si può fornire energia sottoforma di radiofrequenza (ν ) per promuovere la transizione tra questi 2 livelli energetici in un campo magnetico stazionario B 0 secondo l equazione: = B 0 /2 Fornendo al protone una frequenza di 00MHz in un campo magnetico B 0 di 2.35 tesla (T) esso risuona l energia viene assorbita dal protone che passa ad uno stato energetico superiore E m I = -/2, E E m I =/2, E 0 B 0
12 Cosa succede dopo che il sistema è stato irradiato? z x y 2
13 Cosa succede dopo che il sistema è stato irradiato? z Gli spin nucleari tornano alla situazione di equilibrio, attraverso una serie di processi noti come fenomeni di rilassamento, che permettono alla magnetizzazione totale di allinearsi al campo magnetico. Per effetto del rilassamento la componente della magnetizzazione nel piano xy si riduce sino ad annullarsi, e di conseguenza si riduce anche la corrente elettrica oscillante rivelata dalla bobina posta nell asse y. Questo è il segnale NMR. x y FID: Free Induction Decay Decadimento (decay) all equilibrio, libero (free) dall influenza del campo a rf ed indotto (induced) nella bobina 3
14 intensità intensità Spettroscopia di Risonanza Magnetica Nucleare (NMR) Il segnale che rappresenta il decadimento dell induzione magnetica in funzione del tempo può essere convertito, applicando la trasformata di Fourier, in un segnale in funzione della frequenza. f(ω(= f(t)e iωω dt Trasformata di Fourier (FT) tempo frequenza 4
15 In un campione reale i nuclei di un dato isotopo non risuonano alla stessa frequenza, in quanto il campo magnetico che effettivamente viene sentito dal nucleo dipende dalla distribuzione elettronica attorno al nucleo, la quale a sua volta dipende dal contesto molecolare in cui è inserito il nucleo. Per fare entrare contemporaneamente in risonanza tutti i nuclei protonici si inviano contemporaneamente tutte le frequenze entro l intervallo in cui risuonano i nuclei protonici. Questo viene fatto inviando una radiazione monocromatica ν 0 per un tempo molto breve (dell ordine dei µs): un breve pulso di durata t P converte la radiazione monocromatica in una banda di frequenze aventi tutte la stessa intensità entro un intervallo di +/- /4t P Hz. t p 4t P /t p 0 5
16 FT tempo frequenza FT tempo frequenza FT tempo frequenza 6
17 Campione Inserimento nel Magnete 7
18 Campione B 0 z x z x Magnetizzazione Inserimento nel Magnete y y 8
19 Campione Inserimento nel Magnete B 0 z x y Impulso rf a 90 x z y x y Magnetizzazione Perturbazione: irraggiamento 9
20 Campione Inserimento nel Magnete B 0 z x Magnetizzazione Risposta Perturbazione: irradiamento y Rivelazione 20
21 Campione Inserimento nel Magnete Magnetizzazione Perturbazione: irradiament Risposta Rivelazione Raccolta Dati 2
22 intensità Spettroscopia di Risonanza Magnetica Nucleare (NMR) Campione Inserimento nel Magnete Magnetizzazione Perturbazione: irradiament Risposta Rivelazione FT Raccolta Dati Trasformata di Fourier frequenza Spettro NMR 22
23 Strumentazione Strumenti di a generazione - spettrometri a onda continua I primi spettrometri, costruiti a partire dal 953, utilizzavano magneti permanenti o elettromagneti con campi da.4,.87, 2.2 o 2.35 tesla. Questo tipo di strumento utilizza elettromagneti che arrivano a intensità massime di circa 2.35 T bassa intensità di campo bassa intensità di segnale In genere si mantiene costante il campo magnetico applicato B 0 e si fa variare nel tempo la frequenza della radiofrequenza applicata 23
24 Strumentazione Strumenti di 2 a generazione - spettrometri a impulsi o a Trasformata di Fourier Questo tipo di strumento utilizza crio-magneti (superconduttori che possono essere magnetizzati a bassissime temperature). Questi consentono di raggiungere intensità di campo magnetico molto elevate. Strumenti a.7 T (500 MHz per H) sono comuni, si arriva oltre i 8.8 T per H (800 MHz 24
25 Strumentazione In questi strumenti si invia un impulso di radiofrequenza nel range di frequenze di risonanza del nucleo in studio, perpendicolarmente al campo magnetico applicato B 0. Questo impulso induce la transizione di tutti i nuclei interessati dallo stato di spin α allo stato β. 25
26 Strumentazione: Spettrometri a Trasformata di Fourier I nuclei che sono passati nello stato di spin a più alta energia ritornano allo stato fondamentale riemettendo una radiazione nel campo delle radiofrequenze. Viene emessa una serie di radiofrequenze, una per ogni differente nucleo presente che nel loro insieme costituisce il FID (free induction decay - segnale di decadimento a induzione libera), un insieme di frequenze modulate nel dominio del tempo. Un ricevitore di radiofrequenze registra e amplifica il FID (intensità vs tempo) Il FID viene elaborato mediante trasformata di Fourier per ottenere lo spettro (intensità vs frequenza) 26
27 Spettroscopia di Risonanza Magnetica Nucleare (NMR) Strumentazione: Spettrometri a Trasformata di Fourier Ogni sequenza di acquisizione base consiste di una serie regolare di operazioni: ) impulso di radiofrequenza, 2) da un breve tempo morto (non si acquisisce segnale) 3) tempo di acquisizione sufficientemente lungo 4) eventuale intervallo intersequenza. 27
28 Spettroscopia di Risonanza Magnetica Nucleare (NMR) Strumentazione: Spettrometri a Trasformata di Fourier Le sequenze di acquisizione possono essere ripetute in successione una serie molto lunga di volte e i FID ottenuti possono essere sommati. I segnali risuonano sempre alla stessa frequenza mentre il rumore di fondo risuona a frequenze casuali sommando i FID si incrementa molto di più il segnale rispetto al rumore di fondo notevole miglioramento del rapporto segnale / rumore, con notevole incremento della sensibilità. 28
29 Strumentazione: Spettrometri a Trasformata di Fourier Vantaggi dell FT-NMR Campi magnetici applicati stabili e molto intensi aumento dell intensità del segnale di risonanza possibilità di effettuare spettri di NMR su quantità più esigue di campione maggiore risoluzione dei segnali Possibilità di acquisire in tempi molto brevi un FID Possibilità di sommare più FID dello stesso campione in modo da migliorare il rapporto segnale / rumore Con modeste differenze strumentali si possono acquisire con la stessa strumentazione spettri di più nuclei ( H, 3 C, 9 F, 3 P ) 29
30 Liq N 2 Liq He Magnete 30
31 3
32 Probe Probe Spettroscopia di Risonanza Magnetica Nucleare (NMR) Spire del Magnete Bobine di shimming 32
33 Magnete Bobine di shimming Probe Probe Spettroscopia di Risonanza Magnetica Nucleare (NMR) Sorgente RF 33
34 Magnete Bobine di shimming Probe Probe Spettroscopia di Risonanza Magnetica Nucleare (NMR) Amplificatore Timer Sorgente RF 34
35 Magnete Bobine di shimming Probe Probe Spettroscopia di Risonanza Magnetica Nucleare (NMR) z z x 90 x y y Amplificatore Timer Sorgente RF 35
36 Magnete Bobine di shimming Probe Probe Spettroscopia di Risonanza Magnetica Nucleare (NMR) z z x 90 x y y Amplificatore Ricevitore Timer Sorgente RF 36
37 Magnete Bobine di shimming Probe Probe Spettroscopia di Risonanza Magnetica Nucleare (NMR) Sottrae la frequenza proveniente dal probe dalla frequenza operativa Amplificatore Ricevitore Detector Timer Sorgente RF 37
38 Magnete Bobine di shimming Probe Probe Spettroscopia di Risonanza Magnetica Nucleare (NMR) Trasforma il segnale da analogico (elettrico) in digitale (cioè in numeri che possano poi essere analizzati dal computer) Convertitore AD Amplificatore Ricevitore Detector Timer Sorgente RF 38
39 Magnete Bobine di shimming Probe Probe Spettroscopia di Risonanza Magnetica Nucleare (NMR) FT Computer Convertitore AD Amplificatore Ricevitore Detector Timer Sorgente RF 39
40 Magnete Bobine di shimming Probe Probe Per aumentare la sensibilità intrinsecamente bassa della spettroscopia NMR si registra lo stesso spettro per un numero anche molto elevato di volte Computer Convertitore AD Amplificatore Ricevitore Detector Timer Sorgente RF 40
41 Spettroscopia di Risonanza Magnetica Nucleare (NMR) Preparazione del campione Tubi I tubi sono in quarzo, sono lunghi da 7 a 22 cm e per l uso più comune sono larghi 5 mm. Per nuclei meno sensibili ( 7 O) si utilizzano tubi larghi 0 mm. Gli spinner servono a tenere il tubo contenente il campione all interno del probe dello spettrometro e a permettergli di ruotare velocemente e senza vibrazioni. 4
42 Spettroscopia di Risonanza Magnetica Nucleare (NMR) Preparazione del campione Solventi Si utilizzano solventi deuterati (D 2 O, CDCl 3, CH 3 OD, (CD 3 ) 2 CO, (CD 3 ) 2 SO, C 6 D 6, CD 3 CN ) con percentuali di D > % Non danno segnali nel campo delle frequenze osservate ( H, 3 C, 5 N, 9 F.) Il segnale del D può essere utilizzato come riferimento per compensare elettronicamente (circuito di LOCK) lo spostamento degli altri segnali dovuti alle oscillazioni di intensità del campo magnetico B 0 42
43 Clean clear solution Suspension or opaque solution Precipitate Concentration gradient Two phases Not enough solvent GOOD! B a d S a m p l e s! 43
44 H-NMR: Lo spettro Gli assorbimenti NMR sono in genere in forma di picchi stretti I valori di assorbimento NMR sono relativi alla posizione di un composto di riferimento, il tetrametilsilano (TMS) cui si assegna il valore 0 I segnali sono riportati con valori crescenti di chemical shift da destra a sinistra La maggior parte dei protoni assorbe da 0 a 0 ppm 44
45 H-NMR: Lo spettro In uno spettro di NMR-protonico guardiamo: Il numero di segnali ci dice quanti tipi di H equivalenti ci sono nella molecola La posizione dei segnali ci dà informazioni sul tipo di H presenti (aromatici, alchilici, vinilici, alcolici, ammidici ) Intensità dei segnali ci dice quanti H dello stesso tipo ci sono Molteplicità del segnale ci da informazioni sul numero di H vicini a quello considerato 45
46 H-NMR: Numero di segnali Il numero di segnali è uguale al numero di differenti tipi di H presenti nel composto H con un diverso intorno chimico (non equivalenti) danno differenti segnali H equivalenti danno lo stesso segnale 46
47 H-NMR: Numero di segnali Per determinare gli H equivalenti in alcheni e cicloalcani conviene esplicitare tutti gli H Possiamo dire che due H sono equivalenti solo se sono entrambi cis (o trans) rispetto allo stesso gruppo 47
48 H-NMR: Numero di segnali 48
49 H-NMR: Intensità dei segnali L area sottesa a ciascuno dei picchi che compongono uno spettro NMR viene definita come intensità del segnale e viene rappresentata con una curva a gradino detta integrale. Nella spettroscopia H le aree associate ai vari picchi sono direttamente proporzionali al numero dei protoni che danno origine al segnale stesso. 49
50 H-NMR: Intensità dei segnali Si misura l area del segnale e si calcola il numero di H che lo hanno dato 2 casi Si conosce la formula bruta della sostanza in esame Si somma il valore dell altezza di tutti gli integrali e si divide per il numero totale di H presenti nella molecola. Si calcola l altezza di integrale corrispondente ad un H. Si divide poi l altezza di ciascun integrale per il valore precedentemente calcolato e si ottiene il numero di Non si conosce la formula bruta della sostanza in esame Si divide il valore dell altezza di ciascun integrale per il valore di altezza corrispondente all integrale meno alto. Se si hanno numeri frazionari si moltiplicano tutti i valori per un numero intero tale da ottenere numeri interi più piccoli possibile. Bisogna tenere presente che se la molecola è simmetrica si può osservare un numero di H inferiore a quello realmente presente si conosce solo il rapporto tra gli H che hanno dato i vari segnali 50
51 H-NMR: Intensità dei segnali C H 3 NO ,5=6,5 6,5/3=0,5 H=0,5 2H 2H 2H 2H 2H 3H 5
52 52 2H 3H 3H Spettroscopia di Risonanza Magnetica Nucleare (NMR) H-NMR: Intensità dei segnali Valore di integrale più piccolo = 5.00 divido tutti i valori di integrale per 5 a 5.00/5 = b 7.5/5 =.5 c 7.49/5 =.5 Moltiplico tutto per 2 per arrivare ai più piccoli valori interi
53 H-NMR: Intensità dei segnali Valore di integrale più piccolo =.50 divido tutti i valori di integrale per.5 a.50/.5 = b.5/.5 = c 2.26/.5 =.5 Moltiplico tutto per 2 per arrivare ai più piccoli valori interi a 2H b 2H c 3H Osservati in totale 7 H La formula bruta è C 6 H 4 O 53
54 H-NMR: Chemical shift, posizione dei segnali 54
55 H-NMR: Chemical shift, posizione dei segnali In prossimità del nucleo, il campo magnetico generato dalla circolazione degli elettroni fa diminuire l intensità del campo magnetico che effettivamente agisce sul nucleo. In virtù della presenza degli elettroni i nuclei sono magneticamente schermati, ciò vuol dire che risentono di un campo effettivo che è minore rispetto al campo magnetico applicato. I differenti nuclei di H in una stessa molecola avranno differenti schermature e quindi differenti frequenze di risonanza 55
56 H-NMR: Chemical shift, posizione dei segnali Gli elettroni sono particelle cariche e, come tali, quando vengono immersi nel campo magnetico B o, si muovono e generano un piccolo campo magnetico indotto βi opposto a quello molto più forte applicato. Questo campo magnetico indotto scherma il nucleo dalla piena forza del campo applicato. Il campo magnetico sentito dal nucleo è quindi B = B o β i. 56
57 H-NMR: Chemical shift, posizione dei segnali Gli elettroni sono particelle cariche e, come tali, quando vengono immersi nel campo magnetico B o, si muovono e generano un piccolo campo magnetico indotto βi opposto a quello molto più forte applicato. Questo campo magnetico indotto scherma il nucleo dalla piena forza del campo applicato. Il campo magnetico sentito dal nucleo è quindi B = B o β i. 57
58 H-NMR: Chemical shift, posizione dei segnali Per l atomo di idrogeno, che possiede un elettrone ed una distribuzione di carica simmetrica (sferica), lo schermo è principalmente dato da quello che, viene definito termine di schermo diamagnetico, che viene calcolato, facendo riferimento al moto di un elettrone su un orbita circolare. In pratica, questo effetto diamagnetico fa sì che il campo magnetico esterno sul nucleo venga schermato dalla carica elettronica. 58
59 H-NMR: Chemical shift, posizione dei segnali Questo non è valido se prendo in considerazioni protoni all interno di una molecola. Viene meno l assunto iniziale della distribuzione di carica sferica e simmetrica. Gli elettroni negli orbitali p non hanno simmetria sferica. Essi daranno luogo a campi magnetici più intensi (relativamente al nucleo interessato) originando uno spostamento a frequenze maggiori (ex low field shift). Questo "deshielding" viene detto paramagnetic shift. 59
60 H-NMR: Chemical shift, posizione dei segnali Per l atomo di idrogeno: SCHERMO (Shielding) equivale al campo magnetico che si oppone e quindi significa: maggiore densità elettronica intorno al nucleo minore frequenza precessionale (il nucleo risente di un B eff minore) valori più bassi di chemical shift (ppm) =low-freq shift (ex upfield shift) DESCHERMO (Deshielding) vuol quindi significare: minore densità elettronica al nucleo (minore schermo dovuto ad es. alla vicinanza di gruppi elettron-attrattori) maggiore frequenza precessionale (il nucleo risente di un B eff maggiore) valori più alti di chemical shift (ppm)=hi-freq shift (ex downfield shift) 60
61 H-NMR: Chemical shift, posizione dei segnali Gli elettroni di legame, in particolare, possono trovarsi più vicini o più lontani dall atomo in esame (ad es. H) a seconda dell elettronegatività dell altro atomo legato. 6
62 H-NMR: Chemical shift, posizione dei segnali La differenza nella posizione di assorbimento di un particolare protone rispetto alla posizione di assorbimento di un protone di riferimento viene detto spostamento chimico (chemical shift) Il composto di riferimento più utilizzato è il tetrametilsilano (TMS) CH 3 H 3 C Si CH 3 Vantaggi: CH Chimicamente inerte 3 Simmetrico E volatile e può essere allontanato dal campione per recuperare quest ultimo Solubile nella maggior parte dei solventi organici I 2 H del TMS producono un solo picco e sono i più schermati tra i protoni organici. 62
63 H-NMR: Chemical shift, posizione dei segnali In un insieme di nuclei quelli meno schermati sentono maggiormente il campo magnetico applicato (B 0 ) rispetto a quelli più schermati. I nuclei deschermati, rispetto a quelli schermati, sentono un campo magnetico più intenso e richiedono una maggiore frequenza per la risonanza. Le frequenze più alte sono a sinistra nello spettro NMR, quindi segnali di nuclei maggiormente deschermati si spostano a frequenze di risonanza più elevate 63
64 H-NMR: Chemical shift, posizione dei segnali Il protone H b più vicino a Cl, atomo elettronegativo, risulta maggiormente deschermato rispetto ad H a risuona a frequenze più alte (downfield shift) Il protone H b vicino a F, atomo più elettronegativo rispetto a Br, risulta maggiormente deschermato rispetto ad H a risuona a frequenze più alte (downfield shift) Il protone H b vicino a due atomi di Cl risente di un maggior effetto deschermante rispetto ad H a risuona a frequenze più alte (downfield shift) 64
65 H-NMR: Chemical shift, posizione dei segnali 65
66 H-NMR: Chemical shift, posizione dei segnali In uno spettro H-NMR le differenze nelle frequenze di risonanza tra i vari tipi di H sono molto piccole se riportate in MHz (differenze di Hz su valori di campo in MHz) La frequenza di risonanza di un nucleo (quindi anche le differenze nelle frequenze di risonanza) dipende dal campo magnetico applicato B 0 e dallo strumento utilizzato. Lo spostamento chimico assoluto, è proporzionale al campo applicato, quindi strumenti che usano campi magnetici più intensi producono spostamenti chimici assoluti maggiori. NECESSITA DI UNIFORMARE I CHEMICAL SHIFT INDIPENDENTEMENTE DAI CAMPI MAGNETICI APPLICATI E QUINDI DI DIVERSI STRUMENTI UTILIZZATI 66
67 H-NMR: Chemical shift, posizione dei segnali Scala δ del chemical shift Per rendere indipendente la posizione del segnale rispetto al campo applicato si utilizza la scala δ (in ppm) In questo modo lo spostamento chimico δ, misurato in ppm (Hz/MHz), è indipendente dal campo applicato, quindi è uguale su tutti gli strumenti indipendentemente dall intensità del loro campo magnetico. 67
68 H-NMR: Chemical shift, posizione dei segnali Sono QUATTRO i principali fattori che determinano la posizione (sulla scala ppm ) dei principali tipi di protoni:. Deschermatura per la presenza di atomi elettronegativi (effetto induttivo). 2. Campi di anisotropia di solito dovuti a elettroni π nella molecola. 3. Deschermatura dovuta a legami H. 4. Effetto del solvente. 68
69 H-NMR: Fattori che influenzano il Chemical shift. Effetto induttivo Csp 3 -H In una molecola contenete gruppi elettron-attrattori esiste un campo elettrico che influenza la distribuzione della densità elettronica all interno della molecola e quindi lo schermo magnetico dei nuclei. La diminuzione di densità elettronica per effetto di gruppi elettronegativi comporta deschermaggio. Gli effetti di elettronegatività sono trasmessi attraverso gli orbitali molecolari e si risentono non solo sul H legato ad un C a sua volta legato direttamente ad X ma anche su H legati a C vicinali. 69
70 H-NMR: Fattori che influenzano il Chemical shift. Effetto induttivo Csp 3 -H Es: Il Cloro descherma il protone, diminuendo la densità elettronica del C, che a sua volta diminuisce la densità elettronica dell idrogeno deschermando quindi il protone. 70
71 H-NMR: Fattori che influenzano il Chemical shift. Effetto induttivo Csp 3 -H 7
72 H-NMR: Fattori che influenzano il Chemical shift. Effetto induttivo Csp 3 -H 72
73 H-NMR: Fattori che influenzano il Chemical shift 2. Campi di anisotropia (Csp 2 -H e Csp-H) I legami chimici sono in genere magneticamente anisotropi hanno un comportamento magnetico differente nelle tre direzioni dello spazio cartesiano. Il momento magnetico indotto da un campo applicato non è quindi uguale in tutte le direzioni dello spazio e lo schermo di un nucleo dipende essenzialmente dalla sua posizione nella geometria della molecola. 73
74 H-NMR: Fattori che influenzano il Chemical shift 2. Campi di anisotropia (Csp 2 -H e Csp-H) Quando un qualsiasi legame covalente è sottoposto ad un campo magnetico esterno B o, il movimento degli elettroni impegnati nel legame genera delle linee di forza. L effetto globale della costante di schermo determinato da queste linee di forza può essere calcolato. Si determinano così delle zone, i cosiddetti coni di anisotropia diamagnetica, che si possono sommare o opporre (schermare o deschermare + o - ) al campo B o 74
75 H-NMR: Fattori che influenzano il Chemical shift 2. Campi di anisotropia (Csp 2 -H e Csp-H) Per un Csp 3 il H cade in una zona di schermo Per un Csp 2 il H cade in una zona di deschermo (CH=C tra 5 e 7 ppm, CH=O tra 9 e 0 ppm) Per un Csp il H cade in una zona di schermo (CHC tra e 3 ppm) 75
76 H-NMR: Fattori che influenzano il Chemical shift 2. Campi di anisotropia (Csp 2 -H e Csp-H) Es: Acetilene Molecola lineare ed il triplo legame è simmetrico rispetto all asse della molecola. Se tale asse si trova allineato con il campo magnetico applicato, gli elettroni π del legame acquistano un moto circolare perpendicolare al campo applicato generando un campo magnetico indotto che si oppone a quello applicato. 76
77 H-NMR: Fattori che influenzano il Chemical shift 2. Campi di anisotropia (Csp 2 -H e Csp-H) Es: Acetilene L idrogeno, che si trova direttamente sull asse del cono di schermo risuonerà a frequenze più basse (2.88 ppm) rispetto ad un normale CH ad esempio rispetto ad C=CH ( 5.28 ppm). 77
78 H-NMR: Fattori che influenzano il Chemical shift 2. Campi di anisotropia (Csp 2 -H e Csp-H) Anche se la densità elettronica dei doppi legami C=C e C=O non è proprio a simmetria assiale, l anisotropia per questi gruppi può essere calcolata, osservando che i coni di schermo e deschermo risultano invertiti rispetto a quelli visti per l acetilene. 78
79 H-NMR: Fattori che influenzano il Chemical shift 2. Campi di anisotropia (Csp 2 -H e Csp-H) L anisotropia del gruppo carbonilico spiega per esempio perché gli idrogeni aldeidici risuonano a 9-0 ppm. Il protone aldeidico infatti si trova nel cono dove il contributo di schermo è negativo per cui risulterà fortemente deschermato. 79
80 H-NMR: Fattori che influenzano il Chemical shift 2. Campi di anisotropia (Csp 2 -H e Csp-H). Effetto della corrente d anello Quando una molecola con un sistema di elettroni delocalizzato viene posta in un campo magnetico si genera una corrente d anello. Anelli aromatici 4n+2 elettroni liberi di muoversi in una corrente d anello 80
81 H-NMR: Fattori che influenzano il Chemical shift 2. Campi di anisotropia (Csp 2 -H e Csp-H). Effetto della corrente d anello La corrente d anello genera un campo magnetico le cui linee di forza al centro del sistema aromatico sono opposte al campo applicato e pertanto determineranno un effetto di schermo (+). Gli idrogeni dell anello aromatico si trovano invece in una regione dello spazio in cui le linee di forza hanno la stessa direzione per cui si sommano producendo un effetto di deschermo (-). 8
82 H-NMR: Fattori che influenzano il Chemical shift 2. Campi di anisotropia (Csp 2 -H e Csp-H). Effetto della corrente d anello 82
83 H-NMR: Fattori che influenzano il Chemical shift 3. Legami idrogeno Protoni legati ad ossigeni attraverso legami ad idrogeno sono particolarmente deschermati il valore di chemical shift è in molti casi superiore a 0. 83
84 H-NMR: Fattori che influenzano il Chemical shift 3. Legami idrogeno 84
85 H-NMR: Fattori che influenzano il Chemical shift 3. Legami idrogeno 85
86 H-NMR: Fattori che influenzano il Chemical shift 4. Effetto del solvente Quando un composto viene sciolto in determinato solvente, lo spettro di risonanza magnetica nucleare, o meglio i valori di chemical shift, dipenderanno dalla interazione con le molecole di solvente. Anche se non è possibile fare una generalizzazione si può sicuramente affermare che effetti diversi si avranno passando da un solvente apolare (CHCl 3 ) ad un solvente polare (DMSO). 86
87 H-NMR: Chemical shift, posizione dei segnali 87
88 H-NMR: Chemical shift, posizione dei segnali H con un dato intorno chimico (appartenenti a determinati gruppi funzionali) hanno chemical shift entro certi limiti prevedibili 88
89 H-NMR: Chemical shift, posizione dei segnali Alcani La principale influenza nel chemical shift dei protoni negli alcani è dovuto alla presenza di sostituenti. I segnali relativi agli alcani sono distribuiti su un range piuttosto vasto di c.s. Alcune regole generali: l effetto induttivo di deschermo è direttamente proporzionale alla elettronegatività del sostituente considerando lo stesso sostituente i protoni metilici (CH 3 ) sono più schermati dei metilenici (CH 2 ) e dei metinici (CH). 89
90 H-NMR: Chemical shift, posizione dei segnali Alcani 90
91 H-NMR: Chemical shift, posizione dei segnali Alcani Nei cicloalcani il c.s. dei protoni dipende innanzitutto dalle dimensioni dell anello, dalla sua mobilità conformazionale e da eventuali costrizioni steriche. La costrizione d anello nel ciclopropano produce una forte anisotropia diamagnetica che porta a segnali molto schermati (0.22 ppm). Tale schermo diminuisce avvicinandosi al cicloeptano, oltre il quale non si osserva più variazione considerevole di c.s. 9
92 H-NMR: Chemical shift, posizione dei segnali 92
93 93
94 H-NMR: Chemical shift, posizione dei segnali ALCHENI I protoni olefinici di etileni variamente sostituiti si incontrano solitamente nel range compreso tra 4 e 7.5 ppm. I sostituenti sul doppio legame influenzano il chemical shift dei protoni olefinici per effetto induttivo, mesomerico o sterico. 94
95 H-NMR: Chemical shift, posizione dei segnali ARENI Per quanto riguarda i composti aromatici, lo schermo è principalmente determinato dall effetto mesomerico dei sostituenti. Es: nell anilina le posizioni orto e para sono più schermate rispetto alle meta poiché, come si ricava dalle strutture limite, sono le posizioni dove la densità di carica negativa è maggiore. 95
96 H-NMR: Chemical shift, posizione dei segnali ARENI Iprotoni 2,4 e 6 sono schermati rispetto al classico valore di risonanza degli idrogeni del benzene (7,27 ppm). Questo schermo è quindi dovuto all effetto mesomerico (+M) del gruppo amminico. 96
97 H-NMR: Regole di Shoolerey Sulla base dell osservazione dei dati sperimentali, è possibile quantizzare gli effetti sul chemical shift di un protone dovuti alla presenza di vari gruppi funzionali. Poiché tali effetti sono spesso additivi, è possibile applicare delle formule semplici per la predizione del chemical shift. Regole di Shoolerey 97
98 H-NMR: Regole di Shoolerey δ = σ W +δ Z 98
99 H-NMR: Regole di Shoolerey 99
100 H-NMR: Regole di Shoolerey 00
101 H-NMR: Regole di Shoolerey 0
102 H-NMR: H su eteroatomi Protoni su eteroatomi, quali ad es. quelli di gruppi OH, NH 2, SH: Questi sono protoni scambiabili nel senso che formano legami a H con altre molecole della stessa natura e con acqua e/o acidi presenti nel solvente. R-OH + D 2 O R-OD + HDO Il segnale del gruppo -OH scompare Il loro δ pertanto è variabile e dipende dalla concentrazione, purezza e temperatura. Sono suscettibili di legami ad idrogeno. Sono spesso soggetti ad effetti del quadrupolo magnetico nucleare dell eteroatomo, 4 N. Per tali motivi essi possono avere chemical shift variabili in funzione della concentrazione, della temperatura e del solvente, e appaiono di norma non accoppiati. 02
103 H-NMR: H su eteroatomi Protoni su eteroatomi, quali ad es. quelli di gruppi OH, NH 2, SH: In genere sono segnali allargati poiché contengono il contributo di tutte le specie intermedie di scambio. Ragionevolmente, aumentando la temperatura, aumenterà la velocità di scambio per cui il segnale diverrà più stretto. 03
104 H-NMR: H su eteroatomi Un metodo per mettere in evidenza la presenza di idrogeni di tipo X-H è quello di sfruttare la loro acidità e quindi la loro facilità a dare processi di scambio. Per trattamento con acqua deuterata, più o meno velocemente, questi idrogeni vengono scambiati con deuterio. Come risultato, dal punto di vista spettroscopicico, si ha che scompariranno dallo spettro NMR protonico tutti i segnali relativi a protoni X-H. 04
105 Analisi dei Medicinali I G. Poce Spettroscopia di Risonanza Magnetica Nucleare (NMR) H-NMR: H su eteroatomi Gruppi -OH chemical shift variabile δ 2-6 ppm shift a campi bassi per effetto di leg H singoletti stretti per rapido scambio che impedisce l accoppiamento; protoni fenolici, più acidi, risuonano generalmente tra d 4 e 7.5 ppm. Leg H intramolecolari portano i segnali a campi bassi, fino a d 0-2. gruppi OH di enoli ed acidi carbossilici: d 0-6 ppm. evidenziabili per trattamento con D 2 O (scompaiono). 05
106 H-NMR: H su eteroatomi Gruppi -NH- momento di quadrupolo magnetico di 4 N velocità di scambio variabile, alta per ammine (picchi stretti non accoppiati), intermedia per ammine aromatiche alchilate (picco largo parzialmente accoppiato), bassa per ammidi primarie e secondarie, pirroli, indoli (picchi larghi, protoni adiacenti accoppiati). ammine alifatiche d ppm; ammine aromatiche d 3-5 ppm, ammidi, pirroli e indoli d 5-9 ppm. shift a campi bassi in presenza di dimetilsolfossido. scambiano in presenza di D 2 O (velocità variabile). 06
107 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Il campo magnetico di un nucleo risente dell orientazione degli spin dei nuclei vicini attraverso gli elettroni di legame, poiché c è una certa tendenza da parte di un elettrone di legame ad accoppiare il proprio spin con quello del protone vicino. Nuclei attivi (protoni) che sono legati (o concatenati) tra loro accoppiano. Questo accoppiamento determina una separazione tra righe, cioè il segnale relativo ad un protone appare come un insieme di linee. Vedere un segnale con una molteplicità di linee significa che il protone in esame vede un altro protone. 07
108 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Il campo di cui risente H b è influenzato dagli stati di spin di H a e viceversa. A seconda dell orientazione dello spin di H a (parallela o antiparallela), il campo di risonanza di H b sarà di poco inferiore o di poco superiore rispetto al valore in assenza di H a. Il segnale di H b è pertanto sdoppiato da H a in due linee di intensità uguale (doppietto) equidistanti dal valore di chemical shift che avrebbe avuto in assenza di H a. Il chemical shift di H b è il valore medio dei due valori in cui il segnale di H b è sdoppiato Il fenomeno è definito accoppiamento spin-spin. L accoppiamento si manifesta solo tra nuclei non equivalenti H b Cl Br H a 08
109 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Il momento magnetico del nucleo produce una piccola polarizzazione degli elettroni di legame e questa è trasmessa attraverso la sovrapposizione orbitalica all altro nucleo. Quindi per il H non vi sarà un unica transizione H α -H β ma 2 possibili transizioni. L interazione si propaga attraverso gli elettroni di legame H-C-H (sp 3 ) 09
110 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin L energia di interazione tra i due spin A-B è : J AB è la costante di accoppiamento scalare (tra i legami) ed è indipendente dal sistema di riferimento usato 0
111 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin La distanza tra i segnali, detta costante di accoppiamento (J), si misura in Hz, è indipendente dal campo magnetico applicato ed assume lo stesso valore per i due nuclei che accoppiano. La J si ottiene misurando la differenza in chemical shift tra due picchi di un multipletto (in ppm) e moltiplicando questo valore per la frequenza corrispondente al campo magnetico applicato (B 0 propria dello spettrometro utilizzato). H b Cl Br H a
112 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Generalmente l accoppiamento perde importanza dopo il terzo legame. In genere, nei sistemi alifatici, l accoppiamento spin-spin si manifesta attraverso massimo 3 legami (J 3 ). Si osservano J 4 o superiori nei sistemi aromatici (J meta 4 legami, J para 5 legami) e J long range nei sistemi coniugati (allilici) o saturi ma conformazionalmente bloccati X Z X Z H a H b X H a H b Z J geminale - 2 legami J vicinale - 3 legami 2
113 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin In due segnali reciprocamente accoppiati il valore di J è lo stesso. 3
114 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin 4
115 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin La molteplicità del segnale è data dalla formula generale: m = 2 n I + dove: m = molteplicità; n = numero di nuclei accoppiati; I = numero quantico di spin dei nuclei accoppiati. Per H, 3 C, 9 F aventi I = ½ la formula diventa m = n + Per cui si è soliti dire che : - un CH che accoppia con un protone è un doppietto (d) - un CH che accoppia con 2 protoni equivalenti è un tripletto (t) - un CH che accoppia con 3 protoni equivalenti è un quartetto (q) - un CH che accoppia con 4 protoni equivalenti è un quintetto (quint) - un CH che accoppia con 5 protoni equivalenti è un sestetto (sest) 5
116 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Il protone H b risente degli stati di spin dei due nuclei H a che esistono in quattro stati possibili con la stessa probabilità. Il segnale è diviso pertanto in 3 picchi di cui quello centrale di intensità doppia (tripletto di aree :2:). 6
117 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin I protoni del CH 2 risentono dei possibili stati di spin dei 3 protoni del metile. Gli stati a spin tra loro antiparalleli hanno nel complesso due effetti sul chemical shift del CH 2 ed hanno probabilità tripla rispetto agli stati a spin tra loro paralleli. Il segnale è diviso pertanto in 4 picchi di cui quelli interni di intensità tripla (quartetto di aree :3:3:). 7
118 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Accoppiamento dell isopropile 8
119 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin L intensità relativa delle linee, per numero quantico di spin I = ½, corrisponde ai coefficienti del teorema binomiale (triangolo di Tartaglia o Pascal). Dallo studio della molteplicità m di un segnale possiamo risalire al numero n di nuclei equivalenti adiacenti n = m -. 9
120 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Sistemi del primo ordine Un sistema di spin è l insieme di nuclei (protoni) che accoppiano tra di loro. Saper analizzare un sistema di spin permette di avere un idea precisa sulle molteplicità attese per i vari gruppi di protoni equivalenti e quindi avere informazioni sulla connettività. Protoni chimicamente equivalenti: sono protoni che presentano lo stesso intorno chimico. Per essi si usa una lettera dell alfabeto con un numeratore che indica il numero di protoni equivalenti ( A 2 ). Se i sistemi sono del primo ordine Δν / J 0 si usano lettere lontane dell alfabeto (AX, A 2 X) se sono di ordine superiore Δν / J < 0 si usano lettere vicine (AB, XY ecc). 20
121 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Sistemi del primo ordine 2
122 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Sistemi del primo ordine In tal caso è possibile interpretare lo spettro secondo i criteri di molteplicità visti prima. E possibile calcolare le J. 22
123 c H b H H a X Y H H H c b J a,b = 9 Hz J b,c = 9 Hz a 23
124 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Sistemi del primo ordine AMX 24
125 H-NMR: Molteplicità dei segnali, accoppiamento spin-spin Sistemi del primo ordine Nei sistemi di primo ordine le costanti di accoppiamento possono essere calcolate scomponendo il segnale, misurando le differenze in ppm e moltiplicando per la frequenza di risonanza in MHz 25
126 nucleo δ (ppm) H m J H a 7.95 dd H b 7.44 td H c 6.98 td H d 6.83 dd
127 nucleo δ (ppm) H m J H a 7.48 t.5 H b 6.94 dt H c 7.32 t 7.5 H d 7.59 dt
128 nucleo δ (ppm) H m J H a d 7.5 H b d
129 H-NMR: Equivalenza chimica ed equivalenza magnetica. 29
130 H-NMR: Equivalenza chimica ed equivalenza magnetica. 30
131 H-NMR: Equivalenza chimica ed equivalenza magnetica. 3
132 H-NMR: Equivalenza chimica ed equivalenza magnetica. Due o più protoni che sono chimicamente equivalenti sono anche magneticamente equivalenti se, rispetto ad un qualsiasi altro protone con cui accoppiano, presentano costanti di accoppiamento uguali. 32
133 33
134 Integrazione =4 4/8=0.5 H=0.5 Assegnazione: Segnale a 2.43 ppm= quadrupletto; 2H;CH 2 ; Ha Segnale a 2. ppm= singoletto; 3H; CH 3 ; Hc Segnale a. ppm= triplettto; 3H; CH 3 ; Hb s 2. Sistema di spin: A 3 A 2 X q t 2H 3H 3H 34
135 35
136 Integrazione.5++.5=4 4/8=0.5 H=0.5 Assegnazione: Segnale a 3.48 ppm= singoletto; 3H; CH 3 ; Hc Segnale a 2 ppm= quadrupletto; 2H; CH 2 ; Hb Segnale a 0.83 ppm= tripletto; 3H; CH 3 ; Hc Sistema di spin: A 3 A 2 X s q t.5.5 3H 2H 3H 36
137 37
138 Integrazione.5+4.5=6 6/4=.5 H=.5 Assegnazione: Segnale a 5.95 ppm= quadrupletto; H; CH; Ha Segnale a 2.08 ppm= doppietto; 3H; CH 3 ; Hb Sistema di spin: AX q d H 3H 38
139 39
140 Integrazione 2+2=4 4/4= H= Assegnazione: Segnale a 3.28 ppm= singoletto; 2H; OH; Ha Segnale a.25 ppm= singoletto; 2H; CH 2 ; Hb.25 Sistema di spin: A2 A s s 2 2 2H 2H 40
141 4
142 Integrazione = /9=0. H=0. Assegnazione: Segnale a 2.44 ppm= tripletto; 2H; CH 2 ; Hb Segnale a.98 ppm= doppio tripletto; 2H; CH 2 ; He Segnale a.79 ppm= tripletto; H; CH; Hf Segnale a.3 ppm= quintupletto; 2H; CH 2 ; Hc Segnale a 0.38 ppm= singoletto broad; 2H; NH 2 ; Ha Sistema di spin: A 2 M 2 X 2 A 2 X t dt t quint Scambia cond 2 O s 2H 2H H 2H 2H 42
143 43
144 Integrazione = /0=0. H=0. 2H H 2H 2H 3H 44
145 Integrazione = /0=0. H=0. Assegnazione: Segnale a 0.30ppm= tripletto; 3H; CH 3 ; Hb Segnale a.25 ppm= quadrupletto; 2H; CH 2 ; Ha Sistema di spin: A 2 X 3 t q 2H 3H 45
146 Integrazione = /0=0. H=0. Assegnazione: Segnale a 7.90ppm= multipletto; 2H; CH; Hc Segnale a 7.47 ppm= multipletto; H; CH; He Segnale a 7.38 ppm= multipletto; 2H; CH; Hd Sistema di spin: AMX m m m 2H H 2H 46
147 47
148 Integrazione = /7=0.4 H=0.4 2H 2H 3H 48
149 Integrazione = /7=0.4 H=0.4 Assegnazione: Segnale a.75ppm= singoletto; 3H; CH 3 ; Ha Segnale a 7.2 ppm= multipletto; 2H; CH; Hc Segnale a 6.90 ppm= multipletto; 2H; CH; Hb Sistema di spin: A A 2 X 2 m m 2H 2H 49
Informazioni che si possono ricavare da uno spettro protonico
 Informazioni che si possono ricavare da uno spettro protonico Per interpretare uno spettro 1 H NMR bisogna: 1) Contare il numero di picchi che corrispondono agli idrogeni fisicamente diversi nella molecola.
Informazioni che si possono ricavare da uno spettro protonico Per interpretare uno spettro 1 H NMR bisogna: 1) Contare il numero di picchi che corrispondono agli idrogeni fisicamente diversi nella molecola.
L effetto del sostituente (induttivo e coniugativo) modifica:
 L effetto del sostituente (induttivo e coniugativo) modifica: 1 la densità elettronica del centro di reazione influenza la REATTIVITA Se da un atomo di ad un altro cambia la distribuzione degli elettroni
L effetto del sostituente (induttivo e coniugativo) modifica: 1 la densità elettronica del centro di reazione influenza la REATTIVITA Se da un atomo di ad un altro cambia la distribuzione degli elettroni
NUCLEI NMR ATTIVI E SPIN
 NUCLEI NMR ATTIVI E SPIN I diversi nuclei risuonano a campi magnetici (e frequenze) molto diversi La frequenza caratteristica a cui risuonano i nuclei dello standard è Ξ Per un nucleo specifico, le variazioni
NUCLEI NMR ATTIVI E SPIN I diversi nuclei risuonano a campi magnetici (e frequenze) molto diversi La frequenza caratteristica a cui risuonano i nuclei dello standard è Ξ Per un nucleo specifico, le variazioni
+ ε (deschermo) ε (schermo) α β α. B o
 Il fenomeno dell accoppiamento di spin Nuclei non equivalenti possono interagire attraverso i loro momenti di spin Ai fini della indagine strutturale di molecole incognite è necessario sario non solo considerare
Il fenomeno dell accoppiamento di spin Nuclei non equivalenti possono interagire attraverso i loro momenti di spin Ai fini della indagine strutturale di molecole incognite è necessario sario non solo considerare
Risonanza Magnetica Nucleare
 Risonanza Magnetica Nucleare Il fenomeno della risonanza magnetica nucleare è legato ad una proprietà p di alcuni nuclei quale lo spin. Lo spin è una proprietà fondamentale come la carica e la massa. Protoni,
Risonanza Magnetica Nucleare Il fenomeno della risonanza magnetica nucleare è legato ad una proprietà p di alcuni nuclei quale lo spin. Lo spin è una proprietà fondamentale come la carica e la massa. Protoni,
Risonanza magnetica di spin: ESR (o EPR) nucleare: RMN/NMR
 Risonanza magnetica di spin: ESR (o EPR) nucleare: RMN/NMR 1944-prima osservazione della ESR 1938-prima osservazione della NMR Tecniche spettroscopiche oggi standard Applicazioni di caratterizzazione e
Risonanza magnetica di spin: ESR (o EPR) nucleare: RMN/NMR 1944-prima osservazione della ESR 1938-prima osservazione della NMR Tecniche spettroscopiche oggi standard Applicazioni di caratterizzazione e
BREVE INTRODUZIONE ALLA SPETTROSCOPIA NMR
 Mauro Tonellato BREVE INTRODUZIONE ALLA SPETTROSCOPIA NMR www.pianetachimica.it Breve introduzione teorica alla Spettroscopia NMR I nuclei degli atomi che possiedono un numero dispari di protoni, un numero
Mauro Tonellato BREVE INTRODUZIONE ALLA SPETTROSCOPIA NMR www.pianetachimica.it Breve introduzione teorica alla Spettroscopia NMR I nuclei degli atomi che possiedono un numero dispari di protoni, un numero
Spettroscopia di Risonanza Magnetica Nucleare
 Spettroscopia di Risonanza Magnetica Nucleare TIPO DI SPETTROSCOPIA INTERVALLO DI LUNGHEZZA D ONDA TIPO DI TRANSIZIONE QUANTICA ULTRAVIOLETTO-VISIBILE 180-780 nm Elettroni di legame INFRAROSSO 0,75-300
Spettroscopia di Risonanza Magnetica Nucleare TIPO DI SPETTROSCOPIA INTERVALLO DI LUNGHEZZA D ONDA TIPO DI TRANSIZIONE QUANTICA ULTRAVIOLETTO-VISIBILE 180-780 nm Elettroni di legame INFRAROSSO 0,75-300
Identificazione di un composto organico:
 Identificazione di un composto organico: Laboratorio di Chimica Organica II? O O NO 2 Identificazione di un composto organico: Laboratorio di Chimica Organica II? Analisi elementare: formula bruta (C x
Identificazione di un composto organico: Laboratorio di Chimica Organica II? O O NO 2 Identificazione di un composto organico: Laboratorio di Chimica Organica II? Analisi elementare: formula bruta (C x
SISTEMI DI SPIN E COSTANTE DI ACCOPPIAMENTO. Corso Metodi Fisici in Chimica Organica Prof. Renzo LUISI Uniba. vietata la vendita
 SISTEMI DI SPIN E COSTANTE DI ACCOPPIAMENTO Accoppiamento di spin Definizione dei sistemi di spin Nuclei chimicamente non-equivalenti vengono identificati dalle lettere A, B, C. X..etc. L attribuzione
SISTEMI DI SPIN E COSTANTE DI ACCOPPIAMENTO Accoppiamento di spin Definizione dei sistemi di spin Nuclei chimicamente non-equivalenti vengono identificati dalle lettere A, B, C. X..etc. L attribuzione
Spettroscopia NMR Interazioni spin-spin
 Spettroscopia NMR Interazioni spin-spin meno schermato più schermato H sch H sch H eff H eff Energia relativa Energia assorbita B 0 Accoppiamento tra nuclei Energia relativa Energia assorbita H A Accoppiamento
Spettroscopia NMR Interazioni spin-spin meno schermato più schermato H sch H sch H eff H eff Energia relativa Energia assorbita B 0 Accoppiamento tra nuclei Energia relativa Energia assorbita H A Accoppiamento
rappresenta la cinetica del processo: se è grande il processo è lento
 Conseguenze del principio di indeterminazione in sistemi coinvolgenti processi cinetici: a) scambio chimico; b) rotazioni impedite attorno a legami; c) tautomerie; d) inversioni di spin ω t 1 2π se i processi
Conseguenze del principio di indeterminazione in sistemi coinvolgenti processi cinetici: a) scambio chimico; b) rotazioni impedite attorno a legami; c) tautomerie; d) inversioni di spin ω t 1 2π se i processi
Risonanza magnetica nucleare
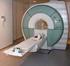 Risonanza magnetica nucleare Università di Firenze Corso di Tecnologie Biomediche Lezione del 31 ottobre 2003 Leonardo Bocchi Principi fisici Premessa Modello classico Visualizzazione semplificata Equazione
Risonanza magnetica nucleare Università di Firenze Corso di Tecnologie Biomediche Lezione del 31 ottobre 2003 Leonardo Bocchi Principi fisici Premessa Modello classico Visualizzazione semplificata Equazione
Spettrometria di Risonanza Magnetica Nucleare
 Spettrometria di Risonanza Magnetica Nucleare Tipo di spettroscopia Intervallo di lunghezza d onda Intervallo di numeri d onda (cm -1 ) Tipo di transizione quantica Emissione raggi γ 0.005-1.4Å - nucleare
Spettrometria di Risonanza Magnetica Nucleare Tipo di spettroscopia Intervallo di lunghezza d onda Intervallo di numeri d onda (cm -1 ) Tipo di transizione quantica Emissione raggi γ 0.005-1.4Å - nucleare
Spettroscopia NMR (Risonanza Magnetica Nucleare)
 Spettroscopia NMR (Risonanza Magnetica Nucleare) studia l assorbimento della radiazione a radiofrequenze da parte di molecole quando i loro atomi sono orientati da un campo magnetico applicato. rispetto
Spettroscopia NMR (Risonanza Magnetica Nucleare) studia l assorbimento della radiazione a radiofrequenze da parte di molecole quando i loro atomi sono orientati da un campo magnetico applicato. rispetto
I RADICALI. Caratteristiche
 I RADIALI aratteristiche os è un radicale Un radicale è una specie che possiede un elettrone spaiato Per rappresentare l elettrone spaiato del composto radicalico si usa un punto R R R R N R O R S R ome
I RADIALI aratteristiche os è un radicale Un radicale è una specie che possiede un elettrone spaiato Per rappresentare l elettrone spaiato del composto radicalico si usa un punto R R R R N R O R S R ome
La strumentazione NMR. ed alcuni dettagli sul metodo a Trasformata di Fourier
 La strumentazione NMR ed alcuni dettagli sul metodo a Trasformata di Fourier 1 Lo Spettrometro NMR 2 Il magnete: genera il campo B 0, intenso, stabile ed omogeneo 600MHz 15 T 900 MHz 22 T 60MHz 1.5 T 3
La strumentazione NMR ed alcuni dettagli sul metodo a Trasformata di Fourier 1 Lo Spettrometro NMR 2 Il magnete: genera il campo B 0, intenso, stabile ed omogeneo 600MHz 15 T 900 MHz 22 T 60MHz 1.5 T 3
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
Struttura dell atomo atomo particelle sub-atomiche - protoni positiva - neutroni } nucleoni - elettroni negativa elemento
 Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Lezione n. 26. Principi generali della spettroscopia IR. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 26 Principi generali della spettroscopia IR 02/03/2008 Antonino Polimeno 1 Spettroscopia infrarossa (1) - La spettroscopia infrarossa studia
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 26 Principi generali della spettroscopia IR 02/03/2008 Antonino Polimeno 1 Spettroscopia infrarossa (1) - La spettroscopia infrarossa studia
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
Spettroscopia 13 C NMR
 L analisi degli spettri 13 C NMR non differisce molto da quella dell 1 H. La principale differenza risiede nella minore sensibilità osservata nella registrazione degli d spettri 13 C che pertanto richiedono
L analisi degli spettri 13 C NMR non differisce molto da quella dell 1 H. La principale differenza risiede nella minore sensibilità osservata nella registrazione degli d spettri 13 C che pertanto richiedono
La radiazione infrarossa si trova nella parte dello spettro elettromagnetico tra le regioni del visibile e delle microonde. La porzione di maggiore
 La radiazione infrarossa si trova nella parte dello spettro elettromagnetico tra le regioni del visibile e delle microonde. La porzione di maggiore interesse per la spettroscopia IR è quella compresa tra
La radiazione infrarossa si trova nella parte dello spettro elettromagnetico tra le regioni del visibile e delle microonde. La porzione di maggiore interesse per la spettroscopia IR è quella compresa tra
Risonanza magnetica nucleare protonica (NMR - PMR)
 Risonanza magnetica nucleare protonica (NMR - PMR) Basi fisiche I nuclei degli atomi hanno un movimento di rotazione intorno a se stessi (spin). Posto che ogni carica dotata di moto genera un campo magnetico,
Risonanza magnetica nucleare protonica (NMR - PMR) Basi fisiche I nuclei degli atomi hanno un movimento di rotazione intorno a se stessi (spin). Posto che ogni carica dotata di moto genera un campo magnetico,
COMPOSTI AROMATICI. Formula C 6 H 6
 COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
MISURA DELLA SUSCETTIVITA MAGNETICA. Elettroni e particelle nucleari sono dotati di spin. Si orientano in un campo magnetico.
 MISURA DELLA SUSCETTIVITA MAGNETICA Elettroni e particelle nucleari sono dotati di spin. Si orientano in un campo magnetico. EFFETTO DIAMAGNETICO (elettroni accoppiati) Quando una qualunque sostanza è
MISURA DELLA SUSCETTIVITA MAGNETICA Elettroni e particelle nucleari sono dotati di spin. Si orientano in un campo magnetico. EFFETTO DIAMAGNETICO (elettroni accoppiati) Quando una qualunque sostanza è
FENOMENI CHE CAUSANO ALLARGAMENTO DI RIGA NEGLI SPETTRI NMR. Nuclei con momento di quadrupolo; Sostanze paramagnetiche; Processi di scambio.
 FENOMENI HE USNO LLRGMENTO DI RIG NEGLI SPETTRI NMR Nuclei con momento di quadrupolo; Sostanze paramagnetiche; Processi di scambio. Sostanze paramagnetiche Le sostanze paramagnetiche sono caratterizzate
FENOMENI HE USNO LLRGMENTO DI RIG NEGLI SPETTRI NMR Nuclei con momento di quadrupolo; Sostanze paramagnetiche; Processi di scambio. Sostanze paramagnetiche Le sostanze paramagnetiche sono caratterizzate
ESPERIMENTI 1D NMR CON SEQUENZE COMPLESSE
 ESPERIMENTI 1D NMR CON SEQUENZE COMPLESSE 13 C NMR VEDREMO ALCUNE SEQUENZE COMPLESSE 1. J-MOD J-MODULATED SPIN ECHO 2. APT ATTACHED PROTON TEST (SPECTRUM EDITING) 3. SPT SELECTIVE POLARIZATION TRANSFER
ESPERIMENTI 1D NMR CON SEQUENZE COMPLESSE 13 C NMR VEDREMO ALCUNE SEQUENZE COMPLESSE 1. J-MOD J-MODULATED SPIN ECHO 2. APT ATTACHED PROTON TEST (SPECTRUM EDITING) 3. SPT SELECTIVE POLARIZATION TRANSFER
Particelle Subatomiche
 GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Introduzione alla Risonanza Magnetica Nucleare
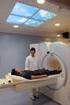 Chimica Fisica III - Modulo B A.A. 203-204 Dott.ssa Marilena Di Valentin con la collaborazione del Dott. Marco Ruzzi Introduzione alla Risonanza Magnetica ucleare Testo di riferimento: Capitolo 4 Peter
Chimica Fisica III - Modulo B A.A. 203-204 Dott.ssa Marilena Di Valentin con la collaborazione del Dott. Marco Ruzzi Introduzione alla Risonanza Magnetica ucleare Testo di riferimento: Capitolo 4 Peter
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Esercizio 2 Soluzione
 Esercizio 2 Soluzione Poiché il testo non ci fornisce la formula molecolare del composto incognito, per prima cosa dobbiamo ricavarla a partire dai dati dell analisi elementare. Con questa tecnica otteniamo
Esercizio 2 Soluzione Poiché il testo non ci fornisce la formula molecolare del composto incognito, per prima cosa dobbiamo ricavarla a partire dai dati dell analisi elementare. Con questa tecnica otteniamo
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Effetto Zeeman anomalo
 Effetto Zeeman anomalo Direzione del campo B esempio: : j=3/2 Direzione del campo B j=1+1/2 = 3/2 s m j =+3/2 m j =+1/2 l m j =-1/2 m j =-3/2 La separazione tra i livelli é diversa l e µ l antiparalleli
Effetto Zeeman anomalo Direzione del campo B esempio: : j=3/2 Direzione del campo B j=1+1/2 = 3/2 s m j =+3/2 m j =+1/2 l m j =-1/2 m j =-3/2 La separazione tra i livelli é diversa l e µ l antiparalleli
Complementi di Chimica Organica. Composti Aromatici: Benzene C 6 H 6 (1825) (1865) Friedrich August Kekulé
 Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
INTRODUZIONE ALLA SPETTROSCOPIA NMR
 Mauro Tonellato INTRODUZIONE ALLA SPETTROSCOPIA NMR www.pianetachimica.it Basi teoriche della spettroscopia NMR www.pianetachimica.it Premessa La spettroscopia di Risonanza Magnetica Nucleare (NMR) è una
Mauro Tonellato INTRODUZIONE ALLA SPETTROSCOPIA NMR www.pianetachimica.it Basi teoriche della spettroscopia NMR www.pianetachimica.it Premessa La spettroscopia di Risonanza Magnetica Nucleare (NMR) è una
Campione sciolto in un solvente (deuterato) e. posto in un tubo. di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm
 posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
La spettroscopia NMR può dare una un grande numero di informazioni sulla struttura di molecola organiche. Esempio di uno spettro NMR
 La spettroscopia di risonanza magnetica nucleare (NMR, dall inglese Nuclear Magnetic Resonance) sfrutta la differenza di energia che i vari stati di spin nucleari possono assumere in presenza di un campo
La spettroscopia di risonanza magnetica nucleare (NMR, dall inglese Nuclear Magnetic Resonance) sfrutta la differenza di energia che i vari stati di spin nucleari possono assumere in presenza di un campo
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
RMN elementi di base
 RMN elementi di base Carpi 3 aprile 2009 Marco Serafini m.serafini@ausl.mo.it Campo magnetico Campo magnetico terrestre valore medio: 0.05 mt (0.5 Gauss) Magneti permanenti intensità: 5-300 mt (50-3000)
RMN elementi di base Carpi 3 aprile 2009 Marco Serafini m.serafini@ausl.mo.it Campo magnetico Campo magnetico terrestre valore medio: 0.05 mt (0.5 Gauss) Magneti permanenti intensità: 5-300 mt (50-3000)
La Risonanza Magnetica Funzionale
 La Risonanza Magnetica Funzionale Facoltà di Farmacia Corso di Laurea in Chimica e Tecnologie Farmaceutiche Attività a scelta dello studente AA 2004-2005 Cosimo Del Gratta Dipartimento di Scienze Cliniche
La Risonanza Magnetica Funzionale Facoltà di Farmacia Corso di Laurea in Chimica e Tecnologie Farmaceutiche Attività a scelta dello studente AA 2004-2005 Cosimo Del Gratta Dipartimento di Scienze Cliniche
Identificazione di un composto organico:
 Identificazione di un composto organico: Laboratorio di Chimica Organica II Analisi elementare: formula bruta (C x H y O z N x )? Analisi cromatografica: purezza, confronto con campioni noti Punto di fusione:
Identificazione di un composto organico: Laboratorio di Chimica Organica II Analisi elementare: formula bruta (C x H y O z N x )? Analisi cromatografica: purezza, confronto con campioni noti Punto di fusione:
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
delle interazioni accoppiate dell intorno dei due atomi nell ambito della molecola.
 FATTORI CHE INFLUENZANO LA FREQUANZA DI ASSORBIMENTO Torniamo ora alla legge di Hooke: : abbiamo detto che questa relazione ci permette di conoscere la frequenza alla quale assorbirà un oscillatore di
FATTORI CHE INFLUENZANO LA FREQUANZA DI ASSORBIMENTO Torniamo ora alla legge di Hooke: : abbiamo detto che questa relazione ci permette di conoscere la frequenza alla quale assorbirà un oscillatore di
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
Spettroscopia. Spettroscopia
 Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
Teoria dell Orbitale Molecolare
 Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
TECNICHE SPETTROSCOPICHE
 TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
RM Formazione dell immagine
 RM Formazione dell immagine Marco Serafini m.serafini@ausl.mo.it FUNZIONE, VARIABILE e DOMINIO Funzione: y = f(x) y = variabile dipendente x = variabile indipendente Esempio: Rappresentazione grafica:
RM Formazione dell immagine Marco Serafini m.serafini@ausl.mo.it FUNZIONE, VARIABILE e DOMINIO Funzione: y = f(x) y = variabile dipendente x = variabile indipendente Esempio: Rappresentazione grafica:
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
Diametro del nucleo: m. Diametro dell atomo: m
 Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
Configurazione elettronica e Tavola periodica. Lezioni 13-16
 Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
ORBITA ORBIT LI ALI MOLECOLARI
 ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
Bassa Energia Alta Energia
 L assorbimento di fotoni causa variazioni nelle vibrazioni molecolari hν Bassa Energia Alta Energia Vibrazioni Molecolari Atomi legati si muovono nello spazio Un ciclo vibrazionale ogni ~10-15 secondi
L assorbimento di fotoni causa variazioni nelle vibrazioni molecolari hν Bassa Energia Alta Energia Vibrazioni Molecolari Atomi legati si muovono nello spazio Un ciclo vibrazionale ogni ~10-15 secondi
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
Testi Consigliati. I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli. Qualsiasi altro testo che tratti gli argomenti elencati nel programma
 Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
ψ = Il carbonio (Z=6) - 2 elettroni equivalenti nello stato 2p - la funzione d onda globale deve essere antisimmetrica tripletto di spin, S=1
 s 1s s 1s p + p o p - configurazione elettronica del C nello stato fondamentale di tripletto di spin [He] (s) (p) p + p o p - configurazione elettronica del C nello stato eccitato di singoletto di spin
s 1s s 1s p + p o p - configurazione elettronica del C nello stato fondamentale di tripletto di spin [He] (s) (p) p + p o p - configurazione elettronica del C nello stato eccitato di singoletto di spin
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
ATOMO POLIELETTRONICO. Numero quantico di spin m s
 ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
LO SPETTRO ELETTROMAGNETICO
 LO SPETTRO ELETTROMAGNETICO cresce cresce Raggi γ Raggi X UV IR Micio onde Onde radio Medio corte medie lunghe Processo: Eccitazione dei nuclei atomici Lontano Vicino Lontano Transizione degli e-interni
LO SPETTRO ELETTROMAGNETICO cresce cresce Raggi γ Raggi X UV IR Micio onde Onde radio Medio corte medie lunghe Processo: Eccitazione dei nuclei atomici Lontano Vicino Lontano Transizione degli e-interni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Prova Scritta di Elettricità e Magnetismo e di Elettromagnetismo A. A Febbraio 2008 (Proff. F.Lacava, C.Mariani, F.Ricci, D.
 Prova Scritta di Elettricità e Magnetismo e di Elettromagnetismo A. A. 2006-07 - 1 Febbraio 2008 (Proff. F.Lacava, C.Mariani, F.Ricci, D.Trevese) Modalità: - Prova scritta di Elettricità e Magnetismo:
Prova Scritta di Elettricità e Magnetismo e di Elettromagnetismo A. A. 2006-07 - 1 Febbraio 2008 (Proff. F.Lacava, C.Mariani, F.Ricci, D.Trevese) Modalità: - Prova scritta di Elettricità e Magnetismo:
CONFIGURAZIONE ELETTRONICA. In generale la configurazione elettronica indica come sono posizionati gli elettroni intorno al nucleo di un atomo.
 CONFIGURAZIONE ELETTRONICA In generale la configurazione elettronica indica come sono posizionati gli elettroni intorno al nucleo di un atomo. ORBITA : Zona intorno al nucleo di diversa energia dove ruotano
CONFIGURAZIONE ELETTRONICA In generale la configurazione elettronica indica come sono posizionati gli elettroni intorno al nucleo di un atomo. ORBITA : Zona intorno al nucleo di diversa energia dove ruotano
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA
 INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
laboratorio di fisica moderna magnetismo e nanostrutture
 laboratorio di fisica moderna magnetismo e nanostrutture il comportamento magnetico dei materiali La materia contiene elettroni, che hanno la caratteristica di possedere un momento magnetico: ogni elettrone
laboratorio di fisica moderna magnetismo e nanostrutture il comportamento magnetico dei materiali La materia contiene elettroni, che hanno la caratteristica di possedere un momento magnetico: ogni elettrone
Si osserva il comportamento dei protoni La proteina è in soluzione
 Risonanza magnetica nucleare Si osserva il comportamento dei protoni La proteina è in soluzione Risonanza magnetica nucleare Si osserva il comportamento dei protoni La proteina è in soluzione Si assegnano
Risonanza magnetica nucleare Si osserva il comportamento dei protoni La proteina è in soluzione Risonanza magnetica nucleare Si osserva il comportamento dei protoni La proteina è in soluzione Si assegnano
1. INTRODUZIONE. CAPITOLO 7 NMR Spettroscopia 13 C-NMR
 CAPITOLO 7 NMR Spettroscopia 13 C-NMR 1. INTRODUZIONE L isotopo più abbondante del carbonio è il C-12 che ha spin uguale a zero e non può pertanto dar luogo a risonanza magnetica nucleare. L isotopo C-13
CAPITOLO 7 NMR Spettroscopia 13 C-NMR 1. INTRODUZIONE L isotopo più abbondante del carbonio è il C-12 che ha spin uguale a zero e non può pertanto dar luogo a risonanza magnetica nucleare. L isotopo C-13
CONFIGURAZIONE ELETTRONICA DEGLI ELEMENTI
 CONFIGURAZIONE ELETTRONICA DEGLI ELEMENTI SOSTANZE: ELEMENTI E COMPOSTI Si definisce sostanza la materia che ha sempre la stessa composizione. Ogni campione di una sostanza ha le stesse propietà chimiche
CONFIGURAZIONE ELETTRONICA DEGLI ELEMENTI SOSTANZE: ELEMENTI E COMPOSTI Si definisce sostanza la materia che ha sempre la stessa composizione. Ogni campione di una sostanza ha le stesse propietà chimiche
SIMULAZIONE - 29 APRILE QUESITI
 www.matefilia.it SIMULAZIONE - 29 APRILE 206 - QUESITI Q Determinare il volume del solido generato dalla rotazione attorno alla retta di equazione y= della regione di piano delimitata dalla curva di equazione
www.matefilia.it SIMULAZIONE - 29 APRILE 206 - QUESITI Q Determinare il volume del solido generato dalla rotazione attorno alla retta di equazione y= della regione di piano delimitata dalla curva di equazione
Meccanica quantistica (5)
 Meccanica quantistica (5) 0/7/14 1-MQ-5.doc 0 Oscillatore armonico Se una massa è sottoposta ad una forza di richiamo proporzionale allo spostamento da un posizione di equilibrio F = kx il potenziale (
Meccanica quantistica (5) 0/7/14 1-MQ-5.doc 0 Oscillatore armonico Se una massa è sottoposta ad una forza di richiamo proporzionale allo spostamento da un posizione di equilibrio F = kx il potenziale (
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
