Termometria e calorimetria
|
|
|
- Ladislao Patti
- 5 anni fa
- Visualizzazioni
Transcript
1 Termometria e alorimetria Priniio zero della termodinamia: 2 ori, A e B, a temerature differenti (T A < T B ) osti a ontatto raggiungono l equilibrio termio. Se A e B sono in equilibrio termio on un terzo oro C allora sono in equilibrio termio tra loro. Termosoi e termometri: disositii er osserare, definire e misurare la temeratura mediante ariazioni di una data grandezza fisia funzione di T (T) nei liquidi LL(T) nei solidi PP(T) nei gas a ost. (T) nei gas a P ost Temeratura1 Temeratura2
2 Taratura di un termometro: unto di fusione del ghiaio (0 C) e unto di ebollizione dell aqua (100 C) sala di temerature Celsius (sala entigrada) Taratura on il metodo del unto trilo Termometro a gas a olume ostante T T A nrt A ost. nr 0 + ρgh
3 sala termodinamia assoluta o sala Kelin T T C F T T F 9 5 T 9 5 C + 32 F T C ( 0 C,100 C) ( 32 F,212 F)
4 I gas ( ) ( ) t t α α ost. 0 0 (T ost) Legge di Boyle (t C, ost.) I legge di Gay-Lussa (t C, ost.) II legge di Gay-Lussa mole k J R nrt / 8.3 Dilatazione termia di solidi e liquidi ( ) ( ) T T T T L T L L L T L L γ γ γ α α α γ 3α e l aqua?
5 Direzionalità del Trasferimento del Calore Il alore si trasferise dall oggetto iù aldo a quello iù freddo. ESOtermio: il alore si trasferise dal SISTEMA all AMBIENTE CIRCOSTANTE. T(sistema) diminuise T(ambiente)aumenta esemio
6 Direzionalità del Trasferimento del Calore Il Calore si trasferise semre dall oggetto iù aldo a quello iù freddo. ENDOtermio: il alore si trasferise dall AMBIENTE CIRCOSTANTE al SISTEMA. T(sistema)aumenta T (ambiente)diminuise(
7 Caaità termia C T ( ) C T f T i il alore è la quantità di energia sambiata er effetto della differenza di temeratura. Unità di misura: Calorie o Joule aloria: la quantità di alore neessaria er innalzare la temeratura di 1 g di H 2 O da 14.5 a 15.5 C alore seifio: aaità termia er unità di massa C m m T al 1 g C H 2 O
8 Sostanza Caaità Termia Seifia Cal. Se. (J/g K) H 2 O Gliol etilenio 2.39 Al etro 0.84 Al
9 Trasferimento di Calore senza ambiamento di stato q (alore se.)(massa)( T)
10 Trasferimento di dicalore on Cambiamento di distato Il ambiamento di stato oinolge energia (a T ostante) Ghiaio J/g (alore( di fusione) Aqua liquida q (alore( di fusione)(massa) Ghiaio seo1 Ghiaio seo2
11 Cure di diraffreddamento/risaldamento dell aqua 0 risaldamento fusion e risaldamento Calore assorbito ebollizione Calore eduto risaldamento Nota he T è ostante quando il ghiaio fonde e quando l aqua bolle
12 trasmissione del alore: onduzione onezione irraggiamento alorimetri: strumenti er misurare quantità di alore sambiate e alori seifii. Esemio: il alorimetro delle mesolanze x a x m m m m a x a x ( T T1 ) ( T T) 2 ( T T1 ) ( T T) 2
13 Termodinamia studia il modo in ui il alore e il laoro engono sambiati tra un sistema e l ambiente on ui esso interagise sistema - ambiente - stato termodinamio Sistema termodinamio: è ostituito da un grandissimo numero di artielle (ordine di grandezza ) di ui interessa il omortamento di insieme esemio di sistema termodinamio: un gas ontenuto all interno di un allonino Sistema termodinamio modello: gas ideale (ontenuto in un ilindro munito di istone rio di attriti) ariabili termodinamihe: grandezze fisihe he desriono lo stato del sistema, la sua energia e le trasformazioni del sistema (,, T)
14 Equilibrio termodinamio: le ariabili termodinamihe sono ostanti Ogni unto nel iano P- raresenta uno stato termodinamio Trasformazioni ideali quasi-statihe e trasformazioni reali (raresentazione nel iano -) A A B B le trasformazioni ideali quasi-statihe ossono essere reersibili o irreersibili
15 Il sistema uò sambiare energia on l ambiente sotto forma di laoro o alore gas (,, T) il laoro è ositio (L > 0) se omiuto dal sistema sull ambiente il alore ( > 0) è ositio se assorbito dal sistema Termostato: sorgente di alore a T ost. in grado di fornire una qualunque quantità di alore senza he la sua temeratura ari (aaità termia infinita)
16 equialente meanio del alore L mgh ma T L J Joule al animazione
17 dl L Laoro in Termodinamia esansione quasi-statia (gas ideale, ilindro-istone) f dl i f Fdy i A f Ady i d d i f A i il laoro è l area sottesa dalla ura he raresenta la trasformazione nel iano - L > 0 B f i A L < 0 B f B A gas (,, T) L > 0 L < 0 dy i f f i
18 trasformazione isobara: ost. trasformazione isoora: ost. L f L 0 i i f trasformazione isoterma: T ost. nrt R 8.3J / K mole A L f d i f i nrt d nrt ln f i i f i f B
19 il laoro non è una funzione di stato ma diende dalla trasformazione eseguita A A A i i i f B f B f B i f i f i f il alore non è una funzione di stato 2, 2, T 2, 2, T 1, 1, T termostato uoto 1, 1, T membrana esansione isoterma e esansione libera adiabatia
20 I riniio della termodinamia E L E energia interna funzione di stato Il I riniio è l esressione del riniio di onserazione dell energia in termodinamia N.B. energia interna alore il alore è l energia he fluise fra il sistema e l ambiente er effetto della differenza di temeratura
21 Trasformazioni adiabatihe ( 0) E L Trasformazioni isoore ( ost.) E Trasformazioni ilihe E 0 L Esansione libera adiabatia (0, L 0) E E(T) E 0
22 il alore non è una funzione di stato bis E AB AB ost. L AB 0 B f i A C T+ T T E AC AC L AC AC i f T B T C T f E AB E AC ; E E(T) AB AC AB < AC
23 Calore seifio a olume ostante e a ressione ostante dei gas erfetti E AB AB ost. L AB 0 E AC AC L AC AC T B T C T f E AB E AC ; E E(T) f i A i B C f T+ T T AB AC AB AC T alore seifio molare a ost. T alore seifio molare a ost. T T R T R R > er un gas ideale monoatomio 3 E RT teoria inetia dei gas 2 E T T de 3 R dt R
24 Legge delle adiabatihe reersibili ( 0) E L γ ost. γ >1 B E ( L) A C E L
25 Legge delle adiabatihe reersibili ( 0) de + dl / E L er trasformazioni infinitesime de + d 0 onsideriamo una trasformazione on ost. (stesso de) de d / 0 dt il sistema assa da T a T + dt dt dt + + γ d RT d 0 0 T T γ 1 R dt T lnt T + R R + γ R γ d ln 0 B A lnt T T T R R A e ( ) γ 1 A B B B γ RB ost.
26 Entalia E L + E ( 2 1 ) + ( E2 E1 ) ( + E ) ( + E ) H H H 2 La maggior arte delle reazioni himihe aengono a resione ostante (ad esemio a ressione atmosferia) 2 1 H entalia (f. di stato) alore sambiato a ost Se Se H finale > finale H iniziale iniziale allora H è ositia Il Il roesso è ENDOTERMICO Se Se H finale < finale H iniziale iniziale allora H è negatia Il Il roesso è ESOTERMICO
27 Consideriamo la formazione di H 2 O H 2 (g) + 1/2 O 2 (g) --> > H 2 O(g) kj Reazione esotermia il alore è un rodotto e H H kj
28 H 2 + O 2 gas Prearare H 2 O liquida da H 2 + O 2 oinolge due stadi esotermii termii. H 2 O aore H 2 O liquida
29 Prearare H 2 O da H 2 e O 2 oinolge due stadi. H 2 (g) + 1/2 O 2 (g) ---> > H 2 O(g) H kj H - 44 kj H 2 O(g) ---> > H 2 O(liq) H 2 (g) + 1/2 O 2 (g) --> > H 2 O(liq) H kj Esemio di LEGGE di HESS Se una reazione è la somma di 2 o iù reazioni, il H risultante è la somma dei H delle altre reazioni.
30 alori di Entalia Diendono da ome la reazione è sritta e dalla fase dei reagenti e dei rodotti H 2 (g) + 1/2 O 2 (g) --> > H 2 O(g) 2 H 2 (g) + O 2 (g) --> > 2 H 2 O(g) H 2 O(g) ---> > H 2 (g) + 1/2 O 2 (g) H 2 (g) + 1/2 O 2 (g) --> > H 2 O(l) H -242 kj H -484 kj H +242 kj H -286 kj C + O 2 CO 2 mol 94.03kal H kal C2H6O + 3 O2 2CO2 + 3H2O H kal
Termometria e calorimetria
 ermometria e alorimetria Priniio zero della termodinamia: 2 ori, e, a temerature differenti ( < ) osti a ontatto raggiungono l equilibrio termio. Se e sono in equilibrio termio on un terzo oro C allora
ermometria e alorimetria Priniio zero della termodinamia: 2 ori, e, a temerature differenti ( < ) osti a ontatto raggiungono l equilibrio termio. Se e sono in equilibrio termio on un terzo oro C allora
Applicazione del principio di conservazione dell energia a sistemi aventi un gran numero di particelle.
 PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
Calcolare in quanto tempo uno scaldabagno da 60 litri porta il suo contenuto
 lcuni esemi. Un coro di massa m1kg assorbe una quantità di calore 30cal aumentando la sua temeratura di 10 C. uale sarà il suo calore secifico? uale sarà la sua caacità termica? Calcolare in quanto temo
lcuni esemi. Un coro di massa m1kg assorbe una quantità di calore 30cal aumentando la sua temeratura di 10 C. uale sarà il suo calore secifico? uale sarà la sua caacità termica? Calcolare in quanto temo
Fisica Generale B. Primo principio della termodinamica. Scuola di Ingegneria e Architettura UNIBO Cesena Anno Accademico Maurizio Piccinini
 Maurizio Piinini Fisia Generale B Primo riniio della termodinamia Suola di Ingegneria e Arhitettura UNIBO Cesena Anno Aemio 014 015 Maurizio Piinini Energia e sistemi termodinamii LAB TB TA Teorema delle
Maurizio Piinini Fisia Generale B Primo riniio della termodinamia Suola di Ingegneria e Arhitettura UNIBO Cesena Anno Aemio 014 015 Maurizio Piinini Energia e sistemi termodinamii LAB TB TA Teorema delle
Primo principio della termodinamica
 Primo riniio della termodinamia Priniio di equivalenza Due ori a temeratura diversa, in ontatto, raggiungono l'equilibrio termio Durante il ontatto, il "alore" si trasferise dal oro iù aldo al oro iù freddo
Primo riniio della termodinamia Priniio di equivalenza Due ori a temeratura diversa, in ontatto, raggiungono l'equilibrio termio Durante il ontatto, il "alore" si trasferise dal oro iù aldo al oro iù freddo
Impianti di Propulsione Navale
 A/A 2011/12 orso di: Imianti di Proulsione Naale rihiami di termodinamia e mahine Sistema hiuso a) sistema isolato b) sistema rigido ) sistema adiabatio IPN027 Sistema aerto IPN028 I rinii termodinamia
A/A 2011/12 orso di: Imianti di Proulsione Naale rihiami di termodinamia e mahine Sistema hiuso a) sistema isolato b) sistema rigido ) sistema adiabatio IPN027 Sistema aerto IPN028 I rinii termodinamia
Termodinamica. Studia il bilancio energetico di sistemi fisici nel modo più generale, compresi scambi di energia non meccanici (calore).
 ermodinamia Studia il bilanio energetio di sistemi fisii nel modo iù generale, omresi sambi di energia non meanii (alore). NC In meania E M E K E P L energia meania si onserva se le forze sono onservative
ermodinamia Studia il bilanio energetio di sistemi fisii nel modo iù generale, omresi sambi di energia non meanii (alore). NC In meania E M E K E P L energia meania si onserva se le forze sono onservative
Lezione Trasformazioni termodinamiche
 Lezione rasformazioni termodinamiche Adiabatica; Isocora; Isobara; Isoterma; Energia interna costante; Adiabatica Consideriamo una trasformazione che orti il sistema dallo stato di equilibrio 1 allo stato
Lezione rasformazioni termodinamiche Adiabatica; Isocora; Isobara; Isoterma; Energia interna costante; Adiabatica Consideriamo una trasformazione che orti il sistema dallo stato di equilibrio 1 allo stato
Enunciato di Kelvin-Plank
 ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
Legge del gas perfetto e termodinamica
 Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
= 20 C, dopo aver rappresentato il ciclo nel diagramma di Clapeyron, il lavoro L
 Partendo dallo stato iniziale, un gas erfetto monoatomico comie il ciclo raggiungendo successivamente gli stati intermedi, e e tornando oi dallo stato nello stato iniziale. Il ciclo è costituito da: un
Partendo dallo stato iniziale, un gas erfetto monoatomico comie il ciclo raggiungendo successivamente gli stati intermedi, e e tornando oi dallo stato nello stato iniziale. Il ciclo è costituito da: un
Termodinamica: studio dei trasferimenti di energia
 Termodinamica: studio dei trasferimenti di energia Termodinamica chimica: 1. variazione di energia associata ad una trasformazione 2. spontaneità di una trasformazione Si basa su tre principi (leggi) e
Termodinamica: studio dei trasferimenti di energia Termodinamica chimica: 1. variazione di energia associata ad una trasformazione 2. spontaneità di una trasformazione Si basa su tre principi (leggi) e
La temperatura questa sconosciuta!
 La temperatura questa sconosciuta! Sondaggio Metti «mi piace» alla definizione che ritieni più giusta Energia Calore Misura del caldo/freddo Stato della materia ermometria e calorimetria Principio zero
La temperatura questa sconosciuta! Sondaggio Metti «mi piace» alla definizione che ritieni più giusta Energia Calore Misura del caldo/freddo Stato della materia ermometria e calorimetria Principio zero
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica Mod. 2 CHIMICA FISICA. Lezione 3 TRASFORMAZIONI DEL SISTEMA
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. CHIMICA FISICA Lezione 3 Anno Accademico 00-0 Docente: Dimitrios Fessas RASFORMAZIONI DEL SISEMA i. RASFORMAZIONI
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. CHIMICA FISICA Lezione 3 Anno Accademico 00-0 Docente: Dimitrios Fessas RASFORMAZIONI DEL SISEMA i. RASFORMAZIONI
Esercizi svolti di termodinamica applicata
 0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
FISICA. V [10 3 m 3 ]
![FISICA. V [10 3 m 3 ] FISICA. V [10 3 m 3 ]](/thumbs/24/2838543.jpg) Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Lezione 10 Termodinamica
 rgomenti della lezione: relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot Lezione 0 ermodinamica secondo riiio della termodinamica Gas ideali Un gas
rgomenti della lezione: relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot Lezione 0 ermodinamica secondo riiio della termodinamica Gas ideali Un gas
Lezione 10 Termodinamica
 rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
Fisica Generale A estensione principio di conservazione dell energia energia termica teoria cinetica dei gas 14. I Principio della Termodinamica
 Fisica Generale A 4. I Princiio della ermodinamica htt://camus.cib.unibo.it/2434/ December 3, 2 Primo Princiio e Moti Molecolari Il rimo rinciio della termodinamica è l estensione del rinciio di conservazione
Fisica Generale A 4. I Princiio della ermodinamica htt://camus.cib.unibo.it/2434/ December 3, 2 Primo Princiio e Moti Molecolari Il rimo rinciio della termodinamica è l estensione del rinciio di conservazione
CLASSI SECONDE Formulario (con esercizi) LEGGI DEI GAS
 CLASSI SECONDE Formulario con esercizi) LEGGI DEI GAS Germano D Abramo Versione 1.1 10/03/2016 N.B. Si invita a trovare errori e/o imrecisioni o a richiedere una stesura del testo iù semlice.) Trasformzioni
CLASSI SECONDE Formulario con esercizi) LEGGI DEI GAS Germano D Abramo Versione 1.1 10/03/2016 N.B. Si invita a trovare errori e/o imrecisioni o a richiedere una stesura del testo iù semlice.) Trasformzioni
Forme di energia energia accumulata energia interna, energia esterna energia in transito calore, lavoro
 Forme di energia energia accumulata energia interna, energia esterna energia in transito calore, lavoro alore definizione operativa, capacità termica, calori specifici Lavoro lavoro di configurazione,
Forme di energia energia accumulata energia interna, energia esterna energia in transito calore, lavoro alore definizione operativa, capacità termica, calori specifici Lavoro lavoro di configurazione,
La termochimica. Energia in movimento
 La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
Peso atomico (meglio massa atomica)
 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Calorimetria. Principio zero Trasformazioni termodinamiche Lavoro termodinamico
 Calorimetria Princiio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una articella è definito quando siano note, in un certo istante, la osizione
Calorimetria Princiio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una articella è definito quando siano note, in un certo istante, la osizione
Complementi di Termologia. III parte
 Prof. Michele Giugliano (Dicembre 00) Comlementi di Termologia. III arte N. 3. - Lavoro nelle trasformazioni. In generale se un gas, soggetto ad una variazione della ressione, varia il volume, esso comie
Prof. Michele Giugliano (Dicembre 00) Comlementi di Termologia. III arte N. 3. - Lavoro nelle trasformazioni. In generale se un gas, soggetto ad una variazione della ressione, varia il volume, esso comie
TEORIA CINETICA DEI GAS
 TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
D.E.TE.C. Corso di Termofluidodinamica Prof. Luigi de Luca TERMODINAMICA
 ERMODINAMICA La termodinamia è una arte della fisia he rientra nello studio della meania: studia il omortamento della materia, sia essa allo stato solido, liquido o gassoso. Noi i oueremo dei fluidi, ossia
ERMODINAMICA La termodinamia è una arte della fisia he rientra nello studio della meania: studia il omortamento della materia, sia essa allo stato solido, liquido o gassoso. Noi i oueremo dei fluidi, ossia
pdv + p ponendo v T v p
 Nel aso artiolare in i δl sia esresso in fnzione delle oordinate e, è er trasformazione internamente reersibile ari a : δl d laoro di ariazione di olme, essendo d d d esso si ò osì esrimere δl d d onendo
Nel aso artiolare in i δl sia esresso in fnzione delle oordinate e, è er trasformazione internamente reersibile ari a : δl d laoro di ariazione di olme, essendo d d d esso si ò osì esrimere δl d d onendo
Deduzione della legge dell azione di massa per via cinetica
 L equilibrio chimico Reazioni reversibili o di equilibrio: reazioni che ossono avvenire sia in senso diretto che in senso inverso Deduzione della legge dell azione di massa er via cinetica A + B C + D
L equilibrio chimico Reazioni reversibili o di equilibrio: reazioni che ossono avvenire sia in senso diretto che in senso inverso Deduzione della legge dell azione di massa er via cinetica A + B C + D
LAVORO DI UN GAS. Espansione di un gas a pressione costante V A V B
 LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
Fondamenti di Meteorologia e Climatologia
 Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Lezione n. 5. Entalpia. a volume costante a pressione costante Calorimetria differenziale Reazione esotermiche ed endotermiche Legge di Hess
 himica Fisica - himica e Tecnologia Farmaceutiche Lezione n. 5 Entalpia alorimetria a volume costante alorimetria a pressione costante alorimetria differenziale Reazione esotermiche ed endotermiche Legge
himica Fisica - himica e Tecnologia Farmaceutiche Lezione n. 5 Entalpia alorimetria a volume costante alorimetria a pressione costante alorimetria differenziale Reazione esotermiche ed endotermiche Legge
SISTEMA TERMODINAMICO STATO TERMODINAMICO
 SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
UNIVERSITÀ DEGLI STUDI DI TERAMO
 UNIVERSITÀ DEGLI STUDI DI TERAMO FACOLTÀ DI MEDICINA VETERINARIA CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di FISICA MEDICA A.A. 2015 /2016 Docente: Chiucchi Riccardo mail:rchiucchi@unite.it
UNIVERSITÀ DEGLI STUDI DI TERAMO FACOLTÀ DI MEDICINA VETERINARIA CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di FISICA MEDICA A.A. 2015 /2016 Docente: Chiucchi Riccardo mail:rchiucchi@unite.it
SISTEMA TERMODINAMICO STATO TERMODINAMICO
 SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
Termologia. Paolo Bagnaia - CTF Esercizi di termologia e termodinamica 1
 ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
Il primo principio della termodinamica
 Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
La termochimica. Energia in movimento
 La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
CHIMICA FISICA I. Le leggi dei gas
 A.A. 2014-2015 Corso di Laurea in CHIMICA INDUSTRIALE CHIMICA FISICA I Le leggi dei gas Lezioni di Chimia Fisia I A.A. 2014-2015 Leggi dei gas - Pagina 1 Un sistema ostituito da un gas puro si omporta
A.A. 2014-2015 Corso di Laurea in CHIMICA INDUSTRIALE CHIMICA FISICA I Le leggi dei gas Lezioni di Chimia Fisia I A.A. 2014-2015 Leggi dei gas - Pagina 1 Un sistema ostituito da un gas puro si omporta
Parte II. I Principio della TERMODINAMICA a.a
 Parte II I Princiio della TERMODINAMICA a.a. 04-5 Equazioni di bilancio Mentre un sistema aerto consente flussi di massa e di energia attraerso le sezioni di ingresso e di uscita e flussi di energia attraerso
Parte II I Princiio della TERMODINAMICA a.a. 04-5 Equazioni di bilancio Mentre un sistema aerto consente flussi di massa e di energia attraerso le sezioni di ingresso e di uscita e flussi di energia attraerso
Prova scritta del 27 novembre 2018
 Prova scritta del 27 novembre 2018 1 Un reciiente della caacità di 1.00 L e contenente un gas A alla ressione di 10.0 kpa viene connesso ad un altro reciiente avente il volume di 3.00 L con all interno
Prova scritta del 27 novembre 2018 1 Un reciiente della caacità di 1.00 L e contenente un gas A alla ressione di 10.0 kpa viene connesso ad un altro reciiente avente il volume di 3.00 L con all interno
dz dx + dy y x x y se z e una funzione di due generiche variabili x ed y ossia se z= a prescindere dal fatto che le variabili x ed y
 Richiami matematici se z e una funzione di due generiche variabili x ed y ossia se z= zxy (, ) a rescindere dal fatto che le variabili x ed y siamo indiendenti o siano diendenti da altre variabili il differenziale
Richiami matematici se z e una funzione di due generiche variabili x ed y ossia se z= zxy (, ) a rescindere dal fatto che le variabili x ed y siamo indiendenti o siano diendenti da altre variabili il differenziale
Il I principio della termodinamica. Calore, lavoro ed energia interna
 Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Trasformazione isobara
 Trasformazione isobara Q DU Il calore immesso diventa: - avoro - Aumento di temperatura Si mantiene costante: egge: Calore: avoro: a pressione 1 a legge di Gay-ussac: V/T=cost Q = c p n DT = p DV Grafico
Trasformazione isobara Q DU Il calore immesso diventa: - avoro - Aumento di temperatura Si mantiene costante: egge: Calore: avoro: a pressione 1 a legge di Gay-ussac: V/T=cost Q = c p n DT = p DV Grafico
,MOTORE A COMBUSTIONE INTERNA
 ,MOTOE A COMBUSTIONE INTENA Un motore alternativo a ombustione interna, ilo Otto a quattro temi, er uso aeronautio, ha le seguenti aratteristihe: - ilindrata V =. m - raorto di omressione volumetrio r
,MOTOE A COMBUSTIONE INTENA Un motore alternativo a ombustione interna, ilo Otto a quattro temi, er uso aeronautio, ha le seguenti aratteristihe: - ilindrata V =. m - raorto di omressione volumetrio r
Cap. 7 - Termochimica. Le variazioni di energia relative ai processi chimici
 Cap. 7 - Termochimica Le variazioni di energia relative ai processi chimici 1 Energia La capacità di svolgere lavoro o di trasferire calore Energia Cinetica Energia di movimento; KE = ½ mv 2 Energia Potenziale
Cap. 7 - Termochimica Le variazioni di energia relative ai processi chimici 1 Energia La capacità di svolgere lavoro o di trasferire calore Energia Cinetica Energia di movimento; KE = ½ mv 2 Energia Potenziale
TERMODINAMICA 28/10/2015 SISTEMA TERMODINAMICO
 TERMODINAMICA Studia quale è la forza propulsiva delle reazioni chimiche valutando le proprietà macroscopiche di un sistema. Si può in tale modo sapere se una reazione procede spontaneamente. Si occupa
TERMODINAMICA Studia quale è la forza propulsiva delle reazioni chimiche valutando le proprietà macroscopiche di un sistema. Si può in tale modo sapere se una reazione procede spontaneamente. Si occupa
Lezione VII - 11/03/2003 ora 14:30-16:30 - Entropia, trasformazione isoentropica, pompe di calore - Originale di Unetti Matteo
 Lezione VII - /03/003 ora 4:30-6:30 - Entroia, trasformazione isoentroica, ome di calore - Originale di Unetti Matteo Entroia Si uò introdurre una nuoa funzione di stato, l Entroia, definita così come
Lezione VII - /03/003 ora 4:30-6:30 - Entroia, trasformazione isoentroica, ome di calore - Originale di Unetti Matteo Entroia Si uò introdurre una nuoa funzione di stato, l Entroia, definita così come
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
GRANDEZZE OPERATIVE DELLE MACCHINE OPERANTI CON FLUIDI COMPRIMIBILI
 CAPITOLO 6 GRANDEZZE OPERATIVE DELLE MACCHINE OPERANTI CON FLUIDI COMPRIMIBILI 6.) Lavori, rendimenti e otenze. Sviluando i termini ontenuti nell'equazione dell'energia (3.) e indiando on i edii "" e ""
CAPITOLO 6 GRANDEZZE OPERATIVE DELLE MACCHINE OPERANTI CON FLUIDI COMPRIMIBILI 6.) Lavori, rendimenti e otenze. Sviluando i termini ontenuti nell'equazione dell'energia (3.) e indiando on i edii "" e ""
Termodinamica Chimica
 Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Energia e Lavoro dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Energia e Lavoro dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
Esercitazione 8. Soluzione Il rendimento di una macchina di Carnot in funzione delle temperature è: η = 1 T 2 T 1 = = 60%
 Esercitazione 8 Esercizio 1 - Macchina di arnot Una macchina di arnot assorbe una certa quantità di calore Q 1 da una sorgente a temperatura T 1 e cede calore Q 2 ad una seconda sorgente a temperatura
Esercitazione 8 Esercizio 1 - Macchina di arnot Una macchina di arnot assorbe una certa quantità di calore Q 1 da una sorgente a temperatura T 1 e cede calore Q 2 ad una seconda sorgente a temperatura
La Pressione (1) La Pressione è una grandezza scalare ed in un fluido rappresenta una proprietà meccanica dello stesso.
 La Pressione (1) Trasformazioni termodamiche del Gas Ideale - 1 ds La Pressione è una grandezza scalare ed un fluido raresenta una rorietà meccanica dello stesso. d n F df ds = 1 = mg h (1) = ds ds n π
La Pressione (1) Trasformazioni termodamiche del Gas Ideale - 1 ds La Pressione è una grandezza scalare ed un fluido raresenta una rorietà meccanica dello stesso. d n F df ds = 1 = mg h (1) = ds ds n π
Energia e reazioni chimiche. Cap , 19-21, 27-30, 47-48, 50, 59-62
 2016-2017 CCS Biologia CCS Scienze Geologiche 1 Energia e reazioni chimiche Cap 5. 7-13, 19-21, 27-30, 47-48, 50, 59-62 2009 Brooks/Cole - Cengage Energia & Chimica 2 ENERGIA è la capacità di compiere
2016-2017 CCS Biologia CCS Scienze Geologiche 1 Energia e reazioni chimiche Cap 5. 7-13, 19-21, 27-30, 47-48, 50, 59-62 2009 Brooks/Cole - Cengage Energia & Chimica 2 ENERGIA è la capacità di compiere
Termodinamica. Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico
 Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
CICLO JOULE o BRAYTON /1
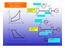 CICLO JOULE o BRAYON / Combustore m& b A CIRCUIO APERO urbina s Comressore Sambiatore ombustore v A CIRCUIO CHIUSO Comressore urbina Sambiatore en. sario Lo studio di ueste diaositive non è sostitutivo
CICLO JOULE o BRAYON / Combustore m& b A CIRCUIO APERO urbina s Comressore Sambiatore ombustore v A CIRCUIO CHIUSO Comressore urbina Sambiatore en. sario Lo studio di ueste diaositive non è sostitutivo
Il secondo principio della Termodinamica
 Il secondo principio della ermodinamica non tutte le trasformazioni sono possibili (es.: passaggio di calore, cascata, attrito, espansione libera) le trasformazioni naturali sono irreversibili ed avvengono
Il secondo principio della ermodinamica non tutte le trasformazioni sono possibili (es.: passaggio di calore, cascata, attrito, espansione libera) le trasformazioni naturali sono irreversibili ed avvengono
relazioni tra il calore e le altre forme di energia.
 Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
GESTIONE delle RISORSE IDRICHE
 Corso di laurea seialistia in Ingegneria delle Aque e della Difesa del Suolo Corso di GESTIONE delle RISORSE IDRICHE a.a. 2003-2004 Lezione 6 Prof. Lua Lanza Diartimento di Ingegneria Ambientale - DIAM
Corso di laurea seialistia in Ingegneria delle Aque e della Difesa del Suolo Corso di GESTIONE delle RISORSE IDRICHE a.a. 2003-2004 Lezione 6 Prof. Lua Lanza Diartimento di Ingegneria Ambientale - DIAM
 La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più
 I Fluidi Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più comunemente forze di coesione) che caratterizzano
I Fluidi Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più comunemente forze di coesione) che caratterizzano
Laboratorio di Misure Fisiche per Scienze Biologiche
 Laboratorio di Misure Fisihe per Sienze Biologihe Nozioni di alorimetria e misura del alore speiio di una sostanza Rihiami di teoria (Ragozzino et al Fondamenti di Fisia) - Il onetto di temperatura. -
Laboratorio di Misure Fisihe per Sienze Biologihe Nozioni di alorimetria e misura del alore speiio di una sostanza Rihiami di teoria (Ragozzino et al Fondamenti di Fisia) - Il onetto di temperatura. -
Temperatura, calore e prima legge termodinamica
 Temperatura, calore e prima legge termodinamica Principio di conservazione Energia ΔE tot = ΔE i = ΔT tot = ΔT j = L +Q +... Energia Termica - Calore Temperatura Conservazione energia Forme di energia
Temperatura, calore e prima legge termodinamica Principio di conservazione Energia ΔE tot = ΔE i = ΔT tot = ΔT j = L +Q +... Energia Termica - Calore Temperatura Conservazione energia Forme di energia
5. Energia libera e potenziale chimico
 5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
Esercitazione 7. Soluzione. Il sistema è isolato, quindi l energia totale si conserva. Applicando il primo principio della termodinamica si ottiene:
 Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
CALORE E TERMODI NAMI CA - PRI MO PRI NCI PI O
 CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: dv dp. dv dt. nrt dt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
BIOLOGIA A. A CHIMICA
 Laurea triennale in BIOLOGIA A. A. 03-4 4 CHIMICA Lezioni di Chimica Fisica rof. Antonio Toffoletti Conversione di una grandezza tra unità di misura differenti Uno scienziato ha misurato la pressione atmosferica
Laurea triennale in BIOLOGIA A. A. 03-4 4 CHIMICA Lezioni di Chimica Fisica rof. Antonio Toffoletti Conversione di una grandezza tra unità di misura differenti Uno scienziato ha misurato la pressione atmosferica
2) Primo principio della Termodinamica
 2) Primo rinciio della Termodinamica Anteatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica delle
2) Primo rinciio della Termodinamica Anteatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica delle
Sistemi termodinamici. I sistemi aperti e chiusi possono essere adiabatici quando non è consentito lo scambio di calore
 Sistemi termodinamici Sistema: regione dello spazio oggetto delle nostre indagini. Ambiente: tutto ciò che circonda un sistema. Universo: sistema + ambiente Sistema aperto: sistema che consente scambi
Sistemi termodinamici Sistema: regione dello spazio oggetto delle nostre indagini. Ambiente: tutto ciò che circonda un sistema. Universo: sistema + ambiente Sistema aperto: sistema che consente scambi
Apparecchiatura sperimentale utilizzata da Joule per stabilire l'equivalenza tra calore e lavoro.
 OAIO SERRA ELEMENI di ERMODINAMICA (Se non si conosce il calcolo differenziale e integrale, ci si limiti ai concetti) Premessa sulle leggi dei gas rarefatti. La temeratura è, er il momento, quella grandezza
OAIO SERRA ELEMENI di ERMODINAMICA (Se non si conosce il calcolo differenziale e integrale, ci si limiti ai concetti) Premessa sulle leggi dei gas rarefatti. La temeratura è, er il momento, quella grandezza
LE LEGGI DEI GAS. Prof. Michele Barcellona
 LE LEGGI DEI GAS Prof. Michele Barcellona STATO DI UN GAS Lo stato di un gas dipende dalle seguenti grandezze: Massa (in moli) Volume V Pressione P Temperatura T LE TRASFORMAZIONI DI UN GAS La modifica
LE LEGGI DEI GAS Prof. Michele Barcellona STATO DI UN GAS Lo stato di un gas dipende dalle seguenti grandezze: Massa (in moli) Volume V Pressione P Temperatura T LE TRASFORMAZIONI DI UN GAS La modifica
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica. FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti. Esercitazione del 03/11/2010
 CorsI di aurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CIMICA Docente: Cristian Gambarotti Esercitazione del // Argomenti della lezione avoro, Calore, Energia Interna, Entalpia relativi
CorsI di aurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CIMICA Docente: Cristian Gambarotti Esercitazione del // Argomenti della lezione avoro, Calore, Energia Interna, Entalpia relativi
Il primo principio della termodinamica Argomenti
 Il primo principio della termodinamica Termodinamica (generalità) 1 principio della termodinamica Argomenti Definizione di sistema termodinamico Funzioni di stato (generalità) Esercizi Obiettivi Conoscere
Il primo principio della termodinamica Termodinamica (generalità) 1 principio della termodinamica Argomenti Definizione di sistema termodinamico Funzioni di stato (generalità) Esercizi Obiettivi Conoscere
Fisica Generale A. 9. Esercizi sul Primo Principio della Termodinamica. ( ) dt. Esercizio 1. Esercizio 1 (III) Esercizio 1 (II)
 Fisia Geerale A 9. Eserizi sul Primo Priipio della Termodiamia Eserizio U reipiete ilidrio dotato di ua base mobile pistoe otiee 3 moli di gas peretto biatomio alla temperatura 0 C. Mediate lo spostameto
Fisia Geerale A 9. Eserizi sul Primo Priipio della Termodiamia Eserizio U reipiete ilidrio dotato di ua base mobile pistoe otiee 3 moli di gas peretto biatomio alla temperatura 0 C. Mediate lo spostameto
TERMODINAMICA CHIMICA
 TERMODINAMICA CHIMICA Si definisce FUNZIONE DI STATO una variabile il cui valore dipende solo dallo stato iniziale e finale del sistema e non dal cammino percorso nella trasformazione effettuata Sono funzioni
TERMODINAMICA CHIMICA Si definisce FUNZIONE DI STATO una variabile il cui valore dipende solo dallo stato iniziale e finale del sistema e non dal cammino percorso nella trasformazione effettuata Sono funzioni
UNIVERSITÀ DEGLI STUDI DI TERAMO
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di : FISICA MEDICA A.A. 015 /016 Docente: Dott. Chiucchi Riccardo mail:rchiucchi@unite.it Medicina Veterinaria: CFU
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di : FISICA MEDICA A.A. 015 /016 Docente: Dott. Chiucchi Riccardo mail:rchiucchi@unite.it Medicina Veterinaria: CFU
ma come si puo misurare una grandezza fisica della quale si postula l esistenza, ma di cui non si conosce nulla? chiaramente misurarla direttamente
 Princiio zero della termodinamica gli stati di equilibrio termico godono della articolare rorieta che i sistemi all equilibrio termico tra loro condividono una stessa grandezza fisica, detta temeratura
Princiio zero della termodinamica gli stati di equilibrio termico godono della articolare rorieta che i sistemi all equilibrio termico tra loro condividono una stessa grandezza fisica, detta temeratura
Q Q. Energia scambiata per ciclo legata alle differenze di pressione ed al valore della pressione stessa. I Principio macchina CICLICA L = Q 12 -Q 34
 Fisia enia G. Grazzini UNIVERSIA DI FIRENZE Diagramma Indiatore Energia sambiata per ilo legata alle differenze di pressione ed al alore della pressione stessa. I Prinipio maina CICLICA L 2-34 L ε 2 Reersibilità
Fisia enia G. Grazzini UNIVERSIA DI FIRENZE Diagramma Indiatore Energia sambiata per ilo legata alle differenze di pressione ed al alore della pressione stessa. I Prinipio maina CICLICA L 2-34 L ε 2 Reersibilità
9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI
 9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI 9. Introduzione I rocessi termodinamici che vengono realizzati nella ratica devono consentire la realizzazione di uno scambio di energia termica o di energia
9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI 9. Introduzione I rocessi termodinamici che vengono realizzati nella ratica devono consentire la realizzazione di uno scambio di energia termica o di energia
Il termoscopio. Il termoscopio è uno strumento che serve per decidere, in modo oggettivo, se un corpo è più caldo o più freddo di un altro.
 La temperatura Il termoscopio Il termoscopio è uno strumento che serve per decidere, in modo oggettivo, se un corpo è più caldo o più freddo di un altro. In quale vaschetta c è l acqua più calda? temperatura
La temperatura Il termoscopio Il termoscopio è uno strumento che serve per decidere, in modo oggettivo, se un corpo è più caldo o più freddo di un altro. In quale vaschetta c è l acqua più calda? temperatura
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
Termodinamica. Francesco Lai. Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari
 Termodinamica Francesco Lai Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari Solubilità La solubilità di una sostanza (farmaco) ad
Termodinamica Francesco Lai Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari Solubilità La solubilità di una sostanza (farmaco) ad
Chimica Fisica. Libro di testo consigliato P.W. Atkins, Chimica Fisica, Ed. Zanichelli
 Chimica Fisica Corso di laurea in Chimica e Tecnologia Farmaceutiche Anno Accademico 2017/2018 Prof. Giovanna Fronzoni Dipartimento di Scienze Chimiche e Farmaceutiche (edificio C11) e-mail: fronzoni@units.it
Chimica Fisica Corso di laurea in Chimica e Tecnologia Farmaceutiche Anno Accademico 2017/2018 Prof. Giovanna Fronzoni Dipartimento di Scienze Chimiche e Farmaceutiche (edificio C11) e-mail: fronzoni@units.it
D.E.TE.C. Corso di Termofluidodinamica Prof. Luigi de Luca CICLI TERMODINAMICI. Figura 16
 D.E.E.C. Corso di ermofluidodamica Prof. Luigi de Luca CICLI ERMODINAMICI CICLO OO Iniziamo ora lo studio di cicli di teresse iù ratico. Sul ciclo Otto si basa il funzionamento dei motori ad accensione
D.E.E.C. Corso di ermofluidodamica Prof. Luigi de Luca CICLI ERMODINAMICI CICLO OO Iniziamo ora lo studio di cicli di teresse iù ratico. Sul ciclo Otto si basa il funzionamento dei motori ad accensione
Laurea in Biologia Molecolare. Chimica Fisica. Formulario. Elisabe1a Collini, O1obre 2014
 Laurea in Biologia Molecolare Chimica Fisica Formulario Elisabe1a Collini, O1obre 2014 E(T, p, n) E m (T, p) = n Grandezze di stato H =U + pv G = H TS =U + pv TS grandezze molari: E m (T, p) = E(T, p,
Laurea in Biologia Molecolare Chimica Fisica Formulario Elisabe1a Collini, O1obre 2014 E(T, p, n) E m (T, p) = n Grandezze di stato H =U + pv G = H TS =U + pv TS grandezze molari: E m (T, p) = E(T, p,
Energia e trasformazioni spontanee
 Energia e trasformazioni spontanee Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede energia. La termodinamica è quella scienza che studia le variazioni di energia in una
Energia e trasformazioni spontanee Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede energia. La termodinamica è quella scienza che studia le variazioni di energia in una
Primo principio della Termodinamica
 rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
Calorimetria. Principio zero Trasformazioni termodinamiche Lavoro termodinamico
 Calorimetria Principio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una particella è definito quando per ogni istante siano note, la posizione (x,
Calorimetria Principio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una particella è definito quando per ogni istante siano note, la posizione (x,
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: nrt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du δ δl () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du δ δl () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che
Tale errata concezione del calore fu abbandonata quando si intuì che il calore non è altro che una forma di energia.
 CALORE Secondo la teoria fluidistica il calore era concepito come una sostanza imponderabile (fluido calorico o semplicemente calorico) permeante tutti i corpi. Mettendo a contatto due corpi a diversa
CALORE Secondo la teoria fluidistica il calore era concepito come una sostanza imponderabile (fluido calorico o semplicemente calorico) permeante tutti i corpi. Mettendo a contatto due corpi a diversa
TERMODINAMICA. A.A Prof. Federico Ferrari 1
 TERMODINAMICA Meccanica: il sistema è descritto dalla caratterizzazione dello stato di moto delle sue parti. Occorre conoscere posizione e velocità in funzione del tempo. Termodinamica: descrizione di
TERMODINAMICA Meccanica: il sistema è descritto dalla caratterizzazione dello stato di moto delle sue parti. Occorre conoscere posizione e velocità in funzione del tempo. Termodinamica: descrizione di
TERMOLOGIA & TERMODINAMICA I
 TERMOLOGIA & TERMODINAMICA I 1 Meccanica: studia il moto dei corpi e le cause che lo genera Grandezze meccaniche: massa, velocità, accelerazione, forza, energia Struttura atomica dei gas: particelle tutte
TERMOLOGIA & TERMODINAMICA I 1 Meccanica: studia il moto dei corpi e le cause che lo genera Grandezze meccaniche: massa, velocità, accelerazione, forza, energia Struttura atomica dei gas: particelle tutte
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
6. I GAS IDEALI. 6.1 Il Gas perfetto
 6. I GAS IDEALI 6. Il Gas erfetto Il gas erfetto o ideale costituisce un modello astratto del comortamento dei gas cui tendono molti gas reali a ressioni rossime a quella atmosferica. Questo modello di
6. I GAS IDEALI 6. Il Gas erfetto Il gas erfetto o ideale costituisce un modello astratto del comortamento dei gas cui tendono molti gas reali a ressioni rossime a quella atmosferica. Questo modello di
Il secondo principio della Termodinamica
 Il secondo principio della ermodinamica non tutte le trasformazioni sono possibili (es.: passaggio di calore, cascata, attrito, espansione libera) le trasformazioni naturali sono irreversibili ed avvengono
Il secondo principio della ermodinamica non tutte le trasformazioni sono possibili (es.: passaggio di calore, cascata, attrito, espansione libera) le trasformazioni naturali sono irreversibili ed avvengono
