Esercitazione n Reazioni degli alogenuri alchilici.
|
|
|
- Valeria Negro
- 5 anni fa
- Visualizzazioni
Transcript
1 Esercitazione n Reazioni degli alogenuri alchilici. 1. Dare definizione ed un esempio per ciascuno dei seguenti termini: Non sottovalutate questo tipo di esercizio: è importante saper esporre in modo chiaro e sintetico i concetti. Se si è capito un concetto, bisogna saperlo esprimere! Provate ad esprimerlo con parole vostre, prima di guardare le risposte. a) nucleofilo b) elettrofilo c) gruppo uscente d) sostituzione e) reazione S N 2 f) reazione S N 1 Reagente che partecipa alla formazione di un nuovo legame con una coppia di elettroni Reagente che partecipa alla formazione di un nuovo legame con orbitale vuoto Atomo (o insieme di atomi) che si stacca dal centro di reazione N la coppia di elettroni di legame Reazione in cui un atomo (o insieme di atomi) esce dal centro di reazione e viene sostituito da un altro Reazione di sostituzione nucleofila bimolecolare, in cui substrato e nucleofilo prendono parte allo stato di transizione dell unico stadio Reazione di sostituzione nucleofila unimolecolare, in assenza di Nu forte, in cui il substrato si dissocia nello stadio lento ed il Nu si lega al carbocatione nello stadio veloce g) solvolisi Reazione di sostituzione nucleofila in cui il Nu (debole) è il solvente polare protico (acqua, alcooli, acidi carbossilici)
2 h) eliminazione Reazione in cui due atomi (o insiemi di atomi) escono da due adiacenti (che si danno legame p) formando una molecola piccola e neutra. i) reazione E2 j) reazione E1 Reazione di eliminazione bimolecolare in un unico stadio. Accompagna S N 2 se Nu forte è anche B forte Reazione di eliminazione unimolecolare in due stadi, dal carbocatione per perdita di in b. Accompagna sempre S N 1 k) trasposizione Migrazione di un metile (più difficilmente di un ) da una posizione a quella adiacente per dare un carbocatione più stabile l) ingombro sterico Spazio occupato da un gruppo (tenendo conto anche della rotazione attorno ai legami -) m) composto litioorganico omposto con legame -Li ( molto negativo: praticamente carbanione, Nu forte, B forte) n) reattivo di Grignard omposto con legame -Mg ( molto negativo: praticamente carbanione, Nu forte, B forte) o) dialchilcuprato di litio R 2 uli, omposto con legame -u ( molto negativo: praticamente carbanione, Nu forte, B forte); complessivamente anione, con Li come ione di bilanciamento
3 2. Scrivere le seguenti reazioni, identificando, in ogni caso, il reagente nucleofilo, l'atomo nucleofilo, l'atomo elettrofilo, il gruppo uscente: a) clorometano Na E l Nu - l - b) 2-bromobutano K E - - Nu c) 1-iodo-2-metilpropano cianuro di potassio (KN) N N E - - Nu
4 d) bromocicloesano metantiolato di sodio ( SNa) E S Nu - - S e) iodoetano ammoniaca N - N E Nu N 2 f) bromometano trimetilfosfina, P( ) E Nu - P( ) P( ). Per ciascuna delle seguenti serie, mettere i gruppi in ordine crescente di: (1) basicità (2) nucleofilicità () capacità come gruppo uscente: basicità: capacità di donare elettroni a capacità come gruppo uscente: inverso della basicità nucleofilicità: capacità di donare elettroni a E
5 basicità nucleofilicità capacità come gruppo uscente F - l basicità nucleofilicità capacità come gruppo uscente basicità N - P2 - N2 capacità come gruppo uscente N - N2 - P2 nucleofilicità
6 basicità capacità come gruppo uscente nucleofilicità F - S - F S - basicità 2 S capacità come gruppo uscente 2 N nucleofilicità 2 N 2 S
7 4. he cosa rappresentano (a), (b) e (c) nei seguenti diagrammi di energia? a) Energia di attivazione (DG = ) b) Stato di transizione c) DG della reazione a) Energia di attivazione (DG = ) dello stadio lento b) Energia di attivazione (DG = ) dello stadio lento c) DG della reazione
8 5. Disegnare il diagramma dell'energia per la reazione S N 1 che dal 2- bromo-2-metil-butano porta al 2-metil-2-butanolo. per S N E coordinata di reazione
9 6. Mettere i seguenti carbocationi in ordine di stabilità crescente (spiegare): Un carbocatione è una specie a difetto elettronico: è stabilizzato se delocalizza la carica per risonanza oppure se ci sono sostituenti alchilici (a rilascio elettronico per effetto induttivo, ) < < <
10 7. ndicare il raggruppamento allilico o benzilico nei seguenti composti, specificando anche se è primario, secondario o terziario: a) -clorociclopentene; b) 2-cloro-2-fenilpropano; c) 1-bromo-2-metilenecicloesano; d) bromocicloesilfenilmetano; e) -cloro-5-metilciclopentene l l allilico 2 benzilico allilico 2 benzilico 2 allilico 2 l
11 10. ndividuare nelle seguenti strutture gli atomi di carbonio e di idrogeno in b all'alogeno, specificando quanti tipi di idrogeno a ci sono in ciascun composto e scrivendo i prodotti di eliminazione: a) 2-bromopentano b b' b) 1-bromo-1-metilciclopentano b b' b c) bromocicloesano b b
12 d) bromobenzene b b niente eliminazione (alogenuro arilico) e) bromometilcicloesano b f) 1-bromo-2-metilbutano b g) -iodopentano b b
13 11. a) Quale è l'alchene più stabile tra -metil-1-butene e 2-metil-2-butene? L alchene con il maggior numero di sostituenti sul = < b) Quale sarà il prodotto principale di una E1 eseguita sul 2-bromo-2-metilpentano? E1 b b > c) Quale è il prodotto principale di eliminazione E1 dell'1-bromo-1- metilcicloesano? b E1 b >
14 12. Quali composti, tra i seguenti, contengono un buon gruppo uscente: a) 2-iodo-2-metilpropano; b) 2-bromonaftalene; c) clorociclopentano; d) iodobenzene; e) -cloropropene; f) 2-cloropropene. Buon gruppo uscente: gruppo (poco basico) che ospita bene gli elettroni di legame dopo la scissione eterolitica dal sp l l l
15 1. ndicare quale atomo di carbonio può essere attaccato da un nucleofilo nei seguenti composti: Un Nu attaccherà un sp 1 o 2 con un buon gruppo uscente Nu: - a) bromometano b) bromociclopentano c) 1-bromo-1- metilcicloesano d) bromobenzene e) bromuro di benzile f) bromuro di m-bromobenzile g) 1-bromo-1-bromometilcicloesano
16 14. Scrivere le strutture di risonanza dei seguenti carbocationi: 2 ecc. ecc. NN PU' ESSERE STABLZZAT PER RSNANZA 2 2
17 15. Quali dei seguenti sono composti organometallici: a) g; b) ( 6 5 ) 2 Mg; c) ( ) Si - Na. un composto è organometallico quando contiene almeno un legame -metallo g Mg - Si Na 16. Dare il nome ai seguenti composti: Mgl a) 6 5 Mgl cloruro di fenilmagnesio b) Mgl cloruro di propilmagnesio c) ( ) 4 Li esillitio d) ( ) 2 uli dimetilcuprato di litio e) ( 6 5 ) 2 uli ) 2 uli difenilcuprato di litio
18 17. ompletare le seguenti reazioni, scrivendo i prodotti di sostituzione (se ce n'è) a) 1-iodopentano N - - N b) bromociclopentano metantiolato di sodio - N S - S - c) clorobenzene acqua l 2 nessuna reazione d) cloruro di p-clorobenzile - e) 1-cloro-1-butene - l - l - l l nessuna reazione 2 l
19 18. ompletare le seguenti reazioni, indicando tutti i possibili prodotti di sostituzione, il meccanismo e specificando il nome dei prodotti: a) 1-bromo-2-metilenecicloesano (= 1-bromo-2-metilidenecicloesano) N N N Nu forte S N 2 2-metilidenecicloesancarbonitrile b) 1-bromo-2-metilenecicloesano metanolo assenza di Nu forte; solvente polare protico 1-metilidene-2- metossicicloesano S N 1-1-metossimetilcicloesene 2 2 2
20 c) 2-clorometilnaftalene S - l - S S Nu forte S N 2 2-mercaptometilnaftalene g) fenolo cloruro di benzile l benzil fenil etere Nu debole, solvente polare protico - ecc. S N 1
21 d) fenossido di sodio (=fenato = ) cloruro di benzile - l Nu forte S N 2 benzil fenil etere e) 1-cloro-2,4-esadiene metossido di sodio l - Nu forte S N 2 1-metossi-2,4-esadiene
22 f) 1-cloro-2,4-esadiene metanolo l assenza di Nu forte; solvente polare protico S N 1 1-metossi-2,4-esadiene -metossi-1,4-esadiene 5-metossi-1,-esadiene
23 19. Scrivere i prodotti (ed i relativi nomi) delle seguenti reazioni S N : a) cloroetano etossido di sodio in etanolo l - S N 2 dietil etere b) 1-bromo-2-feniletano cianuro di sodio in acetone - N S N 2 N -fenilpropanonitrile c) clorocicloesano metantiolato di sodio l S - S N 2 S cicloesil metil solfuro
24 d) 1-clorodecano ioduro di sodio in acetone S N 2 l - 1-iododecano e) piridina (= azabenzene) ioduro di metile N S N 2 N - ioduro di N-metilpiridinio f) 1-bromo-,-dimetilbutano ammoniaca (in eccesso) S N 2 N (eccesso) - 2 N 2 N,-dimetil-1-butanammina
25 20. Quale sarà il prodotto organico principale in ciascuna delle seguenti reazioni? ndicare il tipo di meccanismo: a) ioduro di terz-butile metanolo Nu debole, solvente protico S N 1 E1 b) fenossido di sodio ioduro di metile - (Na ) S N 2 Nu forte
26 c) 2-cloro-2-metilbutano metossido di sodio l - (Na ) alogenuro terziario Nu forte, B forte E2 d) 2-bromopentano idrossido di sodio in etanolo a caldo - D Nu forte, B forte la temperatura elevata favorisce l eliminazione E2 e) 2-bromo-2-metilbutano terz-butossido di potassio - Nu forte, B forte ofmann alogenuro terziario E2
27 f) (R)-2-bromobutano acido acetico Nu debole, solvente protico (R).. S N 1 E1 (S) (R)
28 21. seguenti alogenuri alchilici vengono riscaldati in K metanolica. Scrivere i prodotti delle reazioni di deidroalogenazione, indicando il prevalente quando ce n'è più di uno: a) cis-1-bromo-2-metilcicloesano K a caldo > E2 b) trans-1-bromo-2-metilcicloesano c) 4-cloroeptano l
29 22. ompletare le seguenti reazioni, specificando il nome del composto organico che si forma: a) 2-iodonaftalene magnesio, in dietil etere Mg Mg ioduro di 2-naftilmagnesio b) 1-iodocicloesene magnesio, in dietil etere Mg Mg ioduro di cicloesenilmagnesio c) bromocicloesano magnesio, in dietil etere Mg Mg bromuro di cicloesilmagnesio d) cloruro di benzile magnesio, in dietil etere l Mg Mgl cloruro di benzilmagnesio
30 2. Scrivere i prodotti della reazione dello ioduro di metilmagnesio con: a) acqua - Mg base 2 acido 4 Mg() b) etanolo Mg Mg 4 c) ammoniaca N (N 2 )Mg Mg 4 d) fenolo Mg 4 - Mg e) etilammina Mg N 2 N - 4 Mg f) acido acetico Mg Mg g) propino Mg 4 - Mg
31 24. ompletare le seguenti reazioni, specificando il nome del prodotto organico: a) bromocicloesano litio b) ciclopentillitio dietilammina 2 Li Li Li cicloesillitio - Li ( ) 2 N ( ) 2 N - Li ciclopentano c) bromuro di etile magnesio Mg Mg bromuro di etilmagnesio d) bromuro di fenilmagnesio acido formico ( metanoico) Mg - 2 Mg benzene
32 e) butillitio ioduro rameoso 2 Li u [( )u]li uli dibutilcuprato di litio f) butillitio acqua Li 2 Li 25. Scrivere le equazioni chimiche delle reazioni del 2-metil-2-bromopentano con: a) etanolo; b) etossido di sodio; c) magnesio; d) litio. butano 2 - Mg Mg 2 2 Li Li Li
33 Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N 2 a) 1-propanolo b) 2-propanolo c) 1-butanolo P P P 1- bromopropano 2-bromopropano 1-bromobutano d) alcool isobutilico P 1-bromo-2-metilpropano e) cis-2-metilciclopropanolo P trans-1-bromo-2-metilciclopropano
34 f) 1-terz-butil-1-cicloesanolo P nessuna reazione ( terziario) g) 2,2,6,6-tetrametilcicloesanolo P nessun prodotto (ingombro sterico) 2. Scrivere i prodotti della reazione degli alcooli dell'esercizio precedente con: a) acido solforico concentrato, a caldo; b) con concentrato. on metanolo ed alcooli primari: bimolecolare; con alcooli secondari e terziari: carbocatione a) 1-propanolo 2 S 4, D
35 b) 2-propanolo 2 2 S 4, D 2 2 c) 1-butanolo 2 S 4, D d) alcool isobutilico 2 S 4, D
36 e) cis-2-metilciclopropanolo 2 S 4, D f) 1-terz-butil-1-cicloesanolo 2 2 S 4, D
37 g) 2,2,6,6-tetrametilcicloesanolo 2 trasp. 2 S 2 4 D trasp.
38 . Scrivere le reazioni dell'1-pentanolo con i seguenti reagenti, specificando i nomi dei prodotti: a) terz-butossido di potassio ( ) - K ( ) 4 - K 2 ( ) 2 2 b) sodio metallico 1-pentossido (di potassio) Na ( ) 4 - Na 1/2 2 1-pentossido (di sodio) c) metillitio Li ( ) 4 - Li 4 1-pentossido (di litio) d) concentrato 1-iodopentano e) l Znl 2 Znl l 2 l cloropentano
39 f) acido solforico concentrato, a caldo 2 S 4, D 1-pentene g) P P 1-bromopentano h) Sl 2 Sl 2 l 1-cloropentano i) K 2 r S 4 in acqua K 2 r S 4, 2 acido pentanoico
40 4. ompletare le seguenti reazioni: a) trans-2-metilciclopentanolo 2,2-dimetil--iodobutano Nu debole; solvente protico alogenuro secondario trasp.
41 b) 2,2-dimetil-1-butanolo l, Znl 2 l Znl 2 2 trasp. 2 l l l l - 2
42 c) cicloesilmetanolo acido solforico concentrato, a caldo 2 2 S 4, D d) biciclo-[4.4.0]-decan-1-olo 2 S 4 2 S 4, D 5. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si formano: a) 2-butanolo acido solforico concentrato 2 S 4, D 2-butene 1-butene
43 b) 2-propanolo acido cromico 2 r 4 propanone (dimetil chetone; acetone) c) 2-butanolo d) 1-propanolo r 2 S 4 e) alcool terz-butilico KMn 4 2-bromobutano 1-butene 2 r 4 KMn 4 2-butene ac.propanoico NESSUNA REAZNE
44 f) etil isopropil etere a caldo, D iodoetano 2-propanolo 2-iodopropano etanolo g) 2,-butandiolo propanale
45 6. ompletare le seguenti reazioni, specificando il nome dei composti organici: a) (R)-2-butanolo cloruro di p-toluensolfonile (= p-metilbenzensolfonile); (R) S 2 -l S b) p-toluensolfonato di (S)-1-metilpropile Na (S) S (Na ) - l (R) p-toluensolfonato di sec-butile (di 1- metilpropile) S - (R) 2-bromobutano
46 c) cicloottanolo r / 2 S 4 in acetone r / 2 S 4 in cicloottanone d) ciclopentilmetanolo r.piridina r N ciclopentancarbaldeide e) ciclopentanolo l/znl 2 l/znl 2 l clorociclopentano ciclopentene
47 f) cicloottilmetanolo bromuro di etilmagnesio - Mg Mg cicloottilmetossido etano g) terz-butossido di potassio ioduro di metile - (K ) metil terz-butil etere h) metossido di sodio ioduro di terz-butile - metilpropene metanolo
48 i) 1-butanolo j) ciclopentanolo 2 S 4 a caldo 1-bromobutano 2 S 4 ciclopentene k) etossido di sodio 1-bromobutano butil etil etere - Na l) etossido di sodio 2-metil-2-bromobutano - Na 2-metil-2-butene 2-metil-1-butene
49 7. Scrivere le reazioni dei seguenti alcooli con (1) Na 2 r 2 7 / 2 S 4, (2) il reattivo di Jones, () r.piridina, (4) KMn 4 in ambiente basico, (5) acido nitrico: (1) Na 2 r S 4 (= 2 r 4 ) (2) reattivo di Jones: Na 2 r S 4 diluito in acetone (= 2 r 4 ) () r. (4) N N SSDANT a) 1-butanolo (2),() (1),(2),(4)
50 b) 2-butanolo (1),(2),(),(4) c) 1-metilcicloesanolo (1),(2),() NESSUNA REAZNE 2 N
51 8. Scrivere le reazioni con acido cromico dei seguenti composti: 2 r 4 ossidante a) cicloesanolo b) 1-metilcicloesanolo NESSUNA REAZNE c) 2-metilcicloesanolo d) etanolo
52 9. Scrivere le reazioni del cicloesilmetanolo con ciascuno dei seguenti reagenti: a) Na 2 r 2 7 / 2 S 4, b) reattivo di Jones; c) reattivo di ollins; d) clorocromato di piridinio. b), c), d) a) 10. Scrivere le reazioni di disidratazione catalizzata da acido solforico per i seguenti alcooli: 2 S 4, D eliminazione di 2 a) 1-esanolo b) 2-esanolo
53 c) -pentanolo d) 1-metilciclopentanolo e) idrossimetilciclopentano f) 2-metilciclopentanolo
54 11. ompletare le seguenti reazioni: a) 1-metossi-2-(2-metossietil)cicloesano (2 equivalenti) a caldo -
55 b) 2-metilossacicloesano (un equivalente), a caldo S N 2 - c) 2-metilossacicloesano (due equivalenti), a caldo d) (S)-2-pentanolo cloruro di p-toluensolfonile S l (S) S (S)
56 e) (R)-2-butanolo 2 S 4 a caldo 2 S 4 (R) f) ossaciclobutano concentrato, a caldo g),4-dimetilossaciclopentano concentrato, a caldo
57 12. ompletare le seguenti reazioni (se c'è reazione), specificando i nomi dei composti organici: a) isopropil sec-butil etere concentrato, a caldo, D b) etil terz-butil etere concentrato a caldo, D NESSUNA REAZNE c) dibutil etere Na concentrata, a caldo d) dibutil etere Na metallico Na, D Na NESSUNA REAZNE
58 e) etossibenzene a caldo, D sp 2 f) ossaciclopropano, g) trans-2-butil--metilossaciclopropano 2, 2 2
59
60 h) metilossaciclopropano metanammina N 2 N N 2 2 i) terz-butossido di potassio 1-bromobutano - - ( ) 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si formano: a) metanammina iodometano - N 2 N 2 N N dimetilammina
61 b) 2-propanammina acido nitroso (N 2 ) N 2 N 2 N c) cloruro di etiltrimetilammonio K a caldo N K N 2 2 K d) idrossido di (1-metilpropil)trimetilammonio a caldo - N N
62 14. ompletare le seguenti reazioni: a) dimetilpropilammina 2 2 ; N N b) il prodotto ottenuto in (a) sottoposto a riscaldamento; - - N D N c) bromuro di trimetil(2-metilbutil)ammonio K a caldo. N K D N
63 15. Prevedere i prodotti di metilazione esauriente (degradazione di ofmann) dei seguenti composti: N b K a N N D b a b K N D N K N 2 N( ) D N( )
64 N b a N K D N b a N b K D N N N K D N N K D N
65 N N K a D b N N K D N K D N N N N K D N N K D N b b N K D N
66 21. ompletare le reazioni del cis--metilcicloesanolo, con i seguenti reagenti, specificando l'andamento stereochimico; a) P ; b) Sl 2 /piridina; c) l/ Znl 2 ; d) concentrato; e) cloruro di p-toluensolfonile/piridina e poi Na. a) P P S N 2 trans b) Sl 2 /piridina Sl 2, piridina S N 2 l trans
67 c) l/ Znl 2 l, Znl 2 S N 1 l l alcheni trans cis d) concentrato S N 1 trans cis alcheni
68 e) cloruro di p-toluensolfonile/piridina e poi Na S 2 -l S cis - S N 2 trans
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Tabella. Permittività relativa, parametro di solubilità, parametri empirici di polarità di alcuni solventi Solvente (a 25 C) ε r.
 Tabella. Permittività relativa, parametro di solubilità, parametri empirici di polarità di alcuni solventi ε r δ Z E T S π* (a 25 ) kcal/mole kcal/mole Esano 1.88 7.27 0.9 0.7 0.08 icloesano 2.02 8.2 1.2
Tabella. Permittività relativa, parametro di solubilità, parametri empirici di polarità di alcuni solventi ε r δ Z E T S π* (a 25 ) kcal/mole kcal/mole Esano 1.88 7.27 0.9 0.7 0.08 icloesano 2.02 8.2 1.2
CHIMICA ORGANICA. Gli alcoli
 1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
Competizione tra reazioni di sostituzione e di eliminazione
 Competizione tra reazioni di sostituzione e di eliminazione C δ + δ - CH 2 G Centro elettrofilo δ + H Centro elettrofilo Potenziale buon gruppo uscente Si distinguono due principali meccanismi di eliminazione:
Competizione tra reazioni di sostituzione e di eliminazione C δ + δ - CH 2 G Centro elettrofilo δ + H Centro elettrofilo Potenziale buon gruppo uscente Si distinguono due principali meccanismi di eliminazione:
Sostituzioni sull anello aromatico
 Sostituzioni sull anello aromatico Criteri per stabilire l esistenza di carattere aromatico 1. Il composto deve essere ciclico, planare e deve avere una nuvola ininterrotta di elettroni π sopra e sotto
Sostituzioni sull anello aromatico Criteri per stabilire l esistenza di carattere aromatico 1. Il composto deve essere ciclico, planare e deve avere una nuvola ininterrotta di elettroni π sopra e sotto
Državni izpitni center. Prova d esame 1. Giovedì, 29 agosto 2013 / 90 minuti
 odice del candidato: ržavni izpitni center *M13243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 29 agosto 2013 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
odice del candidato: ržavni izpitni center *M13243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 29 agosto 2013 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
SCHEDA TECNICA DI PRODOTTO STP A4_I. Passo METRICO M 1,5 CEI EN 60423 CEI EN 50262
 Passo METRICO M 1,5 CEI EN 60423 CEI EN 50262 Tipo Grigio Chiaro P Foro Fissaggio Ø A mini-max B Chiave C L Imballo 1900.M12 M12x1,5 12,2 3,5-7 15 8 18-22 100 1900.M16 M16x1,5 16,2 5-10 19 8 22-27 100
Passo METRICO M 1,5 CEI EN 60423 CEI EN 50262 Tipo Grigio Chiaro P Foro Fissaggio Ø A mini-max B Chiave C L Imballo 1900.M12 M12x1,5 12,2 3,5-7 15 8 18-22 100 1900.M16 M16x1,5 16,2 5-10 19 8 22-27 100
L acidità del protone legato al carbonio in α compete con la. quanto accade con gli acidi carbossilici e le ammidi primarie e secondarie
 CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in a ad un gruppo carbonilico (aldeidi, chetoni, esteri) L acidità del protone legato al carbonio in α compete
CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in a ad un gruppo carbonilico (aldeidi, chetoni, esteri) L acidità del protone legato al carbonio in α compete
Daniele Trovò allievo dell ITIS Natta di Padova Reazioni degli acidi carbossilici 1
 Indice: Pagina Acidità degli acidi carbossilici 2 eattività degli acidi carbossilici 4 Preparazione dei cloruri 5 Preparazione delle anidridi 6 Preparazioni degli esteri 7 Preparazioni delle ammidi 8 Sintesi
Indice: Pagina Acidità degli acidi carbossilici 2 eattività degli acidi carbossilici 4 Preparazione dei cloruri 5 Preparazione delle anidridi 6 Preparazioni degli esteri 7 Preparazioni delle ammidi 8 Sintesi
PROVA STRUTTURATA DI CHIMICA ORGANICA
 1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
Prova di ammissione al corso di laurea in Medicina e Chirurgia 2013
 Francesco Ranaldi Chimica organica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni
Francesco Ranaldi Chimica organica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni
Gruppi funzionali. La maggior parte delle molecole organiche oltre ai legami C-C e C-H possiedono: - Eteroatomi (O, N, Alogeni);
 --- himica rganica - SG --- --- himica rganica - SG --- Gruppi funzionali Il carbonio forma sempre 4 legami, con l eccezione di intermedi di reazione, che possono avere 3 legami, e dei carbeni, che hanno
--- himica rganica - SG --- --- himica rganica - SG --- Gruppi funzionali Il carbonio forma sempre 4 legami, con l eccezione di intermedi di reazione, che possono avere 3 legami, e dei carbeni, che hanno
Gli Alcheni : struttura e nomenclatura
 Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
IDROCARBURI AROMATICI. Scaricato da Sunhope.it
 IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
Teoria di Arrhenius. Vengono definiti acidi quei composti che, in soluzione acquosa, sono in grado di dissociarsi liberando ioni H +
 Teoria di Arrhenius Vengono definiti acidi quei composti che, in soluzione acquosa, sono in grado di dissociarsi liberando ioni H + H-Cl H + + Cl - Vengono definiti basi quei composti che, in soluzione
Teoria di Arrhenius Vengono definiti acidi quei composti che, in soluzione acquosa, sono in grado di dissociarsi liberando ioni H + H-Cl H + + Cl - Vengono definiti basi quei composti che, in soluzione
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
Flamma fumo est proxima. Paolo Cardillo. pcardillo@alice.it. Dove c è fumo c è fiamma
 Flamma fumo est proxima Dove c è fumo c è fiamma Paolo Cardillo pcardillo@alice.it Incendio? Un incendio è una reazione chimica che coinvolge la rapida ossidazione, cioè la combustione, di un combustibile
Flamma fumo est proxima Dove c è fumo c è fiamma Paolo Cardillo pcardillo@alice.it Incendio? Un incendio è una reazione chimica che coinvolge la rapida ossidazione, cioè la combustione, di un combustibile
Areni Composti aromatici
 Areni Composti aromatici Areni: composti contenenti l anello benzenico Aromatico: aggettivo usato un tempo per indicare fragrante, ora indica la elevata stabilità di un sistema ciclico contenente elettroni
Areni Composti aromatici Areni: composti contenenti l anello benzenico Aromatico: aggettivo usato un tempo per indicare fragrante, ora indica la elevata stabilità di un sistema ciclico contenente elettroni
Dalla Chimica Generale
 RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
Reazioni degli Alcheni e degli Alchini
 Reazioni degli Alcheni e degli Alchini Reazioni di addizione elettrofila La caratteristica comune a tutte le reazioni degli alcheni può essere riassunta dicendo che: gli elettroni del legame relativamente
Reazioni degli Alcheni e degli Alchini Reazioni di addizione elettrofila La caratteristica comune a tutte le reazioni degli alcheni può essere riassunta dicendo che: gli elettroni del legame relativamente
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
Sistema di scarico fonoassorbente ad innesto. rumorosità certificata 12 db a 2 l/s Euroclasse di reazione al fuoco B s2 d0 EDILIZIA SIFONI E VALVOLE
 SCARICO IDROSANITARIO DRENAGGIO SUOLO FOGNATURA SIFONI E VALVOLE EDILIZIA Sistema di scarico fonoassorbente ad innesto rumorosità certificata 12 db a 2 l/s Euroclasse di reazione al fuoco B s2 d0 ENERGY
SCARICO IDROSANITARIO DRENAGGIO SUOLO FOGNATURA SIFONI E VALVOLE EDILIZIA Sistema di scarico fonoassorbente ad innesto rumorosità certificata 12 db a 2 l/s Euroclasse di reazione al fuoco B s2 d0 ENERGY
Nuclei concettuali fondamentali di chimica organica
 Nuclei concettuali fondamentali di chimica organica Istruzioni per l uso La seguente dispensa raccoglie e tratta sommariamente i principali nuclei concettuali della chimica organica, la cui conoscenza
Nuclei concettuali fondamentali di chimica organica Istruzioni per l uso La seguente dispensa raccoglie e tratta sommariamente i principali nuclei concettuali della chimica organica, la cui conoscenza
ACIDI CARBOSSILICI E DERIVATI
 AIDI ARBSSILII E DERIVATI Indice degli argomenti: Pagina - Struttura degli acidi carbossilici 2 - Acidità degli acidi carbossilici 4 - Reattività di acidi carbossilici e derivati 6 - Preparazione dei cloruri
AIDI ARBSSILII E DERIVATI Indice degli argomenti: Pagina - Struttura degli acidi carbossilici 2 - Acidità degli acidi carbossilici 4 - Reattività di acidi carbossilici e derivati 6 - Preparazione dei cloruri
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
La nomenclatura dei composti organici polifunzionali. Appendice
 Appendice A La nomenclatura dei composti organici polifunzionali on oltre 37 milioni di composti organici già conosciuti e le molte migliaia in più che si creano quotidianamente, assegnare un nome a ciascun
Appendice A La nomenclatura dei composti organici polifunzionali on oltre 37 milioni di composti organici già conosciuti e le molte migliaia in più che si creano quotidianamente, assegnare un nome a ciascun
Chimica organica. Biomolecole. Tessuti biologici. Polimeri proprietà funzioni
 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni 1 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni C O N 1 Chimica organica Biomolecole Tessuti biologici
Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni 1 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni C O N 1 Chimica organica Biomolecole Tessuti biologici
R i c o n o s c i m e n t o d e i g r u p p i f u n z i o n a l i attraverso r e a z i o n i s p e c i f i c h e
 R i c o n o s c i m e n t o d e i g r u p p i f u n z i o n a l i attraverso r e a z i o n i s p e c i f i c h e Considerazioni preliminari: 1) Sono saggi qualitativi in cui la positività del saggio viene
R i c o n o s c i m e n t o d e i g r u p p i f u n z i o n a l i attraverso r e a z i o n i s p e c i f i c h e Considerazioni preliminari: 1) Sono saggi qualitativi in cui la positività del saggio viene
SERIE OMOLOGHE E GRUPPI FUNZIONALI.
 SERIE OMOLOGE E GRUPPI FUZIOALI. 1. Le serie omologhe e i gruppi funzionali I composti organici sono estremamente numerosi, ma la loro descrizione può essere semplificata se li si raggruppa in cosiddette
SERIE OMOLOGE E GRUPPI FUZIOALI. 1. Le serie omologhe e i gruppi funzionali I composti organici sono estremamente numerosi, ma la loro descrizione può essere semplificata se li si raggruppa in cosiddette
SCHEDA TECNICA DI PRODOTTO STP A17_I
 Cilindretti per chiusura fori Tipo A L Adatto Imballo per standard/minimo guarnizione (mm) (mm) TGM38 36A3M1623 3 8 5.000/100 TGM48 36A3M1624 + 36A3M2034 + 36A3M2554 4 8 5.000/100 TGM58 36A3M2025 5 8 5.000/100
Cilindretti per chiusura fori Tipo A L Adatto Imballo per standard/minimo guarnizione (mm) (mm) TGM38 36A3M1623 3 8 5.000/100 TGM48 36A3M1624 + 36A3M2034 + 36A3M2554 4 8 5.000/100 TGM58 36A3M2025 5 8 5.000/100
I derivati del benzene e la loro chimica
 I derivati del benzene e la loro chimica Benzene: 6 e- π Questi composti sono chiamati aromatici è hanno 4N + 2 e- π in un anello planare (regola di Hückel). La delocalizzazione di questi e- π stabilizza
I derivati del benzene e la loro chimica Benzene: 6 e- π Questi composti sono chiamati aromatici è hanno 4N + 2 e- π in un anello planare (regola di Hückel). La delocalizzazione di questi e- π stabilizza
SCHEDA TECNICA DI PRODOTTO STP A5_I
 Passo Pg DIN 40 430 Tipo Grigio Chiaro P Foro Fissaggio Ø A B Chiave C L Imballo 1900.07 Pg 7 12,7 3,5-7 15 8 18-22 100 1900.09 Pg 9 15,5 5-8 19 8 22-26 100 1900.11 Pg11 18,8 5-10 22 8 23-28 100 1900.13
Passo Pg DIN 40 430 Tipo Grigio Chiaro P Foro Fissaggio Ø A B Chiave C L Imballo 1900.07 Pg 7 12,7 3,5-7 15 8 18-22 100 1900.09 Pg 9 15,5 5-8 19 8 22-26 100 1900.11 Pg11 18,8 5-10 22 8 23-28 100 1900.13
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale.
 Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari.
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI Idrocarburi ciclici contenenti un sistema di elettroni delocalizzati su tutto il perimetro dell anello BENZENE C 6 H 6 sp 2 angoli 120 coplanarità struttura simmetrica ad esagono
IDROCARBURI AROMATICI Idrocarburi ciclici contenenti un sistema di elettroni delocalizzati su tutto il perimetro dell anello BENZENE C 6 H 6 sp 2 angoli 120 coplanarità struttura simmetrica ad esagono
Reazioni di aldeidi e chetoni
 Reazioni di aldeidi e chetoni Introduzione Il gruppo funzionale di aldeidi e chetoni è il carbonile ( terminale, nei chetoni si trova all interno della catena. 2 2 pentanale aldeide 2 ). Nelle aldeidi
Reazioni di aldeidi e chetoni Introduzione Il gruppo funzionale di aldeidi e chetoni è il carbonile ( terminale, nei chetoni si trova all interno della catena. 2 2 pentanale aldeide 2 ). Nelle aldeidi
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
CAPPA ASPIRANTE ASALAIR CARBO 900 CODICE CIVAB CIRASA9C
 CAPPA ASPIRANTE ASALAIR CARBO 900 MOD. 900/A CODICE 29940002 MOD. 900/B CODICE 29940009 CODICE CIVAB CIRASA9C Questo apparecchio è stato progettato, costruito e testato secondo le norme e direttive europee:
CAPPA ASPIRANTE ASALAIR CARBO 900 MOD. 900/A CODICE 29940002 MOD. 900/B CODICE 29940009 CODICE CIVAB CIRASA9C Questo apparecchio è stato progettato, costruito e testato secondo le norme e direttive europee:
CAPPA ASPIRANTE ASALAIR CARBO 900 900/R
 ASAL S.R.L. - APPARECCHI SCIENTIFICI ATTREZZATURE LABORATORI Azienda con sistema di gestione qualità conforme ai requisiti della norma UNI EN ISO 9001:2008. Certificato TÜV Italia n 50 100 3290 Rev. 04
ASAL S.R.L. - APPARECCHI SCIENTIFICI ATTREZZATURE LABORATORI Azienda con sistema di gestione qualità conforme ai requisiti della norma UNI EN ISO 9001:2008. Certificato TÜV Italia n 50 100 3290 Rev. 04
Scritto Chimica generale 13.02.2012 Gruppo A
 Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Giochi della Chimica 1988 Fase regionale Classi A e B
 Giochi della Chimica 1988 Fase regionale Classi A e B 1. Il diagramma indica la variazione dell'energia potenziale di un sistema durante il decorso di una reazione: A + B C + D Quale, fra le seguenti affermazioni,
Giochi della Chimica 1988 Fase regionale Classi A e B 1. Il diagramma indica la variazione dell'energia potenziale di un sistema durante il decorso di una reazione: A + B C + D Quale, fra le seguenti affermazioni,
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
SOLUZIONI DEGLI ESERCIZI
 Valitutti, Taddei, Kreuzer, Massey, Sadava, Hillis, Heller, Berenbaum Dal carbonio agli OGM PLUS Chimica organica, biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 1 Dal carbonio agli idrocarburi
Valitutti, Taddei, Kreuzer, Massey, Sadava, Hillis, Heller, Berenbaum Dal carbonio agli OGM PLUS Chimica organica, biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 1 Dal carbonio agli idrocarburi
Modulo di CHIMICA ORGANICA
 orso di Laurea TEIE DELLA PEVEZIE ELL'AMBIETE E EI LUGI DI LAV orso Integrato di himica e Biochimica Modulo di IMIA GAIA Prof. Giuseppe Faita a.a. 03/4 Introduzione La himica rganica è la chimica dei composti
orso di Laurea TEIE DELLA PEVEZIE ELL'AMBIETE E EI LUGI DI LAV orso Integrato di himica e Biochimica Modulo di IMIA GAIA Prof. Giuseppe Faita a.a. 03/4 Introduzione La himica rganica è la chimica dei composti
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Programmazione Disciplinare: Chimica Organica e Biochimica Classi: III
 Istituto Tecnico Tecnologico Basilio Focaccia Salerno Programmazione Disciplinare: Chimica Organica e Biochimica Classi: III I Docenti della Disciplina Salerno, lì... settembre 2014 Finalità della Disciplina:
Istituto Tecnico Tecnologico Basilio Focaccia Salerno Programmazione Disciplinare: Chimica Organica e Biochimica Classi: III I Docenti della Disciplina Salerno, lì... settembre 2014 Finalità della Disciplina:
ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ]
![ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ] ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ]](/thumbs/19/303703.jpg) ESERCIZI DI CHIMICA 1. Calcolare:a) le moli di H 2 O e le moli di atomi d idrogeno ed ossigeno contenuti in 10g di H 2 O; b) il numero di molecole di H 2 O e di atomi di idrogeno e di ossigeno. [0,55 moli;
ESERCIZI DI CHIMICA 1. Calcolare:a) le moli di H 2 O e le moli di atomi d idrogeno ed ossigeno contenuti in 10g di H 2 O; b) il numero di molecole di H 2 O e di atomi di idrogeno e di ossigeno. [0,55 moli;
Il Benzene e l aromaticità
 Il Benzene e l aromaticità Il benzene Il benzene è un idrocarburo la cui formula bruta, nota sin dal 1825, è C 6 H 6. In confronto ad un alcano a sei atomi di carbonio (C 6 H 14 ) e un cicloesano a sei
Il Benzene e l aromaticità Il benzene Il benzene è un idrocarburo la cui formula bruta, nota sin dal 1825, è C 6 H 6. In confronto ad un alcano a sei atomi di carbonio (C 6 H 14 ) e un cicloesano a sei
Gli alcool, i composti carbonilici e gli acidi carbossilici
 Gli alcool, i composti carbonilici e gli acidi carbossilici Con questa unità didattica inizieremo a prendere in considerazione dei composti della chimica organica caratterizzati dal contenere oltre ai
Gli alcool, i composti carbonilici e gli acidi carbossilici Con questa unità didattica inizieremo a prendere in considerazione dei composti della chimica organica caratterizzati dal contenere oltre ai
LATI COMPOUND DATI RESISTENZE CHIMICHE
 LTI COMPOUND DTI RESISTENZE CHIMICHE =Buona, B=Discreta, C=Scadente CIDI INORGNICI LSTIROL (PS) LSTIL (SN) LTI S.p.. - Ed. 03/02 LSTILC (BS) LTILON (PC) LRIL (PPOm) LSTNE (PUR) LSULF (PSU) Conc. 23 50
LTI COMPOUND DTI RESISTENZE CHIMICHE =Buona, B=Discreta, C=Scadente CIDI INORGNICI LSTIROL (PS) LSTIL (SN) LTI S.p.. - Ed. 03/02 LSTILC (BS) LTILON (PC) LRIL (PPOm) LSTNE (PUR) LSULF (PSU) Conc. 23 50
Gruppo 10 Nickel Ni (1751)
 Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA. L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
 COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
Organic Chemistry. 4 th Edition Paula Yurkanis Bruice. Delocalizzazione degli elettroni e risonanza
 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Nomenclatura IUPAC e struttura di alcheni e alchini
 Imparare la chimica con l aiuto del computer Nomenclatura IUPAC e struttura di alcheni e alchini Aggiornata alla nuova nomenclatura IUPAC 2009. Con questa esercitazione imparerete a disegnare semplici
Imparare la chimica con l aiuto del computer Nomenclatura IUPAC e struttura di alcheni e alchini Aggiornata alla nuova nomenclatura IUPAC 2009. Con questa esercitazione imparerete a disegnare semplici
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 CHIMICA ORGANICA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Atomo di C e ibridizzazione sp 2 Nel suo stato fondamentale l atomo di C presenta
CHIMICA ORGANICA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Atomo di C e ibridizzazione sp 2 Nel suo stato fondamentale l atomo di C presenta
DCE - DCE/N Filtri carrellati per fumi di saldatura
 84 filtri carrellati DCE - DCE/N Filtri carrellati per fumi di saldatura DESCRIZIONE La serie di depuratori DCE è indicata per l aspirazione e la depurazione di aria in postazioni imprevedibili, ed è in
84 filtri carrellati DCE - DCE/N Filtri carrellati per fumi di saldatura DESCRIZIONE La serie di depuratori DCE è indicata per l aspirazione e la depurazione di aria in postazioni imprevedibili, ed è in
A B C D E F G Cloro residuo/biossido di cloro Cloro residuo/biossido di Cloro residuo/biossido di cloro Cloro residuo/biossido di cloro
 Rev. 05 del 08/04/2014 Pag. 1 di 5 D.L. 31/01 D.G.R. 28/05/03 Controlli sistematici Indicativamente mensili A B C D E F G Cloro /biossido di cloro Cloro /biossido di Cloro /biossido di cloro Cloro /biossido
Rev. 05 del 08/04/2014 Pag. 1 di 5 D.L. 31/01 D.G.R. 28/05/03 Controlli sistematici Indicativamente mensili A B C D E F G Cloro /biossido di cloro Cloro /biossido di Cloro /biossido di cloro Cloro /biossido
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016. CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO
 ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE Elaborata conformemente alle linee
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE Elaborata conformemente alle linee
Quesiti e problemi (sul libro da pag. 600)
 apitolo 23 Dal carbonio agli idrocarburi Queiti e problemi (ul libro da pag. 600) 2 Gli idrocarburi aturi: alcani e cicloalcani 1 Qual è il numero dei legami covalenti in una molecola di etano? 7 2 Qual
apitolo 23 Dal carbonio agli idrocarburi Queiti e problemi (ul libro da pag. 600) 2 Gli idrocarburi aturi: alcani e cicloalcani 1 Qual è il numero dei legami covalenti in una molecola di etano? 7 2 Qual
Formule di Struttura delle Molecole Organiche
 Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012)
 CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
Corrodibilità leghe (escluse Al-Cu) Acetilendicloruro Buona resistenza Buona resistenza. Buona resistenza (purché anidro)
 Ottobre 2015 L impiego di materiali ferrosi, non ferrosi e materie plastiche per la costruzione di apparecchiature elettriche ed elettroniche adatte ad essere installate in ambienti con pericolo di esplosione
Ottobre 2015 L impiego di materiali ferrosi, non ferrosi e materie plastiche per la costruzione di apparecchiature elettriche ed elettroniche adatte ad essere installate in ambienti con pericolo di esplosione
Giochi della Chimica 2003 Fase nazionale Classi A e B
 Giochi della Chimica 2003 Fase nazionale Classi A e B 1. Il comportamento di un gas reale può essere assimilato con buona approssimazione a quello di un gas ideale: A) a bassa P e T B) a elevate P e T
Giochi della Chimica 2003 Fase nazionale Classi A e B 1. Il comportamento di un gas reale può essere assimilato con buona approssimazione a quello di un gas ideale: A) a bassa P e T B) a elevate P e T
IL TESSUTO ADIPOSO La funzione del tessuto adiposo, che è costituito da adipociti, è quella di garantire all organismo animale una riserva di
 IL TESSUTO ADIPOSO La funzione del tessuto adiposo, che è costituito da adipociti, è quella di garantire all organismo animale una riserva di energia, prontamente disponibile quando l organismo ne ha bisogno.
IL TESSUTO ADIPOSO La funzione del tessuto adiposo, che è costituito da adipociti, è quella di garantire all organismo animale una riserva di energia, prontamente disponibile quando l organismo ne ha bisogno.
Linee di Luce Microscopia / Diffrazione e Linee di Luce Spettroscopia / Scattering. Regolamento
 Smaltimento dei rifiuti chimici prodotti Il documento originale nello stato di revisione corrente è quello disponibile sul sistema documentale aziendale. Questo documento è riservato e non può essere diffuso
Smaltimento dei rifiuti chimici prodotti Il documento originale nello stato di revisione corrente è quello disponibile sul sistema documentale aziendale. Questo documento è riservato e non può essere diffuso
GUARNIZIONI. Mescola a base di EPDM (gomma etilene propilene) con ottima resistenza agli agenti atmosferici ed all ozono.
 TIPO DENOMINAZIONE TECNICA GOMMA NATURALE COLORE GRIGIO NERO PERBUNAN NITRILE () SILICON (VMO VMQ) NERO BIANCO TRASPARENTE BEIGE NOTA TECNICA Mescola a base di NR (gomma naturale) con ottima elasticità
TIPO DENOMINAZIONE TECNICA GOMMA NATURALE COLORE GRIGIO NERO PERBUNAN NITRILE () SILICON (VMO VMQ) NERO BIANCO TRASPARENTE BEIGE NOTA TECNICA Mescola a base di NR (gomma naturale) con ottima elasticità
MEMBRANE. struttura: fosfolipidi e proteine
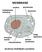 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
I legami. 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1):
 Percorso 3 I legami E S E R C I Z I A Legame covalente omeopolare 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1): 2) Rappresenta la struttura della molecola di ossigeno
Percorso 3 I legami E S E R C I Z I A Legame covalente omeopolare 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1): 2) Rappresenta la struttura della molecola di ossigeno
SELEZIONE DEGLI INQUINANTI INDICATORI
 SELEZIONE DEGLI INQUINANTI INDICATORI (ISS) Istituto Superiore di Sanità 1 Selezione degli inquinanti indicatori Contaminante Indice secondo il D. Lgs. 152/06 La scelta dei contaminanti indice, desunti
SELEZIONE DEGLI INQUINANTI INDICATORI (ISS) Istituto Superiore di Sanità 1 Selezione degli inquinanti indicatori Contaminante Indice secondo il D. Lgs. 152/06 La scelta dei contaminanti indice, desunti
COMPOSTI ORGANICI DEL RAME
 PEPAAZINE MPSTI GANII DEL AME La chimica dei composti organici del rame inizia verso la metà degli anni 50, ma le prime informazioni sul meccanismo arrivano solo trenta anni dopo. ggi sono molto utilizzati
PEPAAZINE MPSTI GANII DEL AME La chimica dei composti organici del rame inizia verso la metà degli anni 50, ma le prime informazioni sul meccanismo arrivano solo trenta anni dopo. ggi sono molto utilizzati
2009. Vietata la riproduzione anche parziale per usi commerciali PARTE 4 DISPOSIZIONI RELATIVE ALLA UTILIZZAZIONE DEGLI IMBALLAGGI E DELLE CISTERNE
 PARTE 4 DISPOSIZIONI RELATIVE ALLA UTILIZZAZIONE DEGLI IMBALLAGGI E DELLE CISTERNE 495 496 CAPITOLO 4.1 UTILIZZAZIONE DI IMBALLAGGI COMPRESI I CONTENITORI INTERMEDI PER IL TRASPORTO ALLA RINFUSA (IBC)
PARTE 4 DISPOSIZIONI RELATIVE ALLA UTILIZZAZIONE DEGLI IMBALLAGGI E DELLE CISTERNE 495 496 CAPITOLO 4.1 UTILIZZAZIONE DI IMBALLAGGI COMPRESI I CONTENITORI INTERMEDI PER IL TRASPORTO ALLA RINFUSA (IBC)
potenziale elettrico: Volt carica elettrica: Coulomb temperatura: grado centigrado e grado kelvin
 Corso di Chimica Medica e Biochimica (lauree triennali) Programma del corso (argomenti delle lezioni per un corso di 2 CFU = 13 14 lezioni): 1) L'atomo: nucleo, elettroni, orbitali, orbitali ibridi. 2)
Corso di Chimica Medica e Biochimica (lauree triennali) Programma del corso (argomenti delle lezioni per un corso di 2 CFU = 13 14 lezioni): 1) L'atomo: nucleo, elettroni, orbitali, orbitali ibridi. 2)
Nota dell editore Presentazione
 00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
CUPOLA ASPIRANTE modelli 901 901/R. TIPO A - codice A2940012 - CIVAB CIRASA91 FILTRO A CARBONI ATTIVI PER SOSTANZE GENERICHE
 CUPOLA ASPIRANTE modelli 901 901/R TIPO A - codice A2940012 - CIVAB CIRASA91 FILTRO A CARBONI ATTIVI PER SOSTANZE GENERICHE TIPO B - codice A2940026 - CIVAB CIRASA91 FILTRO A CARBONI IMPREGNATO PER SOSTANZE
CUPOLA ASPIRANTE modelli 901 901/R TIPO A - codice A2940012 - CIVAB CIRASA91 FILTRO A CARBONI ATTIVI PER SOSTANZE GENERICHE TIPO B - codice A2940026 - CIVAB CIRASA91 FILTRO A CARBONI IMPREGNATO PER SOSTANZE
Pillole di... Chimica organica
 ISIS Calabrese-Levi as 2009/2010 Pillole di... Chimica organica dispensa elaborata dalla prof.ssa Silvia Recchia sulla base del testo Chimica interattiva di Passannanti e Sbriziolo, Ed. Tramontana Trenz
ISIS Calabrese-Levi as 2009/2010 Pillole di... Chimica organica dispensa elaborata dalla prof.ssa Silvia Recchia sulla base del testo Chimica interattiva di Passannanti e Sbriziolo, Ed. Tramontana Trenz
TEST DI CHIMICA ORGANICA
 TEST DI CHIMICA ORGANICA Su numeri quantici, ibridazione del carbonio, gruppi funzionali, isomeria 1. Due atomi di C asimmetrici sono entrambi: A) ibridati sp 3 B) legati agli stessi raggruppamenti C)
TEST DI CHIMICA ORGANICA Su numeri quantici, ibridazione del carbonio, gruppi funzionali, isomeria 1. Due atomi di C asimmetrici sono entrambi: A) ibridati sp 3 B) legati agli stessi raggruppamenti C)
MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA
 MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità
MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità
PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO: CHIMICA, MATERIALI E BIOTECNOLOGIE
 RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
Giochi della Chimica 2013 Fase nazionale Classe C
 Giochi della himica 2013 Fase nazionale lasse www.pianetachimica.it 1. Un miscuglio di due alogenuri d argento (Agl e AgBr; 1,000 g) rivela all analisi la presenza di 6,457 10 1 g di Ag +. Individuare
Giochi della himica 2013 Fase nazionale lasse www.pianetachimica.it 1. Un miscuglio di due alogenuri d argento (Agl e AgBr; 1,000 g) rivela all analisi la presenza di 6,457 10 1 g di Ag +. Individuare
Chimica Organica. Definizione. La chimica organica è la chimica dei composti contenenti carbonio
 Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni
 Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Saggi di riconoscimento dei gruppi funzionali e preparazione dei derivati cristallini
 Saggi di riconoscimento dei gruppi funzionali e preparazione dei derivati cristallini F. rtuso - Analisi dei Medicinali II Derivati cristallini Il riconoscimento dei gruppi funzionali presenti in un composto
Saggi di riconoscimento dei gruppi funzionali e preparazione dei derivati cristallini F. rtuso - Analisi dei Medicinali II Derivati cristallini Il riconoscimento dei gruppi funzionali presenti in un composto
PROGRAMMAZIONE DIDATTICA ANNUALE DI DIPARTIMENTO
 ISTITUTO TECNICO INDUSTRIALE STATALE ALESSANDRO ROSSI - VICENZA PROGRAMMAZIONE DIDATTICA ANNUALE DI DIPARTIMENTO ANNO SCOLASTICO 2014-15 DIPARTIMENTO DI CHIMICA VICENZA 10/10/2014 CLASSE 3ACH DIPARTIMENTO
ISTITUTO TECNICO INDUSTRIALE STATALE ALESSANDRO ROSSI - VICENZA PROGRAMMAZIONE DIDATTICA ANNUALE DI DIPARTIMENTO ANNO SCOLASTICO 2014-15 DIPARTIMENTO DI CHIMICA VICENZA 10/10/2014 CLASSE 3ACH DIPARTIMENTO
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
LISTINO CARLO ERBA REAGENTS CHEMICALS/LABCHEM & BULKCHEM 2014/15 Validità 01/11/2014
 LabChem 300101 Assorbente per liquidi versati-re-puro 1 kg 48,00 LabChem 300102 Assorbente per liquidi versati-re-puro 5 kg 83,00 LabChem 300857 p-acetilfenetidina-re-puro 1 kg 466,00 LabChem 301251 Acetofenone-RE-Puro
LabChem 300101 Assorbente per liquidi versati-re-puro 1 kg 48,00 LabChem 300102 Assorbente per liquidi versati-re-puro 5 kg 83,00 LabChem 300857 p-acetilfenetidina-re-puro 1 kg 466,00 LabChem 301251 Acetofenone-RE-Puro
CHIMICA ORGANICA. L isomeria
 1 B-ISOMERIA IMIA ORGANIA L isomeria Gli isomeri sono composti diversi (ciascuno con proprietà fisiche e chimiche proprie) che hanno tuttavia la stessa composizione chimica e quindi la stessa formula chimica
1 B-ISOMERIA IMIA ORGANIA L isomeria Gli isomeri sono composti diversi (ciascuno con proprietà fisiche e chimiche proprie) che hanno tuttavia la stessa composizione chimica e quindi la stessa formula chimica
Azienda con sistema di gestione qualità conforme ai requisiti della norma UNI EN ISO 9001:2008. Certificato TÜV Italia n 50 100 3290 Rev.
 ASAL S.R.L. - APPARECCHI SCIENTIFICI ATTREZZATURE LABORATORI Azienda con sistema di gestione qualità conforme ai requisiti della norma UNI EN ISO 9001:2008. Certificato TÜV Italia n 50 100 3290 Rev. 03
ASAL S.R.L. - APPARECCHI SCIENTIFICI ATTREZZATURE LABORATORI Azienda con sistema di gestione qualità conforme ai requisiti della norma UNI EN ISO 9001:2008. Certificato TÜV Italia n 50 100 3290 Rev. 03
CAPPA ASPIRANTE MODELLO 900
 CAPPA ASPIRANTE MODELLO 900 MOD. 900/A CODICE 29940002 FILTRO A CARBONI ATTIVI MOD. 900/B CODICE 29940009 FILTRO A CARBONI ATTIVI PER APPLICAZIONI SPECIALI CODICE CIVAB CIRASA9C Distribuito da: Zetalab
CAPPA ASPIRANTE MODELLO 900 MOD. 900/A CODICE 29940002 FILTRO A CARBONI ATTIVI MOD. 900/B CODICE 29940009 FILTRO A CARBONI ATTIVI PER APPLICAZIONI SPECIALI CODICE CIVAB CIRASA9C Distribuito da: Zetalab
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
I termini e i concetti fondamentali
 unità Elementi di chimica I termini e i concetti fondamentali 1 la materia e le sue proprietà Le caratteristiche fondamentali della materia sono tre: la massa (m) o quantità di materia di cui sono formati
unità Elementi di chimica I termini e i concetti fondamentali 1 la materia e le sue proprietà Le caratteristiche fondamentali della materia sono tre: la massa (m) o quantità di materia di cui sono formati
Scelta del solvente per ricristallizzare
 Ghisa Matteo 3b Ch 07/02/2006 Scelta del solvente per ricristallizzare biettivo: lo scopo dell esperienza è quello di individuare, partendo dalle esperienze pratiche, una regola generale che indica qual
Ghisa Matteo 3b Ch 07/02/2006 Scelta del solvente per ricristallizzare biettivo: lo scopo dell esperienza è quello di individuare, partendo dalle esperienze pratiche, una regola generale che indica qual
CAPITOLO 4.1 UTILIZZAZIONE DI IMBALLAGGI, DI CONTENITORI INTERMEDI PER IL TRASPORTO ALLA RINFUSA (IBC) E DI GRANDI IMBALLAGGI
 CAPITOLO 4.1 UTILIZZAZIONE DI IMBALLAGGI, DI CONTENITORI INTERMEDI PER IL TRASPORTO ALLA RINFUSA (IBC) E DI GRANDI IMBALLAGGI 4.1.1 Disposizioni generali relative all imballaggio di merci pericolose diverse
CAPITOLO 4.1 UTILIZZAZIONE DI IMBALLAGGI, DI CONTENITORI INTERMEDI PER IL TRASPORTO ALLA RINFUSA (IBC) E DI GRANDI IMBALLAGGI 4.1.1 Disposizioni generali relative all imballaggio di merci pericolose diverse
INTRODUZIONE ALLA SPETTROSCOPIA NMR
 Mauro Tonellato INTRODUZIONE ALLA SPETTROSCOPIA NMR www.pianetachimica.it Basi teoriche della spettroscopia NMR www.pianetachimica.it Premessa La spettroscopia di Risonanza Magnetica Nucleare (NMR) è una
Mauro Tonellato INTRODUZIONE ALLA SPETTROSCOPIA NMR www.pianetachimica.it Basi teoriche della spettroscopia NMR www.pianetachimica.it Premessa La spettroscopia di Risonanza Magnetica Nucleare (NMR) è una
isomeria di struttura isomeria di posizione isomeria di catena stereoisomeria isomeria di conformazione isomeria di configurazione 'isomeria ottica
 ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
MODULO ASPIRANTE MODELLO 1200 COMBI
 MODULO ASPIRANTE MODELLO 1200 COMBI 1200 COMBI / A COD. 29940021 FILTRO A CARBONI ATTIVI 1200 COMBI / B COD. 29940024 FILTRO A CARBONI ATTIVI PER APPLICAZIONI SPECIALI CODICE CIVAB CIRASAC2 Ed. 01/11 Pagina
MODULO ASPIRANTE MODELLO 1200 COMBI 1200 COMBI / A COD. 29940021 FILTRO A CARBONI ATTIVI 1200 COMBI / B COD. 29940024 FILTRO A CARBONI ATTIVI PER APPLICAZIONI SPECIALI CODICE CIVAB CIRASAC2 Ed. 01/11 Pagina
