TEST DI CHIMICA ORGANICA
|
|
|
- Marino Cortese
- 7 anni fa
- Visualizzazioni
Transcript
1 TEST DI CHIMICA ORGANICA Su numeri quantici, ibridazione del carbonio, gruppi funzionali, isomeria 1. Due atomi di C asimmetrici sono entrambi: A) ibridati sp 3 B) legati agli stessi raggruppamenti C) appartenenti alla serie stereochimica D D) ibridati sp E) non ibridati 2. Lo ione ammonio (NH 4 + ) e il metano (CH 4 ) hanno in comune: A) il peso molecolare B) l ibridazione sp 3 C) l ibridazione sp 2 D) la struttura planare E) il carattere nettamente acido 3. Il cicloesano: A) presenta carattere aromatico B) è costituito da sei atomi di C e sei atomi di H C) ha struttura non planare D) possiede atomi di C ibridati sp E) dà facilmente reazioni di addizione 4. Un atomo di C viene definito secondario quando: A) è il secondo della catena carboniosa B) è legato ad altri due atomi di C C) è ibridato sp 2 D) fa parte della molecola di una ammina secondaria E) presenta due valenze invece di quattro 5. Qual è la struttura spaziale di una molecola con ibridazione sp 3? A) tetraedrica B) quadrata C) cubica D) cilindrica E) trigonale 6. A quale elemento neutro, non eccitato, appartiene la seguente struttura elettronica esterna 2s 2 2p 2? A) Fe B) O C) C D) N E) F 7. Gli orbitali ibridi sp 3 sono in numero di: A) 1 B) 2 C) 3 D) 4 E) 7 1
2 8. Qual è la forma geometrica di una ibridazione sp 2? A) tetraedrica B) quadrata C) cubica D) lineare E) trigonale planare 9. Nell acido cianidrico il C è ibridato: A) sp B) sp 2 C) sp 3 D) sp 4 E) non vi è ibridazione 10. Quale delle seguenti affermazioni relative al metano è errata? A) l atomo di C è ibridato sp 3 B) gli angoli di legame sono di circa 109 C) i quattro atomi di H si trovano ai vertici di un tetraedro regolare D) la molecola non è planare E) la molecola è polare 11. L ibridazione degli orbitali dell atomo di N: A) è di tipo sp 3 sia nell ammoniaca che nelle ammine B) è di tipo sp 2 sia nell ammoniaca che nelle ammine C) è di tipo sp nell ammoniaca e nelle ammine primarie, di tipo sp 2 nelle ammine secondarie, di tipo sp 3 nelle ammine terziarie D) è di tipo sp sia nell ammoniaca che nelle ammine E) è di tipo sp 3 nell ammoniaca, mentre nelle ammine non esiste ibridazione 12. Quale delle seguenti caratteristiche è comune al benzene e all etene? A) la scarsa reattività B) la struttura tetraedrica C) la capacità di dare facilmente reazioni di addizione D) l ibridazione sp 2 E) l ibridazione sp 13. Che tipo di ibridazione degli orbitali presenta il C nell etere dietilico? A) sp 3 B) sp 2 C) sp D) sp 3 d 2 E) sp 3 d 14. Nella molecola C 2 H 2 (acetilene) i due atomi di C sono uniti da: A) un legame π e due legami σ B) tre legami σ C) un legame σ e due π D) tre legami π E) un legame σ, un legame π e un legame dativo 15. Il gruppo funzionale CHO si chiama: A) alcoolico primario B) alcoolico secondario C) aldeidico D) carbossilico E) chetonico 2
3 16. L acetone e il propanale: A) sono antipodi ottici B) hanno entrambi forte carattere acido C) hanno entrambi forte carattere basico D) possiedono entrambi un carbonile E) sono epimeri 17. La molecola dei chetoni presenta il gruppo: A) carbammilico B) carbossilico C) carbonilico D) ossidrilico E) ammidico 18. Il gruppo funzionale CH 2 OH si chiama: A) alcolico primario B) alcolico secondario C) carbonilico D) carbossilico E) alcolico terziario 19. Il gruppo funzionale CH 3 -CH 2 -NH- CH 2 -CH 3 A) un nitrile B) un ammina primaria C) un ammide D) un nitrito E) un ammina secondaria 20. Un gruppo OH è presente: A) nei chetoni B) nelle ammine C) negli alcoli D) negli idrocarburi E) nelle ammidi 21. La formula generale di un aldeide è: A) R-CHO B) R-CN C) R-COOH D) R-R E) R-CH 2 OH 22. La desinenza one, secondo IUPAC spetta: A) ai sali di acidi a lunga catena B) agli esteri C) ai chetoni D) alle ammidi E) agli alcoli secondari 23. Quale delle seguenti formule è quella dell acido formico? A) CH 3 CH 2 COOH B) C 6 H 5 COOH C) HCOOH D) CH 3 CH 2 OH E) HCHO 3
4 24. Il fruttosio contiene i seguenti gruppi funzionali: A) amminico e alcolico B) carbossilico e alcolico C) chetonico e alcolico D) aldeidico e chetonico E) amminico e carbossilico 25. Oico, secondo IUPAC, è la desinenza da assegnare ad un: A) idrocarburo saturo B) chetone C) acido carbossilico D) idrocarburo polinsaturo E) alcool terziario 26. Un atomo di C è terziario se: A) è il terzo della catena carboniosa B) è coinvolto in un triplo legame C) è legato ad altri tre atomi di C D) è ibridato sp 3 E) ha numero di ossidazione Il gruppo funzionale COOH si chiama: A) carbonile B) carbossile C) carbamile D) metile E) radicale acido 28. Un esempio di ammina secondaria è rappresentata dalla formula: A) CH 3 -CH 2 -CO-NH 2 B) (CH 3 ) 3 N C) CH 3 -CH 2 -NH-CH 3 D) CH 3 -CH 2 -CH 2 -NH 2 E) CH 3 -CO-NH-CH Quale dei seguenti composti è un alogenuro alchilico? A) CH 3 CH 2 OH B) CH 3 Cl C) C 6 H 5 Cl D) CH 3 OCH 3 E) CH 3 COCl 30. Nella molecola di una ammide sono contenute almeno le seguenti specie atomiche: A) C e N B) C, N e O C) C, N e H D) N e O E) C, H, N e O 31. A quale categoria di composti organici appartiene (CH 3 CH 2 ) 2 O? A) eteri B) esteri C) anidridi D) aldeidi E) chetoni 4
5 32. Tra i seguenti solventi organici, indicare quello più clorurato: A) clorobenzene B) cloroformio C) cloruro di metile D) diclorometano E) para-di-clorobenzene 33. Un alcol si dice terziario quando: A) contiene tre atomi di carbonio B) contiene tre ossidrili C) per ossidazione fornisce tre molecole di acido D) l ossidrile è legato ad un carbonio terziario E) l ossidrile è legato al terzo atomo di carbonio 34. L urea: A) una diammina B) una diammide C) un amminoacido D) un derivato chetonico E) una proteina 35. I tioli contengono la funzione: A) SH B) S S C) SO 2 OH D) SO OH E) S OH 36. La formula dell acetone è: A) CH 3 -CO-CH 3 B) CH 3 -CH 2 -OH C) CH 3 Cl D) C 6 H 5 -COOH E) CH 3 -COOH 37. Quale delle seguenti formule rappresenta un fenolo? A) C 6 H 5 -O-C 6 H 5 B) C 6 H 5 -CH 2 -OH C) C 6 H 5 -CHO D) C 6 H 5 -COOH E) C 6 H 5 -OH 38. La formula R-CO-R corrisponde a: A) un chetone B) un ossiacido C) un etere D) un alchene E) una anidride 39. Un composto rappresentato dalla formula CH 3 CO O CO CH 3 è: A) un aldeide B) un chetone C) un anidride D) un etere E) un estere 5
6 40. Un ammide è rappresentata dalla formula: A) CH 3 -CH 2 -NH 2 B) (CH 3 ) 2 NH C) CH 3 -CO-NH 2 D) CH 3 -COO-NH 4 E) CH 3 -CH 2 -CN Gli ioni di ammonio quaternari in cui i quattro residui alchilici sono diversi l uno dall altro, presentano il fenomeno della stereoisomeria ottica. Così, per esempio, il metil-etil-propil-isobutilammonio esiste in due forme otticamente attive, in cui i gruppi alchilici sono disposti nello spazio in modo differente rispetto all atomo di azoto centrale, che presenta ibridazione sp 3, e costituisce un centro chirale; la situazione è del tutto analoga a quella che si verifica intorno ad un atomo di carbonio tetraedrico asimmetrico. 41. Quale delle seguenti affermazioni può essere dedotta dalla lettura del brano precedente? A) tutti i sali di ammonio quaternari presentano il fenomeno della stereoisomeria ottica B) l unico sale di ammonio quaternario che presenta stereoisomeria ottica è il metil-etil-propilisobutil-ammonio C) sia il carbonio che l azoto possono presentare ibridazione sp 3 D) l azoto presenta in tutti i suoi composti l ibridazione sp 3 E) non sempre il carbonio asimmetrico costituisce un centro chirale 42. L attività ottica è dovuta alla presenza nelle molecole di: A) almeno un atomo di C asimmetrico B) un doppio legame C) due gruppi funzionali diversi D) un triplo legame E) una struttura ciclica 43. L acetone e il propanale: A) sono antipodi ottici B) sono isomeri di struttura C) hanno lo stesso punto di ebollizione D) sono difficilmente ossidabili E) hanno entrambi netto carattere acido L amminoacido alanina è una molecola asimmetrica, perché il suo atomo di carbonio centrale è legato a quattro gruppi diversi tra loro: un metile, un gruppo amminico, un gruppo carbossilico e un atomo di idrogeno; l atomo di carbonio centrale dell alanina è pertanto un atomo di carbonio asimmetrico, detto anche chirale. Un composto in cui è presente un centro chirale esiste in due forme isomere, dette enantiomeri o antipodi ottici. I due enantiomeri hanno la stessa formula grezza e la stessa formula di struttura, differiscono l uno dall altro per la disposizione spaziale dei gruppi intorno al carbonio asimmetrico. 44. Quale delle seguenti affermazioni può essere dedotta dalla lettura del brano precedente? A) l atomo di C centrale dell alanina è simmetrico perché è legato ad un gruppo metilico B) uno dei gruppi legati al carbonio centrale dell alanina è CHO C) in un composto che contiene un centro chirale deve essere presente il gruppo amminico D) uno dei gruppi legati al carbonio centrale dell alanina è CH 2 -CH 3 E) i due enantiomeri dell alanina hanno lo stesso peso molecolare 6
7 45. Si definisce racemo: A) una miscela in parti uguali di due enantiomeri B) una miscela in parti uguali di due diasteroisomeri C) un composto otticamente attivo D) un composto con due centri chirali equivalenti E) una qualsiasi miscela di due enantiomeri 46. L isomeria ottica è dovuta alla presenza nella molecola di: A) un doppio legame B) un triplo legame C) un atomo di carbonio asimmetrico D) due gruppi funzionali diversi E) più atomi di carbonio 47. Gli isomeri cis e trans sono: A) isomeri ottici B) isomeri geometrici C) isomeri conformazionali D) tautomeri E) non esistono queste definizioni 48. Gli isomeri sono composti che hanno: A) la stessa formula di struttura B) la stessa formula bruta C) la stessa carica D) lo stesso numero di elettroni E) le stesse proprietà chimiche 49. Quando si ha l isomeria ottica? A) quando due composti diversi hanno la stessa formula grezza B) quando si ha la presenza di un doppio legame tra due atomi di C C) quando si ha diversa posizione di un sostituente su una catena di atomi di C D) quando si ha la presenza di un C chirale E) quando si ha la presenza di un triplo legame tra due atomi di C 50. Quali delle sostanze di formula: A) CH 3 -CH 2 Cl B) CH 3 -CHCl 2 C) CH 3 -CCl 3 D) CH 2 Cl-CH 2 Cl sono isomere tra loro? A) A e B B) A e C C) A e D D) B e D E) B e C 51. Un atomo di C è asimmetrico quando: A) presenta ibridazione sp 2 B) la molecola che lo contiene presenta elementi di simmetria C) è legato a quattro gruppi o atomi diversi D) è legato ad altri 4 atomi di carbonio E) presenta ibridazione sp 7
8 52. Quale dei seguenti composti possiede nella molecola più atomi di ossigeno? A) dialdeide B) glicole etilenico C) alcool terziario monofunzionale D) alcool primario monofunzionale E) diidrossiacetone 53. Quale delle seguenti sostanze NON è un amminoacido? A) triptofano B) leucina C) alanina D) glicina E) anilina 54. Il butirrato di propile è: A) un sale B) un etere C) un estere D) un radicale alchilico E) un radicale acido 55. Le ammine hanno carattere: A) fortemente acido B) debolmente acido C) fortemente basico D) debolmente basico E) sempre neutro 56. Quale delle seguenti coppie di composti sono collegate da legami a ponte di idrogeno? A) acqua etano B) etano - propano C) etanolo - metanolo D) acqua - ciclopentano E) benzene - acqua 57. Si definiscono isomeri, composti A) che hanno la stessa formula molecolare e diversa disposizione nello spazio B) con diversa formula molecolare ma stessa disposizione nello spazio C) che appartengono alla stessa serie omologa D) che hanno gli stessi punti di fusione E) che non appartengono alla stessa serie omologa 58. Quale è la formula bruta del dimetilchetone? A) C 3 H 3 O 2 B) C 3 H 2 O C) C 3 H 3 O D) C 3 H 4 O E) C 3 H 6 O 59. Quale è la formula bruta dell aldeide propionica (propanale)? A) C 3 H 5 O B) C 3 H 6 O C) C 2 H 4 O D) C 2 H 3 O 2 E) C 3 H 6 O 2 8
9 60. Per quanti atomi di idrogeno il benzene differisce dal cicloesano? A) 3 B) 5 C) 4 D) 6 E) Quale tra le seguenti formule di composti organici rappresenta un generico estere? A) RCOOR B) RCOR C) RCOOH D) ROR E) ROH 62. La seguente struttura organica CH 3 COOCH 2 CH 3 corrisponde a: A) un acido carbossilico B) un etere C) un estere D) un chetone E) un fenolo 63. Il cicloesanone è: A) un alcol B) una aldeide C) un idrocarburo aromatico D) un chetone E) un alchene 64. Quanti isomeri strutturali della molecola C 4 H 9 Br esistono? A) 3 B) 2 C) 4 D) 5 E) Quanti atomi di idrogeno sono presenti in una molecola di ciclopentadiene? A) 6 B) 10 C) 8 D) 7 E) Nei trigliceridi gli acidi grassi sono legati a: A) 1- propanolo B) glicerolo C) glicerofosfato D) propandiolo E) acido glicerico 67. Quale delle seguenti è la formula bruta di un idrocarburo lineare monoinsaturo? A) C n H 2n+2 B) C n H n+2 C) C n H 2n-2 D) C n H n-2 E) C n H 2n 9
10 68. Qual è la formula dell acetato di calcio? A) Ca 2 (C 2 H 3 O 2 ) 4 B) Ca 2 C 2 H 3 O 2 C) Ca(C 2 H 3 O 2 ) 2 D) CaC 2 H 3 O 2 E) Ca(C 2 H 3 O 2 ) Qual è lo stato di ibridazione degli orbitali del carbonio nel cicloesano (C 6 H 12 )? A) sp B) sp 2 C) sp 3 D) sp 2 d E) sp 3 d 70. Che cosa sono gli enantiomeri? A) isomeri geometrici B) isomeri strutturali senza particolari proprietà C) isomeri ottici che sono l uno l immagine speculare dell altro D) isomeri conformazionali E) isomeri ottici che non sono l uno l immagine speculare dell altro 71. Se la soluzione di un composto è in grado di deviare la luce polarizzata: A) il composto è sicuramente a catena chiusa B) il composto presenta almeno un atomo di carbonio con ibridazione tetraedrica C) il composto presenta almeno un atomo di carbonio con ibridazione trigonale planare D) non si tratta di un composto aromatico E) il composto contiene almeno un doppio legame 72. C 5 H 10 è la formula bruta del: A) pentano B) pentene C) ciclopentene D) pentadiene E) isopentano 73. Quale tra le seguenti sostanze è un composto eterociclico con carattere aromatico? A) fenolo B) tetraidrofurano C) piridina D) cicloesene E) benzene 74. Il gruppo funzionale CH 2 OH si chiama: A) alcolico terziario B) alcolico secondario C) alcolico primario D) carbossilico E) carbonilico 75. In quale delle seguenti molecole è contenuto meno ossigeno? A) acido butanoico B) esilpropiletere C) 2,4-diidrossipentanale D) acetato di etile E) diidrossiacetone 10
11 76. Una ammina terziaria deve contenere almeno: A) sei atomi di azoto B) due atomi di carbonio C) tre atomi di azoto D) sei atomi di carbonio E) tre atomi di carbonio 77. Gli omega tre sono: A) acidi grassi contenente azoto B) acidi grassi polinsaturi C) acidi grassi ossigenati D) acidi grassi saturi E) acidi grassi monoinsaturi 78. Quale delle formule seguenti corrisponde a una generica ammide? A) R-CH 2 -NH 2 B) R 2 C=NH C) R-CO-NH 2 D) R-CH 2 -N=N-CH 3 E) R-O-NH 2 Su reazioni di vario tipo 79. Il cicloesene: A) presenta carattere aromatico B) è costituito da 6 atomi di C e 4 atomi di H C) possiede tutti i carboni ibridati sp 2 D) possiede atomi di C ibridati sp E) dà facilmente reazioni di addizione 80. Nella reazione tra l acido acetico e l alcool propilico si forma: A) un etere ed acqua B) un chetone ed acqua C) un estere ed ossigeno D) una anidride E) un estere ed acqua 81. Per ossidazione blanda degli alcoli secondari si ottengono: A) acidi carbossilici B) chetoni C) miscele di aldeidi di e chetoni D) aldeidi E) miscele di alcoli primari e di alcoli terziari 82. Il benzene, in presenza di opportuni catalizzatori, reagisce con l acido nitrico, con il cloro e con il clorometano; si tratta, in tutti e tre i casi, di reazione di: A) sostituzione nucleofila B) addizione elettrofila C) addizione nucleofila D) sostituzione elettrofila E) sostituzione radicalica 11
12 83. La reazione del propano C 3 H 8 con O 2 (combustione) avviene con formazione di CO 2 e H 2 O; per bruciare una mole di propano, le moli di O 2 necessarie sono: A) 4 B) 5 C) 6 D) 7 E) La reazione caratteristica del benzene è: A) addizione nucleofila B) addizione elettrofila C) sostituzione nucleofila D) sostituzione elettrofila E) esterificazione 85. I chetoni per blanda ossidazione danno: A) acidi carbossilici B) nessun prodotto C) composti aldeidici D) eteri E) alcoli secondari 86. Dalla reazione tra CH 3 -CH 2 -COOH e CH 3 OH si ottiene: A) un sale B) un etere C) un estere D) una anidride E) un chetone 87. Quale delle seguenti reazioni conduce alla formazione di ammidi? A) alcool + alcool B) aldeide + alcool C) ammina + alcool D) ammina + aldeide E) acido + ammoniaca 88. Quale delle seguenti reazioni ha come prodotto un estere? A) alcool + alcool B) acido + alcool C) acido + acido D) alcool + aldeide E) aldeide + chetone 89. I chetoni danno reazioni di: A) somma al doppio legame C=N B) somma al doppio legame C=O C) ossidazione con formazione di esteri D) condensazione con formazione di eteri E) sostituzione elettrofila 90. Gli acidi carbossilici, R-COOH, interagiscono con l acqua dando luogo a: A) R-COO - + H 3 O + B) R-COO + + H 3 O + C) R-COO 2 + H 2 O 2 D) R-CHO + H 2 O 2 E) R-CO + + OH - 12
13 91. Per ossidazione dell etanolo si può ottenere: A) glicerolo B) acido acetico C) acetone D) metano E) propano 92. Qual è il prodotto di addizione di acqua ad un alchene A) alcool B) etere C) aldeide D) chetone E) alcano 93. Per idrogenazione degli alcheni si ottengono: A) idruri B) alcoli C) alcani D) alchini E) aldeidi 94. Un etere si può preparare per reazione tra: A) un acido carbossilico ed un alcool B) un aldeide ed un estere C) un aldeide ed un alcool D) due acidi carbossilici E) due alcoli 95. La reazione di riduzione delle aldeidi porta alla formazione di: A) alcoli primari B) nitrili C) alcoli secondari D) acidi carbossilici E) eteri 96. I prodotti della combustione del propene sono: A) C e H 2 O B) CO 2 e H 2 O C) C e CH 4 D) CO e H 2 O 2 E) CO e H 2 O 97. La reazione del pentano C 5 H 12 con O 2 (combustione) avviene con formazione di CO 2 ed H 2 O. Per una molecola di pentano le molecole di O 2 necessarie sono: A) 8 B) 7 C) 6 D) 5 E) Mediante decarbossilazione dell acido propionico si ottiene: A) propano B) etano C) butano D) propene E) aldeide propionica 13
14 99. La reazione CH 2 =CH 2 + H 2 CH 3 -CH 3 è una reazione di: A) ossidazione B) addizione C) doppio scambio D) decomposizione E) idrolisi 100. La reazione di idrolisi delle ammidi primarie porta alla formazione di: A) ammoniaca ed alcoli B) ammoniaca ed acidi carbossilici C) ammoniaca ed aldeidi D) azoto ed acidi carbossilici E) ammine ed aldeidi 101. Quale delle seguenti reazioni porta alla formazione di ammidi? A) alcool + alcool B) chetone + alcool C) ammoniaca + alogeno alcano D) ammoniaca + aldeide E) ammoniaca + acido carbossilico 102. Mediante una reazione di deidrogenazione, da un alcool secondario si ottiene: A) una aldeide B) una ammide C) un etere D) un alchene E) nessuno dei composti indicati sopra 103. La reazione che trasforma gli alcani in alcheni è: A) idrogenazione B) riduzione C) deidrogenazione D) deidratazione E) deprotonazione 104. Gli esteri derivano dalla reazione tra: A) un alcool e una aldeide B) un idracido e un alcool C) un ossiacido e un alcool D) due molecole di alcool E) un ossiacido e una aldeide 105. L etene reagisce con il cloro, con l acqua ossigenata e con lo iodio; si tratta, in tutti e tre i casi, di reazioni di: A) sostituzione nucleofila B) addizione elettrofila C) addizione nucleofila D) sostituzione elettrofila E) meccanismo diverso da quelli indicati nelle precedenti risposte Gli esteri si ottengono dalla reazione tra: A) un acido ossigenato organico o inorganico e un alcool, con eliminazione di acqua B) un aldeide e un alcool con eliminazione di acqua C) un aldeide e un alcool senza eliminazione di acqua D) un acido ossigenato organico o inorganico e un alcool, senza eliminazione di acqua E) due alcooli, uguali o differenti, con eliminazione di acqua 14
15 I composti organici in cui uno o più atomi di idrogeno di un idrocarburo alifatico o aliciclico vengono sostituiti da gruppi ossidrilici vengono definiti alcooli. Nonostante l apparente rassomiglianza con gli idrossidi metallici, essi non si ionizzano per formare ioni ossidrile, e perciò non hanno gusto amaro né consistenza scivolosa, e non colorano in blu la cartina al tornasole Quale delle seguenti affermazioni può essere dedotta dalla lettura del brano precedente? A) la reazione degli alcooli con il tornasole è dovuta agli ioni ossidrile B) gli idrossidi metallici non sono in grado di formare ioni ossidrile C) gli idrossidi metallici non hanno consistenza scivolosa né gusto amaro D) gli alcooli hanno comportamento chimico e fisico simile a quello degli idrossidi metallici E) il gusto amaro degli idrossidi metallici è dovuto agli ioni ossidrile 108. In relazione ai problemi legati all uso dei combustibili nella vita quotidiana, indica quale delle seguenti affermazioni NON è corretta: A) alcuni combustibili contengono zolfo che durante la combustione reagendo con l ossigeno forma ossidi acidi allo stato gassoso B) gli ossidi di azoto e di zolfo, prodotti nelle combustioni, possono reagire con l acqua e formare sostanze acide che ricadono a terra creando il problema delle piogge acide C) il problema dell effetto serra potrebbe essere contenuto se tutti utilizzassero come combustibile solo legna D) le piogge acide provocano gravi danni alle foreste E) la grande produzione di CO2 incrementa l effetto serra dell atmosfera causando un aumento della temperatura globale 109. Individua la successione numerica che indica correttamente i coefficienti della seguente reazione chimica: C 6 H 6 + O 2 CO 2 + H 2 O A) 2, 7 = 3, 1 B) 1, 6 = 3, 3 C) 1, 6 = 6, 3 D) 2, 9 = 12, 6 E) 2, 15 = 12, Un estere può essere prodotto dalla reazione dell acido propanoico con l 1- butanolo. Qual è la formula dell estere? A) C 4 H 9 COOC 3 H 7 B) CH 3 COOC 4 H 9 C) C 2 H 5 COOC 4 H 9 D) C 3 H 7 COOC 4 H 9 E) C 2 H 5 COOC 2 H Cosa si ottiene per idrogenazione catalitica di un acido grasso monoinsaturo? A) un tioestere dell acido grasso B) un trigliceride C) il corrispondente acido grasso saturo D) un fosfolipide E) un estere dell acido grasso 112. Il pentene reagisce con l idrogeno, con l acqua ossigenata e con lo iodio; si tratta in tutti e tre i casi, di reazione di: A) sostituzione elettrofila B) sostituzione nucleofila C) addizione elettrofila D) addizione nucleofila E) meccanismo diverso da quello indicato nelle altre risposte 15
16 Su carboidrati, lipidi, proteine, enzimi, acidi nucleici 113. L emoglobina sta al Fe come la clorofilla sta al: A) Zn B) Mg C) Mn D) Al E) Co 114. Un amminoacido essenziale è: A) un amminoacido che è codificato da una sola tripletta B) un amminoacido che le nostre cellule non sanno sintetizzare C) un amminoacido che è presente solo nella proteina di origine vegetale D) un amminoacido che fa parte del sito attivo di un enzima E) un amminoacido presente in tutte le proteine La glutammato deidrogenasi è un enzima allosterico complesso. Il suo peso molecolare è di circa unità di massa atomica; l enzima è formato da sei subunità identiche, ognuna delle quali contiene una singola catena polipeptidica Ammettendo che il peso molecolare medio di ciascun residuo di aminoacido sia 100 u.m.a, il numero di tali residui presenti in ciascuna subunità dell enzima è circa: A) 500 B) 5000 C) D) 3000 E) 300 Gli enzimi hanno un ph ottimale caratteristico, al quale la loro attività è massima; a ph ottimale i gruppi donatori o accettori di protoni nel sito catalitico dell enzima si trovano nelle migliori condizioni di ionizzazione. Il ph ottimale di un enzima non è necessariamente identico al ph del suo ambiente naturale, il quale può essere anche abbastanza più alto o abbastanza più basso. L attività catalitica degli enzimi può essere regolata variando il ph dell ambiente circostante Quale delle seguenti affermazioni può essere dedotta dalla lettura del brano precedente? A) al ph ottimale i gruppi accettori e donatori di protoni del sito catalitico dell enzima sono dissociati in misura uguale B) il ph ottimale coincide col ph dell ambiente naturale dell enzima C) l attività dell enzima cresce in genere al crescere del ph D) variando il ph l attività dell enzima varia E) se il ph è molto basso, l enzima perde del tutto la sua attività 117. Quale delle seguenti sostanze NON è una proteina? A) colesterolo B) fibrinogeno C) lisozima D) mioglobina E) tripsina 118. Nelle proteine la struttura terziaria non è influenzata: A) dalle interazioni idrofobiche B) dalla sequenza degli amminoacidi C) dai legami idrogeno D) dai legami disolfuro E) dai legami peptidici 16
17 Nell uomo solo una piccola parte dell energia deriva dal catabolismo degli amminoacidi; dopo la rimozione dei gruppi amminici per transaminazione, gli scheletri carboniosi degli amminoacidi subiscono una degradazione ossidativa a composti che sono in grado di entrare nel ciclo dell acido citrico per venirvi ossidati a diossido di carbonio ed acqua Quale delle seguenti affermazioni NON può essere dedotta dalla lettura del brano precedente? A) gli scheletri carboniosi degli amminoacidi vengono trasformati in sostanze capaci di entrare nel ciclo dell acido citrico B) la rimozione dei gruppi amminici degli amminoacidi fornisce una parte dell energia C) gli scheletri carboniosi degli amminoacidi vengono trasformati in CO 2 e H 2 O D) il catabolismo degli amminoacidi contribuisce a fornire energia E) una grande parte dell energia deriva da processi metabolici diversi dal catabolismo degli amminoacidi Gli animali superiori non sono in grado di sintetizzare alcuni amminoacidi, che per essi risultano quindi essenziali, cioè da assumere necessariamente dall esterno; l impossibilità di sintetizzare gli amminoacidi essenziali è legata alla mancanza, negli animali superiori, di alcuni enzimi necessari a tali sintesi; le più complesse delle vie che portano alla formazione di amminoacidi essenziali sono quelle che portano a fenilalanina, triptofano e istidina, che presentano nelle loro molecole anelli benzenici od eterociclici; la sintesi di questi anelli, in particolare dei due anelli condensati del triptofano, richiede numerosi passaggi enzimatici piuttosto complicati Quale delle seguenti affermazioni può essere dedotta dalla lettura del brano precedente? A) gli animali superiori non sono in grado di sintetizzare alcun amminoacido B) la fenilalanina non è un amminoacido essenziale per gli animali superiori C) l impossibilità di sintesi degli amminoacidi essenziali negli animali superiori può essere superata modificando i relativi enzimi D) l unico amminoacido che gli animali superiori devono assumere dall esterno è il triptofano, che è l amminoacido più difficile da sintetizzare E) le vie metaboliche che portano alla sintesi di anelli benzenici od eterociclici sono in genere piuttosto complesse 121. Che cos è l RNA? A) acido grasso B) acido desossiribonucleico C) acido ribonucleico D) acido lattico E) acido glutammico 122. Quale dei seguenti composti contiene soltanto glucosio? A) amido B) saccarosio C) DNA D) proteina E) lipide 123. Gli acidi ribonucleici sono costituiti da: A) basi azotate acido solforico ribosio B) amminoacidi acido fosforico - desossiribosio C) basi azotate acido fosforico - ribosio D) basi azotate acido fosforico - desossiribosio E) acidi grassi fosfato - ribosio 17
18 124. Nella cellula l ATP ha funzioni di: A) riserva di energia chimica B) attivatore-trasportatore di proteine C) attivatore di qualsiasi tipo di enzima D) riserva di fosfati organici ed inorganici E) svolge tutte queste funzioni 125. La struttura primaria di una proteina, formata da una o più catene polipeptidiche, è definita da: A) la disposizione assunta dalle catene polipeptidiche quando sono denaturate B) il ripiegamento ad alfa-elica presente in alcuni tratti delle catene polipeptidiche C) la forma assunta dalla proteina per la presenza di ponti disolfuro D) l ordine di successione degli aminoacidi nelle catene polipeptidiche E) la posizione nella catena proteica dei gruppi amminici primari 126. Un nucleoside è: A) l estere di una base azotata con acido fosforico B) il glicoside di una base azotata con ribosio o desossiribosio C) l anidride di un acido nucleico D) l estere fosforico del ribosio E) un acido nucleico a basso peso molecolare 127. Gli enzimi sono: A) proteine con attività catalitica B) macromolecole biologiche legate alla divisione cellulare C) molecole informazionali D) attivatori della sintesi proteica E) alcune muffe capaci di favorire la fermentazione 128. Gli acidi nucleici sono composti da unità chiamate: A) basi azotate B) nucleosidi C) nucleotidi D) adenine E) amminoacidi 129. Quali legami chimici determinano la struttura primaria di una proteina: A) legami idrogeno B) legami covalenti C) interazioni idrofobiche D) forze di Van der Waals E) legami dativi 130. Indicare quale di questi composti contiene Fe: A) trigliceridi B) mioglobina C) clorofilla D) carotene E) insulina 131. Gli enzimi catalizzano le reazioni chimiche. Questo significa che: A) le accelerano aumentando la probabilità di collisione tra i reagenti B) forniscono energia ai reagenti C) sottraggono energia ai reagenti D) le rendono energeticamente possibili E) aumentano la temperatura delle reazioni 18
19 132. Le proteine sono polimeri costituiti: A) dall unione di più molecole di acidi grassi B) da unità monosaccaridiche unite da legami glicosidici C) da amminoacidi legati tra loro da legami peptidici D) dall unione di più molecole di acidi bicarbossilici E) da amminoacidi legati tra loro con legami idrogeno 133. Polisaccaridi strutturali rispettivamente dei vegetali e degli animali sono: A) amido e glicogeno B) cellulosa e amido C) cellulosa e glicogeno D) glicogeno e mucopolisaccaridi E) cellulosa e mucopolisaccaridi 134. Il colesterolo è: A) uno zucchero B) uno steroide C) una proteina vegetale D) una tossina animale E) una vitamina 135. Quale, tra i seguenti composti, NON è un costituente di un generico acido nucleico? A) timina B) adenina C) guanina D) serina E) citosina 136. I grassi sono: A) oligosaccaridi B) polipeptidi C) acidi carbossilici D) acilgliceroli E) idrocarburi ad alto peso molecolare 137. Nelle proteine, la struttura primaria è definita: A) dai legami a idrogeno B) dalla composizione in amminoacidi C) dalla sequenza degli amminoacidi D) dalla formazione di una alfa elica E) dalla struttura della prima subunità 138. L insulina è un: A) ormone steroideo B) enzima C) ormone proteico D) antibiotico E) amminoacido 139. L albumina è: A) un trigliceride B) una ammina C) una proteina D) un amminoacido E) un polisaccaride 19
20 140. La struttura quaternaria di una proteina è generata: A) dall ordine di sequenza degli amminoacidi B) dai legami idrogeno fra legami peptidici C) da legami disolfuro D) dalle interazioni non covalenti fra più subunità E) da legami covalenti fra subunità 141. Il legame peptidico è presente: A) negli acidi nucleici B) nelle proteine C) nei polisaccaridi D) nei carboidrati E) solo nel DNA 142. L emoglobina: A) trasporta elettroni B) trasporta ossigeno C) catalizza la degradazione dell amido D) fornisce energia ai tessuti E) contiene cobalto 143. I glicidi sono: A) zuccheri complessi B) polimeri di amminoacidi C) prodotti di idrolisi dei grassi D) esteri della glicerina con acidi grassi E) alcoli polivalenti 144. Quale dei seguenti anelli eterociclici è sempre presente nella struttura degli acidi nucleici? A) tiofene B) piridina C) pirimidina D) pirrolo E) pirazina 145. I comuni lipidi sono costituiti da mescolanze di: A) glicidi B) glicerine C) gliceridi D) acidi grassi superiori E) esteri della glicerina con altri alcoli 146. Le proteine derivano: A) dall idrolisi dei grassi B) dalla condensazione di zuccheri C) dall idrolisi di amminoacidi D) dalla condensazione di amminoacidi E) dalla condensazione di zuccheri e basi azotate 147. Quale delle seguenti macromolecole è un omopolimero? A) glicogeno B) DNA C) emoglobina D) RNA E) albumina 20
21 148. Il valore calorico dei seguenti componenti alimentari è (Kcal/g): carboidrati 4; grassi 9; proteine 4. Un campione di formaggio contiene 19,5 g di proteine, 0,5 g di grassi e 2,0 g di carboidrati. Il valore calorico totale del campione ammonta a Kcal: A) 4,5 B) 78,0 C) 90,5 D) 94,6 E) 100, Se si idrolizza un trigliceride in ambiente basico, si ottengono: A) grassi B) proteine C) un alcool trivalente e saponi D) tre molecole di glicerolo E) una molecola di acido carbossilico e tre molecole di alcool monovalente 150. Le basi azotate presenti nell RNA sono: A) adenina timina uracile citosina B) adenina guanina timina citosina C) adenina guanina pirimidina citosina D) adenina guanina uracile citosina E) alanina guanina uracile citosina 151. I legami che definiscono la struttura primaria delle proteine sono: A) adipici B) peptidici C) idrogeno D) ossigeno E) disolfuro 152. Quale delle seguenti sostanze NON è un amminoacido A) leucina B) anilina C) alanina D) glicina E) triptofano 153. La percentuale di acqua nell organismo umano è, in media, circa il: A) 40% B) 90% C) 5% D) 70% E) 15% 154. In un disaccaride i due monosaccaridi costituenti sono legati attraverso un legame: A) ionico B) glicosidico C) a ponte idrogeno D) secondario E) peptidico 155. A ph inferiore al suo punto isoelettrico, un amminoacido è prevalentemente in forma: A) anfionica B) cationica C) senza carica D) anionica E) tautomeria 21
22 156. L attività di un enzima dipende dalla temperatura, e si raddoppia per ogni aumento di 10 C; se la temperatura aumenta di 20 C, qual è l aumento percentuale dell attività dell enzima? A) 100% B) 200% C) 300% D) 400% E) 500% 157. Il legame che stabilizza l alfa elica di una proteina è: A) glicosidico B) peptidico C) disolfuro D) a ponte idrogeno E) ionico 158. L acido glutammico è un: A) dolcificante prodotto dagli amidi B) amminoacido naturale C) derivato dal glucosio D) acido corrosivo e velenoso E) polipeptide con funzioni vitaminiche 159. Il comune zucchero da cucina è: A) il fruttosio B) il glucosio C) il saccarosio D) il maltosio E) la saccarina 160. Il glucosio è un: A) monosaccaride B) chetoesoso C) disaccaride D) aldopentoso E) lipide semplice 161. Glucosio e fruttosio: A) hanno diverso numero di atomi di carbonio B) hanno diverso gruppo funzionale C) hanno diverso peso molecolare D) sono entrambi disaccaridi E) sono entrambi polisaccaridi 162. Gli amminoacidi naturali sono: A) 8 B) poco più di 20 C) più di 50 D) più di 1000 E) in numero illimitato 163. I trigliceridi sono: A) zuccheri complessi B) triesteri del glicerolo C) i prodotti di idrolisi dei grassi D) miscele di glicerolo e di altri trioli E) tripeptidi contenenti glicina 22
23 164. Il legame peptidico è un legame di tipo: A) acetalico B) ammidico C) etereo D) estereo E) glicosidico 165. La glicerina è: A) un alcool terziario B) un alcool esterificato C) un propantriolo D) non è un alcool E) un alcool primario 166. I carboidrati sono: A) acidi carbossilici in soluzione acquosa B) basi organiche C) poliosi-aldeidi e poliosi-chetoni D) amminoacidi E) acidi inorganici 167. Quale dei seguenti composti è un amminoacido? A) adrenalina B) colina C) treonina D) istammina E) uridina 168. L idrolisi completa di una proteina provoca la formazione di: A) amminoacidi B) acidi e sali ammonici C) polipeptidi D) sali amminici e amminoacidi E) acidi carbossilici e ammine 169. Un amminoacido è una: A) sostanza contenente i gruppi carbossilico ed amminico B) sostanza contenente i gruppi funzionali alcolico ed amminico C) sostanza che per idrolisi produce proteine D) sostanza ottenuta per idrolisi dei trigliceridi E) proteina semplice 170. Quale dei seguenti glicidi NON è un monosaccaride? A) glucosio B) galattosio C) saccarosio D) fruttosio E) ribosio 171. Indicare quale delle seguenti sostanze ha comportamento anfotero: A) un acido nucleico B) un amminoacido C) un monosaccaride D) un trigliceride E) un polisaccaride 23
24 172. Il legame che unisce due osi nelle molecole di un dioloside è: A) glicosidico B) sulfidrilico C) estereo D) carbammidico E) peptidico 173. L idrolisi dell amido conduce a: A) acidi grassi B) aldeidi e chetoni C) glucosio D) glicerolo E) glucosio e fruttosio 174. Mediante la reazione di saponificazione di un trigliceride si ottiene: A) glicerina e saponi B) sapone e zucchero C) glicerina e glucosio D) glucosio e saponi E) glucosio e acidi grassi 175. Il fruttosio contiene i seguenti gruppi funzionali: A) amminico e alcolico B) carbossilico e alcolico C) chetonico e alcolico D) aldeidico e chetonico E) amminico e carbossilico 176. La denominazione scientifica dell aspirina è: A) acido salicilico B) estere aromatico dell acido picrico C) acido acetilsalicilico D) estere tra acido salicilico e aldeide acetica E) salicilato di etile 177. Il legame glicosidico si stabilisce tra: A) due funzioni aldeidiche B) due funzioni chetoniche C) una funzione aldeidica e una funzione carbossilica D) una funzione emiacetalica e una funzione alcolica E) una funzione aldeidica e una funzione chetonica 178. Nella molecola di un amminoacido sono contenute almeno le seguenti specie atomiche: A) carbonio e azoto B) azoto e ossigeno C) carbonio, azoto e idrogeno D) carbonio, azoto e ossigeno E) carbonio, idrogeno, azoto e ossigeno 179. Il lattosio è un disaccaride formato da: A) glucosio e fruttosio B) galattosio e mannosio C) glucosio e galattosio D) due molecole di glucosio E) due molecole di galattosio 24
25 180. Alcuni zuccheri sono detti esosi perché: A) hanno sei atomi di C nella molecola B) sono disaccaridi C) presentano sei doppi legami nella molecola D) sono costituiti da sei monomeri E) contengono sei gruppi alcolici 181. Che cos è l adenina? A) una base azotata B) un amminoacido C) uno zucchero D) una vitamina E) un acido grasso 182. Nell idrolisi di un protide naturale semplice si formano: A) L-amminoacidi B) D-amminoacidi C) ammine D) monosaccaridi E) acidi grassi 183. Quale di queste sostanze è un acido grasso? A) CH 3 CH 2 OH B) C 6 H 5 -COOH C) C 13 H 27 -COOH D) CH 3 NH 2 E) CH 3 CH Una proteina con punto isoelettrico uguale a 4 è particolarmente ricca in amminoacidi: A) basici B) apolari C) contenenti solfo D) acidi E) con residuo aromatico 185. I carboidrati sono composti organici che contengono C, H e O; H e O sono presenti nella stessa proporzione dell acqua. Quale dei seguenti composti è un carboidrato? A) C 57 H 110 O 6 stearina B) C 12 H 18 N 4 O 2 S tiamina C) C 51 H 98 O 6 palmitina D) (C 6 H 10 O 5 ) n amiloso E) C 17 H 20 N 4 O 6 riboflavina 186. La reazione intramolecolare che provoca la conversione di un monosaccaride dalla forma aperta alla forma ciclica è una reazione di: A) esterificazione B) addizione C) neutralizzazione D) condensazione E) ossidazione 187. Quando due molecole di glucosio (C 6 H 12 O 6 ) reagiscono per formare una molecola di maltosio (C 12 H 22 O 11 ) la formula del maltosio non è C 12 H 24 O 12 perché: A) si verifica una idrolisi B) si elimina acqua C) si aggiunge acqua D) si ha una transesterificazione E) si verifica una ossidazione 25
26 188. Il glucosio differisce dal galattosio per: A) la configurazione di un C asimmetrico B) la composizione isotopica C) le dimensioni della catena D) il numero di gruppi OH presenti nella molecola E) il peso molecolare 189. Quale degli acidi grassi sotto indicati contiene un solo doppio legame tra C e C? A) acido stearico B) acido oleico C) acido linoleico D) acido linolenico E) acido palmitico 190. La glicina (o glicocolla) è: A) un polisaccaride B) un amminoacido C) un polimero di sintesi D) una proteina adesiva E) un dipeptide 191. Quale dei seguenti composti è una proteina? A) C 12 H 22 O 11 B) C 6 H 2 O 6 C) C 708 H 1130 O 224 N 180 S 4 P 4 D) (C 6 H 10 O 5 ) n E) C 17 H 35 COOH 192. L acido aspartico è: A) un acido minerale forte B) un ossiacido C) un amminoacido D) un peptide acido E) un dipeptide 193. Quali tra i seguenti composti è un amminoacido? A) alanina B) anilina C) atropina D) formalina E) adenina 194. Il fruttosio è: A) un polidrossichetone B) una ammina C) un fenolo D) una anidride E) una aldeide 195. Il cosiddetto indurimento degli oli consiste in: A) clorurazione dei grassi B) deidrogenazione degli oli C) deidrogenazione dei grassi D) idrogenazione degli oli E) solidificazione degli oli 26
27 196. Un polimero è sempre formato da: A) chetoacidi legati tra loro B) isotopi legati tra loro C) epimeri legati tra loro D) monomeri legati tra loro E) isomeri legati tra loro 197. L urea è un composto azotato. Pertanto non può derivare dal metabolismo di: A) amminoacidi B) proteine semplici C) peptidi D) proteine coniugate E) glicogeno 198. Gli steroidi si classificano tra: A) zuccheri B) vitamine C) lipidi D) acidi nucleici E) proteine 199. La mutarotazione del glucosio in soluzione acquosa: A) fa aumentare il potere ottico rotatorio dello zucchero B) fa diminuire il potere ottico rotatorio dello zucchero C) lascia invariato il potere ottico rotatorio dello zucchero D) fa raggiungere un potere ottico rotatorio intermedio tra i due anomeri dello zucchero E) annulla completamente il potere ottico rotatorio dello zucchero 200. L amido è: A) un polisaccaride composto da saccarosio e amilosio B) un componente delle membrane cellulari C) è un altro nome del glicogeno D) è una miscela dei polisaccaridi di amilosio e amilopectina E) è un altro nome della cellulosa 201. Quale dei seguenti amminoacidi contiene zolfo? A) valina B) prolina C) tirosina D) lisina E) metionina 202. Indicare quale tra le seguenti affermazioni è corretta. A) tutte le proteine contengono zolfo B) alcune proteine non contengono carbonio C) tutte le proteine contengono fosforo D) alcune proteine non contengono azoto E) tutte le proteine contengono azoto 203. Gli amminoacidi naturali che costituiscono le proteine: A) hanno tutti un solo gruppo amminico B) hanno tutti un gruppo amminico sul C2 C) hanno tutti almeno due gruppi amminici D) sono tutti amminoacidi essenziali E) hanno tutti un solo gruppo amminico ed un solo gruppo carbossilico 27
28 CORRETTORE TEST DI CHIMICA ORGANICA Su numeri quantici, ibridazione del carbonio, gruppi funzionali, isomeria 1 = A; 2 = B; 3 = C; 4 = B; 5 = A; 6 = C; 7 = D; 8 = E; 9 = A; 10 = E; 11 = A; 12 = D; 13 = A; 14 = C; 15 = C; 16 = D; 17 = C; 18 = A; 19 = E; 20 = C; 21 = A; 22 = C; 23 = C; 24 = C; 25 = C; 26 = C; 27 = B; 28 = C; 29 = B; 30 = E; 31 = A; 32 = B; 33 = D; 34 = B; 35 = A; 36 = A; 37 = E; 38 = A; 39 = C; 40 = C; 41 = C; 42 = A; 43 = B; 44 = E; 45 = A; 46 = C; 47 = B; 48 = B; 49 = D; 50 = D; 51 = C; 52 = E; 53 = E; 54 = C; 55 = D; 56 = C; 57 = A; 58 = E; ; 59 = B; 60 = D; 61 = A; 62 = C; 63 = D; 64 = C; 65 = A; 66 = B; 67 = E; 68 = C; 69 = C; 70 = C; 71 = B; 72 = B; 73 = C; 74 = C; 75 = B; 76 = E; 77 = B; 78 = C; Su reazioni di vario tipo 79 = E; 80 = E; 81 = B; 82 = D; 83 = B; 84 = D; 85 = B; 86 = C; 87 = E; 88 = B; 89 = B; 90 = A; 91 = B; 92 = A; 93 = C; 94 = E; 95 = A; 96 = B; 97 = A; 98 = B; 99 = B; 100 = B; 101 = E; 102 = E; 103 = C; 104 = C; 105 = B; 106 = A; 107 = E; 108 = C; 109 = E; 110 = C; 111 = C; 112 = C; Su carboidrati, lipidi, proteine, enzimi, acidi nucleici 113 = B; 114 = B; 115 = A; 116 = D; 117 = A; 118 = E; 119 = B; 120 = E; 121 = C; 122 = A; 123 = C; 124 = A; 125 = D; 126 = B; 127 = A; 128 = C; 129 = B; 130 = B; 131 = A; 132 = C; 133 = E; 134 = B; 135 = D; 136 = D; 137 = C; 138 = C; 139 = C; 140 = D; 141 = B; 142 = B; 143 = A; 144 = C; 145 = C; 146 = D; 147 = A; 148 = C; 149 = C; 150 = D; 151 = B; 152 = B; 153 = D; 154 = B; 155 = B; 156 = D; 157 = D; 158 = B; 159 = C; 160 = A; 161 = B; 162 = B; 163 = B; 164 = B; 165 = C; 166 = C; 167 = C; 168 = A; 169 = A; 170 = C; 171 = B; 172 = A; 173 = C; 174 = A; 175 = C; 176 = C; 177 = D; 178 = E; 179 = C; 180 = A; 181 = A; 182 = A; 183 = C; 184 = D; 185 = D; 186. = B; 187 = B; 188 = A; 189 = B; 190 = B; 191 = C; 192 = C; 193 = A; 194 = A; 195 = D; 196 = D; 197 = E; 198 = C; 199 = D; 200 = D; 201 = E; 202 = E; 203 = B. 28
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
H N H R N H R N R R N R H H H
 AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
Jay Phelan, Maria Cristina Pignocchino. Scopriamo la biologia
 Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Le biomolecole si trovano negli organismi viventi
 Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Il carbonio è l elemento più abbondante nelle molecole biologiche
 Le biomolecole Il carbonio è l elemento più abbondante nelle molecole biologiche Le molecole contenenti carbonio sono chiamate biomolecole. Le biomolecole fanno parte di un gruppo molto ampio di composti
Le biomolecole Il carbonio è l elemento più abbondante nelle molecole biologiche Le molecole contenenti carbonio sono chiamate biomolecole. Le biomolecole fanno parte di un gruppo molto ampio di composti
I composti organici. Il carbonio e i composti organici
 I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
Il carbonio è l elemento di base delle biomolecole. Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici.
 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Chimica Organica. Studio dei composti del CARBONIO
 Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
Gli acidi nucleici, DNA (acido deossiribonucleico) e RNA (acido. ribonucleico), sono polimeri biologicamente importanti in quanto
 Gli acidi nucleici, DA (acido deossiribonucleico) e RA (acido ribonucleico), sono polimeri biologicamente importanti in quanto svolgono ruoli fondamentali nell ereditarietà e nella sintesi proteica. Sono
Gli acidi nucleici, DA (acido deossiribonucleico) e RA (acido ribonucleico), sono polimeri biologicamente importanti in quanto svolgono ruoli fondamentali nell ereditarietà e nella sintesi proteica. Sono
Le molecole biologiche. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Chimica organica Chimica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi: H, O, N, P,
 himica organica himica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi:,, N, P, S, alogeni. Le molecole organiche presentano particolari raggruppamenti
himica organica himica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi:,, N, P, S, alogeni. Le molecole organiche presentano particolari raggruppamenti
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Capitolo 24 Dai gruppi funzionali ai polimeri
 Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, orradi, Desco, Ropa himica seconda edizione Bagatti, orradi, Desco, Ropa, himica seconda edizione apitolo 16. Molecole per la vita SEGUI LA MAPPA glicosidico distinguere tra peptidico Struttura
Bagatti, orradi, Desco, Ropa himica seconda edizione Bagatti, orradi, Desco, Ropa, himica seconda edizione apitolo 16. Molecole per la vita SEGUI LA MAPPA glicosidico distinguere tra peptidico Struttura
Riassunto delle lezioni precedenti..
 Riassunto delle lezioni precedenti.. Chimica del Carbonio L atomo di Carbonio può formare legami singoli, legami doppi e legami tripli IDROCARBURI formati solo da carbonio e idrogeno Si dividono in 3 classi:
Riassunto delle lezioni precedenti.. Chimica del Carbonio L atomo di Carbonio può formare legami singoli, legami doppi e legami tripli IDROCARBURI formati solo da carbonio e idrogeno Si dividono in 3 classi:
R = GRUPPO FUNZIONALE Atomo o raggruppamento atomico
 GRUPPI FUNZIONALI GRUPPO FUNZIONALE Atomo o raggruppamento atomico presente in un composto organico, che conferisce adesso particolari proprietà fisiche e chimiche E il punto più reattivo della molecola
GRUPPI FUNZIONALI GRUPPO FUNZIONALE Atomo o raggruppamento atomico presente in un composto organico, che conferisce adesso particolari proprietà fisiche e chimiche E il punto più reattivo della molecola
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
Domanda 4 Dal punto di vista della reattività, il doppio legame si comporta spesso da:
 Tema svolto Domanda 1 Al punto isoelettrico la solubilità di una amminoacido in acqua è: 1. intermedia (-1) 2. doppia rispetto ad un ph più acido e dimezzata rispetto ad un ph più basico (-1) 3. la più
Tema svolto Domanda 1 Al punto isoelettrico la solubilità di una amminoacido in acqua è: 1. intermedia (-1) 2. doppia rispetto ad un ph più acido e dimezzata rispetto ad un ph più basico (-1) 3. la più
Isomeria ottica. Un atomo di carbonio presente in un composto organico viene definito asimmetrico quando lega quattro sostituenti diversi.
 Isomeria ottica Un atomo di carbonio presente in un composto organico viene definito asimmetrico quando lega quattro sostituenti diversi. Un atomo di carbonio asimmetrico è un centro chirale, e forma così
Isomeria ottica Un atomo di carbonio presente in un composto organico viene definito asimmetrico quando lega quattro sostituenti diversi. Un atomo di carbonio asimmetrico è un centro chirale, e forma così
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
LE MOLECOLE BIOLOGICHE
 LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
Domanda 1 2(R)-iodo-2butanolo subisce attacco nucleofilo da parte dello ione cloruro attraverso un meccanismo SN 2. Il prodotto della reazione sarà:
 CHIMICA ORGANICA-Appello del 4 Novembre 2016 Domanda 1 2(R)-iodo-2butanolo subisce attacco nucleofilo da parte dello ione cloruro attraverso un meccanismo SN 2. Il prodotto della reazione sarà: 1. Il racemo
CHIMICA ORGANICA-Appello del 4 Novembre 2016 Domanda 1 2(R)-iodo-2butanolo subisce attacco nucleofilo da parte dello ione cloruro attraverso un meccanismo SN 2. Il prodotto della reazione sarà: 1. Il racemo
Stampa Preventivo. A.S Pagina 1 di 8
 Stampa Preventivo A.S. 2009-2010 Pagina 1 di 8 Insegnante POLESEL Classe 4LTS ART Materia chimica organica e biochimica preventivo consuntivo 106 0 titolo modulo 1. Idrocarburi 2. Composti ossigenati 3.
Stampa Preventivo A.S. 2009-2010 Pagina 1 di 8 Insegnante POLESEL Classe 4LTS ART Materia chimica organica e biochimica preventivo consuntivo 106 0 titolo modulo 1. Idrocarburi 2. Composti ossigenati 3.
Di cosa è fatta una cellula?
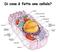 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
Capitolo 24 Le famiglie dei composti organici
 Capitolo 24 Le famiglie dei composti organici DOMANDE ED ESERCIZI (versione integrale) 24.1 I composti organici sono raggruppati in famiglie 1. Che cosa si intende per gruppo funzionale? Scrivi le formule
Capitolo 24 Le famiglie dei composti organici DOMANDE ED ESERCIZI (versione integrale) 24.1 I composti organici sono raggruppati in famiglie 1. Che cosa si intende per gruppo funzionale? Scrivi le formule
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
Problemi 1 PROPEDEUTICITÀ
 Problemi 1 PROPEDEUTICITÀ Da manifesto degli studi del corso per sostenere l esame di Chimica Biologica bisogna aver superato: Citologia e Istologia Chimica Organica (Chimica generale) Non vale questa
Problemi 1 PROPEDEUTICITÀ Da manifesto degli studi del corso per sostenere l esame di Chimica Biologica bisogna aver superato: Citologia e Istologia Chimica Organica (Chimica generale) Non vale questa
La chimica della vita
 La chimica della vita La materia presente nell universo è formata da 92 elementi Gli elementi si legano tra loro per formare le molecole che costituiscono i composti Legame covalente O H H Molecola Composto
La chimica della vita La materia presente nell universo è formata da 92 elementi Gli elementi si legano tra loro per formare le molecole che costituiscono i composti Legame covalente O H H Molecola Composto
Corso di orientamento e preparazione ai Corsi di Laurea della Scuola di Medicina ad accesso programmato a.a. 2019/2020 CHIMICA
 Corso di orientamento e preparazione ai Corsi di Laurea della Scuola di Medicina ad accesso programmato a.a. 2019/2020 CHIMICA «Nulla si crea, nulla si distrugge, ma tutto si trasforma.» (Antoine-Laurent
Corso di orientamento e preparazione ai Corsi di Laurea della Scuola di Medicina ad accesso programmato a.a. 2019/2020 CHIMICA «Nulla si crea, nulla si distrugge, ma tutto si trasforma.» (Antoine-Laurent
I composti più importanti dal punto di vista biologico, detti anche. BIOMOLECOLE, appartengono a quattro classi: carboidrati, proteine,
 I composti più importanti dal punto di vista biologico, detti anche BIMLELE, appartengono a quattro classi: carboidrati, proteine, acidi nucleici e lipidi. arboidrati: polimeri di monosaccaridi Proteine:
I composti più importanti dal punto di vista biologico, detti anche BIMLELE, appartengono a quattro classi: carboidrati, proteine, acidi nucleici e lipidi. arboidrati: polimeri di monosaccaridi Proteine:
I composti del carbonio
 Elementi di chimica I composti del carbonio Esistono numerosissimi composti del carbonio sono oggetto di studio della chimica organica. Il carbonio tende a formare 4 legami covalenti. Il gruppo funzionale
Elementi di chimica I composti del carbonio Esistono numerosissimi composti del carbonio sono oggetto di studio della chimica organica. Il carbonio tende a formare 4 legami covalenti. Il gruppo funzionale
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 9 Il mondo del carbonio 3 Sommario 1. Esiste un enorme varietà di composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 9 Il mondo del carbonio 3 Sommario 1. Esiste un enorme varietà di composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani
L acqua e il legame idrogeno
 Elementi di chimica L acqua e il legame idrogeno La molecola di acqua è polare formazione di legami idrogeno. Da questi legami derivano le peculiarità dell acqua (ad es. «solvente universale»). Le reazioni
Elementi di chimica L acqua e il legame idrogeno La molecola di acqua è polare formazione di legami idrogeno. Da questi legami derivano le peculiarità dell acqua (ad es. «solvente universale»). Le reazioni
Soluzioni RAGIONAMENTO LOGICO E CULTURA GENERALE. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta.
 Soluzioni 1 A 2 B 3 B 4 E 5 D 6 E 7 B 8 D 9 C 10 B 11 D 12 B 13 E 14 D 15 C 16 C 17 B 18 D 19 A 20 C 21 D 22 C 23 D 24 C 25 E 26 C 27 D 28 C 29 B 30 B 31 D 32 E 33 B 34 C 35 E 36 A 37 D 38 B 39 C 40 D
Soluzioni 1 A 2 B 3 B 4 E 5 D 6 E 7 B 8 D 9 C 10 B 11 D 12 B 13 E 14 D 15 C 16 C 17 B 18 D 19 A 20 C 21 D 22 C 23 D 24 C 25 E 26 C 27 D 28 C 29 B 30 B 31 D 32 E 33 B 34 C 35 E 36 A 37 D 38 B 39 C 40 D
La massa è la quantità di materia di cui è fatta una qualsiasi cosa
 Dall atomo all organizzazione cellulare Tutti gli organismi viventi sono costituiti da atomi Due o più atoni insieme formano le molecole La materia è tutto ciò che occupa uno spazio, ha un volume e una
Dall atomo all organizzazione cellulare Tutti gli organismi viventi sono costituiti da atomi Due o più atoni insieme formano le molecole La materia è tutto ciò che occupa uno spazio, ha un volume e una
ELEMENTI DI CHIMICA ORGANICA
 ELEMENTI DI CHIMICA ORGANICA Idrocarburi La chimica organica è la chimica dei composti del carbonio Il carbonio, salvo rarissime eccezioni, forma sempre 4 legami I più semplici composti del carbonio sono
ELEMENTI DI CHIMICA ORGANICA Idrocarburi La chimica organica è la chimica dei composti del carbonio Il carbonio, salvo rarissime eccezioni, forma sempre 4 legami I più semplici composti del carbonio sono
Struttura e legami dei composti organici. VIDEOLEZIONE L ibridazione dell atomo di carbonio. Alcani e cicloalcani
 III 1 Struttura e legami dei composti organici 1.1 La nascita della chimica organica 2 1.2 Struttura elettronica degli atomi 3 1.3 Regola dell ottetto e simbolismo di Lewis 5 1.4 Elettronegatività e legami
III 1 Struttura e legami dei composti organici 1.1 La nascita della chimica organica 2 1.2 Struttura elettronica degli atomi 3 1.3 Regola dell ottetto e simbolismo di Lewis 5 1.4 Elettronegatività e legami
Gli idrocarburi contengono solo atomi di carbonio e di idrogeno. Gli idrocarburi alifatici hanno molecole lineari (talora ramificate) mentre quelli
 Gli idrocarburi contengono solo atomi di carbonio e di idrogeno. Gli idrocarburi alifatici hanno molecole lineari (talora ramificate) mentre quelli ciclici presentano molecole ad anello. Se hanno tutti
Gli idrocarburi contengono solo atomi di carbonio e di idrogeno. Gli idrocarburi alifatici hanno molecole lineari (talora ramificate) mentre quelli ciclici presentano molecole ad anello. Se hanno tutti
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi dondi@unipv.it Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
Introduzione alla chimica organica Daniele Dondi dondi@unipv.it Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
Indagine biologica: elevato livello di organizzazione delle strutture coinvolte.
 Indagine biologica: elevato livello di organizzazione delle strutture coinvolte. L organizzazione biologica si basa su una gerarchia di livelli strutturali Si parte dall atomo tessuti organi molecola organismo
Indagine biologica: elevato livello di organizzazione delle strutture coinvolte. L organizzazione biologica si basa su una gerarchia di livelli strutturali Si parte dall atomo tessuti organi molecola organismo
I composti organici. Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H)
 I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
Le molecole della vita
 Le molecole della vita Introduzione: cose da sapere per capire. Gli atomi (es. carbonio, ossigeno, idrogeno) si uniscono a formare molecole Le molecole costituiscono tutta la materia che ci circonda Atomi
Le molecole della vita Introduzione: cose da sapere per capire. Gli atomi (es. carbonio, ossigeno, idrogeno) si uniscono a formare molecole Le molecole costituiscono tutta la materia che ci circonda Atomi
Chimica del carbonio. 1. Composti contenenti azoto (C,H,N) ammine. Aromatici (derivati del benzene di formula C 6 H 6 )
 himica del carbonio Il carbonio forma con 4 atomi diversi 4 legami covalenti equivalenti posti a 109,5, oppure con 3 atomi diversi 3 legami posti a 120, di cui uno doppio, oppure 2 legami covalenti con
himica del carbonio Il carbonio forma con 4 atomi diversi 4 legami covalenti equivalenti posti a 109,5, oppure con 3 atomi diversi 3 legami posti a 120, di cui uno doppio, oppure 2 legami covalenti con
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
LA CHIMICA DELLA VITA
 LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
IDROCARBURI. Alcani Alcheni Alchini C-C C=C C C
 IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
LE BIOMOLECOLE LIPIDI, PROTEINE E ACIDI NUCLEICI GSCATULLO
 LE BIOMOLECOLE LIPIDI, PROTEINE E ACIDI NUCLEICI GSCATULLO ( Le Biomolecole I Lipidi Definizione e classificazione I lipidi rappresentano una vasta classe di composti chimicamente eterogenea per struttura
LE BIOMOLECOLE LIPIDI, PROTEINE E ACIDI NUCLEICI GSCATULLO ( Le Biomolecole I Lipidi Definizione e classificazione I lipidi rappresentano una vasta classe di composti chimicamente eterogenea per struttura
La chimica organica. La chimica organica è la chimica dei composti del carbonio.
 La chimica organica La chimica organica è la chimica dei composti del carbonio. Gli Idrocarburi sono composti organici contenenti solo carbonio (C) e idrogeno (H). Ci sono composti organici che contengono
La chimica organica La chimica organica è la chimica dei composti del carbonio. Gli Idrocarburi sono composti organici contenenti solo carbonio (C) e idrogeno (H). Ci sono composti organici che contengono
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
 http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
Pillole di... Chimica organica
 sono composti binari che contengono soltanto idrogeno e carbonio. Pillole di... Chimica organica Idrocarburi saturi contengono soltanto legami semplici tra gli atomi di carbonio Alcani (idrocarburi lineari)
sono composti binari che contengono soltanto idrogeno e carbonio. Pillole di... Chimica organica Idrocarburi saturi contengono soltanto legami semplici tra gli atomi di carbonio Alcani (idrocarburi lineari)
Idrocarburi. alifatici ciclici, detti aliciclici con catena chiusa ad anello, Entrambi possono essere:
 Facoltà di Medicina e Chirurgia Preside: Prof. Gian Franco Gensini ELEMENTI DI CHIMICA ORGANICA Prof. M. Stefani 26/07/12 PRECORSO 2012: ciclo formativo di orientamento alle prove di ammissione ai Corsi
Facoltà di Medicina e Chirurgia Preside: Prof. Gian Franco Gensini ELEMENTI DI CHIMICA ORGANICA Prof. M. Stefani 26/07/12 PRECORSO 2012: ciclo formativo di orientamento alle prove di ammissione ai Corsi
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
SOLUZIONI DEGLI ESERCIZI
 Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Quesiti e problemi (sul libro da pag. 653)
 Quesiti e problemi (sul libro da pag. 653) 1 I carboidrati 1 Quale ruolo hanno gli zuccheri negli organismi viventi? sono la prima fonte di energia 2 Scrivi le formule del e del glucosio. Scrivi le formule
Quesiti e problemi (sul libro da pag. 653) 1 I carboidrati 1 Quale ruolo hanno gli zuccheri negli organismi viventi? sono la prima fonte di energia 2 Scrivi le formule del e del glucosio. Scrivi le formule
primario secondario terziario quaternario alchilico arilico
 PRECORSO 2014 ELEMENTI DI CHIMICA ORGANICA 25 Luglio 2014 Ciclo formativo di orientamento alle prove di ammissione ai Corsi di studio delle Lauree Sanitarie triennali della Scuola di Scienze della Salute
PRECORSO 2014 ELEMENTI DI CHIMICA ORGANICA 25 Luglio 2014 Ciclo formativo di orientamento alle prove di ammissione ai Corsi di studio delle Lauree Sanitarie triennali della Scuola di Scienze della Salute
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi dondi@unipv.it 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
Introduzione alla chimica organica Daniele Dondi dondi@unipv.it 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
Irrancidimento (ossidazione) degli acidi grassi insaturi
 Irrancidimento (ossidazione) degli acidi grassi insaturi Aldeidi STPA-Chimica rganica Alcuni saggi sui grassi numero di acidità (titolazione in presenza di fenolftaleina con base forte diluita a temperatura
Irrancidimento (ossidazione) degli acidi grassi insaturi Aldeidi STPA-Chimica rganica Alcuni saggi sui grassi numero di acidità (titolazione in presenza di fenolftaleina con base forte diluita a temperatura
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
Introduzione alla Chimica Organica. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
CARBOIDRATI SEMPLICI
 CARBOIDRATI Dal greco glucos =dolce Glucidi Zuccheri Sostanze formate acqua e carbonio Hanno forma molecolare (CH₂O)n 1 CARBOIDRATI SEMPLICI Monosaccaridi, una sola unità di poliidrossi aldeide o di poliidrossi
CARBOIDRATI Dal greco glucos =dolce Glucidi Zuccheri Sostanze formate acqua e carbonio Hanno forma molecolare (CH₂O)n 1 CARBOIDRATI SEMPLICI Monosaccaridi, una sola unità di poliidrossi aldeide o di poliidrossi
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di:
 Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
DAI GRUPPI FUNZIONALI AI POLIMERI
 DAI GRUPPI FUNZIONALI AI POLIMERI 1. I GRUPPI FUNZIONALI 2. DERIVATI OSSIGENATI DEGLI IDROCARBURI : ALCOLI, FENOLI, ETERI, ALDEIDI E CHETONI, ACIDI CARBOSSILICI E LORO DERIVATI 3. DERIVATI AZOTATI DEGLI
DAI GRUPPI FUNZIONALI AI POLIMERI 1. I GRUPPI FUNZIONALI 2. DERIVATI OSSIGENATI DEGLI IDROCARBURI : ALCOLI, FENOLI, ETERI, ALDEIDI E CHETONI, ACIDI CARBOSSILICI E LORO DERIVATI 3. DERIVATI AZOTATI DEGLI
CARBOIDRATI Sono aldeidi o chetoni con diversi gruppi ossidrilici (formula molecolare di base (CH2O)n, con n =>3) Funzioni riserva energetica
 CARBOIDRATI Sono aldeidi o chetoni con diversi gruppi ossidrilici (formula molecolare di base (CH2O)n, con n =>3) Funzioni riserva energetica combustibili intermedi metabolici Impalcatura del DNA e RNA
CARBOIDRATI Sono aldeidi o chetoni con diversi gruppi ossidrilici (formula molecolare di base (CH2O)n, con n =>3) Funzioni riserva energetica combustibili intermedi metabolici Impalcatura del DNA e RNA
Forze intermolecolari
 Forze intermolecolari Sono le forze che si instaurano tra le molecole di un composto e ne determinano lo stato di aggregazione (gas, liquido, solido) interazioni dipolo-dipolo attrazioni di van der Waals
Forze intermolecolari Sono le forze che si instaurano tra le molecole di un composto e ne determinano lo stato di aggregazione (gas, liquido, solido) interazioni dipolo-dipolo attrazioni di van der Waals
Carboidrati puri : zucchero e amido nei cibi, cellulosa nel legno, carta e cotone
 Carboidrati Carboidrati puri : zucchero e amido nei cibi, cellulosa nel legno, carta e cotone Glucosio Carboidrati modificati: membrane cellulari, acidi nucleici, Da carbonio idrato: glucosio= C 6 H 12
Carboidrati Carboidrati puri : zucchero e amido nei cibi, cellulosa nel legno, carta e cotone Glucosio Carboidrati modificati: membrane cellulari, acidi nucleici, Da carbonio idrato: glucosio= C 6 H 12
Carboidrati puri : zucchero e amido nei cibi, cellulosa nel legno, carta e cotone
 Carboidrati Carboidrati puri : zucchero e amido nei cibi, cellulosa nel legno, carta e cotone Glucosio Carboidrati modificati: membrane cellulari, acidi nucleici, Da carbonio idrato: glucosio= C 6 H 12
Carboidrati Carboidrati puri : zucchero e amido nei cibi, cellulosa nel legno, carta e cotone Glucosio Carboidrati modificati: membrane cellulari, acidi nucleici, Da carbonio idrato: glucosio= C 6 H 12
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale.
 Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
28/07/11. Idrocarburi
 Facoltà di Medicina e Chirurgia Preside: Prof. Gian Franco Gensini ELEMENTI DI CHIMICA ORGANICA Prof. M. Stefani 28/07/11 PRECORSO 2011: ciclo formativo di orientamento alle prove di ammissione ai Corsi
Facoltà di Medicina e Chirurgia Preside: Prof. Gian Franco Gensini ELEMENTI DI CHIMICA ORGANICA Prof. M. Stefani 28/07/11 PRECORSO 2011: ciclo formativo di orientamento alle prove di ammissione ai Corsi
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare quattro legami covalenti. Questi
apitolo 3 Le biomolecole I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare quattro legami covalenti. Questi
04/10/17 I LEGAMI DEL CARBONIO. Nei composti organici gli atomi di C sono uniti tra loro a formare lo scheletro delle molecole
 04/10/17 I LEGAMI DEL CARBONIO TETRAEDRO se forma 4 legami semplici Nei composti organici gli atomi di C sono uniti tra loro a formare lo scheletro delle molecole SCHELETRO CARBONIOSO 1 04/10/17 Estrema
04/10/17 I LEGAMI DEL CARBONIO TETRAEDRO se forma 4 legami semplici Nei composti organici gli atomi di C sono uniti tra loro a formare lo scheletro delle molecole SCHELETRO CARBONIOSO 1 04/10/17 Estrema
Corso di orientamento e preparazione ai Corsi di Laurea della Scuola di Medicina ad accesso programmato a.a. 2019/2020 CHIMICA
 Corso di orientamento e preparazione ai Corsi di Laurea della Scuola di Medicina ad accesso programmato a.a. 2019/2020 CHIMICA «Nulla si crea, nulla si distrugge, ma tutto si trasforma.» (Antoine-Laurent
Corso di orientamento e preparazione ai Corsi di Laurea della Scuola di Medicina ad accesso programmato a.a. 2019/2020 CHIMICA «Nulla si crea, nulla si distrugge, ma tutto si trasforma.» (Antoine-Laurent
Tipologie di formule chimiche
 CHIMICA ORGANICA Tipologie di formule chimiche FORMULA RAZIONALE Tipo di formula che utilizza una rappresentazione analoga alla formula bruta per quei gruppi di atomi sulla cui disposizione non vi possono
CHIMICA ORGANICA Tipologie di formule chimiche FORMULA RAZIONALE Tipo di formula che utilizza una rappresentazione analoga alla formula bruta per quei gruppi di atomi sulla cui disposizione non vi possono
AMINOACIDI Struttura. Funzione. Classificazione. Proprietà
 AMINOACIDI Struttura Funzione Classificazione Proprietà 1 STRUTTURA Composti caratterizzati dalla presenza di un gruppo aminico (NH 2 ) e di un gruppo acido (COOH) legati al medesimo carbonio (C). In soluzione
AMINOACIDI Struttura Funzione Classificazione Proprietà 1 STRUTTURA Composti caratterizzati dalla presenza di un gruppo aminico (NH 2 ) e di un gruppo acido (COOH) legati al medesimo carbonio (C). In soluzione
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
I composti organici. Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi.
 I composti organici Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi. I composti organici possono essere costituiti da lunghe catene grazie alla capacità
I composti organici Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi. I composti organici possono essere costituiti da lunghe catene grazie alla capacità
CHIMICA ORGANICA. 2 a D. Novembre Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14. Ponte Felcino Perugia.
 CHIMICA ORGANICA 2 a D Novembre 2014 Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14 Ponte Felcino Perugia Manuela Casasoli IL CARBONIO La chimica organica studia i composti organici in cui il
CHIMICA ORGANICA 2 a D Novembre 2014 Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14 Ponte Felcino Perugia Manuela Casasoli IL CARBONIO La chimica organica studia i composti organici in cui il
PRINCIPI DI CHIMICA ORGANICA
 DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea in Scienze farmaceutiche applicate Anno accademico 2017/2018-2 anno - Curriculum Scienze Erboristiche e dei Prodotti Nutraceutici PRINCIPI DI CHIMICA
DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea in Scienze farmaceutiche applicate Anno accademico 2017/2018-2 anno - Curriculum Scienze Erboristiche e dei Prodotti Nutraceutici PRINCIPI DI CHIMICA
CORSO DI LAUREA IN SCIENZE BIOLOGICHE III GRUPPO Prof. Antonio Evidente Monte S. Angelo 1P-14. Descrizione dell insegnamento
 CORSO DI LAUREA IN SCIENZE BIOLOGICHE III GRUPPO Prof. Antonio Evidente Monte S. Angelo 1P-14 Insegnamento: Chimica organica Descrizione dell insegnamento Settore Scientifico- Disciplinare: CHIM/06 CFU:
CORSO DI LAUREA IN SCIENZE BIOLOGICHE III GRUPPO Prof. Antonio Evidente Monte S. Angelo 1P-14 Insegnamento: Chimica organica Descrizione dell insegnamento Settore Scientifico- Disciplinare: CHIM/06 CFU:
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
ESERCIZI AGGIUNTIVI DI FINE CAPITOLO
 Phelan, Pignocchino Le scienze naturali Osservare i viventi ESERCIZI AGGIUNTIVI DI FINE CAPITOLO Capitolo 2 L IDENTITÀ DEGLI ATOMI 1. Con quale relazione si ricava il numero massimo di elettroni in ciascun
Phelan, Pignocchino Le scienze naturali Osservare i viventi ESERCIZI AGGIUNTIVI DI FINE CAPITOLO Capitolo 2 L IDENTITÀ DEGLI ATOMI 1. Con quale relazione si ricava il numero massimo di elettroni in ciascun
PERCHE STUDIARE LA CHIMICA ORGANICA?
 CIMICA ORGANICA CE COSA E LA CIMICA ORGANICA? La chimica organica è dedicata alla descrizione della struttura, delle proprietà e delle funzioni dei composti del carbonio (C). PERCE STUDIARE LA CIMICA ORGANICA?
CIMICA ORGANICA CE COSA E LA CIMICA ORGANICA? La chimica organica è dedicata alla descrizione della struttura, delle proprietà e delle funzioni dei composti del carbonio (C). PERCE STUDIARE LA CIMICA ORGANICA?
M i n i s t e r o d e l l I s t r u z i o n e, d e l l U n i v e r s i t à e d e l l a R i c e r c a
 PROGRAMMA SVOLTO DOCENTE: Campani Maria Varini Simone A.S: 2018/2019 DISCIPLINA: Chimica organica e biochimica CLASSE: 3^A CHI MAT Per ogni Tema svolto vengono indicati i relativi contenuti. LEGAME CHIMICO
PROGRAMMA SVOLTO DOCENTE: Campani Maria Varini Simone A.S: 2018/2019 DISCIPLINA: Chimica organica e biochimica CLASSE: 3^A CHI MAT Per ogni Tema svolto vengono indicati i relativi contenuti. LEGAME CHIMICO
Di cosa è fatta una cellula?
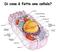 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
