Maria Luisa Nolli Founder of NCNbio srl Member of Directive Council AFI Assobiotec Board EuropaBio Board
|
|
|
- Berta Angeli
- 6 anni fa
- Visualizzazioni
Transcript
1 I MEDICINALI PER TERAPIE AVANZATE: LA RIVOLUZIONE IN MEDICINA Maria Luisa Nolli Founder of NCNbio srl Member of Directive Council AFI Assobiotec Board EuropaBio Board
2 BIOFARMACI E MEDICINALI PER TERAPIE AVANZATE Prodotti dalle cellule Anticorpi monoclonali (rituximab) Proteine ricombinanti (EPO, Interferoni) Cellule e tessuti come prodotti Farmaci biotecnologici si intendono in senso lato anche piccole molecole scoperte con processi biotech Ingegneria dei tessuti Membrane per rigenerazione tissutale Terapia cellulare (condroselect, holoclar)
3 TEAM DEFINIZIONI BIOFARMACI Biodrugs «è una sostanza prodotta da organismi viventi o a partire da un loro prodotto. Vengono usati per prevenzione, diagnosi, o trattamento di patologie. Farmaci biologici comprendono tra gli altri anticorpi, interleuchine e vaccini» TERAPIE AVANZATE - Advanced therapy medicinal product «si intendono qualunque dei seguenti prodotti medicinali per uso umano: - Medicinali di Terapia Cellulare Somatica - Medicinali di Terapia Genica - Prodotti di ingegneria tessutale» US National Cancer Institute for Health REGULATION (EC) No 1394/2007 OF THE EUROPEAN PARLIAMENT BUONE NORME DI FABBRICAZIONE GMP (Good Manufacturing Practice) Defined as «That part of Quality Assurance which ensures that products are consistently produced and controlled to the quality standards appropriate to their intended use.» Compliance with these principles and guidelines is mandatory within the European Economic Area Volume 4 EU Guidelines to Good Manufacturing Practice
4 LA RIVOLUZIONE IN MEDICINA MEDICINA PERSONALIZZATA
5 AUTOLOGO VS PERSONALIZZATO Terapia con cellule autologhe Biopsia / prelievo Terapia personalizzata Biopsia / prelievo Caratterizzazione Cellule funzionalizzate Scelta del farmaco / trattamento
6 I NUMERI DEL BIOTECH 6
7 I BIOFARMACI STANNO CRESCENDO Analisi di prodotto per tipologia e fase di sviluppo Tipo di prodotti Fase di sviluppo Small molecule Anticorpi monoclonali Proteine ricombinati Terapia cellulare* Medicina rigenerativa* Peptidi Prodotti naturali Terapia genica Vaccino Altro (*) Terapie avanzate (TA) Tra il 2009 e il 2013 i biofarmaci sono passati dal 36 al 45% Fonte: Ernst & Young Assobiotec, BioInItaly Report 2014
8 LO SVILUPPO DI UN FARMACO SEGUE L ITER DEL FARMACO TRADIZIONALE ma. CON UNA MAGGIORE COMPLESSITA Phase Pre-clinical Clinical trials Large scale Research Development Phase 1 Phase 2 Phase 3 Market FASE I: volontario sano; farmacologia clinica e tollerabilità FASE II: paziente; verifica preliminare della efficacia terapeutica; studi-pilota FASE III: paziente (fase allargata); valutazione confirmatoria e comparativa della efficacia e tollerabilità; confronti MERCATO: fase post-registrazione
9 Value / costs MODELLO DI BUSINESS CREAZIONE DEL VALORE Phase Pre-clinical Clinical trials Large scale Research Development Phase 1 Phase 2 Phase 3 Market Value Develop costs Interazione tra Accademia/piccola/media biotech Riduzione costi iniziali Alta qualità e processi dedicati Co-sviluppo e contract development Licensing out / big pharma Investimenti per fasi cliniche avanzate Possibilità di future royalties Stage
10 The Italian red biotech Advanced therapies and orphan drugs T 7 companies obtained an ODD 4 in the Phase III clinical development Excellence of the Italian manufacturing processes is internationally recognised ADVANCED THERAPIES MANUFACTURING FACILITIES 29 project of advanced therapies 8 projects already at the development stage 1 products has been recently authorised by EMA
11 EMA approval for ATMP The Italian ATMPs In 2016 two new marketing authorisations for ATMPs were granted by EMA, bringing to 3 out of 6 the ATMPs currently authorised that originate from the Italian research. Holoclar, an Advanced Therapy for the treatment of patients with severe burns of the cornea based on autologous stem cells Strimvelis, an Advanced Therapy for the treatment of children affected by ADA-SCID by gene-replacement Zalmoxis, a cell therapy product for the treatment of haematological malignancies has just been granted a conditional markenting authorisation and the ODD (Centro Studi Assobiotec)
12 Clinical trial for ATMPs Clinical trials and ATMPs At the end of 2015, a research identified 939 clinical trials investigating ATMPs (85% ongoing, 15% completed). Phase I, I/II: 64.3%, Phase II, II/III: 27.9%, Phase 3: 6.9%. Due to the peculiarity of ATMPs, new clinical trial methodologies are being considered. These include: small sample size, non-randomised trials, single-arm trials, surrogate endpoints, integrated protocols, adaptive designs (Centro Studi Assobiotec, adapted from Hanna et al JMAHP)
13 Clinical trial for ATMPs Main diseases addressed by the ATMPs in development As of October 2015, the clinical trials ongoing were for: 53.6% of trials for somatic cell therapies, 22.8% for tissue-engineered products, 22.4% for gene therapies, (Centro Studi Assobiotec, adapted from Hanna et al JMAHP)
14 Showcase stories The last products of the Italian red biotech Out of six products of advanced therapies currently authorised three are results of the Italian research: Holoclar, an Advanced Therapy for the treatment of patients with severe burns of the cornea based on autologous stem cells Strimvelis, an Advanced Therapy for the treatment of children affected by ADA-SCID by gene-replacement Zalmoxis, a cell therapy product for the treatment of haematological malignancies has just been granted a conditional markenting authorisation and the ODD
15 TERAPIA CELLULARE - PRODOTTI APPROVATI Name Company Description Countries approved Indication Chondrocelect Tigenix Autologous chondrocytes EU Cartilage regeneration Holoclar Holostem Autologous stem cells EU Cornea regeneration Provenge Dendreon Autologous dendritic cells USA/EU Prostate cancer Maci Genzyme Autologous chondrocytes EU Cartilage regeneration Laviv Fibrocell sciences Autologous fibroblasts USA Wrinkles treatment (cosmetic) Hemacord New York Blood Center Autologous hematopoietic cells USA Immunologic reconstitution Prochymal Osiris Allogeneic mesenchymal stem cells Canada New Zealand Graft versus host disease Hearticell-gram Pharmicell Autologous mesenchymal stem cells S. Korea Myocardial infarction Cartistem Medipost Umbilical cordmesenchymal stem cells S. Korea Osteoarthritis Cupistem Anterogen Adipose-derived mesenchymal stem cells S. Korea Chron s disease
16 TERAPIA GENICA PRODOTTI APPROVATI Name Company Description Countries approved Indication Glybera UniQure Adeno-associated virus EU Lipoprotein lipase deficiency Trial clinici di terapia genica Comprende: -Vettori virali - Drug Antisenso (RNAi, micro RNA, e altri) - DNA Plasmidico vaccinale - Cellule geneticamente mod
17 RECENTI ACCORDI TRA BIG FARMA NELLA CELL THERAPY Year Big Pharma Company/Institution Subject of the deal 2012 Novartis University of Pennsylvania Funding of T-cell adoptive therapy 2011 Pfizer Roslin Cells Evaluation of stem-cell based therapies for licensing 2010 Cephalon (now Teva) Mesoblast Worldwide rights for commercialization of adult stem cell therapies 2010 GSK Telethon Rare diseases 2009 Pfizer Athersys Licensing of of Multistem therapy 2009 Pfizer University College London Funding of stem cell therapy for Macular Degeneration
18 DIMENSIONI E COMPLESSITA x30x1500 Aspirin: 0,7 nm IgG: ~20 nm Eukaryotic cell: ~30 µm
19 UN SETTORE ALTAMENTE REGOLATO Istituto Superiore della Sanità sperimentazione clinica fase I Agenzia Italiana del Farmaco autorizzazione produzione sperimentazione clinica fase II-III immissione in commercio European Medicines Agency (EU) immissione in commercio terapie avanzate Food and Drug Administration (USA) sperimentazione clinica immissione in commercio
20 ADVANCED THERAPY MEDICINAL PRODUCTS New european law defines: ADVANCED THERAPY MEDICINAL PRODUCTS (ATMPs) Cell Therapy Gene Therapy Tissue engineering
21 ICH Q5D CELL LINES
22 REC PROTEINS AND MONOCLONAL ANTIBODIES Bioinformatics study on protein properties Choice of suitable host DNA codon optimization Gene synthesis Cloning in expression vector Trasformation/ transfection and screening Formulation / Filling of product Scale-up in bioreactor Set-up of purification strategy Fermentation / small scale culture terapie AVANZATETERAPIE ADVANCED THERAPIES AVANZATE reinfusion Patient Biopsy Seeding in culture Expansion Harvest Final doses
23 TERAPIE AVANZATE Regenerative medicine and cell therapy platform: from tissue samples to potent therapeutical applications Biopsy of donor tissue Cutting and enzymatic digestion Seeding in flasks Expansio n Freezing of Master Cell Bank Thawing, expansion and preparation of bags for reinfusion
24 CELLULE MESENCHIMALI - PRODUZIONE Paziente Campione tessuto / biopsia Semina in coltura Espansione Harvest Dosi finali QC Analisi sul campione di ingresso QC Analisi in process QC Rilascio del lotto
25 PRODOTTI A BASE DI CELLULE - APPLICAZIONI From regenerative medicine to oncology and immunology Tissue engineering Oncology (cytotoxic cells) Immunology (GVHD) Neurodegeneration Oncology (DCs vaccination) Metabolic diseases
26 ADVANCED THERAPIES reinfusion Patient Arrival of the cells from the hospital to the GMP facility Incoming material Shipment validation Contamination control QC (critical materilals) Tech transfer, feasibility Bioreactor choice Process development Analytical methods Biopsy Seeding in culture Process validation Batch production record Lot reference production Drug master file Production, scale up Media flll Fill and finishing Monitoring (in process analysis) Expansion Harvest Final doses Batch release Quality control Quality assurance QP Shipment of the product Choice of the courier Certification, T Refill dry ice Transport validation QC of the product Evaluation of data (data logger)
27 SINGLE-USE BIOREACTORS (SUT) High-quality and cost-effective manufacturing No cleaning validation Easy to use No cross-contamination Modular scale-up Fast turnover of batches Regulatory-friendly Reduced investments Flexible
28 SCALE UP IN SINGLE-USE SYSTEMS A cost-effective and high-quality manufacturing Cell Bank Small scale culture Inoculum preparation Production with parallel bioreactors, 25 L each Comparison with linear scale-up model
29 STRATEGIE DI UTILIZZO DELLA SUT DURANTE IL PROCESSO Per prodotti a base di cellule l utilizzo della SUT è «obbilgatorio» Mentre per le molecole biotech l uso della SUT deve essere effettuato dall inizio dello sviluppo di processo perché cambiamenti a stadi più avanzati potrebbero avere conseguenze importanti sul processo regolatorio di approvazione Questo è importante perché all inizio dello sviluppo di una molecola biotech non si conoscono le caratteristiche del prodotto finale (stabilità, dosaggio, popolazione target, biomarcatori) e con la SUT si può ottimizzare la quantità di lotti necessari per gli step successivi
30 ESPERIENZA SCIENTIFICA E TECNICA CON LA SUT Abbiamo iniziato ad utilizzare la SUT a metà degli anni 80 alc entro di Ricerche Lepetit (sistema hollow fibers per produrre anticorpi monoclonali anti-cea, e eritropoietina) A metà degli anni 90, utilizzando il bioreattore Cell Cube sono stati prodotti i primi grammi di GA-EPO e paragonati a quelli prodotti con i bioreattori convenzionali, air-lift fermenter, con capacità L a Peace NH. La GA-EPO da Cell Cube sì è dimostrata contenere tutte le isoforme ed essere correttamente «folded», i lotti consistenti l uno con l altro, mentre quella prodotta con i fermentatori air lift ha dimostrato avere una variabilità dei lotti 30%
31 ESPERIENZA SCIENTIFICA E TECNICA CON LA SUT All inizio del 2000 abbiamo organizzato un GMP plant per produrre farmaci biotech e ATMPs attrezzato solo con SUT (è stato il primo impianto in Italia). L impianto ha avuto l autorizzazione a produrre batch clinici nel L impianto oggi detiene una multipurpose GMP authorization. Negli ultimi anni c è stata un esplosione di SUT ora sembra che i concetti che abbiamo divulgato nei nostri 20 anni di esperienza siano ora adottati da un sempre maggior numero di aziende non solo per l upstream ma anche nel downstream e filling)
32 GUIDELINES Guideline on the Requirements for Quality Documentation Concerning Biological Investigational Medicinal Products in Clinical Trials (EMA/CHMP/BWP/534898/2008) Guideline on scientific requirements for the environmental Risk Assessment of Gene Therapy Medicinal Products (EMEA/CHMP/GTWP/125491/2006) Guideline on Human Cell-Based medicinal Products (EMEA/CHMP/410869/2006) Guideline on virus safety evaluation of Biotechnological Investigational Medicinal Products (EMEA/CHMP/BWP/398498/05) Guideline on Strategies to Identify and Mitigate Risks for First-In-Human Clinical Trials with Investigational Medicinal Products (EMEA/CHMP/SWP/28367/07)
33 ICH Q5D CELL LINES
34 TEAM Annex 2: production of biological medicinal products for human use La produzione di prodotti medicinali biologici include processi e materiali come la coltivazione e/o l estrazione di materiali da organismi viventi che per la loro natura mostrano un intrinseca variabilità. Quality Risk Management : Minimizzare la variabilità Ridurre la contaminazione e la cross-contaminazione
35 Annex 2: production of biological medicinal products for human use Tessuti o cellule umane (Advanced Therapy ): Donazione, Approvvigionamento, controllo, distribuzione (directive 2004/23/EC, 2006/17/EC) Tracciabilità, notifica di eventi avversi (directive 2006/86/EC) Confidenzialità del donatore e del paziente
36 LA QUALITÀ DEL PRODOTTO È LA QUALITÀ DEL PROCESSO Un principio guida dell industria biotech è che il processo è il prodotto Quality by design: Incorporare la conoscenza del prodotto e del processo in ogni sua parte per assicurare che tutti I parametri critici di qualità siano sotto controllo.
37 SCHEMA DI UNA PRODUZIONE GMP Incoming sample Validation of shipping Mycoplasma testing Quality controls Technology transfer and feasibility Bioreactor choice Product specifications Set-up of methods for analysis and potency test Shipment Validated transport with data logging Follow up Batch Release Specifications in range Sterility and Viral clearance Certificate of Analysis Validation Production of three batches Preparation of the Drug Master File Production and filling Batch Product Record Preparation of the final doses for the patients
38 IL MANUFACTURING FARMA/BIOTECH Scenario farmaco tradizionale Materiale di partenza Produzione GMP Licence owner Contract Manufacturing Organization (CMO) Drug Product OSPEDALE FARMACIA
39 IL MANUFACTURING FARMA/BIOTECH Scenario farmaco terapie avanzate Materiale di partenza (ospedale) Produzione GMP Licence owner CMO OSPEDALE Drug Product OSPEDALE OSPEDALE OSPEDALE OSPEDALE
40 APPLICATIONS SFIDE NELLO SVILUPPO DI ATMPs Modello di business nuovo Commerciabilità e sostenibilità Ambito regolatorio in continua evoluzione La big pharma ha iniziato ad investire con modelli nuovi di buisness che vanno dall acquisizione della piccola bitoech ad alleanze con istituti di ricerca
41 LA TERAPIA CELLULARE La terapia cellulare somatica è l uso nell uomo di cellule vive autologhe, allogeniche o xenogeniche le cui caratteristiche biologiche sono state modificate come risultato della manipolazione per ottenere un effetto terapeutico, diagnostico o preventivo attraverso mezzi metabolici, farmacologici, immunologici Questa manipolazione comprende l espansione o l attivazione di poplazioni cellulari ex vivo, l uso di cellule allogeniche o xenogeniche associate con medical devices usati ex vivo o in vivo Le cellule o tessuti si devono considerare ingegnerizzati se soddisfano i seguenti parametri: Le cellule o i tessuti sono stati oggetto di manipolazione sostanziale in modo che vengano soddisfatte le caratteristiche biologiche, le funzioni fisiologiche o le proprietà strutturali rilevanti per la rigenerazione, il riparo o la sostituzione Le cellule o i tessuti non sono utilizzati per la stessa funzione essenziale nell organismo ricevente rispetto al donatore.
42 TEAM Annex 2: production of biological medicinal products for human use La produzione di prodotti medicinali biologici include processi e materiali come la coltivazione e/o l estrazione di materiali da organismi viventi che per la loro natura mostrano un intrinseca variabilità. Quality Risk Management : Minimizzare la variabilità Ridurre la contaminazione e la cross-contaminazione
43 Annex 2: production of biological medicinal products for human use Tessuti o cellule umane (Advanced Therapy ): Donazione, Approvvigionamento, controllo, distribuzione (directive 2004/23/EC, 2006/17/EC) Tracciabilità, notifica di eventi avversi (directive 2006/86/EC) Confidenzialità del donatore e del paziente
44 LA TERAPIA CELLULARE Esempi di prodotti per cell therapy: T-cells autologhe espanse per trattamento di tumori Cellule Dendritiche per vaccinazione terapeutica Cellule Staminali Mesenchimali Espanse Condrociti autologhi espansi Cellule Natural killer espanse o attivate
45 TERAPIA CELLULARE ASPETTI DI QUALITÀ According to current GMP regulations, cellular products must be tested for: Identity Purity Sterility Potency / Functionality Kariology / Tumorigenicity Biocompatibility Consistency In-process controls Stability
46 TERAPIA CELLULARE FABBRICAZIONE Un approccio Innovativo al manufacturing Generalmente terapie paziente specifica Sistemi single-use dedicati e chiusi Prodotti autologhi difficilmente diverranno blockbusters Prodotti allogenici: un challenge nella standardizzazione Nuovi modelli per I trials clinici che devono definire la variabilità tra preparazioni diverse e possibilmente correlarle con lo outcome Inoltre, la variabilità relativa al paziente non può essere eliminata
47 TERAPIA CELLULARE TERRENI DI COLTURA Forte spinta verso formulationi animal free FBS è tuttora accettato con alcune limitazioni Formulazioni di terreni di coltura chemicamente definiti sono attualmente disponibili per diversi tipi di cellule I produttori di terreni devono documentare la origine di ogni componente del medium I rischi maggiori sono la contamination da TSE e virale Per la TSE, solo prodotti da TSE free zones sono accettabili
48 TERAPIA CELLULARE FATTORI DI CRESCITA Devono essere ridotti all essenziale Abbassare i costi Meno analisi delle cytokine residue da eseguire (...riduce i costi) Un processo più semplice è un processo più robusto Solo pochi fattori di crescita sono disponibili in grado GMP Tutti gli altri fattori devono essere valutati con cura e il loro uso giustificato con una analisi rischio/beneficio Inoltre, l uso di reagenti non GMP è solo tollerato in clinical trials di Phase I
49 STERILITÀ DI PRODOTTI CELLULARI Applicazione: quando la formulazione finale del farmaco non può essere sterilizzata per filtrazione o altri metodi come autoclavaggio, trattamenti chimici (perossido di idrogeno); qualsiasi prodotto di terapia cellulare Il solo test di sterilità non è sufficiente ad assicurare che tutte le dosi che sono state preparate siano sterili La assicurazione di sterilità si compone di molti parameteri, che tutti insieme contribuiscono alla definizione di prodotto sterile.
50 STERILITÀ DI PRODOTTI CELLULARI Test Test Test Test.. Analizzare tutte le sacche è il solo modo per escludere ogni contaminazione con certezza assoluta. Restando però senza dosi per il paziente QUALITY SYSTEM Analizzare solo un campione rappresentativo Manufacturing Filling TEST AND MONITORING BATCH or LOT Quantità definita di prodotto fabbricato in un processo (o un insieme di processi) che ci si aspetta essere omogeneo
51 STERILITÀ DI PRODOTTI CELLULARI Sterility test (14 giorni di incubazione dopo inoculo diretto in terreno ricco) Media fill (simulazione dell intero processo in condizioni stressanti ad arte) Environmental monitoring di particelle e di contaminanti microbiologici (aria, superfici, operatori) Procedure di pulizia per strumentazione e ambienti e Cleaning validation Addestramento continuo e valutazione degli operatori
52 STABILITÀ GENETICA Analisi del Cariotipo su diverse metafasi Comparare le cellule del paziente prima e dopo la manipolazione in vitro Investigare solamente le maggiori mutazioni geniche (delezioni, translocazioni, inversioni, aneuploidie) Cariotipo Normale
53 LOGISTICA E CATENA DEL FREDDO Storage under cgmp quality system Released batch Stability study Validated transport Data logging Dry ice refill guarantee
54 CONTATTI NCNbio srl Via Mosè Bianchi 26 Milano Italy Tel/fax mlnolli@ncnbio.it
27/02/2013 IL BIOTECH ITALIANO: UN SETTORE IN CRESCITA. Maria Luisa Nolli
 IL PROCESSO DI CERTIFICAZIONE VISTO DA UNA PMI Maria Luisa Nolli SEMINARIO SSFA Cell factories and advanced therapies 14 gennaio 2013 IL BIOTECH ITALIANO: UN SETTORE IN CRESCITA 450 400 350 300 250 200
IL PROCESSO DI CERTIFICAZIONE VISTO DA UNA PMI Maria Luisa Nolli SEMINARIO SSFA Cell factories and advanced therapies 14 gennaio 2013 IL BIOTECH ITALIANO: UN SETTORE IN CRESCITA 450 400 350 300 250 200
MEDICINALI PER TERAPIE AVANZATE: ASPETTI REGOLATORI
 MEDICINALI PER TERAPIE AVANZATE: ASPETTI REGOLATORI Maria Cristina Galli, Ph.D. Dipartimento di Biologia Cellulare e Neuroscienze Istituto Superiore di Sanità Roma 53 Simposio AFI, Rimini 12-14 giugno
MEDICINALI PER TERAPIE AVANZATE: ASPETTI REGOLATORI Maria Cristina Galli, Ph.D. Dipartimento di Biologia Cellulare e Neuroscienze Istituto Superiore di Sanità Roma 53 Simposio AFI, Rimini 12-14 giugno
GMP nel Biotech. Dr.ssa Maria Luisa Nolli Founder & CEO
 areta international GMP nel Biotech Dr.ssa Maria Luisa Nolli Founder & CEO TEAM DEFINIZIONI BIOFARMACI Biodrugs «è una sostanza prodotta da organismi viventi o a partire da un loro prodotto. Vengono usati
areta international GMP nel Biotech Dr.ssa Maria Luisa Nolli Founder & CEO TEAM DEFINIZIONI BIOFARMACI Biodrugs «è una sostanza prodotta da organismi viventi o a partire da un loro prodotto. Vengono usati
new engineering solutions & technologies
 new engineering solutions & technologies n es t ew Innovazione, flessibilità ed esperienza in ogni servizio Innovation, flexibility and experience in every service delivered ngineering Progettazione, commissioning,
new engineering solutions & technologies n es t ew Innovazione, flessibilità ed esperienza in ogni servizio Innovation, flexibility and experience in every service delivered ngineering Progettazione, commissioning,
Lazio Network for Translational Medicine and Cancer Biotherapies Carmela Rozera
 Lazio Network for Translational Medicine and Cancer Biotherapies Carmela Rozera Persona Qualificata FaBioCell Dipartimento di Ematologia Oncologia e Medicina Molecolare Istituto Superiore di Sanità - Roma
Lazio Network for Translational Medicine and Cancer Biotherapies Carmela Rozera Persona Qualificata FaBioCell Dipartimento di Ematologia Oncologia e Medicina Molecolare Istituto Superiore di Sanità - Roma
Fabbricazione Industriale dei Medicinali
 Universita degli Studi di Milano Corso di Laurea in Chimica e Tecnologia Farmaceutiche Fabbricazione Industriale dei Medicinali slides Dott. Vittorino Ravelli Prof. Andrea Gazzaniga ORGANIZZAZIONE AZIENDALE
Universita degli Studi di Milano Corso di Laurea in Chimica e Tecnologia Farmaceutiche Fabbricazione Industriale dei Medicinali slides Dott. Vittorino Ravelli Prof. Andrea Gazzaniga ORGANIZZAZIONE AZIENDALE
Marta Galgano QA Manager
 PRODOTTI BIOLOGICI PER USO UMANO Sessione I - GMP: Presente e Futuro Marta Galgano QA Manager TEAM DEFINIZIONI BIOFARMACI Biodrugs «è una sostanza prodotta da organismi viventi o a partire da un loro prodotto.
PRODOTTI BIOLOGICI PER USO UMANO Sessione I - GMP: Presente e Futuro Marta Galgano QA Manager TEAM DEFINIZIONI BIOFARMACI Biodrugs «è una sostanza prodotta da organismi viventi o a partire da un loro prodotto.
1. Medicinali di terapia cellulare somatica e medicinali di ingegneria tissutale
 Allegato 1 1. Medicinali di terapia cellulare somatica e medicinali di ingegneria tissutale La sostanza attiva del medicinale è rappresentata da cellule e/o tessuti prodotti dall ingegneria cellulare o
Allegato 1 1. Medicinali di terapia cellulare somatica e medicinali di ingegneria tissutale La sostanza attiva del medicinale è rappresentata da cellule e/o tessuti prodotti dall ingegneria cellulare o
Convegno Qualità Microbiologica dei Cosmetici: Aspetti Tecnici e Normativi Milano, 15 maggio Lucia Bonadonna Istituto Superiore di Sanità
 Convegno Qualità Microbiologica dei Cosmetici: Aspetti Tecnici e Normativi Milano, 15 maggio 2015 Lucia Bonadonna Istituto Superiore di Sanità REGOLAMENTO (CE) n. 1223/2009 DEL PARLAMENTO EUROPEO E DEL
Convegno Qualità Microbiologica dei Cosmetici: Aspetti Tecnici e Normativi Milano, 15 maggio 2015 Lucia Bonadonna Istituto Superiore di Sanità REGOLAMENTO (CE) n. 1223/2009 DEL PARLAMENTO EUROPEO E DEL
Le terapie avanzate in Italia: fotografia e ruolo nel contesto europeo
 Le terapie avanzate in Italia: fotografia e ruolo nel contesto europeo Eugenio Aringhieri, Presidente Gruppo Biotecnologie Farmindustria Roma, 25 ottobre 2016 New normal world, l innovazione possibile
Le terapie avanzate in Italia: fotografia e ruolo nel contesto europeo Eugenio Aringhieri, Presidente Gruppo Biotecnologie Farmindustria Roma, 25 ottobre 2016 New normal world, l innovazione possibile
BIOTECNOLOGIE E SALUTE
 BIOTECNOLOGIE E SALUTE Le ragioni del successo del Biotech Leonardo Vingiani - Direttore Assobiotec Roma, 22 maggio 2007 Le biotecnologie rappresentano il futuro della Medicina Un settore che esiste da
BIOTECNOLOGIE E SALUTE Le ragioni del successo del Biotech Leonardo Vingiani - Direttore Assobiotec Roma, 22 maggio 2007 Le biotecnologie rappresentano il futuro della Medicina Un settore che esiste da
Normative per la produzione
 Istituto dei Tessuti Officina di Produzione Normative per la produzione Codice comunitario relativo ai medicinali per uso umano 2001/83/CE Recepito da DL 24/4/2006 n 219 Attuazione di 2003/63/CE (che modifica
Istituto dei Tessuti Officina di Produzione Normative per la produzione Codice comunitario relativo ai medicinali per uso umano 2001/83/CE Recepito da DL 24/4/2006 n 219 Attuazione di 2003/63/CE (che modifica
Qualifica di un Fornitore/Distributore nell ambito Bio-tech:! l iter approvativo e sue criticità. Maria Adele Imro
 Qualifica di un Fornitore/Distributore nell ambito Bio-tech:! l iter approvativo e sue criticità Maria Adele Imro MolMed S.P.A. MolMed S.p.A. è una società di biotecnologie mediche focalizzata su ricerca,
Qualifica di un Fornitore/Distributore nell ambito Bio-tech:! l iter approvativo e sue criticità Maria Adele Imro MolMed S.P.A. MolMed S.p.A. è una società di biotecnologie mediche focalizzata su ricerca,
Sfide ed opportunità per il settore farmaceutico Rimini, 10 Giugno Riccardo Palmisano. Vice Presidente Esecutivo Assobiotec
 Quali opportunità dalle biotecnologie per il futuro dell'industria farmaceutica? Sfide ed opportunità per il settore farmaceutico Rimini, 10 Giugno 2011 Riccardo Palmisano Vice Presidente Esecutivo Assobiotec
Quali opportunità dalle biotecnologie per il futuro dell'industria farmaceutica? Sfide ed opportunità per il settore farmaceutico Rimini, 10 Giugno 2011 Riccardo Palmisano Vice Presidente Esecutivo Assobiotec
MASTER UNIVERSITARIO DI II LIVELLO IN TECNOLOGIE FARMACEUTICHE E ATTIVITA REGOLATORIE Programma del corso 2016/2017 Lezioni Frontali
 MASTER UNIVERSITARIO DI II LIVELLO IN TECNOLOGIE FARMACEUTICHE E ATTIVITA REGOLATORIE Programma del corso 2016/2017 Lezioni Frontali Maggio 2017 Modulo 4 Argomenti specialistici (1 CFU) Data Orario Titolo
MASTER UNIVERSITARIO DI II LIVELLO IN TECNOLOGIE FARMACEUTICHE E ATTIVITA REGOLATORIE Programma del corso 2016/2017 Lezioni Frontali Maggio 2017 Modulo 4 Argomenti specialistici (1 CFU) Data Orario Titolo
Registrazione Partecipanti Introduzione al Corso 10.00 13.00 L azienda farmaceutica: organizzazione e funzioni G. Breghi
 05.02.16 9.00 9.30 9.30 10.00 Università degli Studi di Siena Dipartimento di Biotecnologie, Chimica e Farmacia Master di II Livello in Tecnologie Farmaceutiche Industriali A.A. 2015-2016 Unità Didattica
05.02.16 9.00 9.30 9.30 10.00 Università degli Studi di Siena Dipartimento di Biotecnologie, Chimica e Farmacia Master di II Livello in Tecnologie Farmaceutiche Industriali A.A. 2015-2016 Unità Didattica
Le prospettive occupazionali dei laureati in Scienze del Farmaco
 Università degli Studi di Milano 7 Marzo 2016 Incontro con le Associazioni di settore Incontri di preparazione dedicati agli studenti e ai neolaureati di Scienze del Farmaco Le prospettive occupazionali
Università degli Studi di Milano 7 Marzo 2016 Incontro con le Associazioni di settore Incontri di preparazione dedicati agli studenti e ai neolaureati di Scienze del Farmaco Le prospettive occupazionali
ARETA e IL SUO VALORE
 ARETA e IL SUO VALORE Dr. Maria Luisa Nolli C.E.O. Areta International www.aretaint.com 1 ARETA INTERNATIONAL Areta è una società di biotecnologie nel settore delle colture cellulari per lo sviluppo di
ARETA e IL SUO VALORE Dr. Maria Luisa Nolli C.E.O. Areta International www.aretaint.com 1 ARETA INTERNATIONAL Areta è una società di biotecnologie nel settore delle colture cellulari per lo sviluppo di
Prof.ssa Adriana Ceci
 Prof.ssa Adriana Ceci Fondazione per la Ricerca Farmacologica Gianni Benzi Onlus Via Abate Eustasio, 30-70010 Valenzano (Ba) C.F. 93347800729 - P.IVA 06780820723 Tel 080-9643146 - Fax 080-9643144 - info@fondazionebenzi.org
Prof.ssa Adriana Ceci Fondazione per la Ricerca Farmacologica Gianni Benzi Onlus Via Abate Eustasio, 30-70010 Valenzano (Ba) C.F. 93347800729 - P.IVA 06780820723 Tel 080-9643146 - Fax 080-9643144 - info@fondazionebenzi.org
«Fiera delle idee» PO FESR SICILIA Catania, 31 gennaio 2017, Dipartimento di Fisica e Astronomia, Università degli Studi di Catania
 «Fiera delle idee» PO FESR SICILIA 2014-2020 Catania, 31 gennaio 2017, Dipartimento di Fisica e Astronomia, Università degli Studi di Catania Presenter: Dr. Giulia Russo, giulia.russo@unict.it - University
«Fiera delle idee» PO FESR SICILIA 2014-2020 Catania, 31 gennaio 2017, Dipartimento di Fisica e Astronomia, Università degli Studi di Catania Presenter: Dr. Giulia Russo, giulia.russo@unict.it - University
RICERCA E SVILUPPO DI NUOVI FARMACI
 RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
Generalità sul contesto normativo: cosa significa lavorare in GMP e in GLP
 Generalità sul contesto normativo: cosa significa lavorare in GMP e in GLP Le aziende farmaceutiche operano in un ambiente molto regolamentato I prodotti farmaceutici sono progettati e sviluppati in modo
Generalità sul contesto normativo: cosa significa lavorare in GMP e in GLP Le aziende farmaceutiche operano in un ambiente molto regolamentato I prodotti farmaceutici sono progettati e sviluppati in modo
Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie per l innovazione di processi e prodotti A.A. 2011/12
 Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie per l innovazione di processi e prodotti A.A. 2011/12 Titolo insegnamento: Biotecnologie delle fermentazioni (Prof. Luigi Palmieri) integrato
Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie per l innovazione di processi e prodotti A.A. 2011/12 Titolo insegnamento: Biotecnologie delle fermentazioni (Prof. Luigi Palmieri) integrato
Quality by Design: innovazione per il life-cycle del prodotto
 Giornata di studio Applicazione del Quality by Design (QbD) ai processi farmaceutici 22 Aprile 2013 Quality by Design: innovazione per il life-cycle del prodotto Paolo Mazzoni Agenda Cosa è il Quality
Giornata di studio Applicazione del Quality by Design (QbD) ai processi farmaceutici 22 Aprile 2013 Quality by Design: innovazione per il life-cycle del prodotto Paolo Mazzoni Agenda Cosa è il Quality
La qualità del farmaco sperimentale come partner indispensabile per la ricerca clinica
 52 SIMPOSIO AFI 30-31 MAGGIO 1GIUGNO 2012 - RIMINI La qualità del farmaco sperimentale come partner indispensabile per la ricerca clinica Luciano Gambini 1 L obiettivo di qualità del farmaco sperimentale
52 SIMPOSIO AFI 30-31 MAGGIO 1GIUGNO 2012 - RIMINI La qualità del farmaco sperimentale come partner indispensabile per la ricerca clinica Luciano Gambini 1 L obiettivo di qualità del farmaco sperimentale
Centro Nazionale Malattie Rare: ricerca sperimentale e sanità pubblica
 Centro Nazionale Malattie Rare: ricerca sperimentale e sanità pubblica Marco Salvatore, Domenica Taruscio Centro Nazionale Malattie Rare Istituto Superiore Sanità Malattie cardiovascolari Anomalie congenite
Centro Nazionale Malattie Rare: ricerca sperimentale e sanità pubblica Marco Salvatore, Domenica Taruscio Centro Nazionale Malattie Rare Istituto Superiore Sanità Malattie cardiovascolari Anomalie congenite
L unità di terapia cellulare al Cardiocentro Ticino
 L unità di terapia cellulare al Cardiocentro Ticino Dr.ssa Lucia Turchetto 25 luglio 2012 Sommario L UTC al CCT: idea e scopo Cosa facciamo? Stato dell arte delle terapie avanzate Come funziona una Cell
L unità di terapia cellulare al Cardiocentro Ticino Dr.ssa Lucia Turchetto 25 luglio 2012 Sommario L UTC al CCT: idea e scopo Cosa facciamo? Stato dell arte delle terapie avanzate Come funziona una Cell
La convalida di prodotti medicinali per terapie avanzate
 La convalida di prodotti medicinali per terapie avanzate Livia Roseti Laboratorio di Manipolazione Cellulare Estensiva, PROMETEO Istituto Ortopedico Rizzoli, Bologna Qualified Person: Alessandra Bassi
La convalida di prodotti medicinali per terapie avanzate Livia Roseti Laboratorio di Manipolazione Cellulare Estensiva, PROMETEO Istituto Ortopedico Rizzoli, Bologna Qualified Person: Alessandra Bassi
Ministero della salute Dott.ssa Monica Capasso m.capasso@sanita.it
 Ministero della salute Dott.ssa Monica Capasso m.capasso@sanita.it Decreto Legislativo 50/2007 Art. 1. Campo di applicazione 1. Il presente decreto disciplina l'adozione e l'applicazione dei principi di
Ministero della salute Dott.ssa Monica Capasso m.capasso@sanita.it Decreto Legislativo 50/2007 Art. 1. Campo di applicazione 1. Il presente decreto disciplina l'adozione e l'applicazione dei principi di
Nuovi scenari della ricerca clinica in Europa. Giuseppe Banfi Direttore Generale Fondazione Centro San Raffaele Università Vita e Salute San Raffaele
 Nuovi scenari della ricerca clinica in Europa Giuseppe Banfi Direttore Generale Fondazione Centro San Raffaele Università Vita e Salute San Raffaele 1 Riduzione del numero di clinical trials in Europa
Nuovi scenari della ricerca clinica in Europa Giuseppe Banfi Direttore Generale Fondazione Centro San Raffaele Università Vita e Salute San Raffaele 1 Riduzione del numero di clinical trials in Europa
Tecnologie del DNA ricombinante. Farmaci e tessuti BIOTECNOLOGICI
 Tecnologie del DNA ricombinante. Farmaci e tessuti BIOTECNOLOGICI INGEGNERIA CELLULARE definizioni: DNA ricombinante: Molecole di DNA prodotte artificialmente e contenenti sequenze provenienti da diversi
Tecnologie del DNA ricombinante. Farmaci e tessuti BIOTECNOLOGICI INGEGNERIA CELLULARE definizioni: DNA ricombinante: Molecole di DNA prodotte artificialmente e contenenti sequenze provenienti da diversi
STABILITA DELLE FORME DI DOSAGGIO
 STABILITA DELLE FORME DI DOSAGGIO Capacità di una formulazione, in uno specifico contenitore, di mantenere inalterate le sue proprietà entro limiti definiti durante il periodo di conservazione ed utilizzo
STABILITA DELLE FORME DI DOSAGGIO Capacità di una formulazione, in uno specifico contenitore, di mantenere inalterate le sue proprietà entro limiti definiti durante il periodo di conservazione ed utilizzo
Bioequivalenti e biosimilari: aspetti regolatori e loro impatto sull appropriatezza prescrittiva
 Bioequivalenti e biosimilari: aspetti regolatori e loro impatto sull appropriatezza prescrittiva Pierluigi Navarra Istituto di Farmacologia Facoltà di Medicina e Chirurgia Università Cattolica - Roma Analisi
Bioequivalenti e biosimilari: aspetti regolatori e loro impatto sull appropriatezza prescrittiva Pierluigi Navarra Istituto di Farmacologia Facoltà di Medicina e Chirurgia Università Cattolica - Roma Analisi
Produzione e Controllo degli IMPs Concetti di base
 Produzione e Controllo degli IMPs Concetti di base Luciano Gambini GMP Consultant SOMMARIO DEFINIZIONI LA DIRETTIVA 2001/20 DIFFERENZE FRA IMPS E FARMACI COMMERCIALI LE RESPONSABILITÀ DURANTE IL CICLO
Produzione e Controllo degli IMPs Concetti di base Luciano Gambini GMP Consultant SOMMARIO DEFINIZIONI LA DIRETTIVA 2001/20 DIFFERENZE FRA IMPS E FARMACI COMMERCIALI LE RESPONSABILITÀ DURANTE IL CICLO
Audit a studi clinici in cui si utilizzano sistemi elettronici
 Congresso Nazionale GIQAR 2012 - Torino Audit a studi clinici in cui si utilizzano sistemi elettronici Romina Zanier Computerised System Validation Specialist SIGMA-TAU ecrf electronic Case Report Form
Congresso Nazionale GIQAR 2012 - Torino Audit a studi clinici in cui si utilizzano sistemi elettronici Romina Zanier Computerised System Validation Specialist SIGMA-TAU ecrf electronic Case Report Form
CONFERENZA STAMPA DI PRESENTAZIONE DI XELLBIOGENE DEL
 CONFERENZA STAMPA DI PRESENTAZIONE DI XELLBIOGENE DEL 20.2.2014 Sintesi dell intervento del Dr. Marco Dieci L Ospedale Pediatrico Bambino Gesù e il Policlinico Universitario Agostino Gemelli fanno il loro
CONFERENZA STAMPA DI PRESENTAZIONE DI XELLBIOGENE DEL 20.2.2014 Sintesi dell intervento del Dr. Marco Dieci L Ospedale Pediatrico Bambino Gesù e il Policlinico Universitario Agostino Gemelli fanno il loro
La nuova legislazione sulla Farmacovigilanza
 La nuova legislazione sulla Farmacovigilanza Il Sistema di Gestione del Rischio Stefania De Santis Sigma-Tau IFR S.p.A., GdL Farmacovigilanza Farmindustria Auditorium Confindustria Roma, 13 settembre 2012
La nuova legislazione sulla Farmacovigilanza Il Sistema di Gestione del Rischio Stefania De Santis Sigma-Tau IFR S.p.A., GdL Farmacovigilanza Farmindustria Auditorium Confindustria Roma, 13 settembre 2012
Ordinanza concernente il trapianto di organi, tessuti e cellule umani
 Ordinanza concernente il trapianto di organi, tessuti e cellule umani (Ordinanza sui trapianti) Modifica del 12 gennaio 2010 Il Dipartimento federale dell interno, visto l articolo 53 dell ordinanza del
Ordinanza concernente il trapianto di organi, tessuti e cellule umani (Ordinanza sui trapianti) Modifica del 12 gennaio 2010 Il Dipartimento federale dell interno, visto l articolo 53 dell ordinanza del
La sicurezza del sangue e degli emoderivati
 La sicurezza del sangue e degli emoderivati Vincenzo de Angelis Coordinamento Regionale del Sistema Trasfusionale Regione Autonoma Friuli Venezia Giulia 1 QUALITY SYSTEM IN THE CLINICAL USE OF BLOOD GUIDE
La sicurezza del sangue e degli emoderivati Vincenzo de Angelis Coordinamento Regionale del Sistema Trasfusionale Regione Autonoma Friuli Venezia Giulia 1 QUALITY SYSTEM IN THE CLINICAL USE OF BLOOD GUIDE
LE SOMMINISTRAZIONI DOMICILIARI DEI FARMACI ORFANI E I REGISTRI DEI FARMACI
 STATO DELL ASSISTENZA ALLE PERSONE CON MALATTIA RARA IN ITALIA: IL CONTRIBUTO DELLE REGIONI Venezia, 21 Aprile 2015 LE SOMMINISTRAZIONI DOMICILIARI DEI FARMACI ORFANI E I REGISTRI DEI FARMACI Coordinamento
STATO DELL ASSISTENZA ALLE PERSONE CON MALATTIA RARA IN ITALIA: IL CONTRIBUTO DELLE REGIONI Venezia, 21 Aprile 2015 LE SOMMINISTRAZIONI DOMICILIARI DEI FARMACI ORFANI E I REGISTRI DEI FARMACI Coordinamento
Curriculum Farmaceutico Afferisce alla. Facoltà di Scienze del Farmaco
 Corso di Laurea in Biotecnologia Curriculum Farmaceutico Afferisce alla Facoltà di Scienze del Farmaco http://www.scienzedelfarmaco.unimi.it/ Dipartimenti: - Scienze Farmacologiche e Biomolecolari (DiSFeB)
Corso di Laurea in Biotecnologia Curriculum Farmaceutico Afferisce alla Facoltà di Scienze del Farmaco http://www.scienzedelfarmaco.unimi.it/ Dipartimenti: - Scienze Farmacologiche e Biomolecolari (DiSFeB)
Maria Luisa Nolli Chief Executive Officer Areta International
 I FARMACI BIOLOGICI: COME STA CAMBIANDO LA MEDICINA Sessione V - Medicinali Biologici e Medicinali per Terapie Avanzate: Modelli per le Terapie del Futuro Maria Luisa Nolli Chief Executive Officer Areta
I FARMACI BIOLOGICI: COME STA CAMBIANDO LA MEDICINA Sessione V - Medicinali Biologici e Medicinali per Terapie Avanzate: Modelli per le Terapie del Futuro Maria Luisa Nolli Chief Executive Officer Areta
UK NEQAS nel processo di preparazione di cellule staminali CD34+ geneticamente modificate per autotrapianto
 UK NEQAS nel processo di preparazione di cellule staminali CD34+ geneticamente modificate per autotrapianto 7 UK NEQAS USERS MEETING Milano, 13 Novembre 2014 Margherita Neri Development Supervisor Cos
UK NEQAS nel processo di preparazione di cellule staminali CD34+ geneticamente modificate per autotrapianto 7 UK NEQAS USERS MEETING Milano, 13 Novembre 2014 Margherita Neri Development Supervisor Cos
Le terapie avanzate nella cura delle malattie rare
 Le terapie avanzate nella cura delle malattie rare Alessandro Aiuti Dipartimento Pediatrico Universitario Ospedaliero,OPBG, Università di Roma Tor Vergata Istituto San Raffaele Telethon per la Terapia
Le terapie avanzate nella cura delle malattie rare Alessandro Aiuti Dipartimento Pediatrico Universitario Ospedaliero,OPBG, Università di Roma Tor Vergata Istituto San Raffaele Telethon per la Terapia
PRESENTAZIONE AZIENDALE. Spin off dell Università di Ferrara RNA BASED THERAPEUTICS, A R&D CUTTING EDGE
 PRESENTAZIONE AZIENDALE Spin off dell Università di Ferrara RNA BASED THERAPEUTICS, A R&D CUTTING EDGE MISSIONE: ricercare, brevettare e sviluppare Farmaci Biotecnologici innovativi (Gene Therapy Medicinal
PRESENTAZIONE AZIENDALE Spin off dell Università di Ferrara RNA BASED THERAPEUTICS, A R&D CUTTING EDGE MISSIONE: ricercare, brevettare e sviluppare Farmaci Biotecnologici innovativi (Gene Therapy Medicinal
L Agenzia Italiana del Farmaco nel contesto europeo
 L Agenzia Italiana del Farmaco nel contesto europeo Luca Pani @Luca Pani - dg@aifa.gov.it Milano, 18 ottobre 2016 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono
L Agenzia Italiana del Farmaco nel contesto europeo Luca Pani @Luca Pani - dg@aifa.gov.it Milano, 18 ottobre 2016 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono
GMP PER MEDICINALI DA TERAPIE AVANZATE
 GMP PER MEDICINALI DA TERAPIE AVANZATE LE TERAPIE AVANZATE I medicinali per Terapie Avanzate si basano su processi produttivi centrati su varie biomolecole prodotte mediante trasferimento di geni e/o cellule
GMP PER MEDICINALI DA TERAPIE AVANZATE LE TERAPIE AVANZATE I medicinali per Terapie Avanzate si basano su processi produttivi centrati su varie biomolecole prodotte mediante trasferimento di geni e/o cellule
PROGRAMMA DI RICERCA ANALISI DI BUDGET-IMPACT SUI FARMACI INNOVATIVI
 PROGRAMMA DI RICERCA ANALISI DI BUDGET-IMPACT SUI FARMACI INNOVATIVI Introduzione Il numero di farmaci innovativi in fase di sviluppo o di approvazione regolatoria sta rapidamente aumentando. Da un lato
PROGRAMMA DI RICERCA ANALISI DI BUDGET-IMPACT SUI FARMACI INNOVATIVI Introduzione Il numero di farmaci innovativi in fase di sviluppo o di approvazione regolatoria sta rapidamente aumentando. Da un lato
CLASSICHE GENETICA BIOTECNOLOGIE MODERNE BIOLOGIA CELLULARE TECNOLOGIA DEL DNA RICOMBINANTE INGEGNERIA GENETICA
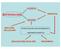 CLASSICHE BIOTECNOLOGIE GENETICA MODERNE BIOLOGIA CELLULARE TECNOLOGIA DEL DNA RICOMBINANTE INGEGNERIA GENETICA BIOLOGIA MOLECOLARE BIOCHIMICA CREAZIONE A FINI MEDICI DI MICRO-ORGANISMI GENETICAMENTE MODIFICATI
CLASSICHE BIOTECNOLOGIE GENETICA MODERNE BIOLOGIA CELLULARE TECNOLOGIA DEL DNA RICOMBINANTE INGEGNERIA GENETICA BIOLOGIA MOLECOLARE BIOCHIMICA CREAZIONE A FINI MEDICI DI MICRO-ORGANISMI GENETICAMENTE MODIFICATI
CERTIFICATO CE. Dichiarazione di approvazione del sistema qualità (Garanzia di qualità della produzione) Certificato n. 1670/MDD MACOSTA MEDITEA SRL
 CERTIFICATO CE Certificato n. 1670/MDD Dichiarazione di approvazione del sistema qualità (Garanzia di qualità della produzione) Visto l'esito delle verifiche condotte in conformità all'allegato V della
CERTIFICATO CE Certificato n. 1670/MDD Dichiarazione di approvazione del sistema qualità (Garanzia di qualità della produzione) Visto l'esito delle verifiche condotte in conformità all'allegato V della
ormazione GMP auditinggmp uditing CONSULEN GMP PREPARAZIONE specialisti
 auditinggmp uditing CONSULEN PROGRAMMA C O R S CONSULENZA preparazio I FORMAZIONE MP GMP ISassistenza specialisti PREPARAZIONE in GMP ormazione enza legale QS 2016.1 Pagina 1 di 6 ELENCO CORSI FORMAZIONE
auditinggmp uditing CONSULEN PROGRAMMA C O R S CONSULENZA preparazio I FORMAZIONE MP GMP ISassistenza specialisti PREPARAZIONE in GMP ormazione enza legale QS 2016.1 Pagina 1 di 6 ELENCO CORSI FORMAZIONE
DIPARTIMENTO DI MEDICINA CLINICA E MOLECOLARE AVVISO INTERNO DI CONFERIMENTO DI INCARICO
 AVVISO N 22/16 Prot. 1079/16 DIPARTIMENTO DI MEDICINA CLINICA E MOLECOLARE AVVISO INTERNO DI CONFERIMENTO DI INCARICO - Visto il Regolamento per l affidamento di incarichi di collaborazione coordinata
AVVISO N 22/16 Prot. 1079/16 DIPARTIMENTO DI MEDICINA CLINICA E MOLECOLARE AVVISO INTERNO DI CONFERIMENTO DI INCARICO - Visto il Regolamento per l affidamento di incarichi di collaborazione coordinata
LE MALATTIE RARE IN ITALIA E IN EUROPA
 LE MALATTIE RARE IN ITALIA E IN EUROPA Domenica Taruscio Dire&ore Centro Nazionale Mala0e Rare Is4tuto Superiore di Sanità Roma Roma 21 Novembre 2014 MALATTIE RARE E FARMACI ORFANI INIZIATIVE INTERNAZIONALI
LE MALATTIE RARE IN ITALIA E IN EUROPA Domenica Taruscio Dire&ore Centro Nazionale Mala0e Rare Is4tuto Superiore di Sanità Roma Roma 21 Novembre 2014 MALATTIE RARE E FARMACI ORFANI INIZIATIVE INTERNAZIONALI
QUALIFICAZIONE DEI FORNITORI DI ECCIPIENTI E MATERIALI DI CONFEZIONAMENTO
 QUALIFICAZIONE DEI FORNITORI DI ECCIPIENTI E MATERIALI DI CONFEZIONAMENTO G. Filippin; M. Agnelli; R. Brusa; M. Canobbio; A. Cifarelli GRUPPO DI STUDIO QUALITÁ E FORNITORI AFI 55 Simposio AFI - Rimini
QUALIFICAZIONE DEI FORNITORI DI ECCIPIENTI E MATERIALI DI CONFEZIONAMENTO G. Filippin; M. Agnelli; R. Brusa; M. Canobbio; A. Cifarelli GRUPPO DI STUDIO QUALITÁ E FORNITORI AFI 55 Simposio AFI - Rimini
Dalle terapie mediche ai farmaci per le terapie avanzate: Holostem e la rigenerazione corneale. Andrea Chiesi CEO Rimini, 13 giugno 2013
 Dalle terapie mediche ai farmaci per le terapie avanzate: Holostem e la rigenerazione corneale Andrea Chiesi CEO Rimini, 13 giugno 2013 L opportunità (dal 2007 ) 6) Chiesi: - competenza industriale e regolatoria
Dalle terapie mediche ai farmaci per le terapie avanzate: Holostem e la rigenerazione corneale Andrea Chiesi CEO Rimini, 13 giugno 2013 L opportunità (dal 2007 ) 6) Chiesi: - competenza industriale e regolatoria
Unità Tecnica Biologia delle Radiazioni e della Salute dell Uomo (UTBIORAD) Responsabile: Dr. Carmela MARINO
 UTBIORAD: Laboratori Unità Tecnica Biologia delle Radiazioni e della Salute dell Uomo (UTBIORAD) Responsabile: Dr. Carmela MARINO Laboratorio di Biologia delle Radiazioni e Biomedicina (RAB) Responsabile:
UTBIORAD: Laboratori Unità Tecnica Biologia delle Radiazioni e della Salute dell Uomo (UTBIORAD) Responsabile: Dr. Carmela MARINO Laboratorio di Biologia delle Radiazioni e Biomedicina (RAB) Responsabile:
ANALISI DEI PERICOLI Hazard Analysis
 7.4 ANALISI DEI PERICOLI Hazard Analysis Identificazione Valutazione Misure di Controllo Identification Assessment Control Measures Taccani 1 7.4.2 Identificare i pericoli e i livelli accettabili Identify
7.4 ANALISI DEI PERICOLI Hazard Analysis Identificazione Valutazione Misure di Controllo Identification Assessment Control Measures Taccani 1 7.4.2 Identificare i pericoli e i livelli accettabili Identify
Ilaria Malerba - Luigi Manzo Centro Reach e Università degli Studi di Pavia
 Safety evaluation of nanomaterials: challenges and current research trends Ilaria Malerba - Luigi Manzo Centro Reach e Università degli Studi di Pavia PNIC, 2 Dicembre 2008 Properties of Nanoparticles
Safety evaluation of nanomaterials: challenges and current research trends Ilaria Malerba - Luigi Manzo Centro Reach e Università degli Studi di Pavia PNIC, 2 Dicembre 2008 Properties of Nanoparticles
LAMISHIELD ANTIBACTERIAL LAMINATE. Unlimited selection
 LAMISHIELD ANTIBACTERIAL LAMINATE Unlimited selection PROTECTION HYGIENE HEALTHCARE LAMINATO ANTIBATTERICO Lamishield è l HPL antibatterico di Abet Laminati. Grazie alla sua protezione antibatterica, totalmente
LAMISHIELD ANTIBACTERIAL LAMINATE Unlimited selection PROTECTION HYGIENE HEALTHCARE LAMINATO ANTIBATTERICO Lamishield è l HPL antibatterico di Abet Laminati. Grazie alla sua protezione antibatterica, totalmente
Registrazione Partecipanti Introduzione al Corso L azienda farmaceutica: organizzazione e funzioni
 01.02.13 9.00 09.30 9.30 10.00 Unità Didattica I: IL PRODOTTO FARMACEUTICO (1-2 Febbraio 2013) Registrazione Partecipanti Introduzione al Corso 10.00 13.00 L azienda farmaceutica: organizzazione e funzioni
01.02.13 9.00 09.30 9.30 10.00 Unità Didattica I: IL PRODOTTO FARMACEUTICO (1-2 Febbraio 2013) Registrazione Partecipanti Introduzione al Corso 10.00 13.00 L azienda farmaceutica: organizzazione e funzioni
CERTIFICATO CE. Dichiarazione di approvazione del sistema qualità (Sistema completo di garanzia qualità) Certificato n. 1668/MDD HMC PREMEDICAL SPA
 CERTIFICATO CE Certificato n. 1668/MDD Dichiarazione di approvazione del sistema qualità (Sistema completo di garanzia qualità) Visto l'esito delle verifiche condotte in conformità all'allegato II, con
CERTIFICATO CE Certificato n. 1668/MDD Dichiarazione di approvazione del sistema qualità (Sistema completo di garanzia qualità) Visto l'esito delle verifiche condotte in conformità all'allegato II, con
CHALLENGE TEST. Valutazione della stabilità microbiologica di un prodotto cosmetico (UNI EN ISO 11930:2012)
 CHALLENGE TEST Valutazione della stabilità microbiologica di un prodotto cosmetico (UNI EN ISO 11930:2012) Evaluation of the microbiological stability of a cosmetic product (UNI EN ISO 11930:2012) FLUIDO
CHALLENGE TEST Valutazione della stabilità microbiologica di un prodotto cosmetico (UNI EN ISO 11930:2012) Evaluation of the microbiological stability of a cosmetic product (UNI EN ISO 11930:2012) FLUIDO
Trasporto del materiale biologico trasfusionale
 Il trasporto delle unità di sangue intero, degli emocomponenti e dei campioni biologici dalle sedi di raccolta ai poli di lavorazione e qualificazione biologica Trasporto del materiale biologico trasfusionale
Il trasporto delle unità di sangue intero, degli emocomponenti e dei campioni biologici dalle sedi di raccolta ai poli di lavorazione e qualificazione biologica Trasporto del materiale biologico trasfusionale
correzione, verifica e validazione dei risultati
 Università degli Studi di Padova Scuola di Specializzazione in Biochimica Clinica (A.A. 2005-2006) INDIRIZZI: DIAGNOSTICO E ANALITICO TECNOLOGICO Biochimica Clinica e Biologia Molecolare Clinica: automazione
Università degli Studi di Padova Scuola di Specializzazione in Biochimica Clinica (A.A. 2005-2006) INDIRIZZI: DIAGNOSTICO E ANALITICO TECNOLOGICO Biochimica Clinica e Biologia Molecolare Clinica: automazione
I farmaci biologici: dallo sviluppo alla clinica
 I farmaci biologici: dallo sviluppo alla clinica Mauro A. Ninci Medical Affairs Director Genzyme 16 settembre 2014 Erik Familial Hypercholesterolemia USA Definizione di farmaco biologico Prodotto medicinale
I farmaci biologici: dallo sviluppo alla clinica Mauro A. Ninci Medical Affairs Director Genzyme 16 settembre 2014 Erik Familial Hypercholesterolemia USA Definizione di farmaco biologico Prodotto medicinale
Le innovazioni del prossimo futuro TECNOLOGIE PRIORITARIE PER L INDUSTRA. Dr.ssa Maria Luisa Nolli. Farmaceutica e biotecnologie
 Le innovazioni del prossimo futuro TECNOLOGIE PRIORITARIE PER L INDUSTRA Farmaceutica e biotecnologie Milano, 30 gennaio 2013 Dr.ssa Maria Luisa Nolli Assobiotec PROFILO DEL SETTORE Grandezze dell Industria
Le innovazioni del prossimo futuro TECNOLOGIE PRIORITARIE PER L INDUSTRA Farmaceutica e biotecnologie Milano, 30 gennaio 2013 Dr.ssa Maria Luisa Nolli Assobiotec PROFILO DEL SETTORE Grandezze dell Industria
INVENT S.r.l. Più di 60 ricercatori sono impiegati nelle start-up
 Gennaio 2015 INVENT S.r.l. Fondata nel 2002 come fondo di seed per investire in start-up innovative. Lo scopo è di valorizzare nuovi prodotti (prototipi/brevetti) mediante il trasferimento verso il mercato
Gennaio 2015 INVENT S.r.l. Fondata nel 2002 come fondo di seed per investire in start-up innovative. Lo scopo è di valorizzare nuovi prodotti (prototipi/brevetti) mediante il trasferimento verso il mercato
Biotecnologia: la salute nel portafoglio
 Biotecnologia: la salute nel portafoglio 2000 - Il genoma umano La decodificazione del DNA ha segnato l inizio dell era più importante nella storia della civiltà umana. Siamo passati dalla rivoluzione
Biotecnologia: la salute nel portafoglio 2000 - Il genoma umano La decodificazione del DNA ha segnato l inizio dell era più importante nella storia della civiltà umana. Siamo passati dalla rivoluzione
Registrazione Partecipanti Introduzione al Corso L azienda farmaceutica: organizzazione e funzioni G. Breghi
 07.02.14 9.00 9.30 9.30 10.00 Università degli Studi di Siena Dipartimento di Biotecnologie, Chimica e Farmacia Master di II Livello in Tecnologie Farmaceutiche Industriali A.A. 2013-2014 Unità Didattica
07.02.14 9.00 9.30 9.30 10.00 Università degli Studi di Siena Dipartimento di Biotecnologie, Chimica e Farmacia Master di II Livello in Tecnologie Farmaceutiche Industriali A.A. 2013-2014 Unità Didattica
Centre tor Health Technologies. University of Pavia
 Centre tor Health Technologies University of Pavia Center for Health Technologies Centro di tecnologie per la salute Riccardo Bellazzi, Carlomaurizio Montecucco, Livia Visai Obiettivi CHT Fornire nuove
Centre tor Health Technologies University of Pavia Center for Health Technologies Centro di tecnologie per la salute Riccardo Bellazzi, Carlomaurizio Montecucco, Livia Visai Obiettivi CHT Fornire nuove
Come organizzare una Syncope Unit nel Tuo ospedale: i criteri GIMSI per la certificazione. Michele Brignole. Key points:
 Come organizzare una Syncope Unit nel Tuo ospedale: i criteri GIMSI per la certificazione Michele Brignole Key points: 1 Il modello organizzativo di Syncope Unit del GIMSI 2 Come ottenere la Certificazione
Come organizzare una Syncope Unit nel Tuo ospedale: i criteri GIMSI per la certificazione Michele Brignole Key points: 1 Il modello organizzativo di Syncope Unit del GIMSI 2 Come ottenere la Certificazione
Il network europeo e lo Studio CERP 2010
 Il network europeo e lo Studio CERP 2010 Il consorzio di ricerca EPRC Il Research network della Società Europea di Cure Palliative Il Centro europeo di ricerca in cure palliative (PCR) 1 Il network europeo
Il network europeo e lo Studio CERP 2010 Il consorzio di ricerca EPRC Il Research network della Società Europea di Cure Palliative Il Centro europeo di ricerca in cure palliative (PCR) 1 Il network europeo
Sinergie e opportunità per l'innovazione e la competitività: il nuovo ruolo di AIFA
 Sinergie e opportunità per l'innovazione e la competitività: il nuovo ruolo di AIFA Prof. Sergio Pecorelli Presidente AIFA Lecce, 5 Dicembre 2014 S.Pecorelli@aifa.gov.it Il contesto globale Il nuovo contesto
Sinergie e opportunità per l'innovazione e la competitività: il nuovo ruolo di AIFA Prof. Sergio Pecorelli Presidente AIFA Lecce, 5 Dicembre 2014 S.Pecorelli@aifa.gov.it Il contesto globale Il nuovo contesto
Presentazione: Criticità nella produzione di medicinali privi di AIC.
 Presentazione: Criticità nella produzione di medicinali privi di AIC. Relatore: Dr. Giampiero Lorenti e Dr. Giuseppe Pimpinella Data: Rimini, 13 Giugno 2013 Dichiarazione di trasparenza/interessi* Le opinioni
Presentazione: Criticità nella produzione di medicinali privi di AIC. Relatore: Dr. Giampiero Lorenti e Dr. Giuseppe Pimpinella Data: Rimini, 13 Giugno 2013 Dichiarazione di trasparenza/interessi* Le opinioni
La nuova legislazione sulla Farmacovigilanza. Responsabilità e compiti dell AIFA. Laura Sottosanti. Roma, 13 settembre 2012
 La nuova legislazione sulla Farmacovigilanza Responsabilità e compiti dell AIFA Laura Sottosanti Roma, 13 settembre 2012 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione
La nuova legislazione sulla Farmacovigilanza Responsabilità e compiti dell AIFA Laura Sottosanti Roma, 13 settembre 2012 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione
CONOSCENZE / COMPETENZE STRUMENTI E METODI LABORATORIO COLLEGAMENTI VERIFICHE ORE
 PROGRAMMAZIONE DIDATTICA DEL CORSO DI BIOLOGIA,MICROBIOLOGIA E TECNOLOGIE DI CONTROLLO SANITARIO CLASSE 5 D ANNO SCOLASTICO 2015-2016 Proff ELENA ZACCHIA, RAFFAELE FIORINI MODULI MODULO 1 Modulo di raccordo
PROGRAMMAZIONE DIDATTICA DEL CORSO DI BIOLOGIA,MICROBIOLOGIA E TECNOLOGIE DI CONTROLLO SANITARIO CLASSE 5 D ANNO SCOLASTICO 2015-2016 Proff ELENA ZACCHIA, RAFFAELE FIORINI MODULI MODULO 1 Modulo di raccordo
INTRODUZIONE AI BIOMARCATORI. D.ssa Francesca Veneziani Laboratorio Analisi Santa Maria Nuova
 INTRODUZIONE AI BIOMARCATORI D.ssa Francesca Veneziani Laboratorio Analisi Santa Maria Nuova DEFINIZIONE I biomarcatori sono misure biologiche di uno stato biologico. Un biomarcatore, è una caratteristica
INTRODUZIONE AI BIOMARCATORI D.ssa Francesca Veneziani Laboratorio Analisi Santa Maria Nuova DEFINIZIONE I biomarcatori sono misure biologiche di uno stato biologico. Un biomarcatore, è una caratteristica
Trials clinici e Rete Oncologica del Veneto
 Trials clinici e Rete Oncologica del Veneto Gian Luca De Salvo UOS Sperimentazioni Cliniche, Biostatistica e Nucleo Ricerca Clinica Istituto Oncologico Veneto IRCCS gianluca.desalvo@ioveneto.it Contenuto
Trials clinici e Rete Oncologica del Veneto Gian Luca De Salvo UOS Sperimentazioni Cliniche, Biostatistica e Nucleo Ricerca Clinica Istituto Oncologico Veneto IRCCS gianluca.desalvo@ioveneto.it Contenuto
Università degli Studi di Perugia Valutazione della Didattica A.A Facoltà di Farmacia
 FARMACIA (Classe LM 13) FARMACOLOGIA E FARMACOTERAPIA E CHEMIOTERAPIA 8,3 58 CHIMICA FARMACEUTICA E TOSSICOLOGICA 2 8,3 52 TERAPIE INNOVATIVE 8,2 11 ANALISI MEDICINALI 3 E 4 8,2 53 FARMACOLOGIA GENERALE
FARMACIA (Classe LM 13) FARMACOLOGIA E FARMACOTERAPIA E CHEMIOTERAPIA 8,3 58 CHIMICA FARMACEUTICA E TOSSICOLOGICA 2 8,3 52 TERAPIE INNOVATIVE 8,2 11 ANALISI MEDICINALI 3 E 4 8,2 53 FARMACOLOGIA GENERALE
Questione farmaci oncologici ad alto costo
 Per un nuovo Codice di Deontologia Medica Giornata di studio Pistoia, 18 gennaio 2014 Questione farmaci oncologici ad alto costo Giuseppe Traversa Centro Nazionale di Epidemiologia, Sorveglianza e Prevenzione
Per un nuovo Codice di Deontologia Medica Giornata di studio Pistoia, 18 gennaio 2014 Questione farmaci oncologici ad alto costo Giuseppe Traversa Centro Nazionale di Epidemiologia, Sorveglianza e Prevenzione
FACOLTÀ DI MEDICINA E CHIRURGIA CORSO DI LAUREA IN BIOTECNOLOGIE MEDICHE E FARMACEUTICHE
 FACOLTÀ DI MEDICINA E CHIRURGIA CORSO DI LAUREA IN BIOTECNOLOGIE MEDICHE E FARMACEUTICHE PRESENTAZIONE Lo sviluppo scientifico in campo biomedico ha subito un accelerazione senza precedenti dalla scoperta
FACOLTÀ DI MEDICINA E CHIRURGIA CORSO DI LAUREA IN BIOTECNOLOGIE MEDICHE E FARMACEUTICHE PRESENTAZIONE Lo sviluppo scientifico in campo biomedico ha subito un accelerazione senza precedenti dalla scoperta
Corso di Laurea in Biotecnologie Mediche e Farmaceutiche
 Corso di Laurea in Biotecnologie Mediche e Farmaceutiche Corso di Laurea in Biotecnologie Mediche e Farmaceutiche Preside della Facoltà di Medicina e Chirurgia: Prof. Massimo Clementi Presidente del Corso
Corso di Laurea in Biotecnologie Mediche e Farmaceutiche Corso di Laurea in Biotecnologie Mediche e Farmaceutiche Preside della Facoltà di Medicina e Chirurgia: Prof. Massimo Clementi Presidente del Corso
Quality Oversight sulla fornitura di API
 Quality Oversight sulla fornitura di API Lavinia Baldan,Bayer HealthCare Manufacturing 27 Aprile 2017 Agenda/ Content La catena di fornitura (API) Requisiti GMP e Regolatori GDP Quality Oversight sulla
Quality Oversight sulla fornitura di API Lavinia Baldan,Bayer HealthCare Manufacturing 27 Aprile 2017 Agenda/ Content La catena di fornitura (API) Requisiti GMP e Regolatori GDP Quality Oversight sulla
SIMPOSIO Dalla qualità percepita alla percezione dell'errore medico Metodologia integrata per l'individuazione dell'errore medico
 FONDAZIONE ARTURO PINNA PINTOR Creata nel 1977 Per la Verifica di Qualità delle cure - Per lo Studio della Medicina Interdisciplinare SIMPOSIO Dalla qualità percepita alla percezione dell'errore medico
FONDAZIONE ARTURO PINNA PINTOR Creata nel 1977 Per la Verifica di Qualità delle cure - Per lo Studio della Medicina Interdisciplinare SIMPOSIO Dalla qualità percepita alla percezione dell'errore medico
BASIC TRAINING. 10 Febbraio Good Distribution Practice. 6 Aprile Annex15: novità su qualifica e convalida processo
 CTPSYSTEM.COM BASIC TRAINING Corsi di taglio basic su argomenti consolidati, frutto di un esperienza pluri-ventennale maturata sul campo in ambito GMP, destinati agli operatori dell Industria Farmaceutica,
CTPSYSTEM.COM BASIC TRAINING Corsi di taglio basic su argomenti consolidati, frutto di un esperienza pluri-ventennale maturata sul campo in ambito GMP, destinati agli operatori dell Industria Farmaceutica,
Linee guida NBF parte III: GMP related documents
 DIPARTIMENTO DELLA SANITÁ PUBBLICA VETERINARIA, DELLA SICUREZZA ALIMENTARE E DEGLI ORGANI COLLEGIALI PER LA TUTELA DELLA SALUTE DIREZIONE GENERALE DELLA SANITÁ ANIMALE E DEI FARMACI VETERINARI Linee guida
DIPARTIMENTO DELLA SANITÁ PUBBLICA VETERINARIA, DELLA SICUREZZA ALIMENTARE E DEGLI ORGANI COLLEGIALI PER LA TUTELA DELLA SALUTE DIREZIONE GENERALE DELLA SANITÁ ANIMALE E DEI FARMACI VETERINARI Linee guida
Conseguenze economiche con i NAO
 1 11 Congresso Nazionale CARD (22-24 maggio 2013) La fibrillazione atriale ed i possibili cambiamenti nelle cure domiciliari indotti dall uso dei nuovi farmaci anticoagulanti orali Conseguenze economiche
1 11 Congresso Nazionale CARD (22-24 maggio 2013) La fibrillazione atriale ed i possibili cambiamenti nelle cure domiciliari indotti dall uso dei nuovi farmaci anticoagulanti orali Conseguenze economiche
Il Ministero della Salute e l applicazione del Regolamento 1223/2009
 "Il Regolamento (CE) n. 1223/2009 del Parlamento Europeo e del Consiglio del 30 novembre 2009 sui prodotti cosmetici" Roma, 6 giugno 2013 Il Ministero della Salute e l applicazione del Regolamento 1223/2009
"Il Regolamento (CE) n. 1223/2009 del Parlamento Europeo e del Consiglio del 30 novembre 2009 sui prodotti cosmetici" Roma, 6 giugno 2013 Il Ministero della Salute e l applicazione del Regolamento 1223/2009
BPL E NBF NEL LABORATORIO DI SVILUPPO ANALITICO: DUE SISTEMI DI QUALITÀ O UN SISTEMA INTEGRATO? LA VALUTAZIONE DEL QUALITY ASSURANCE
 BPL E NBF NEL LABORATORIO DI SVILUPPO ANALITICO: DUE SISTEMI DI QUALITÀ O UN SISTEMA INTEGRATO? LA VALUTAZIONE DEL QUALITY ASSURANCE Fernanda Motta, Emilia F. Corbascio Cell Therapeutics Europe S.r.l.,
BPL E NBF NEL LABORATORIO DI SVILUPPO ANALITICO: DUE SISTEMI DI QUALITÀ O UN SISTEMA INTEGRATO? LA VALUTAZIONE DEL QUALITY ASSURANCE Fernanda Motta, Emilia F. Corbascio Cell Therapeutics Europe S.r.l.,
Nuove terapie: ricerca e sperimentazione
 Nuove terapie: ricerca e sperimentazione Giuseppe Del Giudice, MD, PhD Centro Ricerche, Novartis Vaccini, Siena Chiaramente Scienza, Istituto Veneto di Scienze Lettere ed Arti, Venezia, 8 Aprile 2014 Riduzione
Nuove terapie: ricerca e sperimentazione Giuseppe Del Giudice, MD, PhD Centro Ricerche, Novartis Vaccini, Siena Chiaramente Scienza, Istituto Veneto di Scienze Lettere ed Arti, Venezia, 8 Aprile 2014 Riduzione
Il ruolo delle aziende farmaceutiche nella Ricerca dei farmaci orfani
 Il ruolo delle aziende farmaceutiche nella Ricerca dei farmaci orfani Laura Crippa, Vice Presidente Gruppo Biotecnologie Padova, 5 maggio 2017 I numeri dell industria farmaceutica in Italia Struttura dell
Il ruolo delle aziende farmaceutiche nella Ricerca dei farmaci orfani Laura Crippa, Vice Presidente Gruppo Biotecnologie Padova, 5 maggio 2017 I numeri dell industria farmaceutica in Italia Struttura dell
MASTER HEF Calendario lezioni Modulo CII [20 marzo - 5 maggio 2017]
![MASTER HEF Calendario lezioni Modulo CII [20 marzo - 5 maggio 2017] MASTER HEF Calendario lezioni Modulo CII [20 marzo - 5 maggio 2017]](/thumbs/69/60442029.jpg) MASTER HEF Calendario lezioni Modulo CII [20 marzo - 5 maggio 2017] CII Lun. 20/3 Settimana 10 International Health Law: Reasons, Actors, Sectors and Health as a Human Right, the WHO (introductory remarks)
MASTER HEF Calendario lezioni Modulo CII [20 marzo - 5 maggio 2017] CII Lun. 20/3 Settimana 10 International Health Law: Reasons, Actors, Sectors and Health as a Human Right, the WHO (introductory remarks)
EATRIS ERIC. The European Infrastructure for Translational Medicine. The ISS and its role in the European Research Infrastructure
 EATRIS ERIC The European Infrastructure for Translational Medicine The ISS and its role in the European Research Infrastructure EATRSI ERIC and the ISS EATRIS ERIC Vision Making translation of scientific
EATRIS ERIC The European Infrastructure for Translational Medicine The ISS and its role in the European Research Infrastructure EATRSI ERIC and the ISS EATRIS ERIC Vision Making translation of scientific
 CERTIFICATO C E R T I F I C A T E Certificato No.: Certificate No.: Nome ed indirizzo del richiedente: Name and Address of the certificate holder: Data della domanda: Date of submission: TÜV IT 14 MAC
CERTIFICATO C E R T I F I C A T E Certificato No.: Certificate No.: Nome ed indirizzo del richiedente: Name and Address of the certificate holder: Data della domanda: Date of submission: TÜV IT 14 MAC
Colliri Biologici : Autosiero e lisato piastrinico. Laura MAZZUCCO - Valeria BALBO SC MEDICINA TRASFUSIONALE AO ALESSANDRIA
 Colliri Biologici : Autosiero e lisato piastrinico Laura MAZZUCCO - Valeria BALBO SC MEDICINA TRASFUSIONALE AO ALESSANDRIA Terapia biologica La medicina rigenerativa sfrutta le potenzialità biologiche
Colliri Biologici : Autosiero e lisato piastrinico Laura MAZZUCCO - Valeria BALBO SC MEDICINA TRASFUSIONALE AO ALESSANDRIA Terapia biologica La medicina rigenerativa sfrutta le potenzialità biologiche
Position paper Biosimilari
 Position paper Biosimilari Introduzione I farmaci biologici sono prevalentemente costituiti da prodotti proteici ottenuti mediante metodiche biotecnologiche. I farmaci biosimilari ( biosimilari ) sono
Position paper Biosimilari Introduzione I farmaci biologici sono prevalentemente costituiti da prodotti proteici ottenuti mediante metodiche biotecnologiche. I farmaci biosimilari ( biosimilari ) sono
9 Info-day - 21 maggio 2015. Approfondimenti GMP La posizione di AISA. RELATORE: ALDO BRUSI QA Manager - FATRO SpA
 9 Info-day - 21 maggio 2015 Approfondimenti GMP La posizione di AISA RELATORE: ALDO BRUSI QA Manager - FATRO SpA Principali novità GMP 2015 Eudralex Volume 4 Data Principali novità Nuovo capitolo 3 Premises
9 Info-day - 21 maggio 2015 Approfondimenti GMP La posizione di AISA RELATORE: ALDO BRUSI QA Manager - FATRO SpA Principali novità GMP 2015 Eudralex Volume 4 Data Principali novità Nuovo capitolo 3 Premises
III Convegno Prevenire le complicanze del diabete: dalla ricerca di base all assistenza. Il Progetto IGEA
 III Convegno Prevenire le complicanze del diabete: dalla ricerca di base all assistenza Il Progetto IGEA Marina Maggini Centro Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute Istituto
III Convegno Prevenire le complicanze del diabete: dalla ricerca di base all assistenza Il Progetto IGEA Marina Maggini Centro Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute Istituto
Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche. Studi Clinici. Lisa Pieri Università di Firenze
 Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Studi Clinici Lisa Pieri Università di Firenze SVILUPPO DI UN NUOVO FARMACO STUDI PRECLINICI Formazione di gruppi
Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Studi Clinici Lisa Pieri Università di Firenze SVILUPPO DI UN NUOVO FARMACO STUDI PRECLINICI Formazione di gruppi
