Cinetica Chimica Catalisi
|
|
|
- Agostina Santoro
- 6 anni fa
- Visualizzazioni
Transcript
1 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale CCS CHI e MAT Cinetica Chimica Catalisi Prof. Dipartimento CMIC Giulio Natta
2 Cinetica Chimica 2 La termodinamica fornisce informazioni sulle proprietà del sistema chimico all equilibrio, ma non dice nulla sul tempo necessario a raggiungere tale stato (velocità di reazione). La velocità di reazione è l oggetto della cinetica chimica. v f Concentrazione Velocità : dc [ ] dt [C] (o c) è la concentrazione del prodotto C; t è il tempo La velocità di una reazione dipende dall entità della barriera di attivazione G tr :
3 Il Reale Cammino di Reazione 3 G G reagenti cinetica Stato attivato Energia di Attivazione G (non correlata al G ) G termodinamica 0 G RTln K eq dg G prodotti 0 dr dg dg 0 dr 0 dr r eq. r (coordinata di reazione) Equilibrio (reagenti + prodotti) eq
4 Cinetica di Reazioni Reversibili - continuo. 4 Stessa semplice reazione All equilibrio, la reazione continua a procedere ma la velocità diretta = velocità inversa La velocità netta (complessiva) = 0 25 A B 20 dma/dt mol s equilibrio Velocità diretta Velocità inversa Velocità totale Tempo
5 Cinetica di Reazione 5 Si consideri la semplice reazione in soluzione La concentrazione di A (C A ) diminuisce col tempo e la concentrazione di B (C B ) aumenta col tempo fino al raggiungimento dell equilibrio. La cinetica di reazione descrive quanto veloce procede la reazione. I gradienti danno la velocità netta di perdita di A e la velocità netta di formazione di B a quel tempo Vari modi di esprimere la velocità complessiva di reazione (mol s -1 ) Le reazioni possono procedere più spedite con un catalizzatore ma il punto di equilibrio non varia. dn A /dt = v dc A /dt dc A /dt Concentrazione/ mol dm A Tempo Conversione % B [A] [B] Conversione
6 Velocità di Reazione 6 La velocità di variazione della quantità di un reagente o prodotto (mol s -1 ) Per lavoro a volume costante, si può usare le unità intensive quali velocità di variazione della concentrazione (mol dm -3 s-1 ) o pressione parziale (bar s -1 ). Si può definire la velocità in termini di qualsiasi reagente o prodotto ma si deve tener conto della stechiometria. Esempio 1: A B dca dcb vel. reazione - dt dt Esempio 2: a A + b B c C + d D 1 A 1 B 1 C 1 D vel. reazione - dc dc dc dc a dt b dt c dt d dt
7 Legge Cinetica e Ordine di Reazione 7 Le velocità di reazione normalmente dipendono dalle concentrazioni o pressione dei reagenti. Si consideri la reazione A + 2 B C + 2D La legge empirica di reazione si trova con esperimenti essere: dc velocità di reazione v - dt k C C A x y A A B k è la constante cinetica di reazione. Le sue unità dipendono dall ordine complessivo. La reazione è di ordine x rispetto al reagente A e di ordine y rispetto al reagente B. Se x =1 o 2 allora si dice che sono del 1 ordine o del 2 ordine rispetto ad A. L ordine di reazione complessivo è x + y. L ordine di reazione è una classificazione conveniente. Si possono avere valori negativi. Spesso inoltre non sono numeri interi. Anche i prodotti possono essere implicati.
8 Dipendenza della Costante di Velocità dalla Temperatura: Legge di Arrhenius 8 -Ea k A exp( ) RT Da cui Ea ln k ln A - RT ln (k / s -1 ) Gradiente = - E a /R A = fattore pre-esponenziale E = energia di attivazione / J T = temperatura assoluta / K /(T/K)
9 Meccanismo di Reazione 9 Il meccanismo di reazione descrive la natura del cammino di reazione. Teoria del complesso attivato : i reagenti in un stadio della reazione vengono a contatto in una struttura compatta di energia più elevata. Il massimo si chiama stato di transizione e la differenza dallo stato di partenza e detta energia di attivazione E a dello stadio di reazione. Si noti che lo stadio inverso ha anch esso una energia di attivazione, in questo caso superiore a quella diretta. La molecolarità di uno stadio di reazione è il numero di molecole che si incontrano per reagire in quello stadio non lo stesso dell ordine di reazione. Energia Potenziale E a Stato di Transizione
10 Distribuzione di Maxwell-Boltzmann Effetto della Temperatura sulla k 10 Distribuzione Energia nelle collisioni f(v) E > E att Distribuzione M-B 3/2 m 2 2 ( ) 4 exp( / 2 ) f u u mu kt 2 kt 0
11 Cos e un Catalizzatore 11 Un catalizzatore accelera una reazione chimica : Forma dei legami con le molecole dei reattivi, li lascia reagire per formare un prodotto, che si stacca, lasciando il catalizzatore inalterato per una nuova reazione. nozione di reazione catalitica = ciclo A B separazione P In termini generali : 1- legame di 2 molecole A e B con il catalizzatore, Catalizzatore legame P Catalizzatore 2- A e B reagiscono e danno P, legato al catalizzatore, A B Catalizzatore reazione 3- P si stacca dal catalizzatore, liberandolo per un nuovo ciclo
12 Catalisi nelle Reazioni Chimiche 12 A + B a C + D Particelle con energia in questa regione possono ora reagire ENTALPIA A + B H E a C + D ENTALPIA E a H E a COORDINATA DI REAZIONE COORDINATA DI REAZIONE SENZA CATALIZZATORE CON CATALIZZATORE G cat (riduzione in G da parte del catalizzatore)
13 Esempio di Reazione Catalizzata 13 Composti chimici apparentemente estranei alla reazione in esame (non intervengono cioè nella stechiometria complessiva della reazione) ma che modificano la velocità di reazione. In molti casi è possibile recuperarli alla fine della reazione inalterati. Catalizzatori positivi : aumentano la velocità Catalizzatori negativi : abbassano la velocità (eliminano Cat. positivi) SO 2 + 1/2 O 2 SO 3 G = 70.8 kj mol -1 E att. = 162 kj mol -1 E att. (NO) = 104 kj mol -1 Catalisi omogenea gassosa k 1 NO + 1/2 O 2 NO 2 k 2 SO 2 + NO 2 SO 3 + NO SO 2 + 1/2 O 2 SO 3
14 Inibitori (o Catalizzatori Negativi) 14 A) Eliminatori di catalizzatori positivi (Stabilizzanti) H 2 O 2 H 2 O + 1/2 O 2 G = kj mol -1 M n+ catalizzata da ioni metallici HOOCH 2 C N-CH 2 - HOOCH 2 C EDTA 2 + M n+ L L L complesso M n+ -EDTA poco attivo nella decomp. L L M L B) Interruttori di catene radicaliche (Antiossidanti) O 2 R-H f R. ROO. R-H Inb. R-H o R-Inb. R-PhOH (vit. E) R 2 NH (ALS) Vitamina A e C Tioli e solfuri
15 Cinetica delle Reazioni Catalizzate da Enzimi 15 Gli enzimi sono capaci di aumentare enormemente la velocità delle reazioni chimiche. Per esempio dec. H 2 O 2 : 2 H 2 O 2 (aq) 2 H 2 O(liq) + O 2 (g) In presenza dell enzima catalasi la velocità aumenta di circa 15 ordini di grandezza. Nella maggior parte delle reazioni enzimatiche l azione catalitica consiste in una forte stabilizzazione dello stato di transizione a seguito di interazioni non covalenti.
16 Catalisi Enzimatica 16 Stato di transizione Energia libera (G) E + S G di legame ES EP Non catalizzata G di attivazione catalizzata G di reazione E + P coordinata di reazione
17 Catalisi Enzimatica 17 P d dt 0 inizio termine [S] Dipendenza della velocità di una reazione enzimatica dalla concentrazione del substrato S. La linea tratteggiata corrisponde alla velocità raggiunta ad elevata [S] Substrato Enzima Enzima legato al substrato Substrato spezzato + Enzima non-legato
18 Sito Catalitico dell Enzima 18 Sito catalitico Struttura ai raggi X dell enzima alcol deidrogenasi umana
19 Idrolisi della Cellulosa con Enzimi Cellulasi 19
20 Cinetica di Michaelis-Menten 20 La cinetica di una reazione enzimatica è di ordine complesso. Sistema : catalizzatore E S Reagente (substrato) P l insieme dei prodotti
21 Dati Sperimentali 21 1) La velocità di una reazione enzimatica è proporzionale alla concentrazione dell enzima: [E] 2) A basse concentrazioni di substrato la velocità è proporzionale alla concentrazione del substrato: = k [S] 3) Ad alte concentrazioni di substrato la velocità diventa indipendente dalla [S] e raggiunge il sua valore massimo. = max
22 Cinetica di tipo Michaelis-Menten 22 velocità iniziale K M 1 2 max [S] [S]
23 Complesso ES 23 L esperienza suggerisce la formazione di un complesso intermedio tra S e E (ES). Ad alta [S] tutto l E partecipa al complesso ES: = max Un aumento ulteriore di [S] non influenzerà più la velocità ( = max = cost.). Definizione: la costante catalitica dell enzima (k cat ) : k cat max [E ] [E 0 ] è la concentrazione totale dell enzima. 0
24 Cinetica di Michaelis-Menten a Due Stadi 24 1) Formazione di un complesso (ES) (stadio reversibile): k E + S 1 ES k 1 2) Formazione del prodotto e rigenerazione del catalizzatore: k2 ES E + P
25 Cinetica di Michaelis-Menten a Due Stadi 25 Complessivamente: k 1 k2 E + S ES E + SP k 1 Il secondo stadio diventa anch esso reversibile a tempi lunghi. L equilibrio del 1 stadio si stabilisce prima del 2 si trascura l effetto della reazione opposta nel 2 stadio.
26 Analogie con la TET 26 K # k # A + B AB # C + D k[a][b]= d[c] dt k K # # [A][B] k = k K # #
27 Velocità Iniziale 27 La cinetica di Michaelis-Menten si applica alla velocità iniziale ( 0 ): k 2 ES E + P d[p] k 0 2 dt t0 [ES] k k cat 2 max [E ] 0
28 Stato Stazionario 28 L approssimazione dello stato stazionario ( steady state ) per la [ES] : d[es] dt 0 k [E][S] k [ES] k [ES] k [E][S] ( k k )[ES] [ES] k k 1 [E][S] k 1 2
29 Altre Considerazioni 29 I valori reali di [E] e [S] sono molto difficili da misurare. In realtà si conosce solo [E] 0 e [S] 0 [E] 0 = [E] + [ES] [E] = [E] 0 [ES] La parte di S che è in forma ES è molto più piccola della concentrazione totale [S] 0 : [S] 0 = [S] + [ES] [S]
30 Ulteriori Considerazioni 30 [ES] k k 1 [E][S] k 1 2, [E] = [E] 0 [ES] [ES] k [E] 1 0 k 1 2 [ES] [S] k [ES] 1 [E] 1 0 ( k1 k2) k [S] d[p] k 0 2 dt t0 [ES] k 2 = k cat
31 Equazione di Michaelis-Menten 31 [E] 2 0 0k2[ES] k 1 k k k 1 [S] 0 max K M 1 [S] max = k cat [E] 0 = k 2 [E] 0 K M k k k La costante di Michaelis K M : legata alla stabilità di ES
32 Equazione di Michaelis-Menten 32 0 max K M 1 [S], K M k k k (K M : moli) Le proprietà osservate sperimentalmente si spiegano bene con il modello di Michaelis-Menten: (a) Quando K M è piccola: k 1 > (k + k -1 2 ) e (ES) è più stabile (il legame enzima substrato è più forte). E l opposto quando K M è grande (k 1 < (k + k -1 2 ).
33 Equazione di Michaelis-Menten 33 (b) Quando [S] è bassa: K M /[S] >> 1: [S] max max max 0 K K M M KM 1 [S] [S] k [S] (primo ordine) k = max /K M = costante per una data [E 0 ].
34 Equazione di Michaelis-Menten 34 0 max K M 1 [S] (c) Quando K M /[S] << 1 0 = max : max non dipende che da [E] 0 (d) Quando [S] = K M, l equazione di Michaelis diventa : max Si può stimare K M da un grafico cinetico, determinando max valore di [S] che corrisponde a max /2. e il
35 L equazione di Michaelis-Menten in forma di grafico lineare 35 Grafico di Lineweaver Burk: 0 max K M 1 [S] 1 1 K 1 [S] M M 0 max max o [S] [S] K 0 max max Un grafico di [S]/ 0 (Hanes or Dixon ) in funzione di [S] produce una retta con una pendenza = -1 max e un [S]/v 0 valore all origine = K M / max [S]
36 Conclusioni (sull equazione di Michaelis-Menten) 36 0 max K M 1 [S] 1 1 K M 1 [S] 0 max max I valori importanti : (a) la costante catalitica k cat = k 2 ; (b) la costante di Michaelis K M la stabilità di ES. (c) max = k cat [E] 0 = k 2 [E] 0
37 Inibizione Competitiva 37 Inibitore (I): una sostanza con una struttura simile a quella del substrato occupa il sito attivo dell'enzima. La costante di specificità : k spec = k cat /K M Se si hanno due substrati A e B in competizione per lo stesso sito attivo, il rapporto tra le velocità si ricava da : A ( kspéc) A [A] ( k ) [B] B spéc B
38 Inibizione Competitiva 38 E + S ES E + P E + I EI [E] 0 = [E] + [ES] + [EI] K I [E][I] [EI] [I] [E] 0 [E] 1+ [ES] KI
39 Inibizione Competitiva 39 o = k 2 [ES]: 1 [S] max 0 ' K M K ' M KM1 [I] K I La nuova costante K M tiene conto dell influenza di I sulla cinetica enzimatica: Quando [I] è grande o quando K I è piccola, la costante K M diventa più grande di K M destabilizzazione del complesso (ES) a seguito della presenza dell inibitore.
40 Conclusioni su Inibizione Competitiva 40 max non è influenzata dall inibizione competitiva: quando [S] >> [I] la maggioranza dei siti attivi è occupata da S. La concentrazione [S] che corrisponde a è più 0 max alta a seguito della presenza dell inibitore competitivo. 1 2 Inibizione competitiva: max non varia K M varia verso K M
41 Inibizione Non-Competitiva 41 Un inibitore può legarsi in un punto diverso dal sito attivo: il substrato S non è più in concorrenza con l inibitore I per lo stesso sito attivo. Se una molecola di E è impegnata nella forma (EI) essa diventa inattiva: max diminuisce in funzione della percentuale dell enzima che viene perso sotto forma (EI).
42 Conclusione su Inibitore non Competitivo 42 La costante di Michaelis K M dipende dalla cinetica legata al sito attivo : K M non è influenzata dalla presenza di un inibitore non competitivo. Inibizione non competitiva: max varia K M non varia Inibizione competitiva: max non varia K M varia verso K M
43 Catalisi Eterogenea 43 FASE 1 Condensata FASE 2 Gassosa zona di discontinuità : forti interazioni tra particelle nella fase condensata e con il gas Adsorbimento : fenomeno di concentrazione di particelle sulle superfici di discontinuità tra fasi condensate e gas (o liquidi) a causa del campo generato dagli atomi superficiali e non compensato dall altra fase. H < 0 (esotermico) S > 0 (ordinante) Strato o strati di molecole adsorbite sulla superficie
44 Adsorbimento Fisico e Chimico 44 Adsorbimento fisico Calore di ads. < 40 kj mol -1 Non esiste E att. nel processo Implica multistrati di adsorbato Apprezzabile solo sotto p. eb. adsorbato La quantità di adsorbato è più funzione dell adsorbato che dell assorbente L adsorbato aumenta ad ogni aumento di pressione dell adsorbato in fase gas Adsorbimento chimico Calore di ads. > 80 kj mol -1 Si può avere E att. nel processo Implica al massimo uno strato di adsorbato Può avvenire anche ad alte temperature La quantità di adsorbato è caratteristica sia dell adsorbente che dell adsorbato L adsorbato diminuisce ad ogni aumento di pressione dell adsorbato in fase gas N N H H H O H O C H H H H C O
45 Area Superficiale, Matrici Catalitiche e Catalizzatori 45 superficie esposta particella con bassa area superficiale Materiale compatto, cristalli formati Catalizzatori Gel di silice e allumina Gel di ossido di cromo, cromo su allumina, nichel su allumina Acido fosforico su gel di silice Co, ThO 2, MgO su gel di silice Ferro poroso Pentossido di vanadio Platino su carbone Al(C 2 H 5 ) 3, TiCl 4 particella con alta area superficiale Materiale molto poroso, tipo gel Processi Cracking del petrolio (fraz. alte) Idrogenazione e deidrogenazione di idrocarburi Polimerizzazione di alcheni (C=C) Sintesi di idrocarburi da CO e H 2 Sintesi dell ammoniaca Processo a contatto per H 2 SO 4 Idrogenazioni, Isomerizzazioni Polimerizzazioni di olefine
46 Misure di Adsorbimento 46 Isoterma di adsorbimento moli termostato gas P, atm P/V ads Ipotesi : mono strato e uguale velocità di evaporazione e di condensazione sulla superficie. La velocità di evaporazione è proporzionale alla frazione di superficie coperta Diagramma di Langmuir P, atm
47 Teoria dell Adsorbimento di Langmuir (1916) 47 Velocità di adsorbimento rad p(1 ) Velocità di desorbimento rdes ' p = pressione = copertura N N M Le velocità sono uguali all equilibrio, con b = '/ N p N M b p Isoterma di Langmuir I. Langmuir, J. Am.Chem. Soc. 38 (1916) 2221
48 Il Metodo BET (1938) Isoterma BET Brunauer, Emmett, Teller. Multistrati: 1 strato chemiassorbimento, altri fisiassorbimento. (B) 48 (A) p/ p0 1 C1 p n(1 p/ p ) nmc nmc p 0 0 n ad /n m importante per misure di area superficiali per fisiassorbimento p/p 0 He N 2 Miscelatore gas Trappola fredda TCD Dove p : Pressione parziale p 0 : Tensione di vapore n : mole di gas adsorbito n m : equivalente molare di un monostrato termostato Azoto liquido
49 Catalisi Eterogenea 49 reazione in fase gas E a energia reagenti adsorbimento E a prodotti H reazione catalitica reazione desassorbimento
50 Curva a Vulcano 50 T, K Pt Ir HCOOH 400 Pd Rh Ru Cu a H 2 + CO Ag Co Fe W Au H f formiato, kcal eqiv. -1 Principio di Sabatier: curve a vulcano T v /K. La temperatura a cui la velocità di decomposizione dell acido formico (asse verticale) assume un certo valore v, correlata con il calore di formazione del formiato metallico, in kcal per equivalente (asse orizzontale).
51 Adsorbimento su Facce di Cristalli 51
52 Tecniche Cinetiche Veloci (per analisi di intermedi di reazione) 52 Tecniche spettroscopiche fotoniche (IR) o magnetiche (ESR o NMR) Tecniche a flusso Fotolisi a lampo (multifotonica o laser) Radiolisi pulsata (raggi o X) Tecniche di perturbazione dell equilibrio (jump) Tecniche elettrochimiche Pulse Radiolysis X 1 MeV Lampo spettroscopico Cella di reazione Flash photolysis UV visibile 10-5 s, 2000 J Rivelatore risoluzione temporale = 10-9 s
53 Reazioni Fotochimiche 53 a) - Reazioni fotoiniziate (moli prodotto > moli fotoni usati) H 2 + Cl 2 2 HCl G = kj mol -1 reazione spontanea catena (potenz. esplosiva) b) - Reazioni fotochimiche (moli prodotto e moli fotoni usati) Fotosintesi clorofilliana n CO 2 + n H 2 O + n h (CH 2 O) n + n O 2 ; G = kj mol -1 (n=1) reazione non spontanea Trasforma energia luminosa in energia chimica : prodotti (CH 2 O) n zuccheri e O 2 ossidante essenziale alla vita di piante ed animali. Clorofilla: pigmento verde contenente magnesio che nel sistema cloroplasto (antenne biologiche in grado di accumulare la luce) delle piante verdi è in grado di effettuare tale conversione con una efficienza del %.
54 Reazioni Radicaliche a Catena 54 H 2 + Cl 2 2 HCl Iniziazione Cl 2 2 CI Cl2 Propagazione Cl + H 2 HCl + H H + Cl 2 HCl + Cl HCl Cl. Ri H2 kcl kh Terminazione H + H H 2 Cl + Cl Cl 2 H + Cl Cl 2 In. : h (fotoiniziazione) R-N=N-R (iniziazione termica) Fe o Red. (iniziazione redox) Cl2 H k t Å 10 9 M-1 s-1. kt HCl Terminazione (H2, Cl2, HCl
55 Cinetica Autossidazione di Idrocarburi (R-H) 55 A basse temperature i composti a legami C-H (idrocarburi) subiscono l attacco spontaneo da parte dell ossigeno a dare soprattutto idroperossidi con inserzione di O 2 sul legame C-H. Meccanismo: R-H + O 2 R-O-O-H Iniziazione In. N I. 2 I-O-O. IOO. + R-H IOOH + R. O 2 R i Propagazione R. + O 2 ROO. k a Å 10 9 M-1 s-1 ROO. + R-H ROOH + R. Terminazione ROO. + ROO. Prodotti non radicalici k p k t
56 Combustioni 56 Reazioni radicaliche esotermiche a catena molto complesse in cui i legami C-H e C-C sono rotti con formazione di legami C-O. I prodotti della combustione totale sono H 2 O e CO 2, ma combustioni parziali originano prodotti intermedi (anche tossici). Molte reazioni di combustione possono assumere aspetti esplosivi!! Esplosione Termica Comportamento secondo Arrhenius, l energia rilasciata è intrappolata, causa un aumento nella velocità di reazione, più energia, ulteriore incremento in velocità, più energia, ecc.. Esplosione di Ramificazione di Catena Il numero dei centri di catena crescono esponenzialmente, la velocità di reazione aumenta drammaticamente.
57 Reazioni Esplosive 57 2 H 2 + O 2 H 2 O è di entrambi i tipi H 2 + O 2 2 OH (Iniziazione) H 2 + OH H + H 2 O (Propagazione) O 2 + H OH + O (Ramificazione) O + H 2 OH + H (Ramificazione) O 2 + H + M HO 2 + M* +... (Terminazione)
58 Cambio nelle Caratteristiche di Reazione 58 O H 2 2 H 2 O 6 Terzo limite di esplosione log(p/p a ) Reazione stazionaria Secondo limite di esplosione Primo limite di esplosione Esplosione T/K
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
La cinetica chimica. Velocità media di reazione
 La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
Le reazioni chimiche
 Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Cinetica Chimica. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Cinetica Chimica Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Cinetica Chimica Termodinamica la reaction avrà luogo? Cinetica quanto sarà veloce la reazione?
Cinetica Chimica Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Cinetica Chimica Termodinamica la reaction avrà luogo? Cinetica quanto sarà veloce la reazione?
relazioni tra il calore e le altre forme di energia.
 Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA
 REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio
 Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Velocità di reazione Una trasformazione chimica modifica completamente la natura delle sostanze iniziali ( i reagenti), formando altre specie (i prodo
 Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
Legge dell azione di massa. Misura sperimentale della costante di equilibrio. Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Combustione. Energia chimica. Energia termica Calore. Combustibili fossili
 Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
CORSO DI CHIMICA. Esercitazione del 7 Giugno 2016
 CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
Esercizi di Termochimica
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi di Termochimica Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1-2 (Capacita
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi di Termochimica Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1-2 (Capacita
delle curve isoterme dell anidride carbonica
 COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Le reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Le reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO VIDEO Introduzione (I) La cinetica chimica è la branca della chimica che si interessa della velocità delle reazioni chimiche, cioè la variazione
Le reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO VIDEO Introduzione (I) La cinetica chimica è la branca della chimica che si interessa della velocità delle reazioni chimiche, cioè la variazione
SCIENZA DEI MATERIALI. Chimica Fisica. VI Lezione. Dr. Fabio Mavelli. Dipartimento di Chimica Università degli Studi di Bari
 SCIENZA DEI MATERIALI Chimica Fisica VI Lezione Dr. Fabio Mavelli Dipartimento di Chimica Università degli Studi di Bari Energia Libera di Helmholtz F 2 Definiamo la funzione di stato Energia Libera di
SCIENZA DEI MATERIALI Chimica Fisica VI Lezione Dr. Fabio Mavelli Dipartimento di Chimica Università degli Studi di Bari Energia Libera di Helmholtz F 2 Definiamo la funzione di stato Energia Libera di
PASSAGGI DI STATO. sublimazione fusione ebollizione. solidificazione. condensazione. brinamento. Calore processi fisici endotermici ( H>0).
 PASSAGGI DI STATO Calore processi fisici endotermici (H>0). sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Scrittura in formule: - H 2 O (s) H 2 O (l) fusione - H 2 O (l)
PASSAGGI DI STATO Calore processi fisici endotermici (H>0). sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Scrittura in formule: - H 2 O (s) H 2 O (l) fusione - H 2 O (l)
Equilibri chimici. Consideriamo la seg. reazione chimica in fase omogenea: aa + bb î cc + dd Definiamo, in ogni istante della reazione:
 Equilibri chimici Consideriamo la seg. reazione chimica in fase omogenea: aa + bb î cc + dd Definiamo, in ogni istante della reazione: con A, B, C, D espressi come concentrazioni molari. Il sistema si
Equilibri chimici Consideriamo la seg. reazione chimica in fase omogenea: aa + bb î cc + dd Definiamo, in ogni istante della reazione: con A, B, C, D espressi come concentrazioni molari. Il sistema si
CINETICA CHIMICA. ChimicaGenerale_lezione21 1
 CINETICA CHIMICA La cinetica chimica è lo studio della velocità delle reazioni chimiche, cioè della variazione delle concentrazione dei reagenti (o dei prodotti) in funzione del tempo. ChimicaGenerale_lezione21
CINETICA CHIMICA La cinetica chimica è lo studio della velocità delle reazioni chimiche, cioè della variazione delle concentrazione dei reagenti (o dei prodotti) in funzione del tempo. ChimicaGenerale_lezione21
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Definiamo Entalpia la funzione: DH = DU + PDV. Variando lo stato del sistema possiamo misurare la variazione di entalpia: DU = Q - PDV.
 Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Inquinamento ARIA. Inquinamento ARIA. Inquinamento ARIA. Inquinamento ARIA
 COMBUSTIONE: principi Processo di ossidazione di sostanze contenenti C ed H condotto per ottenere energia termica (calore) C,H + O 2 calore + gas comb. COMBUSTIBILE + COMBURENTE CALORE + RESIDUI [ARIA]
COMBUSTIONE: principi Processo di ossidazione di sostanze contenenti C ed H condotto per ottenere energia termica (calore) C,H + O 2 calore + gas comb. COMBUSTIBILE + COMBURENTE CALORE + RESIDUI [ARIA]
Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo
 1 Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo Limitazioni della prima legge della termodinamica 2 E = q + w E universo = E sistema + E ambiente E sistema =
1 Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo Limitazioni della prima legge della termodinamica 2 E = q + w E universo = E sistema + E ambiente E sistema =
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
PROGRAMMA DISCIPLINARE SVOLTO a. s / N.B. il programma è pubblico ad uso degli studenti e delle famiglie.
 Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Capitolo 16 L energia si trasferisce
 Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Chimica: energia e velocità di reazione
 cbnd Antonio Guermani Scheda n 1 Nome Data Se forniamo al sistema 50 kj di calore e un Per trovare il catalizzatore più adatto per una La sintesi dell'acqua 2H2 + O2 2H2O è lavoro di 40 kj ΔU = 10 kj si
cbnd Antonio Guermani Scheda n 1 Nome Data Se forniamo al sistema 50 kj di calore e un Per trovare il catalizzatore più adatto per una La sintesi dell'acqua 2H2 + O2 2H2O è lavoro di 40 kj ΔU = 10 kj si
Lo stato liquido: il modello
 Lo stato liquido: il modello lemolecolesonoin moto perpetuo e casuale(moto Browniano) l'energia del moto: è dello stesso ordine di grandezza dell'energia di interazione tra le molecole dipende dalla temperatura(agitazione
Lo stato liquido: il modello lemolecolesonoin moto perpetuo e casuale(moto Browniano) l'energia del moto: è dello stesso ordine di grandezza dell'energia di interazione tra le molecole dipende dalla temperatura(agitazione
+ + Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria. CH 4 (g)+ 2 O 2 (g) CO 2 (g) + 2 H 2 O(l) 1
 Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria + + 1 molecola di metano (CH 4 ) 2 molecole di ossigeno (O 2 ) 1 molecola di biossido di carbonio (CO 2 ) 2 molecole
Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria + + 1 molecola di metano (CH 4 ) 2 molecole di ossigeno (O 2 ) 1 molecola di biossido di carbonio (CO 2 ) 2 molecole
Termodinamica. Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico
 Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
- Equilibri omogenei: tutte le sostanze che partecipano alla reazione fanno parte della stessa fase:
 ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
Trasformazioni chimiche degli inquinanti Cenni su stratosfera e troposfera Dinamica degli inquinanti A.A
 Università di Roma Tor Vergata Trasformazioni chimiche degli inquinanti Cenni su stratosfera e troposfera Dinamica degli inquinanti A.A. 2012-2013 1 Composizione chimica dell atmosfera Oltre ad O 2 e N
Università di Roma Tor Vergata Trasformazioni chimiche degli inquinanti Cenni su stratosfera e troposfera Dinamica degli inquinanti A.A. 2012-2013 1 Composizione chimica dell atmosfera Oltre ad O 2 e N
TERMODINAMICA E TERMOCHIMICA
 TERMODINAMICA E TERMOCHIMICA La TERMODINAMICA è una scienza chimico-fisica che studia le trasformazioni dell energia. La TERMOCHIMICA è una particolare branca della termodinamica che valuta quantitativamente
TERMODINAMICA E TERMOCHIMICA La TERMODINAMICA è una scienza chimico-fisica che studia le trasformazioni dell energia. La TERMOCHIMICA è una particolare branca della termodinamica che valuta quantitativamente
Lo stato gassoso e le sue proprietà
 Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Scritto chimica generale
 Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Esercizi sui Bilanci di Massa
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Bilanci di Massa Prof. Dipartimento CMIC Giulio Natta http://iscamap.corsi.chem.polimi.it/citterio Punti
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Bilanci di Massa Prof. Dipartimento CMIC Giulio Natta http://iscamap.corsi.chem.polimi.it/citterio Punti
Cr Mn Fe Co Ni Cu Zn. Chimica Inorganica Biologica Vita ed Energia
 Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
v = d [C] dt d [A] dt CINETICA
![v = d [C] dt d [A] dt CINETICA v = d [C] dt d [A] dt CINETICA](/thumbs/62/46896995.jpg) CINETICA La termodinamica dà informazioni sulla possibilità che un processo avvenga in determinate condizioni, ma non dice nulla sulla velocità con cui un processo possibile avviene in realtà La cinetica
CINETICA La termodinamica dà informazioni sulla possibilità che un processo avvenga in determinate condizioni, ma non dice nulla sulla velocità con cui un processo possibile avviene in realtà La cinetica
Il Gas Ideale. Il gas ideale é un'astrazione
 Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
LA VELOCITA DELLE REAZIONI
 LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
LA VELOCITA DELLE REAZIONI Classe 3 E Anna Onofri Tra le reazioni spontanee che avvengono in natura alcune avvengono MOLTO VELOCEMENTE, altre PIU LENTAMENTE altre richiedono TEMPI LUNGHISSIMI esplosione
Sistemi termodinamici. I sistemi aperti e chiusi possono essere adiabatici quando non è consentito lo scambio di calore
 Sistemi termodinamici Sistema: regione dello spazio oggetto delle nostre indagini. Ambiente: tutto ciò che circonda un sistema. Universo: sistema + ambiente Sistema aperto: sistema che consente scambi
Sistemi termodinamici Sistema: regione dello spazio oggetto delle nostre indagini. Ambiente: tutto ciò che circonda un sistema. Universo: sistema + ambiente Sistema aperto: sistema che consente scambi
v = d [C] dt d [A] dt CINETICA
![v = d [C] dt d [A] dt CINETICA v = d [C] dt d [A] dt CINETICA](/thumbs/62/47041456.jpg) CINETICA La termodinamica dà informazioni sulla possibilità che un processo avvenga in determinate condizioni, ma non dice nulla sulla velocità con cui un processo possibile avviene in realtà La cinetica
CINETICA La termodinamica dà informazioni sulla possibilità che un processo avvenga in determinate condizioni, ma non dice nulla sulla velocità con cui un processo possibile avviene in realtà La cinetica
Cinetica chimica CONTENUTI: (1) Concetti generali (2) Reazioni di combustione (3) Ossidazione del metano (4) Analisi dei meccanismi
 1 Cinetica chimica CONTENUTI: (1) Concetti generali (2) Reazioni di combustione (3) Ossidazione del metano (4) Analisi dei meccanismi 2 Concetti generali La termochimica prevede che assegnate: a) 2 variabili
1 Cinetica chimica CONTENUTI: (1) Concetti generali (2) Reazioni di combustione (3) Ossidazione del metano (4) Analisi dei meccanismi 2 Concetti generali La termochimica prevede che assegnate: a) 2 variabili
Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A
 1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa.
 La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa. ChimicaGenerale_lezione17 1 L'Equilibrio Chimico Nella chimica
La stechiometria di una reazione chimica relaziona le masse di reagenti e prodotti tenendo conto della legge di conservazione della massa. ChimicaGenerale_lezione17 1 L'Equilibrio Chimico Nella chimica
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Il processo di macinazione spesso serve anche per la miscelazione.
 La macinazione rappresenta una fase fondamentale e molto onerosa nella produzione ceramica. Può essere condotta attraverso diversi processi: 1) Mulino a rulli (in acciaio alto-legato o con rivestimento
La macinazione rappresenta una fase fondamentale e molto onerosa nella produzione ceramica. Può essere condotta attraverso diversi processi: 1) Mulino a rulli (in acciaio alto-legato o con rivestimento
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Sistemi Gassosi. GAS = specie che occupa tutto lo spazio disponibile. VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 )
 Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Capitolo 1 Prima legge 1
 Indice Capitolo 1 Prima legge 1 1.1 Sistema e ambiente 1 1.2 Scambi di energia 2 1.3 Energia di un sistema 3 1.4 Energia come funzione di stato 5 1.5 Lavoro 5 1.6 Sistema chiuso 7 1.7 Notazione 7 1.8 Proprietà
Indice Capitolo 1 Prima legge 1 1.1 Sistema e ambiente 1 1.2 Scambi di energia 2 1.3 Energia di un sistema 3 1.4 Energia come funzione di stato 5 1.5 Lavoro 5 1.6 Sistema chiuso 7 1.7 Notazione 7 1.8 Proprietà
Lezione di Combustione
 Lezione di Combustione Introduzione Da un punto di vista chimico-fisico la combustione è un processo reattivo fortemente esotermico Generalmente le temperature in gioco sono particolarmente elevate e dipendono
Lezione di Combustione Introduzione Da un punto di vista chimico-fisico la combustione è un processo reattivo fortemente esotermico Generalmente le temperature in gioco sono particolarmente elevate e dipendono
ELETTROCHIMICA: studia le relazioni tra energia chimica ed energia elettrica
 ELETTROCHIMICA: studia le relazioni tra energia chimica ed energia elettrica Pila Energia chimica? energia elettrica Si basa su reazioni redox con G < 0 Cella di elettrolisi Energia elettrica? energia
ELETTROCHIMICA: studia le relazioni tra energia chimica ed energia elettrica Pila Energia chimica? energia elettrica Si basa su reazioni redox con G < 0 Cella di elettrolisi Energia elettrica? energia
Stati di aggregazione della materia
 Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
LA MATERIA ED I SUOI STATI
 LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
Distribuzione e Temperatura. Pressione di Vapore. Evaporazione
 Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
Principali Caratteristiche di un Combustore GT
 Principali Caratteristiche di un Combustore GT Diversamente dei sistemi di combustione tradizionali i combustori per Turbine a Gas hanno la particolarità di operare con: elevate temperature in ingresso;
Principali Caratteristiche di un Combustore GT Diversamente dei sistemi di combustione tradizionali i combustori per Turbine a Gas hanno la particolarità di operare con: elevate temperature in ingresso;
Lezione n. 4. Lavoro e calore Misura di lavoro e calore Energia interna. 04/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 4 Lavoro e calore Misura di lavoro e calore Energia interna 04/03/2008 Antonino Polimeno 1 Sommario (1) - Un sistema termodinamico è una porzione
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 4 Lavoro e calore Misura di lavoro e calore Energia interna 04/03/2008 Antonino Polimeno 1 Sommario (1) - Un sistema termodinamico è una porzione
Reazioni chimiche reversibili
 Reazioni chimiche reversibili In accordo all esperienza, la maggior parte delle reazioni chimiche possono procedere sia nel verso dai reagenti ai prodotti che nel verso opposto, cioè dai prodotti ai reagenti,
Reazioni chimiche reversibili In accordo all esperienza, la maggior parte delle reazioni chimiche possono procedere sia nel verso dai reagenti ai prodotti che nel verso opposto, cioè dai prodotti ai reagenti,
TERMODINAMICA. Studia le trasformazioni dei sistemi in relazione agli scambi di calore e lavoro. GENERALITÀ SUI SISTEMI TERMODINAMICI
 TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
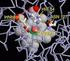 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
REFORMING dei COMBUSTIBILI
 MODELLAZIONE e SIMULAZIONE dei SISTEMI ENERGETICI REFORMING dei COMBUSTIBILI Ing. Vittorio Tola DIMCM - Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali PRODUZIONE di IDROGENO Negli ultimi
MODELLAZIONE e SIMULAZIONE dei SISTEMI ENERGETICI REFORMING dei COMBUSTIBILI Ing. Vittorio Tola DIMCM - Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali PRODUZIONE di IDROGENO Negli ultimi
Cambiamenti di stato
 Cambiamenti di stato Equilibri tra le fasi: diagrammi di stato per un componente puro diagrammi di stato a due componenti 1 Equilibri tra fasi diverse fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente
Cambiamenti di stato Equilibri tra le fasi: diagrammi di stato per un componente puro diagrammi di stato a due componenti 1 Equilibri tra fasi diverse fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente
L ANALISI TERMICA determina l effetto prodotto da un aumento di temperatura su alcune proprietà fisiche del campione. (TG, DTA, TMA, EA, DSC, etc)
 La CALORIMETRIA determina le quantità di calore prodotte dalle trasformazioni fisiche e chimiche di un campione. (Calorimetria adiabatica ed isoterma) L ANALISI TERMICA determina l effetto prodotto da
La CALORIMETRIA determina le quantità di calore prodotte dalle trasformazioni fisiche e chimiche di un campione. (Calorimetria adiabatica ed isoterma) L ANALISI TERMICA determina l effetto prodotto da
Termodinamica II. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Termodinamica II Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Processi Chimici e Fisici Spontanei L acqua scende a valle Un cucchiaino di zucchero si scioglio
Termodinamica II Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Processi Chimici e Fisici Spontanei L acqua scende a valle Un cucchiaino di zucchero si scioglio
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
Esercizi su Chimica Nucleare e Nucleogenesi
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Dipendenza dell'energia libera dalla T e P
 Dipendenza dell'energia libera dalla T e P G = H - TS essendo H = U + PV G = U + PV - TS Una variazione infinitesima di una o più variabili che definiscono lo stato del sistema determina una variazione
Dipendenza dell'energia libera dalla T e P G = H - TS essendo H = U + PV G = U + PV - TS Una variazione infinitesima di una o più variabili che definiscono lo stato del sistema determina una variazione
Università telematica Guglielmo Marconi. Chimica
 Università telematica Guglielmo Marconi Chimica 1 Termodinamica 1 Argomenti Nell unità didattica dedicata alla termodinamica verranno affrontati i seguenti argomenti: L energia interna di un sistema Le
Università telematica Guglielmo Marconi Chimica 1 Termodinamica 1 Argomenti Nell unità didattica dedicata alla termodinamica verranno affrontati i seguenti argomenti: L energia interna di un sistema Le
Programma svolto a.s. 2015/2016. Materia: fisica
 Programma svolto a.s. 2015/2016 Classe: 4A Docente: Daniela Fadda Materia: fisica Dettagli programma Cinematica e dinamica: moto circolare uniforme (ripasso); moto armonico (ripasso); moto parabolico (ripasso);
Programma svolto a.s. 2015/2016 Classe: 4A Docente: Daniela Fadda Materia: fisica Dettagli programma Cinematica e dinamica: moto circolare uniforme (ripasso); moto armonico (ripasso); moto parabolico (ripasso);
LA LEZIONE. Aspetti cinetici delle reazioni chimiche: la catalisi di superficie
 LA LEZIONE Aspetti cinetici delle reazioni chimiche: la catalisi di superficie Come i catalizzatori solidi interagiscono con le molecole per accelerare reazioni chimiche che rivestono un ruolo fondamentale
LA LEZIONE Aspetti cinetici delle reazioni chimiche: la catalisi di superficie Come i catalizzatori solidi interagiscono con le molecole per accelerare reazioni chimiche che rivestono un ruolo fondamentale
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Cine%ca enzima%ca. Copyright 2013 Zanichelli editore S.p.A.
 Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
2. Indicare l'affermazione che descrive più accuratamente il comportamento di un catalizzatore:
 1. "L'energia di attivazione, cioè l'energia necessaria a formare un composto ad alta energia potenziale, intermedio della reazione (il cosiddetto complesso attivato), è una grandezza caratteristica di
1. "L'energia di attivazione, cioè l'energia necessaria a formare un composto ad alta energia potenziale, intermedio della reazione (il cosiddetto complesso attivato), è una grandezza caratteristica di
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico
 Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico 43. A 723 K in un reattore dal volume di 5,000 L sono presenti all'equilibrio 3,356 mol di azoto, 4,070 mol di idrogeno
Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico 43. A 723 K in un reattore dal volume di 5,000 L sono presenti all'equilibrio 3,356 mol di azoto, 4,070 mol di idrogeno
dq = C P (T ) dt dq = T 1 C P (T ) dt q = [16.10T ] K K (JK 1 ) + 2 K 1 ( K)2 = 18.6 kj
![dq = C P (T ) dt dq = T 1 C P (T ) dt q = [16.10T ] K K (JK 1 ) + 2 K 1 ( K)2 = 18.6 kj dq = C P (T ) dt dq = T 1 C P (T ) dt q = [16.10T ] K K (JK 1 ) + 2 K 1 ( K)2 = 18.6 kj](/thumbs/52/30664943.jpg) Esercizio 1 Calcolo q, w, U e H per riscaldamento gas ideale Calcolare q, w, U e H per un gas ideale in seguito all'aumento della sua temperatura da 25 C a 120 C in condizioni di pressione costante, sapendo
Esercizio 1 Calcolo q, w, U e H per riscaldamento gas ideale Calcolare q, w, U e H per un gas ideale in seguito all'aumento della sua temperatura da 25 C a 120 C in condizioni di pressione costante, sapendo
