CICLOALCHENI. legame π C. Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico +. + R CH + CH 2 CH CH 2
|
|
|
- Gustavo Fadda
- 5 anni fa
- Visualizzazioni
Transcript
1 ALI ILALI ARATTRISTIA FUZIAL: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R UVvisibile Un solo legami π: le transizioni π π* richiede λ = 190 nm (lontano UV): fuori dal comune intervallo. Però è una transizione permessa dalla simmetria (ε= per l etene) IR stretching = a sinistra di 000 cm 1 stretching = cm 1 bending = (fuori dal piano) cm 1 = = = = metil1butene Se lo stretching del doppio legame = non modifica il momento di dipolo, non si ha assorbimento 1
2 1pentene cispentene transpentene 1 MR L anisotropia diamagnetica descherma il nucleo 1pentene 1
3 1 MR L anisotropia diamagnetica descherma il nucleo Spesso gli spettri non sono del primo ordine 1pentene vinilici { pentene vinilici { ALI ARATTRISTIA FUZIAL: legame π Più debole del legame σ, è il punto debole degli alcheni. la rottura del legame π porta a due valenze libere sui due atomi di, che vanno soddisfatte. ADDIZI la nuvola elettronica del legame π ATTIRA reagenti poveri di elettroni, RSPIG reagenti ricchi di elettroni. ADDIZI LTTRFILA
4 I reagenti elettrofili possono venire da una molecola di tipo XY o da una molecola di tipo XX δ δ X Y l,, I;, ; Il; l, (, ); B l,, I;, = B = atomo di B (orbitale vuoto) δ δ I l = I l l l l = l = δ δ X Y MAISM 1. lento X X X Processo in due stadi δ X δ. X Y X δ Y X Y Y δ X X Y coordinata di reazione 4
5 RATTIVITA I fattori che stabilizzano il carbocatione: abbassano l'energia dello stato di transizione diminuiscono l'energia di attivazione FAVRIS LA RAZI ' PIU' RATTIV L'AL che dà il ARBATI PIU STABIL RITAMT Se da un alchene si possono formare due carbocationi di diversa stabilità, si forma SL IL ARBATI PIU' STABIL (orientamento secondo Markownikov) RAZI RGISPIFIA SMPI con l l equazione l cloropropano meccanismo: l lento.. :l:.. l con equazione meccanismo: bromometilpropano.. :: lento.. 5
6 con I equazione I I iodometilpropano meccanismo:.. : I : lento.. I con, equazione metilpentanolo meccanismo: lento.... con Ιl equazione l I l I meccanismo:.. lento :l: l.. I l I I con l, equazione l l 1cloropropanolo meccanismo: l l l.... lento l l l l 6
7 con B IDRBRAZI equazione R B (R ) B B ottetto incompleto B 6 diborano B B B B orbitale vuoto B 6 B B l atomo di B è meccanismo: = B.... B complesso tra alchene e borano δ B δ /= δ /= B δ B anche gli altri legami B reagiscono allo stesso modo La reazione avviene in un unico stadio B Reazione RGISPIFIA Anche se non si forma un intermedio carbocationico, lo stato di transizione ha un carattere di parziale carbocatione (sul dove è più stabile) B coordinata di reazione 7
8 I trialchilborani sono utili non come tali, ma perché il B viene sostituito facilmente da un gruppo B (R ) B, R In questo modo è possibile ottenere da un alchene un alcool isomero rispetto a quello della reazione con,. : propanolo B B 1propanolo MRURIAZISLVDMRURIAZI g( ) in solvente polare protico (, R, ) g( ) g g lento g oppure g carbocatione ione mercurinio g Solv g Solv g Solv 8
9 RITAMT si forma il (parziale) carbocatione più stabile : I composti mercurati si trasformano in composti organici per trattamento con idruro di boro e sodio (ab 4 ) in ambiente basico g Solv DMRURIAZI RIDUTTIVA Solv g precipita come mercurio metallico (grigio) Solv = mercuriazione g( ) demercuriazione g g g alcool rispetto all'addizione di acqua acidocatalizzata, questo metodo ha il vantaggio di non passare attraverso un carbocatione libero e quindi di non correre il rischio della trasposizione. Solv = R mercuriazione R g( ) demercuriazione R esempi: g g R g R g( ) g etere 1acetossimercuriometossipropano 9
10 ab 4 g isopropil metil etere g( ) g g acetossimercurioetossipentano acetossimercurioetossipentano etossipentano ab 4 g etossipentano Solv = () mercuriazione g( ) demercuriazione g g g estere acetato di isopropile 10
11 Reazione con alogeni (, l ) Il legame (e ll) è covalente, con gli elettroni tra due atomi con la stessa elettronegatività (legame non polare). Il legame (e ll) può essere polarizzato per interazione donatoreaccettore con un legame π. La polarizzazione è favorita da solventi polari. dopo la polarizzazione SISSI TRLITIA vuoto.. ().. : δ.. δ ione BRMI ione bromuro.. () complesso π δ δ lento δ δ δ δ RAZI STRSPIFIA π coordinata di reazione 11
12 ADAMT STRIMI δ δ π δ δ # partendo da un isomero geometrico: δ δ π δ δ # (A) (B) (A) (B) = = (A) (A) = S = treo (A) S (A) R treo R on l l l, più piccolo di, sovrappone meno bene l'orbitale pieno con l'orbitale vuoto del e quindi non forma un vero legame, ma dà solo un'interazione accettoredonatore l δ l δ π l δ l δ # l l : : l l 1
13 l l l l l l prevalente minore quantità RAZI STRSLTTIVA RAZI con in condizioni radicaliche Fatto sperimentale: l'addizione di agli alcheni dà il regioisomero diverso da quello atteso (orientamento antimarkownikov) meccanismo: RR Δ R. R R.. Vladimir Vasilevich Markonikov lento.. continuala reazione a catena RAZI RGISPIFIA Si forma il radicale più stabile.... rientamento antimarkownikov Quella con in presenza di perossidi è la SLA addizione radicalica degli alcheni. on o l e hν o riscaldamento, hn alchene dà il RADIAL PIU STABIL, che è quello in posizione ALLILIA!!!!! hν 1
14 RIDUZI catalizzatore catalizzatore Pt, Pd, i superficie del catalizzatore insormontabile senza catalizzatore superabile con il catalizzatore enegia di attivazione abbassata coordinata di reazione RAZI STRSPIFIA Pt enantiomeri cis 14
15 D D D = meso Pd D D D Pd D D (R,R) D (S,S) D In soluzione (catalisi omogenea) si riesce ad avere reazione stereospecifica con catalizzatori che hanno un legante chirale: rodio.dip.l (S)()DPA enzimi cerebrali dopammina cura del morbo di Parkinson (neurotrasmettitore) SSIDAZI DGLI ALI senza scissione del legame [] oppure con scissione del legame [] oppure oppure RAGT ssidazione senza scissione KMn 4, s 4 e poi a S R ssidazione con scissione KMn 4,, Δ e poi, e poi Zn, PRDTT 1,Dioli 1,Dioli ssaciclopropani Acidi e/o hetoni Acidi e/o hetoni Aldeidi e/o hetoni 15
16 on KMn 4, KMn 4 5 Mn RAZI STRSPIFIA Mn Mn Mn Mn δ Mn δ δ = = = (S,S) = Mn Mn (R,R) on s 4 s 4 5 RAZI STRSPIFIA s δ s δ δ s a S s a S s (riducente) s 16
17 = = (R,S) meso s s = (R,S) meso on peracidi R R meccanismo: R R acido peracetico acido performico (permetanoico) l acido mcloroperbenzoico 17
18 con scissione del legame KMn 4,, a caldo KMn 4, Δ [] [] [] con gli alcheni terminali si forma KMn 4, Δ R R' [] R R' acido metanoico [] acido carbonico.. Z ( ).. :.. :.. : 1,,triossaciclopentano (4,4,5trimetil) meccanismo probabile: δ δ 1,,4triossaciclopentano (,,5trimetil) Instabile, non si isola 18
19 TRATTAMT RIDUTTIV ad aldeide Zn, ad a chetone TRATTAMT SSIDATIV ad acido carbossilico ad a chetone Addizione di carbeni Molecole contenenti un BIVALT sono rare in himica rganica. Si chiaano ARBI e possono essere di due tipi, a seconda della configurazione elettronica orbitale sp pieno orbitale p vuoto metilene singoletto : ( sp ) orbitale p (un e) R. orbitale p (un e) metilene tripletto.. ( sp) 19
20 Si formano per decomposizione fotochimica del diazometano: : hν : : diazometano Il metilene attacca un legame π =, sia come singoletto che come tripletto con metilene singoletto con metilene tripletto : R R cis.. R R cis R. R cis R. R possibilità di rotazione RAZI STRSPIFIA R R R R cis trans arbeni sostituiti con alogeni sono più stabili e si preparano più facilmente :l diclorocarbene ( ) l l ( ) l : l l :l l Reazione di SimmonsSmith sempio: :l l l I Zn(u) ( 5 ) I ZnI carbenoide sempio: I Zn(u) ( 5 ) 0
21 09/05/014 ARATTRISTIA FUZIAL: ALII legame π IR stretching = a circa 00 cm 1 stretching circa 150 cm 1 manca negli alchini simmetricamente disostituiti aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 9, che corrisponde al carbocatione propargilico R. R. 1ottino 4ottino 1ottino M 1 MR L anisotropia diamagnetica scherma il nucleo sp δ 7090 ppm 4ottino ottino 1ottino 4ottino MR L anisotropia diamagnetica scherma il nucleo δ ppm Danno le stesse reazioni degli alcheni (legame π), con lo stesso meccanismo L'addizione del primo equivalente lascia ancora un legame π, che perciò può dare ulteriore addizione X X Y X Y Y X Y il prodotto della reazione dipende perciò dal numero di equivalenti del reagente elettrofilo esempi: l l trans RAZI STRSPIFIA 1
22 09/05/014 con (addizione elettrofila).. ::.. con (carbocatione più stabile) (carbocatione più stabile) (addizione radicalica).. ::.. Δ R R R. R. R... (radicale più stabile). continua la catena... con, meccanismo: (radicale più stabile) servono anche sali di g come catalizzatori g : carbocatione più stabile continua la catena enolo TAUTMRIA ssidazione con KMn anche a temperatura ambiente si ha 4 scissione del legame KMn 4 R R' R R', 5 R R' RIDUZI Pt La riduzione catalitica arriva ad ALA, se non si usano catalizzatori speciali Pt Per fermarsi ad alchene è necessario che il catalizzatore sia meno attivo Pd "avvelenato" disattivato cis RAZI STRSPIFIA Per ridurre alchini interni ad alcheni trans a trans con a (K, Li ) in liquida RAZI STRSPIFIA ATTZI!! GLI ALII TRMIALI DA GLI ALIURI L'andamento stereochimico viene spiegato con la maggiore stabilità del radicale vinilico con i gruppi R in trans, rispetto a quello con i gruppi R in a : a 1/ meccanismo: R R a a... R R anione radicale R. a... R R a radicale vinilico R R. R.. a a anione vinilico R R R.. R a a R R trans cis (repulsione per ingombro sterico). R. AIDITA' del legame sp R R R. I sali degli alchini terminali (alchinuri) si possono ottenere, oltre che con a, con idrossidi di metalli di transizione R Ag( ) R Ag "Ag " legame covalente polare R u( ) R u "u " legame covalente polare
23 09/05/014 DII ARATTRISTIA FUZIAL: legame π metil1,4pentadiene aratteristiche Spettrali UVvisibile Analoghe a quelle dgli alcheni La coniugazione abbassa la differenza di energia MLUM (shift batocromico) A = B = ppm 11.1 ppm 1,4esadiene Stesse reazioni degli alcheni; il prodotto dipende dal numero di equivalenti del reagente (elettrofilo) l l sp { vinilici { l l l DII IUGATI Anche con un solo equivalente si ottengono più prodotti: l l l addizione 1, a bassa temperatura prevale addizione 1, a temperatura elevata prevale addizione 1,4 addizione 1,4 unico carbocatione DU siti positivi l l δ addizione 1, δ δ # δ l addizione 1,4 # Reazione di DielsAlder π * LUM π M 1 Δ Addotto di DielsAlder 1, a coordinata di reazione l l 1,4 1, controllo cinetico 1,4 controllo termodinamico diene dienofilo nuovo legame π nuovi legami σ
24 09/05/014 La geometria del dienofilo si mantiene nell addotto dienofilo cis addotto cis dienofilo trans addotto trans Se il diene ed il dienofilo sono sostituiti non simmetricamente, si ottengono due addotti tto Paul ermann Diels Kurt Alder Regola endo Quando il dienofilo contiene un legame π nel gruppo elettron attrattore, gli orbitali π in quel gruppo si avvicinano agli atomi centrali del diene. Questa sovrapposizione secondaria aiuta a stabilizzare lo stato di transizione della formazione dell addotto. Fenomeno osservato formando i prodotti biciclici dal ciclopentadiene eso eso endo endo Sovrapposizione secondaria = = == = = = == = e non e non 4
25 09/05/014 MPSTI ARMATII L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. aratteristiche Spettrali La maggior parte dei composti aromatici Spettrometria di massa presenta un picco dello ione molecolare molto intenso. Gli alchilbenzeni hanno una frammentazione molto facile con m/z 91. stato dimostrato che il carbocatione benzilico traspone a catione eptatrienilio. R.. R m/z 91 M (78) M m/z 91 (18)
26 09/05/014 UVvisibile Il benzene ha legami π coniugati Lo spettro di assorbimento elettronico è caratterizzato da due bande dette primarie e una banda detta secondaria o della struttura fine. λ = 184 nm (ε = ) λ = 0 nm (ε = 7 000) A struttura fine λ = 55 nm (ε = 0) È dovuta alle interazioni dei livelli elettronici con i modi vibrazionali nm IR stretching = a sinistra di 000 cm 1 bending = (fuori dal piano) cm 1 stretching = spesso in coppia a 1600 e 1475 cm 1
27 09/05/014 1 MR L anisotropia diamagnetica descherma il nucleo δ ppm 1 MR L anisotropia diamagnetica descherma il nucleo δ 78 ppm
28 09/05/014 MPSTI ARMATII I composti aromatici reagiscono MATD l aromaticità ADDIZI SSTITUZI possibili meccanismi? due eventi: rottura legame aromatico, formazione legame aromatico possiamo ipotizzare che avvengano in uno stadio (eventi contemporanei: processo elementare) o in stadi successivi (processo in più stadi) Prima IPTSI: meccanismo sincrono δ δ Seconda IPTSI: meccanismo in due stadi due possibilità (sulla carta) Si può escludere che si rompa PRIMA aromatico : l intermedio risultante sarebbe troppo instabile meccanismo in due stadi videnze sperimentali D La reazione è stata eseguita sul deuterobenzene D il legame D è piu forte del legame : D D D D k / k = 1 D significa che nello stadio lento non c'e rottura del legame 4
29 09/05/014 In alcuni casi si è riusciti ad isolare l'intermedio BF 4 SbF 6 il MAISM è I DU STADI, con formazione del legame, seguita dalla rottura del legame MAISM DLLA SSTITUZI LTTRFILA ARMATIA primo stadio δ lento δ primo stato di transizione addotto sigma strutture di risonanza dell'intermedio secondo stadio veloce δ δ secondo stato di transizione nergia in funzione della coordinata di reazione: 1 ST ST 10.8 kcal/mole coordinata di reazione 5
30 09/05/014 Tutte le variazioni strutturali che abbassano l'energia dell'intermedio abbassano anche l'energia dello stato di transizione che porta all'addotto σ e quindi rendono più facile la reazione. SSTITUZII LTTRFIL ARMATI principali reazioni di Sostituzione lettrofila ITRAZI S 4 SLFAZI S S 4 X S ALGAZI FeX X X (X = l) (X = ) l Fel l l Fe clorurazione bromurazione R ALILAZI RX All X Alchilazione di Friedelrafts AILAZI R X All R X Acilazione di Friedelrafts Queste reazioni permettono di introdurre nel benzene gruppi funzionali diversi, ma avvengono con lo STSS MAISM. ' perciò importante capire quale è il reagente elettrofilo e come si forma. 6
31 09/05/014 itrazione S 4 S 4 catione ITRI S 4 S 4 S 4 S 4 Solfonazione S S S S S S Alogenazione l l Fel Fel 4 "l " l l Fel 4 l l Fel Fe Fe 4 " " Fe 4 Fe 7
32 09/05/014 Alchilazione (di Friedelrafts) δ δ δ δ R l All R... l... All All 4 R R All "R R Acilazione (di Friedelrafts) R l R δ δ All All 4 : R R R R R All All 4 All R R R l All All si deve usare in quantità stechiometrica perché dà complesso di Lewis con il prodotto Sostituzioni elettrofile aromatiche dei Benzeni SSTITUITI Tutte le posizioni del benzene sono equivalenti. Quando c'è un sostituente, le posizioni sono diverse: orto, meta e 1para se i prodotti si formassero solo su basi statistiche, si dovrebbe avere 40% di orto, 40% di meta e 0% di para a distribuzione dei prodotti osservata sperimentalmente non è MAI quella statistica questo significa che il sostituente presente sull'anello del benzene indirizza l'attacco dell'elettrofilo RITAMT per esempio: l l on è un effetto del sostituente sul substrato! 8
33 09/05/014 RITAMT Stadio lento: formazione dell addotto σ: più stabile è l'addotto sigma, minore è l'energia dello stato di transizione che porta all'addotto. 1. Si scrivono tutti i possibili addotti e le rispettive strutture di risonanza.. Si esamina se c'è una struttura con la carica positiva sul che lega il sostituente.. Si guarda se il sostituente stabilizza (o destabilizza) la carica positiva. meta orto,para benzene coordinata di reazione La reattività del benzene sostituito rispetto a quella del benzene dipende dall'energia di attivazione dello stadio lento e si vede dalla stabilità dell'addotto σ più stabile (del benzene sostituito) rispetto a quella dell'addotto del benzene. Distanza minore tra metile e : massimo effetto induttivo 9
34 09/05/014 l l l l l l l l l l l Solo effetto induttivo (I): dipende dalla distanza orto,para l l Distanza minore tra clorometile e : massimo effetto induttivo meta benzene l l o coordinata di reazione 10
35 09/05/014 struttura di risonanza in più struttura di risonanza in più meta benzene orto,para o coordinata di reazione 11
36 09/05/014 Particolarmente instabili: cariche dello stesso segno vicine orto,para meta benzene o coordinata di reazione 1
37 09/05/014 l l l l l struttura di risonanza in più l l l l l l l struttura di risonanza in più l meta orto,para benzene l l o l coordinata di reazione 1
38 09/05/014 è specie a difetto elettronico reagisce meglio con centri RII di elettroni RATTIVITA Si deve considerare la densità elettronica delle PSIZII RATTIV (orientamento) sempio: mettere i seguenti composti in ordine decrescente di reattività, nei confronti di un reagente elettrofilo l 1. Si individua la posizione (o le posizioni) di attacco, cioè l'orientamento (sulla base della stabilità degli addotti σ).. Si considera l'effetto del sostituente SU QULLA PSIZI.. Maggiore è la densità elettronica, maggiore è la reattività (a parità di elettrofilo). Tutte le posizioni sono equivalenti. on ci sono sostituenti, la densità elettronica è quella di riferimento. rientamento in MTA. In questa posizione il gruppo esercita solo l'effetto induttivo. I attrazione elettronica Le posizioni reattive del nitrobenzene sono più povere di elettroni (e quindi M reattive) delle posizioni reattive del benzene rientamento in RT PARA. In queste posizioni il gruppo esercita sia l'effetto induttivo che quello coniugativo. I, R rilascio elettronico Le posizioni reattive del metossibenzene sono più ricche di elettroni (e quindi PIU reattive) delle posizioni reattive del benzene 14
39 09/05/014 rientamento in RT PARA. In queste posizioni il gruppo esercita solo l'effetto induttivo. I rilascio elettronico Le posizioni reattive del metilibenzene sono più ricche di elettroni (e quindi PIU reattive) delle posizioni reattive del benzene l rientamento in RT PARA. In queste posizioni il gruppo esercita sia l'effetto induttivo che quello coniugativo. I, R attrazione elettronica Le posizioni reattive del clorobenzene sono più povere di elettroni (e quindi M reattive) delle posizioni reattive del benzene Il rilascio elettronico dovuto a risonanza è maggiore di quello induttivo (alchili) Reattività: l > > > > Sostituzioni lettrofile sul AFTAL A differenza del benzene, le posizioni del naftalene non sono tutte equivalenti: RITAMT β β α α α α β β per conoscere l orientamento, basta confrontare gli addotti sigma nelle posizioni α e β L altro anello mantiene la completa aromaticità volte su nella risonanza dell addotto in α, solo 1 nella risonanza dell addotto in β e quindi è più stabile 15
40 09/05/014 Le sostituzioni elettrofile aromatiche sul naftalene avvengono in α S 4 Un caso a parte è la solfonazione, in cui l orientamento dipende dalla temperatura S T<100 o S 4 S S 4, Δ T>150 o S coordinata di reazione α β a T<100 : controllo cinetico, a T>150 : controllo termodinamico S S RAZII LTTRFILI DBLI Avvengono solo con aromatici MLT reattivi 1. Reazione con i sali di benzendiazonio : X X 4idrossiazobenzene L elettrofilo (voluminoso) va in in orto solo se la posizione para è occupata Reagiscono solo: benzenolo (=fenolo) e benzenammina (=anilina) (e analoghi del naftalene) 16
41 09/05/014. Reazione di carbossilazione (Reazione di Kolbe) a Δ δ δ a solo con fenolo aspirina (acido acetilsalicilico) acido acetossibenzencarbossilico acido salicilico (acido idrossibenzencarbossilico). Reazione di formilazione (reazione di ReimerTiemann) a a l K solo con fenolo l :l l :l lettrofilo :l l l l l l aldeide salicilica (idrossibenzencarbaldeide) 17
42 09/05/ Reazione di idrossimetilazione solo con fenolo ochinometano pchinometano PRPARAZI RATTIVITA' DI SALI DI BZDIAZI [] (Fe, l) a, l, S 4 [] (F ), Δ l P l ul KI u u I AgBF 4 a, u BF 4 F Δ (solido) 18
43 09/05/014 US DI SALI DI BZDIAZI 1. Introduzione di gruppi che non si possono introdurre diversamente è nucleofilo da il benzene reagisce con gli elettrofili S 4 [] a l, 0 l. Introduzione di un secondo sostituente in una posizione diversa da quella possibile con una sostituzione elettrofila aromatica, sulla base dell'orientamento provocato dal primo sostituente esempi? PRBLMI SLUZI difficile introdurre orienta un elettrofilo in meta sali di benzendiazonio ( ) All serve per ingombrare stericamente le posizioni orto ed avere solo la sostituzione in para e per diminuire la reattività altrimenti si avrebbero prodotti di polimetilazione, a l, 0 l u 19
44 09/05/014 PRBLMA sia che orientano in orto, para SLUZI sali di diazonio (preparato come prima) Fe ( R > I ) gruppo a rilascio elettronico più forte di, a S 4, 0 5 S 4 P? PRBLMA orienta in orto, para Fe Fe Fe SLUZI SALI DI DIAZI 0
45 09/05/014 in queste condizioni reagiscono tutte le posizioni influenzate da a X, 0 5 gli atomi di sono nella posizione relativa voluta: basta togliere il gruppo X P RATTIVITA' DI ATRA FATR I RAGTI LTTRFILI L'aumento del numero di anelli condensati diminuisce l'aromaticità Fenantrene ed antracene (meno aromatici di benzene e fenantrene) dannoa RAZII DI ADDIZI FATR il legame 910 ha caratteristiche di un doppio legame poco delocalizzato (Fel ) 9bromofenantrene 9,10dibromo9,10diidrofenantrene ATTZI!! nel nome del prodotto di addizione va indicata la presenza dei due : 9,10dibromofenantrene indica che in 9 e 10 ci sono due atomi di AL PST DI DU 9,10dibromofenantrene 1
46 09/05/014 il fenantrene si comporta con X come un alchene l l 9cloro9,10diidrofenantrene L'addizione avviene al legame 910, perché in questo modo rimane intatta l'aromaticità degli altri due anelli benzenici ATRA Si comporta anche come un diene coniugato, dando prodotti di addizione 1,4, oltre ai prodotti di sostituzione elettrofila aromatica (in posizione 9) (Fel ) 9bromoantracene 9,10dibromo9,10diidroantracene L antracene dà le caratteristiche reazioni dei dieni coniugati e perciò reagisce con elettrofili del tipo X e con i dienofili X 9X9,10diidroantracene X addotto di DielsAlder
47 09/05/014 Reazioni in catena laterale I benzeni sostituiti possono reagire anche in catena laterale (cioè sul sostituente), se si usano condizioni opportune. l hν l l Fel l RAZII DI SSIDAZI Monoalchilbenzeni Si ossidano a acido benzencarbossilico KMn 4, Δ KMn 4, Δ ( ) n KMn 4, Δ (n 1) Anello benzenico molto resistente all'ossidazione, V Il naftalene è un po più facile da ossidare, V
48 09/05/014 Un ossidazione meno drastica si può avere con r e gli aromatici con più anelli condensati r 1,4naftalenchinone (1,4naftochinone) r r 9,10fenantrenchinone 9,10antracenchinone benzendioli Si ossidano molto facilmente a chinoni Ag obenzochinone Ag pbenzochinone RAZII DI RIDUZI on La riduzione catalitica richiede pressioni e temperature elevate per la prima addizione (perdita dell aromaticità), mentre le addizioni successive sono più facili., P, Δ on a cat. (Pt, Pd, i, Ru, o Rh) Riduzione di Birch a (o Li) meccanismo: a... carbanione anione radicale.. liquida, radicale. a 4
49 09/05/014 Se la reazione si effettua su un benzene sostituito RITAMT Si formano carbanioni stabilizzati da gruppi ad attrazione elettronica, destabilizzati da gruppi a rilascio elettronico Un carbonio che porta un gruppo ad attrazione elettronica viene ridotto a (o Li) liquida, intermedio stabilizzato Un carbonio che porta un gruppo a rilascio elettronico non viene ridotto a (o Li) liquida, intermedio destabilizzato a (o Li) liquida, intermedio destabilizzato Il benzene non reagisce con i nucleofili u Però.. la sintesi industriale del fenolo parte dal clorobenzene l K, Δ, P Kl..e allora???? SSTITUZI ULFILA ARMATIA Perché i composti aromatici possano reagire con ULFILI, devono possedere i seguenti requisiti 1. BU GRUPP UST. SSTITUT/I A FRT ATTRAZI LTTRIA ( ) In questo caso si ha: Meccanismo di ADDIZILIMIAZI 5
50 09/05/014 La reazione avviene in due stadi, con formazione nello stadio lento di un intermedio (addotto σ negativo o complesso di Meisenheimer), stabilizzato per risonanza dal sostituente l l l X δ l δ X Δ =/ l X coordinata di reazione δ l δ X X l lento l l l Meisenheimer videnze sperimentali: qualche complesso di Meisenheimer è stato isolato F il legame F è più forte di l, ma è più reattivo di l il legame con il gruppo uscente non si rompe nello stadio lento e F (più elettronegativo) favorisce l'attacco del nucleofilo, rendendo più positivo il a cui è legato Però.. la sintesi industriale del fenolo parte dal clorobenzene l K, Δ, P Kl..e allora???? Se manca il sostituente a forte attrazione elettronica, si può avere reazione con i nucleofili, purché vengano soddisfatti i seguenti requisiti: 1. BU GRUPP UST. il nucleofilo è UA BAS FRT K (solida) a in liquida In questo caso si ha: Meccanismo di LIMIAZIADDIZI 6
51 09/05/014 La base forte strappa un protone acido (in orto al gruppo uscente) e la base coniugata forma il benzino, che, essendo molto reattivo, addiziona l'acido coniugato della base l l.. l BZI l'addizione può avvenire in entrambi i modi videnze sperimentali: l * * * l * = 1 con un clorobenzene sostituito si hanno miscele di prodotti pmetilclorobenzene l l l.. l ometilclorobenzene l l 7
52 09/05/014 mmetilclorobenzene l l 8
53 IMIA RGAIA I orso di laurea in IMIA, IMIA APPLIATA, SIZA DI MATRIALI sercitazione n. 14 Reazioni di alcheni, alchini e dieni. TRMII D ARGMTI PR L SVLGIMT DGLI SRIZI DI QUST FGLI: Reazioni degli alcheni. Addizioni di XY (acidi alogenidrici; acqua acidocatalizzata; l acidocatalizzata; Il; idroborazione con B ): stechiometria e meccanismo. Solvomercuriazionedemercuriazione. Addizioni radicaliche ( in presenza di perossidi): stechiometria e meccanismo. Addizione di alogeni: stechiometria e meccanismo. Idrogenazione catalitica. Reazioni di ossidazione senza scissione (KMn 4 ; s 4 ; peracidi) e con scissione (KMn 4 a caldo; ozono): stechiometria e meccanismo. Addizione di metileni (singoletto e tripletto). Solvomercuriazionedemercuriazione. Idrogenazione catalitica. Reazioni di ossidazione senza scissione (KMn 4 ; s 4 ; peracidi) e senza scissione (KMn 4 a caldo; ozono): stechiometria e meccanismo. Addizione di metileni (singoletto e tripletto). Reazioni degli alchini. Reazioni di addizione; tautomeria degli enoli; idrogenazione (ad alcani e ad alcheni); reazione di riduzione con metalli alcalini in ammoniaca (stechiometria e meccanismo); ossidazione (con KMn 4 ); reazioni degli alchini terminali: con sodio, sodioammide, rame ed argento ammoniacali. Reazioni degli alcadieni. Reazioni dei dieni coniugati: con alogeni, con acidi alogenidrici (stechiometria e meccanismo; controllo cinetico e termodinamico); reazione di Diels Alder. sercizi per ricordare le reazioni 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) butene ; b) butene acqua, in ambiente acido.. Scrivere le reazioni del metil1pentene con ciascuno dei seguenti reagenti, specificando i nomi dei prodotti che si formano: a) B e poi, ; b) l; c) ; d), in presenza di perossidi; e) I; f) l ; g) Il; h).. Scrivere le equazioni chimiche ed il meccanismo delle seguenti reazioni: a) 1butene I; b) 1 metilcicloesene l; c) metilpentene S 4 acquoso; d) metilpropene con S 4 in etanolo; e),dimetilesene con acqua in ambiente acido; f) 1butene I. 4. Scrivere la reazione con, dei seguenti alcheni, specificando i nomi dei composti organici che si formano: a) 1butene; b) metilpropene; c) metilbutene; d) metil1butene. 1
54 5. Scrivere le reazioni del etilpentene con ciascuno dei seguenti reagenti, specificando i nomi dei prodotti organici: a) borano e poi, ; b) in ambiente acido; c) ; d) in presenza di perossidi; e) Il. 6. ompletare le seguenti reazioni: a) propene borano e poi, ; b) metilpentene borano e poi, ; c) 1metilcicloesene borano e poi,. 7. Scrivere i prodotti di reazione (specificandone il nome) del bromo con i seguenti alcheni; a) butene; b) metilpropene; c) metilbutene. 8. ompletare le seguenti reazioni, specificando il nome di tutti i composti organici che si ottengono: a) cicloesene ; b) cicloesene, in presenza di perossidi (ATTZI!!! dà addizioni radicaliche al doppio legame...ricordatevi di che cosa facevate nell esercitazione 11!); c) metilbutene cloro; d) 1butene bromo. 9. a) Scrivere il meccanismo della reazione tra metilbutene con acetato mercurico in etanolo. b) Scrivere la reazione tra il prodotto ottenuto in (a) e l'idruro di boro e sodio. 10. ompletare le seguenti reazioni: a) 1metilcicloesene acetato mercurico acquoso e poi ab 4 ; b) 4clorocicloeptene acetato mercurico in metanolo e poi ab 4 ; c) metilpentene acetato mercurico in acido acetico e poi ab Scrivere le reazioni del metil1pentene con ciascuno dei seguenti reagenti, specificando i nomi dei prodotti che si formano: a), Pt; b) D, Pd; c) acido mcloroperbenzoico; d) s 4 e poi a S ; e) KMn 4, ; f) KMn 4,, a caldo. 1. a) Scrivere la reazione del metilene con il cicloesene; b) scrivere le reazione del cicloesene con cloroformio in ambiente basico acquoso. 1. ompletare le seguenti reazioni: a) trans1,difeniletene l, a in acqua; b) cicloesene I, Zn(u); c) cisesene, in ambiente basico acquoso. 14. ompletare le seguenti reazioni, specificando il nome di tutti i composti organici che si ottengono: a) cicloesene KMn 4,, a freddo; b) cicloesene acido perbenzoico; c) cisesene KMn 4, in ambiente basico, a caldo; d) metilpentene e poi Zn,, ; e) metil pentene e poi ; f) 1pentene cloro; g) esene ozono, e poi Zn,,. 15. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) butino (un equivalente); b) butino (un equivalente); c) butino (due equivalenti); d) propino sodioammide.
55 16. Scrivere le reazioni dell'1pentino con i seguenti reagenti, specificando il nome dei prodotti organici: a) un equivalente di cloro; b) due equivalenti di cloro; c) due equivalenti di l; d) sodioammide e poi ioduro di metile; e) /Pt; f) /Pd avvelenato; g) (un equivalente); h) (due equivalenti); i) l (un equivalente); j) l (due equivalenti); k) a in ammoniaca liquida; l),, g; m) a e poi ioduro di metile. 17. Scrivere le equazioni chimiche, specificando i nomi dei prodotti organici, delle reazioni che avvengono trattando il pentino con i reagenti da (a) a (l) dell'sercizio Scrivere il prodotto (o i prodotti) della reazione (se c'è reazione) tra l'1butino ed i seguenti reagenti: a) KMn 4, ; b) /Pt; c) in eccesso; d) al; e),, g ; f) /Pd avvelenato. 19. Scrivere i prodotti (specificandone il nome) che si formano per reazione dell'1pentino con: a) un equivalente di ; b) due equivalenti di ; c) un equivalente di, in presenza di perossidi; d) bromo, in presenza di perossidi; e) /Pd avvelenato; f) a in liquida; /Pt; g) /Pt; h) KMn 4, ; i) Ag( ) ; j) u( ). 0. Scrivere i prodotti (specificandone il nome) che si formano per reazione del esino con: a) borano, e poi, ; b) /Pd disattivato; c) a in ammoniaca liquida. 1. ompletare le seguenti reazioni, specificando il nome dei composti organici che si formano: a) ciclopentadiene (un equivalente); b),4esadiene (due equivalenti); c) ciclopentadiene anidride maleica (=anidride dell'acido cisbutendioico).. Scrivere le equazioni chimiche e dare il nome al prodotto (o ai prodotti) delle reazioni dell'1, pentadiene con: a) (in eccesso)/pt; b) (un equivalente); c) (due equivalenti); d) l (un equivalente); e) l (due equivalenti); f),. sercizi per capire le reazioni. Spiegare l'orientamento che si osserva nell'addizione di l al metilbutene e disegnare il profilo dell'energia della reazione. 4. Scrivere la struttura ed il nome del composto che si ottiene per addizione di Il al propene. Quale è il meccanismo? 5. Mettere i seguenti alcheni in ordine di reattività crescente nei confronti della idratazione acidocatalizzata (= addizione di acqua): propene, etene, vinilbenzene. Spiegare. 6. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene trattando il propene con ; b) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene trattando il propene con, in presenza di perossidi.
56 7. Quale composto in ciascuna delle seguenti coppie è più reattivo nei confronti di l (spiegare): a) 1fenil1butene o 1cicloesil1butene; b) 1,dicloroetene o 1cloropropene; c) pentene o metilbutene. 8. Sistemare i seguenti composti in ordine di reattività decrescente nei confronti dell'acido bromidrico (scrivere il meccanismo in ciascun caso): 1fenil1butene, 1,1difenil1butene, 1 butene, butene, metil1butene. 9. a) Prevedere l'ordine di reattività per la reazione con dei seguenti alcheni: 1butene, etene, metilbutene. b) Scrivere il meccanismo della reazione. c) Scrivere i prodotti che si ottengono ed il meccanismo, se la reazione con si effettua in presenza di perossidi. d) Quale sarà l'ordine di reattività in questo caso? 0. Scrivere equazione chimica e meccanismo della reazione che si ha tra metilpropene e a) in assenza di perossidi; b) in presenza 1. Quando il propene si tratta con l in etanolo, uno dei prodotti è l'etil isopropil etere. Suggerire una spiegazione per la sua formazione.. Scrivere i prodotti per ciascuna delle seguenti reazioni con l, tenendo conto del fatto che i carbocationi possono trasporre: a),dimetil1butene; b) 4,4dimetil1pentene.. Scrivere tutti i passaggi dell'idratazione acidocatalizzata del propene. Spiegare perché il prodotto della reazione è il propanolo e non l'1propanolo. ome si potrebbe ottenere l'1 propanolo dal propene? 4. Scrivere il meccanismo della reazione di idroborazione del metilbutene, spiegando l'orientamento che si osserva. 5. Spiegare che ordine di reattività si osserva se si fanno reagire con l: vinilbenzene, p metossivinilbenzene, pnitrovinilbenzene. 6. a) Scrivere l'equazione chimica ed il meccanismo dell'addizione di bromo all'1metilcicloesene, commentandone l'andamento stereochimico. b) he altro si forma, se la reazione con bromo è fatta in presenza di acqua? 7. Scrivere l'equazione chimica ed il meccanismo della reazione dell'etene con: a) ; b), in presenza di al. In quest'ultimo caso, vi aspettate si possa formare dell'1,dicloroetano? Perché? 8. Scrivere l'equazione chimica ed il meccanismo della reazione del ciclopentene con cloro in acqua, mostrandone l'andamento stereochimico. 4
57 9. Scrivere il meccanismo della reazione con bromo dei seguenti alcheni, mettendo in evidenza l'andamento stereochimico: a) transbutene; b) cispentene; c) (Z)fenilbutene; d) () metilbutenoato di metile. 40. Scrivere le equazioni chimiche delle seguenti reazioni del ciclopentene, indicando il meccanismo e spiegando il corso stereochimico: a) con bromo, in solvente polare; b) con bromo in acqua; c) con cloro, in solvente polare; d) con borano, e poi,. 41. Quando il ciclopentene si fa reagire con bromo in soluzione acquosa di cloruro di sodio, i prodotti sono: il trans1,dibromociclopentano, il trans1bromoclorociclopentano ed il trans bromociclopentanolo. Spiegare, sulla base del meccanismo di reazione. 4. Scrivere le equazioni chimiche delle seguenti reazioni del ciclopentene, indicando il meccanismo e spiegando l andamento stereochimico: a) con KMn 4, in, ; b) con acido performico, e poi, ; c) con acido performico, e poi, ; d) con ozono, e poi Zn,,. 4. ompletare le seguenti reazioni del metilbiciclo[4.4.0]decene, specificando i nomi dei composti organici che si formano: a) con acido perbenzoico; b) con acido perbenzoico, e poi, ; c) con KMn 4 acquoso; d) con KMn 4 acquoso, scaldando; e) con s 4, e poi a S. 44. Scrivere i prodotti, specificandone il nome, dell'ozonolisi sia riduttiva che ossidativa per ciascuno dei seguenti alcheni: a).dimetilbutene; b) metilciclopentene; c) αpinene, un componente della trementina, di nome IUPA 6,6dimetilbiciclo[.1.1]eptene; d) metil butene; e) cicloesene; biciclo[4.4.0]1decene. 45. La reazione con s 4 del biciclo[4.4.0]1,6decene (cioè il doppio legame è tra le posizioni 1 e 6) dà un composto di formula molecolare che, trattato con acido solforico dà trasposizione pinacolica con formazione di un composto di formula molecolare Scrivere i composti, con l'aiuto dei meccanismi corrispondenti. 46. Scrivere l'equazione chimica della reazione che avviene tra butadiene e (un equivalente). ome si può spiegare il fatto che l'addizione 1, è più veloce? ome si può spiegare il fatto che il prodotto di addizione 1,4 è più stabile? 47. Quando il butadiene si fa reagire con l a temperatura ambiente, si ottiene una miscela di 1 clorobutene (%) e cloro1butene (78%). Per trattamento prolungato con l, la miscela è costituita per il 75% da 1clorobutene e per il 5% da cloro1butene. Spiegare e scrivere le reazioni corrispondenti. 48. Il butadiene viene trattato con un equivalente di bromo a 15. Si ottengono due isomeri strutturali, A, in quantità del 46% e B, per il 54%. Quando la reazione si esegue a 60, la miscela di prodotti è costituita per il 90% da A. Quali sono le strutture di A e B? 5
58 49. Dire quale dei seguenti composti reagisce con anidride maleica (=cisbutendioica) e quale no, spiegando e scrivendo l'equazione chimica delle reazioni che avvengono: a) 1,4pentadiene; b) butadiene; c) ciclopentadiene; d) 1,4cicloesadiene; e) 1,cicloesadiene; f) 1,esadiene; g) 1,4 esadiene; h) 1,5esadiene. 50. Prevedere i prodotti delle seguenti reazioni di DielsAlder: a) b) Δ?? Δ Δ? c) d) Δ? sercizi per applicare le reazioni 51. Scrivere l'equazione chimica delle reazioni che permettono di ottenere i seguenti composti a partire dal metilenecicloesano: a) 1metilcicloesanolo; b) cicloesilmetanolo; c) bromometilcicloesano; d) 1bromo1metilcicloesano. 5. ome si può trasformare l'1metilciclopentanolo in metilciclopentanolo? (Suggerimento: sono due passaggi). 5. Indicare come si possono effettuare le seguenti trasformazioni: a) 1butene a 1butanolo; b) 1 butene a butanolo; c) bromo,4dimetilpentano a,4dimetilpentanolo. 54. Suggerite un modo per trasformare il ciclopentene in: a) ciclopentano; b) trans1,dibromociclopentano; c) transbromociclopentanolo. 55. Indicare come si possono effettuare le seguenti trasformazioni: a) transbutene a trans1, dimetilciclopropano; b) ciclopentene a 6bromobiciclo[.1.0]esano; c) cicloesanolo a 7,7 diclorobiciclo[4.1.0]eptano. 56. Partendo da etino, reagenti inorganici ed alogenuri alchilici, preparate i seguenti composti, scrivendo le reazioni chimiche ed indicando i reagenti: a) propino; b) butino; c) cisbutene; d) transbutene; e) transeptene. 57. Anche gli alchini possono essere usati come dienofili nelle reazioni di DielsAlder. Scrivere le strutture dei prodotti che si ottengono dalla reazione del butadiene con: a) esafluorobutino; b) propinoato di metile; c) butindioato dimetilico. 6
59 58. A partire da quali dieni e dienofili si ottengono i seguenti addotti di DielsAlder: a) b) c) d) e) f) g) l k) h) i) j) l) m) n) o) 7
60 sercitazione n. 15 Reazioni e meccanismi dei composti aromatici. TRMII D ARGMTI PR L SVLGIMT DGLI SRIZI DI QUST FGLI: Reazione di sostituzione elettrofila aromatica: alogenazione, nitrazione, solfonazione, alchilazione e acilazione di Friedelrafts; meccanismo, addotti σ, orientamento, reattività. Metallazioni (mercuriazione e talliazione). Reazioni con elettrofili deboli (sali di diazonio, reazione di Reimer Tiemann, reazione di Kolbe, reazione di idrossimetilazione). Trasformazione dei sali di diazonio. Sostituzioni elettrofile aromatiche del naftalene. Reazioni di antracene e fenantrene. Reazioni di riduzione del benzene (con idrogeno, con sodio) e di ossidazione del benzene e di alchilbenzeni, del naftalene, di antracene e fenantrene. Reazioni di sostituzione nucleofila di alogenobenzeni. Meccanismo di addizioneeliminazione e meccanismo di eliminazioneaddizione; benzino. sercizi per iniziare 1. Dare la definizione ed un esempio per ciascuno dei seguenti termini: a) complesso σ; b) solfonazione; c) nitrazione; d) gruppo orto,para orientante; e) alchilazione di Friedelrafts; f) gruppo meta orientante.. Scrivere quale è e come si forma l'elettrofilo nelle seguenti reazioni aromatiche: a) nitrazione; b) clorurazione; c) solfonazione; d) acilazione con cloruro di acetile; e) alchilazione con cloruro di isobutile. sercizi per ricordare le reazioni. ompletare le seguenti reazioni del benzene: a) bromuro di terzbutile All ; b) 1clorobutano All ; c) bromo un chiodo (di ferro... non di acciaio!); d) acido solforico fumante; e) cloruro di benzoile All ; f) acido nitrico acido solforico; g) 1cloro,dimetilpropano All. Scrivere in ogni caso il meccanismo. 4. ompletare le seguenti reazioni dell'isopropilbenzene: a) alla luce; b) Fe ; c) S in acido solforico; d) cloruro di acetile All ; e) cloruro di propile All. 5. ompletare le seguenti reazioni, catalizzate da All : a) clorocicloesano benzene; b) cloruro di metile fenil metil etere; c) cloro,dimetilbutano isopropilbenzene; d) cloropropano nitrobenzene. Dimostrare in ciascun caso l'orientamento, servendosi degli addotti σ. 6. ompletare le seguenti reazioni di sostituzione elettrofila aromatica: a),dimetilanilina cloruro di acetile e cloruro di alluminio; b) clorobenzene bromo e bromuro ferrico; c) propanoato di fenile e acido nitrico acido solforico; d) isopropilbenzene acido solforico ed anidride solforica; e) nitrobenzene acido nitrico ed acido solforico; f) bifenile anidride acetica e cloruro di alluminio. 8
61 7. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si formano: a) metilbenzene cloruro di isobutile All ; b) benzene 1clorobutene e cloruro di alluminio; c) benzene cloruro di butanoile e cloruro di alluminio; d) benzene anidride acetica cloruro di alluminio. 8. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) isopropilbenzene permanganato di potassio (KMn 4 ), a caldo; b) vinilbenzene acido cloridrico; c) metilbenzene cloro, alla luce ultravioletta; d) etilbenzene cloro e cloruro ferrico; e) etilbenzene bromo, a caldo; f) vinilbenzene permanganato di potassio, a caldo; g) metilbenzene 1cloropropano e cloruro di alluminio; h) vinilbenzene (un equivalente) e Pt; i) vinilbenzene e bromo; j) 1,4diidrossimetossibenzene ossido di argento; k) benzene sodio in ammoniaca ed etanolo; l) vinilbenzene (in eccesso) e Pt. 9. Scrivere l'equazione chimica delle seguenti reazioni: a) benzene ossigeno e pentossido di vanadio (V 5 ), ad elevata temperatura; b) antracene anidride cromica (r ) ed acido solforico; c) pbenzendiolo ossido di argento (Ag ); d) propilbenzene permanganato di potassio, a caldo. 10. Scrivere i prodotti delle seguenti reazioni del cloruro di pmetilbenzendiazonio con: a) KI; b) u; c) K; d), a caldo; e) u; f) a, u; g) abf 4 e poi aumentando la temperatura. sercizi per capire le reazioni 11. Scrivere il meccanismo della clorurazione del benzene, mettendo in evidenza il ruolo del catalizzatore. 1. Il pdimetilbenzene si nitra molto più facilmente del benzene. Spiegare. 1. Scrivere il meccanismo della bromurazione aromatica di: a) anilina (= benzenammina); b) etossibenzene. Dimostrare l'orientamento, servendosi degli addotti σ. 14. Spiegare perché il metilbenzene è ortopara orientante, mentre il triclorometilbenzene è meta orientante. 15. Scrivere le reazioni di bromurazione, solfonazione e nitrazione dei seguenti composti, scrivendo in ciascun caso il prodotto (o i prodotti) di reazione ed indicando se la reazione avviene più velocemente o più lentamente della corrispondente reazione del benzene: a) metossibenzene; b) difluorometilbenzene; c) etilbenzene; d) clorobenzene; e) nitrobenzene; f) acido benzensolfonico; g) benzoato di etile; h) difenil etere; i) bifenile; j) terzbutilbenzene; k) fluorobenzene; l) metilbenzene; m) acetato di fenile; n) acetilbenzene (= acetofenone, oppure fenil metil chetone oppure 1 feniletanone); o) benzammide; p) benzonitrile; q) iodobenzene. 9
62 16. In ciascuna delle seguenti serie, ordinare i composti secondo la reattività decrescente nei confronti della sostituzione elettrofila aromatica (spiegare), dopo aver individuato l'orientamento: a) triclorometilbenzene, metilbenzene, diclorometilbenzene, clorometilbenzene; b) etilbenzene, 1,1,1 triclorofeniletano, fenil1,1,1trifluoroetano, 1fenil1,difluoroetano; c) metossibenzene, fenossido di sodio, etanoato di fenile; d) feniletanone, benzammide, benzene. 17. Il nitrobenzene viene trattato con la miscela solfonitrica ( S 4 ). a) Scrivere l'equazione chimica della reazione, dando il nome del prodotto. b) Scrivere il meccanismo, giustificando l'orientamento. c) Prevedere l'ordine di reattività dei seguenti composti nella nitrazione aromatica: nitrobenzene, fenolo, benzene, metilbenzene (spiegare). 18. a) Scrivere l'equazione chimica della reazione che avviene trattando il bromobenzene con acido nitrico acido solforico, giustificando l'orientamento. b) Spiegare l'ordine di reattività che si osserva se, nelle condizioni di (a), si fanno reagire: benzene, bromobenzene, metilbenzene. 19. Disporre i seguenti composti in ordine di reattività crescente nei confronti dell'acido solforico fumante (acido solforico anidride solforica): fenolo, nitrobenzene, metilbenzene, clorobenzene. Scrivere le reazioni corrispondenti e spiegare. 0. Quando il benzoato di fenile viene trattato con un agente nitrante, uno solo degli anelli benzenici reagisce. Dire quale e perché. 1. Il bifenile si può considerare come un benzene con un fenile come sostituente. Dimostrare che la reazione di un elettrofilo con il bifenile avviene con un orientamento orto para.. Il vinilbenzene dà sostituzione elettrofila aromatica molto più facilmente del benzene ed i prodotti sono i derivati orto para. Spiegare, servendosi degli addotti σ.. a) Scrivere l'equazione chimica della reazione che avviene trattando l'acetanilide (= feniletanammide) con bromo e giustificare l'orientamento. b) Spiegare l'ordine di reattività che si osserva se con bromo si fanno reagire: anilina, acetanilide, benzene. 4. Il nitrobenzene viene talvolta usato come solvente nelle alchilazioni di Friedelrafts. Perché il nitrobenzene non interferisce con la reazione desiderata? 5. a) Scrivere l'equazione chimica della reazione che avviene trattando il metilbenzene con cloruro di propanoile e cloruro di alluminio, giustificando l'orientamento. Spiegare l'ordine di reattività che si osserva se, nelle condizioni di (a) si fanno reagire: mdimetilbenzene, metilbenzene, fluorobenzene, benzene. 6. Quale composto in ciascuna delle seguenti coppie è più reattivo nella bromurazione aromatica? (spiegare): a) acetanilide o benzene; b) bromobenzene o metilbenzene; c) pdimetilbenzene o acido 10
63 pmetilbenzoico; d) mdinitrobenzene o mmetilnitrobenzene; e) clorobenzene o mdiclorobenzene; f) metilbenzene o fenolo; g) fenolo o clorobenzene. 7. Il fenolo viene trattato con una soluzione acquosa di bromo; a) scrivere l'equazione chimica della reazione, giustificandone l'orientamento. b) ommentare le condizioni in cui la reazione avviene, confrontandole con quelle necessarie perché la reazione avvenga con il benzene. 8. Dare una spiegazione dei seguenti fatti sperimentali: a) Quando il benzene viene trattato con metilpropene ed acido solforico, si ottiene terzbutilbenzene. b) La nitrazione del cloruro di trimetilanilinio dà un prodotto nitrato in posizione meta. c) Quando l'anilina si tratta con acido nitrico diluito, ad alta temperatura, si ottiene una miscela di orto e paranitroanilina; con acido nitrico concentrato, invece, si ottiene solo la mnitroanilina. d) Quando il benzene si tratta con una quantità equivalente di cloruro di metile e cloruro di alluminio, si ottiene una miscela di benzene, metilbenzene e dimetilbenzeni; quando invece il benzene si tratta con una quantità equivalente di cloruro di acetile e cloruro di alluminio, il solo prodotto di reazione è il feniletanone. e) La bromurazione del terzbutilbenzene non dà prodotto di sostituzione in orto, ma solo in para. 9. Il gruppo nitroso,, come sostituente sul benzene orienta la sostituzione elettrofila aromatica in orto para ed è meno reattivo del benzene. ome potete spiegare questi dati sperimentali? 0. Scrivere i prodotti di mononitrazione dei seguenti composti, giustificando l'orientamento: a) o metilnitrobenzene; b) mclorometilbenzene; c) acido obromobenzoico; d) acido pmetossibenzoico; e) mmetilbenzenolo. 1. L'isopropilbenzene reagisce con il cloro in due modi diversi, a seconda delle condizioni. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene alla luce ultravioletta. b) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene in presenza di cloruro ferrico. a) Scrivere la reazione dell'anilina con il cloruro di pclorobenzendiazionio e spiegare perché questo elettrofilo non reagisce con l'acetanilide (= feniletanammide). b) L'anilina reagisce più velocemente con il cloruro di benzendiazonio o con il cloruro di,4dinitrobenzendiazonio?. L'acido salicilico (= acido oidrossibenzoico) e l'aldeide salicilica (= o idrossibenzencarbaldeide) si preparano dal fenolo. Scrivere le reazioni corrispondenti e spiegare perché gli stessi reagenti non danno reazione con il benzene. 4. a) Scrivere l'equazione chimica ed il meccanismo della nitrazione aromatica del naftalene, giustificandone l'orientamento. b) Scrivere l'equazione chimica ed il meccanismo della solfonazione a bassa temperatura del naftalene. Spiegare perché a temperature più elevate si ottiene un isomero diverso. 11
64 5. A differenza di benzene e naftalene, il fenantrene addiziona una molecola di bromo. Scrivere la reazione e spiegare perché avviene, servendosi delle strutture di risonanza del fenantrene. 6. Per ognuno dei seguenti composti indicare un metodo di preparazione a partire dal benzene: a) acido amminobenzensolfonico; b) mdiamminobenzene; c) pnitroanilina; d) mnitroanilina. 7. ompletare le seguenti reazioni di sostituzione nucleofila aromatica, specificando se avvengono con meccanismo di addizioneeliminazione o di eliminazioneaddizione (via benzino); spiegare il perché della scelta. a) pnitrobromobenzene K; b) mcloronitrobenzene K; c) pdiclorobenzene K (in eccesso); c),4,6trinitroclorobenzene K; d) 4nitroclorobenzene K; e) mclorometilbenzene K; f) pclorometilbenzene K. 8. Scrivere equazione chimica e meccanismo delle seguenti reazioni: a),4dinitroclorobenzene sodioammide; b) 1,dicloro,5dinitrobenzene metossido di sodio (un equivalente) in metanolo; c) 1,dicloro,5dinitrobenzene metossido di sodio (due equivalenti) in metanolo; d) 4 clorometilbenzene K ad elevata temperatura; e) bromometilbenzene dietilammide di litio [= ( ) Li] in dietilammina. 9. Mettere i seguenti composti in ordine di reattività decrescente nei confronti della metanammina (scrivere le reazioni corrispondenti e spiegare): bromonitrobenzene, bromonitrobenzene, 4 bromonitrobenzene,,4dinitrobromobenzene,,4dinitrobromobenzene. 40. Il,4,6trinitroclorobenzene reagisce con a in acqua. a) Scrivere equazione chimica e meccanismo della reazione. b) Il nome corrente del prodotto è "acido picrico", pur trattandosi di un fenolo. ome mai? 41. Il mclorometilbenzene reagisce con sodioammide in ammoniaca liquida, dando tre prodotti isomeri. Scrivere l'equazione chimica della reazione e spiegare la formazione dei tre isomeri, sulla base del meccanismo. sercizi per applicare le reazioni 4. Il 4metossifenilmetanolo contribuisce sia all'aroma della liquerizia che al profumo della lavanda. ome si potrebbe ottenere questo composto a partire dal fenolo? 8. Preparate i seguenti composti, partendo da benzene o da metilbenzene e dai reagenti necessari: a) butilbenzene; b) acido pmetilbenzensolfonico; c) pcloronitrobenzene; d) mcloronitrobenzene; e) metil pmetilfenil chetone. 4. Scrivere i passaggi che permettono di effetturare le seguenti trasformazioni: a) da metilbenzene a bromo4metilanilina; b) da metilbenzene a,5dibromometilbenzene, c) da anilina a,4,6 tricloronitrobenzene; d) da metilbenzene a metil4nitrobenzonitrile; e) da metilbenzene a bromo4iodometilbenzene. 1
65 44. Il defoliante Agent range, usato nella guerra del Vietnam (e che è ritenuto responsabile della malattia e della morte di molti reduci, anche a distanza di anni), contiene l'acido (,4,5 triclorofenossi)etanoico, indicato come,4,5t. Questo acido si prepara per reazione parziale dell'1,,4,5tetraclorobenzene con a, seguita da reazione con cloroacetato di sodio. a) Scrivere la reazione di sintesi del,4,5t. b) Una delle impurezze contenute nell' Agent range (probabilmente il principale componente tossico) era la,,7,8tetraclorodibenzodiossina,,,7,8 TDD, spesso chiamata, impropriamente, diossina. Indicare come,,7,8tdd si forma nel corso della sintesi di,4,5t. c) ome si può eliminare la contaminazione da TDD sia dopo il primo passaggio che alla fine della sintesi? l l l l l,4,5t l l,,7,8tdd 1
66 14/05/014 sercitazione n. 14 Reazioni sulle reazioni di alcheni, alchini e dieni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) butene b) butene acqua, in ambiente acido bromobutano, butanolo. Scrivere le reazioni del metil1pentene con ciascuno dei seguenti reagenti, specificando i nomi dei prodotti che si formano: a) B e poi, ; b) l; c) ; d), in presenza di perossidi; e) I; f) l ; g) Il; h). B (, ) B metil1pentanolo l l clorometilpentano bromometilpentano RR 1bromometilpentano I I iodometilpentano l l l 1,diclorometilpentano 1
67 14/05/014 Il I l cloro1iodometilpentano può essereattaccato da qualsiasi u presente 1,dibromo metilpentano bromo1etossi metilpentano 1bromoetossi metilpentano. Scrivere le equazioni chimiche ed il meccanismo delle seguenti reazioni: a) 1butene I I a) equazione I meccanismo lento I I b) 1metilcicloesene l b) equazione l l meccanismo lento l l
68 14/05/014 c) metilpentene S 4 acquoso c) equazione S 4 meccanismo lento : d) metilpropene con S 4 in etanolo d) equazione S 4 meccanismo lento.. e),dimetilesene con acqua in ambiente acido e) equazione meccanismo lento : f) 1butene I f) equazione Il I I meccanismo Il lento I I I I I
69 14/05/ Scrivere la reazione con, dei seguenti alcheni, specificando i nomi dei composti organici che si formano: a) 1butene; b) metilpropene; c) metilbutene; d) metil1butene. a), butanolo b), metilpropanolo c), metilbutanolo d), metilbutanolo 5. Scrivere le reazioni del etilpentene con ciascuno dei seguenti reagenti, specificando i nomi dei prodotti organici: a) borano e poi, ; b) in ambiente acido; c) ; d) in presenza di perossidi; e) Il. 1. B., Il, RR l I etilpentanolo bromoetilpentano bromoetilpentano bromoetilpentano 4
70 14/05/ ompletare le seguenti reazioni: B e poi, a) propene borano e poi, = B; sostituisce B B ( ) 1propanolo tripropilboro b) metilpentene borano e poi, R B R tri(1isopropil)propilboro metilpentanolo c) 1metilcicloesene borano e poi, metilcicloesanolo 7. Scrivere i prodotti di reazione (specificandone il nome) del bromo con i seguenti alcheni: a) butene addizione elettrofila al doppio legame,dibromobutano b) metilpropene c) metilbutene c) 1,dibromometilpropano,dibromometilbutano 5
71 14/05/ ompletare le seguenti reazioni, specificando il nome di tutti i composti organici che si ottengono: a) cicloesene trans1,dibromocicloesano b) cicloesene, in presenza di perossidi (ATTZI!!! dà addizioni radicaliche agli alcheni ma...) RR bromocicloesene c) metilbutene cloro l l l,diclorometilbutano d) 1butene bromo 1,dibromobutano 9. a) Scrivere il meccanismo della reazione tra metilbutene con acetato mercurico in etanolo. b) Scrivere la reazione tra il prodotto ottenuto in (a) e l'idruro di boro e sodio. g( ) g( ) g( ) δ g g δ g ab 4 6
72 14/05/ ompletare le seguenti reazioni a) 1metilcicloesene acetato mercurico acquoso e poi ab 4 ab 4 g( ) g b) 4clorocicloeptene acetato mercurico in metanolo e poi ab 4 l l l g( ) g l l g ab 4 c) metilpentene acetato mercurico in acido acetico e poi ab 4. g( ) ab 4 g 11. Scrivere le reazioni del metil1pentene con ciascuno dei seguenti reagenti, specificando i nomi dei prodotti che si formano: a), Pt,Pt metilpentano b) D, Pd D, Pd D D 1,dideuterometilpentano c) acido mcloroperbenzoico l 1 metilpropilossaciclopropano 7
73 14/05/014 d) s 4 e poi a S e) KMn 4, s 4 e poi a S KMn 4, metil1,pentandiolo f) KMn 4,, a caldo KMn 4, Δ pentanone 1. a) Scrivere la reazione del metilene con il cicloesene : biciclo[4.1.0]eptano b) scrivere le reazione del cicloesene con cloroformio in ambiente basico acquoso l l l :l :l l l 7,7dimetilbiciclo[4.1.0]eptano 1. ompletare le seguenti reazioni: a) trans1,difeniletene l, a in acqua l a l l b) cicloesene I, Zn(u); I Zn(u) : : c) cisesene, in ambiente basico acquoso : : 8
74 14/05/ ompletare le seguenti reazioni, specificando il nome di tutti i composti organici che si ottengono: a) cicloesene KMn 4,, a freddo KMn 4, b) cicloesene acido perbenzoico cis1,cicloesandio 7ossabiciclo[4.1.0]eptano c) cisesene KMn 4, in ambiente basico, a caldo KMn 4, Δ acido etanoico acido butanoico d) metilpentene e poi Zn,, 1) ) Zn, propanone propanale e) metilpentene e poi 1) ) propanone acido propanoico f) 1pentene cloro l f) l l 1,dicloropentano g) esene ozono, e poi Zn,, 1) g) butanale ) Zn, etanale 9
75 14/05/ ompletare le seguenti reazioni, specificando il nome dei composti organici che si formano: a) butino (un equivalente) transbromobutene ( ),dibromobutano b) butino (un equivalente); c) butino (due equivalenti) trans,dibromobutene,,,tetrabromobutano d) propino sodioammide a (a ) reazione acidobase propinuro (di sodio) 16. Scrivere le reazioni dell'1pentino con i seguenti reagenti, specificando il nome dei prodotti organici: a) un equivalente di cloro; b) due equivalenti di cloro l l l l trans1,dicloro1pentene l l l l 1,1,,tetracloropentano c) due equivalenti di l l l l,dicloropentano d) /Pt; e) /Pd avvelenato /Pd avv. /Pt 1pentene pentano 10
76 14/05/014 f) (un equivalente); g) (due equivalenti) trans1,dibromo1pentene h) l (un equivalente); i) l (due equivalenti) l l l cloro1pentene j) a in ammoniaca liquida 1,1,,tetrabromopentano l l,dicloropentano a in a pentinuro di sodio k),, g,, g pentanone 17. Scrivere le equazioni chimiche, specificando i nomi dei prodotti organici, delle reazioni che avvengono trattando il pentino con i reagenti dell'sercizio 16. a) un equivalente di cloro; b) due equivalenti di cloro l l l l l l l l trans,dicloropentene,,,tetracloropentano c) due equivalenti di l l l l l l,dicloropentano,dicloropentano d) /Pt; e) /Pd avvelenato /Pd avv. /Pt transpentene pentano 11
77 14/05/014 f) (un equivalente); g) (due equivalenti) trans,dibromopentene 1,1,,tetrabromopentano h) (un equivalente); i) (due equivalenti) transbromopentene transbromopentene,dibromopentano,dibromopentano j) a in ammoniaca liquida a in transpentene k),, g,, g pentanone 1
78 14/05/ Scrivere il prodotto (o i prodotti) della reazione (se c'è reazione) tra l'1 butino ed i seguenti reagenti: e) KMn 4, KMn 4, b) /Pt /Pt on c à c) in eccesso (eccesso) d) al al SSUA RAZI e),, g,, g f) /Pd avvelenato /Pd avv. 19. Scrivere i prodotti (specificandone il nome) che si formano per reazione dell'1pentino con: a) un equivalente di ; b) due equivalenti di bromo1pentene,dibromopentano c) un equivalente di, in presenza di perossidi RR 1bromo1pentene rivedere RR 1,1dibromopentano d) bromo, in presenza di perossidi RR SSTITUZI RADIALIA!!. stabilizzato per risonanza e) /Pd avvelenato /Pd avv. 1pentene 1
79 14/05/014 f) a in liquida a in a 1pentinuro di sodio g) /Pt /Pt pentano h) KMn 4, KMn 4, acido butanoico i) Ag( ) ; j) u( ). Ag( ) u( ) Ag u 1pentinuro di argento 1pentinuro di rame 0. Scrivere i prodotti (specificandone il nome) che si formano per reazione del esino con: a) borano, e poi, B B B L!!, esanone b) /Pd disattivato; c) a in ammoniaca liquida esanone /Pd disatt. cisesene a in liq. transesene 14
80 14/05/ ompletare le seguenti reazioni, specificando il nome dei composti organici che si formano: a) ciclopentadiene (un equivalente) = add. 1, add. 1,4 bromociclopentene b),4esadiene (due equivalenti) add. 1, add. 1,4,,4,5tetrabromoesano c) ciclopentadiene anidride maleica (=anidride dell'acido cisbutendioico) addotto di DielsAlder. Scrivere le equazioni chimiche e dare il nome al prodotto (o ai prodotti) delle reazioni dell'1,pentadiene con: a) (in eccesso)/pt (ecc.)/pt pentano b) (un equivalente); c) (due equivalenti),4dibromo1pentene 4,5dibromopentene 1,4dibromopentene 1,,,4tetrabromopentano 15
81 14/05/014 d) l (un equivalente); e) l (due equivalenti) l l 4cloropentene l l l l l,4dicloropentano l l cloro1pentene 1cloropentene l l l l l l l,dicloropentano l l 1,dicloropentano l l 1,dicloropentano f), 1pentenolo pentenolo penten1olo,4pentandiolo,pentandiolo 1,pentandiolo 1,pentandiolo 16
82 14/05/014 sercitazione n. 15 Reazioni e meccanismi dei composti aromatici. 1. Dare la definizione ed un esempio per ciascuno dei seguenti termini: a) complesso σ Intermedio (cationico) nella sostituzione elettrofila aromatica b) solfonazione Sost. lettrofila aromatica ( =S ) che introduce il gruppo acido solfonico (S ) c) nitrazione Sost. lettrofila aromatica ( = ) che introduce il gruppo nitro ( ) d) gruppo orto,para orientante Sostituente presente sull anello benzenico che indirizza l attacco dell elettrofilo in ortopara, stabilizzando gli addotti corrispondenti e) alchilazione di Friedelrafts Sost. lettrofila aromatica ( =R ) che introduce un gruppo alchile (R di RX) f) gruppo meta orientante Sostituente presente sull anello benzenico che indirizza l attacco dell elettrofilo in meta, destabilizzando gli addotti orto e para. Scrivere quale è e come si forma l'elettrofilo nelle seguenti reazioni aromatiche: a) nitrazione; b) clorurazione; c) solfonazione; d) acilazione con cloruro di acetile; e) alchilazione con cloruro di isobutile. v. lezione. ompletare le seguenti reazioni del benzene. Scrivere in ogni caso il meccanismo. a) bromuro di terzbutile All l All l meccanismo: l All All 4 All 4 All l 1
83 14/05/014 b) 1clorobutano All All l meccanismo:... All All l 4 trasposizione... All 4 All 4 All l All 4 All l c) bromo un chiodo (di ferro...non di acciaio!) Fe Fe Fe meccanismo: Fe Fe 4 Fe 4 Fe d) acido solforico fumante S 4 S S S
84 14/05/014 e) cloruro di benzoile All l All l meccanismo: l All All 4 All 4 All l f) acido nitrico acido solforico S 4 meccanismo: S 4 S 4 catione ITRI S 4 S = 4 S 4 S = 4
85 14/05/014 g) 1cloro,dimetilpropano All l All l meccanismo: l All All4 All4 All l 4. ompletare le seguenti reazioni dell'isopropilbenzene: a) alla luce; b) Fe ; c) S in acido solforico; d) cloruro di acetile All ; e) cloruro di propile All. S, hν, S 4 orto, Fe l, S All All l orto 4
86 14/05/ ompletare le seguenti reazioni, catalizzate da All. Dimostrare in ciascun caso l'orientamento, servendosi degli addotti σ. a) clorocicloesano benzene a) l All l tutte le posizioni sono equivalenti b) cloruro di metile fenil metil etere l All.... stabile B. ei compiti (o negli esami scritti) l orientamento DV essere dimostrato come mostrato qui di seguito! l All δ... l... δ All = stabile l l 5
87 14/05/014 c) cloro,dimetilbutano isopropilbenzene l All All4 = stabile stabile d) cloropropano nitrobenzene l All All4 = instabile instabile l 6
88 14/05/ ompletare le seguenti reazioni di sostituzione elettrofila aromatica: a),dimetilanilina cloruro di acetile e cloruro di alluminio l All b) clorobenzene bromo e bromuro ferrico l Fe l l c) propanoato di fenile e acido nitrico acido solforico S 4 d) isopropilbenzene acido solforico ed anidride solforica S S S 4 S e) nitrobenzene acido nitrico ed acido solforico S 4 f) bifenile anidride acetica e cloruro di alluminio ( ) All 7
89 14/05/ ompletare le seguenti reazioni, specificando i nomi dei composti organici che si formano: a) metilbenzene cloruro di isobutile All l All oterzbutilmetilbenzene pterzbutilmetilbenzene poco oisobutilmetilbenzene trasposizione pisobutilmetilbenzene b) benzene 1clorobutene e cloruro di alluminio l All 1fenilbutene fenil1butene l All All4 c) benzene cloruro di butanoile e cloruro di alluminio l All 1fenil1butanone d) benzene anidride acetica cloruro di alluminio All All ( )All feniletanone acetofenone fenil metil chetone 8
90 14/05/ ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) isopropilbenzene permanganato di potassio (KMn4), a caldo KMn 4, Δ acido benzencarbossilico b) vinilbenzene acido cloridrico c) metilbenzene cloro, alla luce l ultravioletta l l, hν 1cloro1feniletano cloruro di benzile d) etilbenzene cloro e cloruro ferrico l l Fel ocloroetilbenzene l pcloroetilbenzene e) etilbenzene bromo, a caldo Δ 1bromo1feniletano f) vinilbenzene permanganato di potassio, a caldo KMn 4, Δ acido benzencarbossilico g) metilbenzene 1cloropropano e cloruro di alluminio l All ometilpropilbenzene oisopropilmetilbenzene pmetilpropilbenzene pisopropilmetilbenzene 9
91 14/05/014 h) vinilbenzene (un equivalente) e Pt i) vinilbenzene e bromo Pt etilbenzene 1,dibromo1fenilbenzene j) 1,4diidrossimetossibenzene ossido di argento Ag metossi1,4benzochinone k) benzene sodio in ammoniaca ed etanolo a in 1,4cicloesadiene l) vinilbenzene (in eccesso) e Pt (eccesso) Pt etilcicloesano 9. Scrivere l'equazione chimica delle seguenti reazioni: a) benzene ossigeno e pentossido di vanadio (V 5 ), ad elevata temperatura V 5 Δ 10
92 14/05/014 b) antracene anidride cromica (r ) ed acido solforico r S 4 c) pbenzendiolo ossido di argento (Ag ) Ag d) propilbenzene permanganato di potassio, a caldo. KMn Scrivere i prodotti delle seguenti reazioni del cloruro di p metilbenzendiazonio con: a) KI l KI I b) u l u c) K l K d), a caldo l Δ e) u l u f) a, u l a, u 11
93 14/05/ Scrivere il meccanismo della clorurazione del benzene, mettendo in evidenza il ruolo del catalizzatore. l l Fel Fel 4 l l l l Fel 4 l Fel 1. Il pdimetilbenzene si nitra molto più facilmente del benzene. Spiegare. tutte le posizioni sono identiche; l'addotto σ è stabilizzato dalla presenza del metile in orto 1. Scrivere il meccanismo della bromurazione aromatica di: Dimostrare l'orientamento, servendosi degli addotti σ. a) anilina (= benzenammina) Fe Fe 4 Fe 4 Fe Fe 4 Fe 1
COMPOSTI AROMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti.
 MPSTI ARMATII L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. aratteristiche Spettrali La maggior parte dei composti aromatici Spettrometria
MPSTI ARMATII L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. aratteristiche Spettrali La maggior parte dei composti aromatici Spettrometria
Esercitazione n Reazioni e meccanismi dei composti aromatici.
 sercitazione n. 1 Reazioni e meccanismi dei composti aromatici.. Scrivere il meccanismo della clorurazione del benzene, mettendo in evidenza il ruolo del catalizzatore. Fe Fe Fe Fe. Il pdimetilbenzene
sercitazione n. 1 Reazioni e meccanismi dei composti aromatici.. Scrivere il meccanismo della clorurazione del benzene, mettendo in evidenza il ruolo del catalizzatore. Fe Fe Fe Fe. Il pdimetilbenzene
Esercitazione n Reazioni e meccanismi dei composti aromatici.
 Esercitazione n. 15 Reazioni e meccanismi dei composti aromatici. 1. Dare la definizione ed un esempio per ciascuno dei seguenti termini: a) complesso σ Intermedio (cationico) nella sostituzione elettrofila
Esercitazione n. 15 Reazioni e meccanismi dei composti aromatici. 1. Dare la definizione ed un esempio per ciascuno dei seguenti termini: a) complesso σ Intermedio (cationico) nella sostituzione elettrofila
CICLOALCHENI. legame π C. Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico +. + R CH + CH 2 CH CH 2
 ALENI ILALENI ARATTERISTIA FUNZINALE: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R 2 2 2
ALENI ILALENI ARATTERISTIA FUNZINALE: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R 2 2 2
ALCHENI CICLOALCHENI. Spettrometria di massa. UV-visibile CH CH CH 2 CH CH 2 R CH + CH 2 CARATTERISTICA FUNZIONALE: legame π C
 ALENI ILALENI ARATTERISTIA FUNZINALE: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R 2 2 2
ALENI ILALENI ARATTERISTIA FUNZINALE: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R 2 2 2
ALCHINI. Spettrometria di massa C CH 2 R. + CARATTERISTICA FUNZIONALE: legame π. Caratteristiche Spettrali
 AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico 2 +. +. + + 2 2 2
AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico 2 +. +. + + 2 2 2
ALCHINI. legame π. Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico +. + R. +
 AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 9, che corrisponde al carbocatione propargilico.. 2 2 2 1-ottino 4-ottino
AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 9, che corrisponde al carbocatione propargilico.. 2 2 2 1-ottino 4-ottino
CHIMICA ORGANICA I. 3. Scrivere il meccanismo della clorurazione del benzene, mettendo in evidenza il ruolo del catalizzatore.
 CHIMICA RGANICA I Corso di laurea in CHIMICA (LT) Esercitazione n. 14 - Reazioni e meccanismi dei composti aromatici. TERMINI ED ARGMENTI PER L SVLGIMENT DEGLI ESERCIZI DI QUEST FGLI: Reazione di sostituzione
CHIMICA RGANICA I Corso di laurea in CHIMICA (LT) Esercitazione n. 14 - Reazioni e meccanismi dei composti aromatici. TERMINI ED ARGMENTI PER L SVLGIMENT DEGLI ESERCIZI DI QUEST FGLI: Reazione di sostituzione
COMPOSTI AROMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti.
 CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. Caratteristiche Spettrali Spettrometria di massa La maggior parte
CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. Caratteristiche Spettrali Spettrometria di massa La maggior parte
COMPOSTI AROMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti.
 CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. Caratteristiche Spettrali Spettrometria di massa La maggior parte
CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. Caratteristiche Spettrali Spettrometria di massa La maggior parte
COMPOSTI AROMATICI. L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti.
 CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. UVvisibile Il benzene ha legami π coniugati Lo spettro di assorbimento
CMPSTI ARMATICI L aromaticità è l aspetto strutturale determinante per le caratteristiche spettrali e di reattività di questi composti. UVvisibile Il benzene ha legami π coniugati Lo spettro di assorbimento
CHIMICA ORGANICA I. Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI
 CHIMICA RGANICA I Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI Esercitazione n. 14 - Reazioni di alcheni, alchini e dieni. TERMINI ED ARGMENTI PER L SVLGIMENT DEGLI ESERCIZI DI
CHIMICA RGANICA I Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI Esercitazione n. 14 - Reazioni di alcheni, alchini e dieni. TERMINI ED ARGMENTI PER L SVLGIMENT DEGLI ESERCIZI DI
Esercitazione - Reazioni sulle reazioni di alcheni. Completare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: CH 3
 Esercitazione - Reazioni sulle reazioni di alcheni. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) 2-butene b) 2-butene acqua, in ambiente acido 2-bromobutano
Esercitazione - Reazioni sulle reazioni di alcheni. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) 2-butene b) 2-butene acqua, in ambiente acido 2-bromobutano
ALCHENI ALCHINI, ALCADIENI, CICLOALCHENI, CICLOALCADIENI ADDIZIONE
 ALNI ALINI, ALADINI, ILALNI, ILALADINI ARATTRISTIA FUNZINAL: legame π Più debole del legame σ, è il punto debole degli alcheni. la rottura del legame π porta a due valenze libere sui due atomi di, che
ALNI ALINI, ALADINI, ILALNI, ILALADINI ARATTRISTIA FUNZINAL: legame π Più debole del legame σ, è il punto debole degli alcheni. la rottura del legame π porta a due valenze libere sui due atomi di, che
1. Completare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: CH 3
 Esercitazione n. 14 Reazioni sulle reazioni di alcheni, alchini e dieni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) 2butene b) 2butene acqua, in ambiente
Esercitazione n. 14 Reazioni sulle reazioni di alcheni, alchini e dieni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) 2butene b) 2butene acqua, in ambiente
Esercitazione n Reazioni sulle reazioni di alcheni, alchini e dieni.
 Esercitazione n. 1 Reazioni sulle reazioni di alcheni, alchini e dieni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) butene b) butene acqua, in ambiente
Esercitazione n. 1 Reazioni sulle reazioni di alcheni, alchini e dieni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) butene b) butene acqua, in ambiente
Esercitazione n Reazioni sulle reazioni di alcheni.
 Esercitazione n. 1 - Reazioni sulle reazioni di alcheni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) -butene b) -butene acqua, in ambiente acido -bromobutano,
Esercitazione n. 1 - Reazioni sulle reazioni di alcheni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) -butene b) -butene acqua, in ambiente acido -bromobutano,
1. Completare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: CH 3 O, H +
 Esercitazione n. 14 - Reazioni sulle reazioni di alcheni, alchini e dieni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) 2-butene b) 2-butene acqua,
Esercitazione n. 14 - Reazioni sulle reazioni di alcheni, alchini e dieni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) 2-butene b) 2-butene acqua,
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
CHIMICA ORGANICA II. Corso di laurea in CHIMICA (LT)
 IMIA RGAIA II orso di laurea in IMIA (LT) Esercitazione n. 4 - Formazione di legami - (I) 1. Scrivere i prodotti delle seguenti reazioni indicare il nuovo legame carbonio-carbonio formato ed identificare
IMIA RGAIA II orso di laurea in IMIA (LT) Esercitazione n. 4 - Formazione di legami - (I) 1. Scrivere i prodotti delle seguenti reazioni indicare il nuovo legame carbonio-carbonio formato ed identificare
Addizioni nucleofile. Addizioni a C=O
 Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Reazioni Stereospecifiche e Stereoselettive
 Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
ALCHENI: Reazioni del doppio legame
 ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
Aromaticità. Addizione elettrofila alcheni
 Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
DIENI CONIUGATI. ADDIZIONE DI HCl. addotto 1,2
 DIENI NIUGATI I dieni coniugati sono diversi dai dieni isolati perché hanno lunghezze anomale dei legami e perché sono più stabili termodinamicamente dato che liberano meno energia nella reazione di idrogenazione
DIENI NIUGATI I dieni coniugati sono diversi dai dieni isolati perché hanno lunghezze anomale dei legami e perché sono più stabili termodinamicamente dato che liberano meno energia nella reazione di idrogenazione
1. Scrivere la formula di struttura di tutti i possibili isomeri aventi le seguenti formule molecolari: a. C 5 H 12 ; b. C 2 H 5 Cl; c. C 4 H 10 O.
 1. Scrivere la formula di struttura di tutti i possibili isomeri aventi le seguenti formule molecolari: a. C 5 12 ; b. C 2 5 Cl; c. C 4 10. 2. Scrivere la formula di struttura dei seguenti composti: a.
1. Scrivere la formula di struttura di tutti i possibili isomeri aventi le seguenti formule molecolari: a. C 5 12 ; b. C 2 5 Cl; c. C 4 10. 2. Scrivere la formula di struttura dei seguenti composti: a.
M i n i s t e r o d e l l I s t r u z i o n e, d e l l U n i v e r s i t à e d e l l a R i c e r c a
 PROGRAMMA SVOLTO DOCENTE: Campani Maria Varini Simone A.S: 2018/2019 DISCIPLINA: Chimica organica e biochimica CLASSE: 3^A CHI MAT Per ogni Tema svolto vengono indicati i relativi contenuti. LEGAME CHIMICO
PROGRAMMA SVOLTO DOCENTE: Campani Maria Varini Simone A.S: 2018/2019 DISCIPLINA: Chimica organica e biochimica CLASSE: 3^A CHI MAT Per ogni Tema svolto vengono indicati i relativi contenuti. LEGAME CHIMICO
Esercitazione n Reazioni e meccanismi di aldeidi e chetoni.
 19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Benzene e Composti Aromatici
 Benzene e Composti Aromatici Contenuti della lezione: Il benzene e i requisiti per l aromaticità Nomenclatura di benzeni mono- e di-sostituiti Composti aromatici diversi dal benzene: IPA e eteroaromatici
Benzene e Composti Aromatici Contenuti della lezione: Il benzene e i requisiti per l aromaticità Nomenclatura di benzeni mono- e di-sostituiti Composti aromatici diversi dal benzene: IPA e eteroaromatici
Complementi di Chimica Organica. Composti Aromatici: Benzene C 6 H 6 (1825) (1865) Friedrich August Kekulé
 Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Reazioni degli alcani
 Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
COMPOSTI AROMATICI. Formula C 6 H 6
 COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
Alchini. Suffisso: -ino. d. H 3 CCH 2 CC CH
 Alchini Suffisso: -ino Indicare la posizione del triplo legame con il numero che lo contraddistingue nella catena. La numerazione comincia sempre dall estremità più prossima al triplo legame. 3 3 2 2 2
Alchini Suffisso: -ino Indicare la posizione del triplo legame con il numero che lo contraddistingue nella catena. La numerazione comincia sempre dall estremità più prossima al triplo legame. 3 3 2 2 2
IDROCARBURI INSATURI: GLI ALCHENI HANNO ALMENO UN DOPPIO LEGAME NELLA STRUTTURA NOMENCLATURA: RADICE COME NEGLI IDROCARBURI, DESINENZA -ENE
 IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
REGISTRO DELLE LEZIONI 2005/2006. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso, libri di testo esami e propedeuticità La struttura elettronica dell'atomo, gli orbitali, tipi di legami, regola dell'ottetto Ibridizzazione strutture di Lewis, carica formale,
Presentazione del corso, libri di testo esami e propedeuticità La struttura elettronica dell'atomo, gli orbitali, tipi di legami, regola dell'ottetto Ibridizzazione strutture di Lewis, carica formale,
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Capitolo 4 Reazioni degli alcheni
 himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
Reattività degli Alcheni. Addizione elettrofila
 Reattività degli Alcheni Addizione elettrofila Reattività degli alcheni Abbiamo visto che il gruppo funzionale che caratterizza un alchene è il doppio legame carbonio-carbonio. Tutti i composti che presentano
Reattività degli Alcheni Addizione elettrofila Reattività degli alcheni Abbiamo visto che il gruppo funzionale che caratterizza un alchene è il doppio legame carbonio-carbonio. Tutti i composti che presentano
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni
 Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni δ - X δ X = F, l, o I Dato il carattere elettrofilo del carbonio alogeno sostituito, buona parte della chimica degli
Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni δ - X δ X = F, l, o I Dato il carattere elettrofilo del carbonio alogeno sostituito, buona parte della chimica degli
Stabilità. 1. più sostituito = più stabile. 2. trans più stabile del cis; E più stabile del Z. II. Relazione struttura-reattività R C R R R
 Alcheni 1 II. Relazione struttura-reattività 1. più sostituito = più stabile Stabilità R R R R R > > R R, R 2 2 > R 2 > R R 2 2 2. trans più stabile del cis; E più stabile del Z repulsione trans-2-butene
Alcheni 1 II. Relazione struttura-reattività 1. più sostituito = più stabile Stabilità R R R R R > > R R, R 2 2 > R 2 > R R 2 2 2. trans più stabile del cis; E più stabile del Z repulsione trans-2-butene
2) Scrivere il nome sistematico per i composti elencati di seguito:
 Chimica Organica Alcheni 1) Disegnare la struttura per le molecole elencate: a. 3,3- dimetilciclopentene c. etil vinil etere b. 6- bromo- 2,3- dimetil- 2- esene d. allil alcol 2) Scrivere il nome sistematico
Chimica Organica Alcheni 1) Disegnare la struttura per le molecole elencate: a. 3,3- dimetilciclopentene c. etil vinil etere b. 6- bromo- 2,3- dimetil- 2- esene d. allil alcol 2) Scrivere il nome sistematico
Stabilità del benzene (entalpie di idrogenazione) Energia di risonanza
 La chimica del benzene e dei suoi derivati I derivati del benzene vengono chiamati composti aromatici poiché inizialmente vennero isolati dal catrame nel 1800 ed erano caratterizzati da un odore aromatico.
La chimica del benzene e dei suoi derivati I derivati del benzene vengono chiamati composti aromatici poiché inizialmente vennero isolati dal catrame nel 1800 ed erano caratterizzati da un odore aromatico.
Esercitazione n Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio.
 Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N 2 a) 1-propanolo b) 2-propanolo
Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N 2 a) 1-propanolo b) 2-propanolo
BENZENE E DERIVATI. Composto aromatico: termine usato per indicare il benzene ed i suoi derivati C 6 H 6. Arene: Idrocarburo aromatico
 BENZENE E DERIVATI Composto aromatico: termine usato per indicare il benzene ed i suoi derivati C 6 H 6 Arene: Idrocarburo aromatico Gruppo arilico: gruppo sostituente che deriva da un arene per rimozione
BENZENE E DERIVATI Composto aromatico: termine usato per indicare il benzene ed i suoi derivati C 6 H 6 Arene: Idrocarburo aromatico Gruppo arilico: gruppo sostituente che deriva da un arene per rimozione
Esercitazione n Reazioni degli alcani
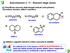 Esercitazione n 11 - Reazioni degli alcani 1 assificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o benzilico: a) ( ) C b) ( ) CH c) H primario d) e) terziario H H
Esercitazione n 11 - Reazioni degli alcani 1 assificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o benzilico: a) ( ) C b) ( ) CH c) H primario d) e) terziario H H
Unità didattica 7 (segue) Reattività del benzene. Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili
 Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
Unità didattica 7 (segue) Reattività del benzene Il benzene è ricco di eletroni π, per cui è un nucleofilo che reagisce con gli elettrofili Se avvenisse anche il secondo stadio dell addizione, il benzene
CHIMICA ORGANICA I. Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI
 CHIMICA RGANICA I Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI Esercitazione n. 11 - Reazioni degli alogenuri alchilici. TERMINI ED ARGMENTI PER L SVLGIMENT DEGLI ESERCIZI DI QUEST
CHIMICA RGANICA I Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI Esercitazione n. 11 - Reazioni degli alogenuri alchilici. TERMINI ED ARGMENTI PER L SVLGIMENT DEGLI ESERCIZI DI QUEST
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio.
 La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
Composti aromatici. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Composti aromatici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Composti aromatici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
REATTIVITA DEI BENZENI SOSTITUITI
 REATTIVITA DEI BENZENI SOSTITUITI 1) Sostituzione radicalica di idrogeni benzilici Reazioni dei sostituenti presenti sull anello benzenico Reazioni dei sostituenti presenti sull anello benzenico 2) Reazioni
REATTIVITA DEI BENZENI SOSTITUITI 1) Sostituzione radicalica di idrogeni benzilici Reazioni dei sostituenti presenti sull anello benzenico Reazioni dei sostituenti presenti sull anello benzenico 2) Reazioni
CHIMICA ORGANICA I. Corso di laurea in CHIMICA (LT)
 CHIMICA RGANICA I Corso di laurea in CHIMICA (LT) Esercitazione n. 13 - Reazioni di alcheni, alchini e dieni. TERMINI ED ARGMENTI PER L SVLGIMENT DEGLI ESERCIZI DI QUEST FGLI: Reazioni degli alcheni. Addizioni
CHIMICA RGANICA I Corso di laurea in CHIMICA (LT) Esercitazione n. 13 - Reazioni di alcheni, alchini e dieni. TERMINI ED ARGMENTI PER L SVLGIMENT DEGLI ESERCIZI DI QUEST FGLI: Reazioni degli alcheni. Addizioni
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
Idrocarburi AROMATICI
 Idrocarburi AROMATICI Composti aromatici Gli idrocarburi aromatici costituiscono una particolare classe di composti che contengono 2n 1 doppi legami coniugati in una struttura ciclica, strutturalmente
Idrocarburi AROMATICI Composti aromatici Gli idrocarburi aromatici costituiscono una particolare classe di composti che contengono 2n 1 doppi legami coniugati in una struttura ciclica, strutturalmente
Idrocarburi Saturi. Reazioni
 Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
DIENI CONIUGATI. ADDIZIONE DI HCl. addotto 1,2 80% 20%
 DIENI NIUGATI wwwpianetachimicait I dieni coniugati sono diversi dai dieni isolati perché hanno lunghezze anomale dei legami e perché sono più stabili termodinamicamente dato che liberano meno energia
DIENI NIUGATI wwwpianetachimicait I dieni coniugati sono diversi dai dieni isolati perché hanno lunghezze anomale dei legami e perché sono più stabili termodinamicamente dato che liberano meno energia
Unità didattica 6. Cosa è una sostutizione? Reazioni di Sostituzione degli Alogenuri Alchilici
 Cosa è una sostutizione? Unità didattica 6 Reazioni di Sostituzione degli Alogenuri Alchilici Capitolo 7 e 8 di Brown e Poon L atomo o il gruppo che è sostituito o eliminato in queste reazioni è detto
Cosa è una sostutizione? Unità didattica 6 Reazioni di Sostituzione degli Alogenuri Alchilici Capitolo 7 e 8 di Brown e Poon L atomo o il gruppo che è sostituito o eliminato in queste reazioni è detto
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione
 Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Gruppi funzionali. aldeidi
 Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Alcheni: : struttura e reattività. Alcheni. Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n. H 2n. Alcheni in biologia
 Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
REAZIONI E LORO MECCANISMI
 REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
R-X ALOGENURI ALCHILICI. F Cl Br I. Nomenclatura. In genere si indicano con. + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo
 ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
Capitolo 8 Alcoli e Fenoli
 Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
Autonomia di giudizio Capacità di razionalizzare e prevedere le possibili trasformazioni di composti organici di interesse biologico e farmaceutico.
 ANNO ACCADEMICO: 2018-2019 INSEGNAMENTO/MODULO: CHIMICA ORGANICA/Modulo A TIPOLOGIA DI ATTIVITÀ FORMATIVA: Base DOCENTE: Prof. Rocco Racioppi e-mail rocco.racioppi@unibas.it sito web: telefono: 0971205494
ANNO ACCADEMICO: 2018-2019 INSEGNAMENTO/MODULO: CHIMICA ORGANICA/Modulo A TIPOLOGIA DI ATTIVITÀ FORMATIVA: Base DOCENTE: Prof. Rocco Racioppi e-mail rocco.racioppi@unibas.it sito web: telefono: 0971205494
Pronti per l Università Liceo Scientifico de Caprariis Atripalda PON F
 Pronti per l Università Liceo Scientifico de Caprariis Atripalda PON F2 2011-14 La chimica del carbonio Il Carbonio Copyright 2008 PresentationFx.com Redistribution Prohibited Image 2008 clix@sxc.hu This
Pronti per l Università Liceo Scientifico de Caprariis Atripalda PON F2 2011-14 La chimica del carbonio Il Carbonio Copyright 2008 PresentationFx.com Redistribution Prohibited Image 2008 clix@sxc.hu This
RADICALI: struttura e geometria. Organic Chemistry, 2 ed. David Klein, Wiley
 RADICALI: struttura e geometria Rottura di legame eterolitica Rottura di legame omolitica Due elettroni Un elettrone Organic Chemistry, 2 ed. David Klein, Wiley RADICALI: struttura e geometria Rottura
RADICALI: struttura e geometria Rottura di legame eterolitica Rottura di legame omolitica Due elettroni Un elettrone Organic Chemistry, 2 ed. David Klein, Wiley RADICALI: struttura e geometria Rottura
CHIMICA ORGANICA. Gli idrocarburi aromatici
 1 D-IDROCARBURI AROMATICI CHIMICA ORGANICA IDROCARBURI AROMATICI Formula generale C n H n Desinenza -benzene Gli idrocarburi aromatici Gli idrocarburi aromatici (areni o alchilbenzeni) sono caratterizzati
1 D-IDROCARBURI AROMATICI CHIMICA ORGANICA IDROCARBURI AROMATICI Formula generale C n H n Desinenza -benzene Gli idrocarburi aromatici Gli idrocarburi aromatici (areni o alchilbenzeni) sono caratterizzati
Figura. Alogenuri alchilici
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni Alogenuri alchilici: nomenclatura Alogenuri
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni Alogenuri alchilici: nomenclatura Alogenuri
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati 1 Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni 2 Alogenuri alchilici: nomenclatura Alogenuri
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati 1 Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni 2 Alogenuri alchilici: nomenclatura Alogenuri
Reazioni degli Alcheni
 Prof Mauro Tonellato Itis Natta Padova Reazioni degli Alcheni Indice delle reazioni: 1) Addizione di acidi alogenidrici 2) Addizione di acqua ) Idrogenazione catalitica 4) Addizione radicalica di 5) Alogenazione
Prof Mauro Tonellato Itis Natta Padova Reazioni degli Alcheni Indice delle reazioni: 1) Addizione di acidi alogenidrici 2) Addizione di acqua ) Idrogenazione catalitica 4) Addizione radicalica di 5) Alogenazione
È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica
 aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
PROGRAMMA SVOLTO ANNO SCOLASTICO 2018/2019
 Nome docenti Materia insegnata Classe Testi adottati Dispense e materiali forniti dal docente Stefano BOTTIGLIENGO, Giuseppe SURANO CHIMICA ORGANICA E BIOCHIMICA 4EI (Istituto: Tecnico - Settore: Tecnologico
Nome docenti Materia insegnata Classe Testi adottati Dispense e materiali forniti dal docente Stefano BOTTIGLIENGO, Giuseppe SURANO CHIMICA ORGANICA E BIOCHIMICA 4EI (Istituto: Tecnico - Settore: Tecnologico
H H. R R δ+ R H. δ Cl
 Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
Guida alla soluzione dei problemi da Chimica organica di Brown, Iverson, Anslyn, Foote
 B. L. Iverson S. Iverson Guida alla soluzione dei problemi da Chimica organica di Brown, Iverson, Anslyn, Foote IV edizione Titolo originale: Brown, Iverson, Anslyn, Foote Student Study Guide and Solutions
B. L. Iverson S. Iverson Guida alla soluzione dei problemi da Chimica organica di Brown, Iverson, Anslyn, Foote IV edizione Titolo originale: Brown, Iverson, Anslyn, Foote Student Study Guide and Solutions
I.T.I.S. VOLTA - Perugia A. S. 2011/2012 CLASSE 3 a sez. AC MATERIA: Chimica Organica Bio-Org. delle Fermentazione e Lab.
 I.T.I.S. VOLTA - Perugia A. S. 2011/2012 CLASSE 3 a sez. AC MATERIA: Chimica Organica Bio-Org. delle Fermentazione e Lab. (Esercizi da svolgere durante il periodo estivo) Strumento da utilizzare: libro
I.T.I.S. VOLTA - Perugia A. S. 2011/2012 CLASSE 3 a sez. AC MATERIA: Chimica Organica Bio-Org. delle Fermentazione e Lab. (Esercizi da svolgere durante il periodo estivo) Strumento da utilizzare: libro
Esercitazione n Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio.
 09/05/01 Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N a) 1-propanolo b) -propanolo
09/05/01 Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N a) 1-propanolo b) -propanolo
Esercitazione n Reazioni acido-base. 3. Nelle seguenti reazioni acido-base individuare l'acido e la base: H NH
 Esercitazione n 10 Reazioni acidobase Nelle seguenti reazioni acidobase individuare l'acido e la base: 1) N : 2 N 4 2 2) N 4 2 N ) 2 2 2 BASE 4) BASE AID AID AID BASE N N BASE AID 2 6) 5) 2 AID BASE N
Esercitazione n 10 Reazioni acidobase Nelle seguenti reazioni acidobase individuare l'acido e la base: 1) N : 2 N 4 2 2) N 4 2 N ) 2 2 2 BASE 4) BASE AID AID AID BASE N N BASE AID 2 6) 5) 2 AID BASE N
Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica.
 Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica. 1. Scrivere la formula condensata per la molecola seguente: Br e la
Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica. 1. Scrivere la formula condensata per la molecola seguente: Br e la
Alcheni. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcheni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcheni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
COMPOSTI AROMATICI POLICICLICI
 CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
5. Addizione di acidi ipoalosi
 IV. Addizione Elettrofila 5. Addizione di acidi ipoalosi loro acquoso è in equilibrio con acido ipocloroso e acido cloridrico, K eq 10-4. La concentrazione di l può essere aumentata aggiungendo Ag. l 2
IV. Addizione Elettrofila 5. Addizione di acidi ipoalosi loro acquoso è in equilibrio con acido ipocloroso e acido cloridrico, K eq 10-4. La concentrazione di l può essere aumentata aggiungendo Ag. l 2
+ + H 2 O NH 3 + H 3 2) NH 4 O + O + + CH 3 3) H 2 H H 3 O + CH 3. Esercitazione n Reazioni acido-base. ACIDO ACIDO ACIDO O + H H 2
 Esercitazione n. 10 Reazioni acidobase. 3. Nelle seguenti reazioni acidobase individuare l'acido e la base: 1) N : 3 2 N 4 2 2) N 4 2 N 3 3 3) 2 2 3 2 BASE 4) BASE AID AID AID BASE N N BASE AID 2 6) 5)
Esercitazione n. 10 Reazioni acidobase. 3. Nelle seguenti reazioni acidobase individuare l'acido e la base: 1) N : 3 2 N 4 2 2) N 4 2 N 3 3 3) 2 2 3 2 BASE 4) BASE AID AID AID BASE N N BASE AID 2 6) 5)
Gli Alcheni. Ibridazione sp 2. I legami chimici degli alcheni
 Gli Alcheni 2p Energia Ibridazione sp 2 sp 2 1s I tre orbitali ibridi sono disposti su un piano secondo una geometria trigonaleplanare con angoli di 120. L'orbitale 2p che non partecipa all'ibridazione
Gli Alcheni 2p Energia Ibridazione sp 2 sp 2 1s I tre orbitali ibridi sono disposti su un piano secondo una geometria trigonaleplanare con angoli di 120. L'orbitale 2p che non partecipa all'ibridazione
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Sistema i seguenti carbocationi in ordine di stabilità crescente:
 Sistema i seguenti carbocationi in ordine di stabilità crescente: C 2 + + + Completa le seguenti reazioni: 3 C C C 2 + C 2 + + Disegna le formule di struttura per i carbocationi isomerici formati per reazione
Sistema i seguenti carbocationi in ordine di stabilità crescente: C 2 + + + Completa le seguenti reazioni: 3 C C C 2 + C 2 + + Disegna le formule di struttura per i carbocationi isomerici formati per reazione
