Marinella Bosetto Irene Lozzi. Elementi di biochimica agraria
|
|
|
- Fabio Alfieri
- 8 anni fa
- Visualizzazioni
Transcript
1 A07 25
2
3 Marinella Bosetto Irene Lozzi Elementi di biochimica agraria
4 Copyright MMVI ARACNE editrice S.r.l. via Raffaele Garofalo, 133 A/B Roma (06) ISBN I diritti di traduzione, di memorizzazione elettronica, di riproduzione e di adattamento anche parziale, con qualsiasi mezzo, sono riservati per tutti i Paesi. Non sono assolutamente consentite le fotocopie senza il permesso scritto dell Editore. I edizione: settembre 2006
5 Indice Capitolo I Introduzione allo studio della biochimica 7 Capitolo II Gli amminoacidi 17 Capitolo III Le proteine 31 Capitolo IV Gli enzimi 47 Capitolo V Principi di bioenergetica 75 Capitolo VI I carboidrati 95 Capitolo VII Il processo respiratorio 117 Capitolo VIII Il ciclo dell acido citrico 135 Capitolo IX La fosforilazione ossidativa 153 Capitolo X Gluconeogenesi e via dei pentosi fosfati 167 Capitolo XI La fotosintesi 179 5
6 6 Indice Capitolo XII I lipidi 225 Capitolo XIII Metabolismo dei lipidi 245 Capitolo XIV Il metabolismo dell azoto 267 Capitolo XV Nucleotidi ed acidi nucleici 289 Capitolo XVI La sintesi proteica 303 Capitolo XVII Composti fenolici delle piante 315 Capitolo XVIII Terpeni e terpenoidi 329 Capitolo XIX Gli alcaloidi 331 Bibliografia 343
7 INTRODUZIONE ALLO STUDIO DELLA BIOCHIMICA La biochimica studia la costituzione chimica degli esseri viventi, le funzioni fisiologiche dei loro prodotti e le trasformazioni chimiche che avvengono a carico di questi e che sono alla base della vita. I sistemi viventi si differenziano dal mondo inanimato per certe peculiari proprietà: possono crescere, muoversi, costruire un metabolismo, rispondere a stimoli provenienti dall ambiente e soprattutto sono in grado di replicare se stessi con eccezionale fedeltà. Gli organismi viventi sono composti da un gran numero di molecole organiche che di per sè stesse sarebbero inerti ma che, riunite in aggregati di un determinato peso molecolare e di idonea complessità, in particolari condizioni possono dare origine a quel complesso sistema di reazioni che prende il nome di vita. Nonostante le molteplici forme in cui si manifesta la vita, l intrico delle strutture biologiche più diverse e la complessità dei meccanismi vitali, le funzioni della vita possono essere interpretate in termini chimici. I costituenti cellulari, o biomolecole, seguono i principi chimici e fisici che governano la materia inanimata. In questo primo capitolo verranno riportate in breve le caratteristiche degli esseri viventi, le principali classi di biomolecole, cioè delle molecole necessarie alla vita e verranno illustrati i fondamenti del metabolismo cellulare. Le singole vie metaboliche, la produzione ed il consumo di energia e le caratteristiche ed il funzionamento dei catalizzatori biologici, gli enzimi, verranno riportati per esteso nei prossimi capitoli. Esaminando attentamente le caratteristiche degli esseri viventi, che li distinguono da un complesso inanimato di molecole come per e- sempio una roccia, vediamo che: 1) sono formati da cellule, che ne sono le unità costitutive fondamentali. Tutti gli organismi viventi sono organizzati su base cellulare; 2) sono sistemi altamente organizzati ed ordinati, le cui strutture interne sono costituite da molti tipi di molecole diverse; 3) sono capaci di costruire strutture molecolari ordinate a partire da materiali più disordinati; 7
8 8 Capitolo I 4) possono estrarre energia dall ambiente, di solito sotto forma di sostanze chimiche nutrienti, e in tal caso si dicono chemiotrofi, oppure utilizzando la luce solare (fototrofi), e sono in grado di utilizzarla trasformandola da una forma in un altra; 5) si mantengono uguali anche al variare delle condizioni chimiche o ambientali; 6) reagiscono agli stimoli e a perturbazioni provenienti dall ambiente o prodotte da essi stessi, e possono agire per ripristinare l equilibrio alterato; 7) sono capaci di riprodursi, cioè di costruire copie di loro stessi che possono essere identiche o diverse; 8) sono capaci di evolversi: i processi di riproduzione, caratterizzati da ricombinazione del materiale genetico, possono dare o- rigine a progenie diversa dai genitori. 9) hanno la capacità di adattarsi all ambiente; 10) si accrescono e si sviluppano; 11) l informazione per ogni loro caratteristica ed attività è contenuta all interno della cellula. Metaboliti e macromolecole I precursori principali per la formazione di biomolecole sono: l acqua (H 2 O), l anidride carbonica (CO 2 ) e tre composti inorganici dell azoto, lo ione ammonio (NH 4 + ), il nitrato (NO 3 - ) e l azoto molecolare (N 2 ). I processi metabolici assimilano e trasformano questi precursori i- norganici in livelli sempre più complessi di biomolecole. In un primo tempo, i precursori vengono trasformati in metaboliti, composti organici semplici che agiscono come intermedi nelle trasformazioni cellulari dell energia e nella biosintesi di vari composti complessi come amminoacidi, zuccheri, nucleotidi, acidi grassi, glicerolo. Legando insieme questi composti complessi, che possono essere considerati come blocchi da costruzione, si ottengono le macromolecole: proteine, polisaccaridi, polinucleotidi (DNA, RNA) e lipidi. Interazioni fra queste macromolecole formano dei livelli superiori di organizzazioni strutturali, cioè complessi sopramolecolari, che svolgono importanti funzioni
9 Introduzione 9 cellulari. Un esempio sono i complessi enzimatici, i ribosomi, i cromosomi. Questi complessi sopramolecolari sono tenuti insieme da interazioni non covalenti fra le macromolecole: legami a idrogeno, attrazioni ioniche, forze di Van der Waals e interazioni idrofobiche. Sebbene queste forze non covalenti siano deboli (meno di 40 KJ/mole), i legami sono tanti e quindi tutti insieme riescono a mantenere l architettura essenziale del complesso sopramolecolare. Ovviamente tutto ciò deve accadere in condizioni di temperatura, ph e forza ionica compatibili con la vita. La cellula è l unità della vita La cellula è la più piccola entità capace di svolgere le funzioni dell essere vivente: la crescita, il metabolismo, la risposta agli stimoli e la replicazione. Gli organelli subcellulari sono entità di dimensioni considerevoli, che si trovano solo nelle cellule eucariotiche, cioè appartenenti agli organismi superiori: all interno di essi si svolgono le reazioni metaboliche. Gli organelli subcellulari che, come dice il nome stesso, sono inclusi nella cellula e sono di solito delimitati da membrane comprendono: il nucleo, i mitocondri, i cloroplasti, i vacuoli ed altri organelli più piccoli, come i lisosomi, i perossisomi e i cromoplasti. Qui di seguito citeremo i più importanti. Il nucleo porta l informazione genetica, contenuta nelle sequenze lineari di nucleotidi nel DNA dei cromosomi. Nei mitocondri avviene il catabolismo aerobico di carboidrati e lipidi, con rilascio di energia che viene conservata in forme utilizzabili metabolicamente come l ATP. I cloroplasti sono gli agenti biologici che raccolgono l energia luminosa e la trasformano in energia chimica utilizzabile nel metabolismo durante la fotosintesi. Le membrane cellulari delimitano i confini delle cellule e degli organelli subcellulari. Sono complessi di lipidi e proteine tenuti insieme da forze non covalenti, fra cui particolarmente importanti sono le interazioni idrofobiche. Queste interazioni riflettono la tendenza delle molecole non polari a riunirsi insieme separandosi dal solvente polare per
10 10 Capitolo I eccellenza, l acqua. La riunione spontanea delle membrane in ambiente acquoso dove la vita è nata e viene mantenuta è il naturale risultato del loro carattere idrofobico. Le membrane di nuclei, organelli e cloroplasti sono diverse l una dall altra: ciascuna di esse ha una sua propria composizione in proteine e lipidi legata alle funzioni dell organello. Inoltre la compartimentazione entro le cellule non è solo una conseguenza inevitabile della presenza delle membrane, ma anche una condizione essenziale per il buon funzionamento dell organello. Proprietà delle biomolecole e loro adattamento alle condizioni della vita Le macromolecole delle cellule viventi sono costituite da unità (amminoacidi nelle proteine, carboidrati nei polisaccaridi) che hanno una polarità strutturale. Cioè le molecole non sono simmetriche e quindi possono essere pensate come composte di una testa e di una coda. La polimerizzazione che porta a collegare queste unità per formare macromolecole avviene tramite connessioni lineari testa-coda. A causa di ciò, anche i polimeri hanno una testa ed una coda e quindi la molecola ha un senso o una direzione nella sua struttura. Da ciò deriva che i blocchi che la compongono, quando vengono letti nella direzione della lunghezza della molecola possono fornire delle informazioni, come le lettere dell alfabeto possono formare parole quando siano messe una accanto all altra. Non tutte le macromolecole sono ricche di informazioni: i polisaccaridi sono spesso composti dallo stesso zucchero che si ripete molte volte, come nell amido e nella cellulosa, che sono omopolimeri costituiti sempre dalla stessa molecola di D-glucosio. Proteine e polinucleotidi invece sono costituiti da blocchi che non costituiscono una struttura ripetitiva: le loro sequenze sono uniche, e nella loro unicità sta il loro significato. Infatti le proteine, sebbene siano costituite da sequenze lineari di amminoacidi legati covalentemente gli uni agli altri, possono torcersi, avvolgersi e disporsi in tre dimensioni costituendo una architettura specifica ed altamente ordinata che è caratteristica di ogni molecola proteica e la identifica fra le altre.
11 Introduzione 11 Le forze che mantengono le strutture biologiche Nelle molecole gli atomi sono in genere tenuti insieme da legami covalenti e da legami ionici. Altre forze attrattive deboli sono i legami a idrogeno, le forze di van der Waals, e le interazioni idrofobiche. Nessuna di queste forze tuttavia riesce da legare stabilmente insieme due atomi. L energia messa in gioco da queste forze per tenere insieme le molecole è solo di poco superiore alla tendenza che hanno le molecole ad allontanarsi per l agitazione termica: quindi, nelle condizioni fisiologiche, i legami si potrebbero creare e rompere in continuazione. Tuttavia, se il numero di legami è molto grande, la struttura acquista stabilità per l azione cumulativa di molte forze deboli che a- giscono insieme. Esaminiamo ora queste forze: 1) Forze di attrazione di van der Waals Sono il risultato di interazioni elettrostatiche indotte fra atomi o molecole molto vicini fra loro. Sono dovute alla fluttuazione della nuvola elettronica carica negativamente che ruota intorno a ciascun nucleo. Si formano dei dipoli momentanei che, se di carica opposta, si attraggono. La forza di questi legami è inversamente proporzionale alla sesta potenza della distanza. 2) Legami a idrogeno Si formano fra un atomo di H legato covalentemente ad un atomo elettronegativo (come O o N) e un altro atomo elettronegativo che serve da accettore. Sono legami più forti di quelli di van der Waals e sono anche direzionali: cioè si formano legami lineari fra donatore, i- drogeno ed accettore. Sono anche più specifici di quelli di van der Waals perchè richiedono la presenza di gruppi donatori ed accettori complementari. 3) Interazioni idrofobiche Sono dovute alla forte tendenza dell acqua a escludere gruppi o molecole non polari. Le interazioni idrofobiche prendono origine non tanto da una affinità intrinseca delle sostanze non polari fra loro, ma dal fatto che le molecole d acqua preferiscono interagire più fortemente fra loro, escludendo i gruppi non polari. Questa esclusione fa sì che
12 12 Capitolo I le sostanze non polari si aggreghino fra loro formando dei cluster in soluzione acquosa. Così, le zone non polari delle macromolecole biologiche stanno confinate all interno della molecola per escludere il mezzo acquoso. Un esempio sono le goccioline d olio che si formano e che tendono ad aggregarsi alla superficie dell acqua. Caratteristiche delle principali classi di biomolecole Le biomolecole sono necessarie per generare, mantenere e perpetuare la vita. Alcune sono più complesse, altre meno, ma tutte ugualmente importanti. La maggior parte dei costituenti molecolari dei sistemi viventi è composta di atomi di carbonio legati con legami covalenti ad altri atomi di carbonio o ad atomi di idrogeno, di ossigeno e di azoto. La materia vivente è infatti composta per il 99% di questi quattro elementi. Idrogeno ed ossigeno sono abbondanti perché sono i costituenti dell acqua, che è il composto più importante in assoluto in tutti gli organismi. Il restante 1% é formato da Ca, P, K, S, Cl, Na e Mg e meno dello 0.01% da elementi in tracce, che tuttavia assolvono a precise funzioni metaboliche. Le particolari proprietà di legame del carbonio, che è sempre tetravalente ma che può condividere fino a 6 elettroni con se stesso o con un altro atomo, consentono la formazione di un gran numero di molecole. I composti organici con massa molecolare relativamente bassa (inferiore a 500) servono come sub-unità monomeriche che sono costituenti delle macromolecole, composti organici che mantengono in vita le cellule e permettono loro di riprodursi. Le quattro classi principali di biomolecole sono: carboidrati, lipidi, proteine e acidi nucleici. I carboidrati ed i lipidi sono sostanze di riserva che forniscono l energia necessaria per fare avvenire migliaia di reazioni chimiche e che svolgono anche altre funzioni di primaria importanza. I carboidrati ed i lipidi sono usati principalmente come fonti di energia e solo in casi particolari come materiali da costruzione (ad es. la cellulosa). Proteine ed acidi nucleici invece hanno compiti strutturali e funzionali. E questa una divisione di compiti molto importante su cui è bene richiamare l attenzione. Fra i carboidrati il più importante è il glucosio, fonte di energia per tutti gli organismi. Possiamo quindi dire che il
13 Introduzione 13 glucosio è il carburante per eccellenza della cellula vivente. Come sostanze di riserva costituita da molecole di glucosio troviamo l amido nelle piante ed il glicogeno negli animali. Carboidrati e lipidi sono dunque riserve energetiche che permettono ai sistemi viventi di compiere trasformazioni che dipendono non solo da quanti materiali nutritivi introducono quotidianamente ma anche dalla capacità di immagazzinare e sfruttare in un secondo tempo quelli non utilizzati immediatamente. Le proteine sono i costituenti strutturali di tutti i sistemi viventi e formano le impalcature che danno ad ogni organismo una forma ed una funzione precisa. Le proteine sono anche i costituenti di una importantissima classe di composti, gli enzimi, che sono insostituibili catalizzatori biologici. Sono gli enzimi, migliaia per ogni cellula, che decidono, con la loro estrema selettività, quale biomolecola deve essere prodotta o eliminata in un certo momento della vita cellulare. Gli acidi nucleici sono le strutture nelle quali sono codificate le caratteristiche genetiche della specie e dell individuo. In particolare il DNA (acido desossiribonucleico) costituisce i geni, il materiale fondamentale dell ereditarietà, del processo cioè che trasferisce l informazione contenuta nei geni da una cellula madre alla cellula figlia. Ognuna di queste classi di composti verrà trattata esaurientemente nel capitolo ad essa dedicato. Il metabolismo cellulare Le trasformazioni realizzate dai sistemi viventi costituiscono il metabolismo, parola greca che significa cambiamento. Il metabolismo è un insieme di processi attraverso il quale molecole grandi e complesse sono ridotte a molecole semplici (in tal caso si parla di catabolismo, o distruzione) che, a loro volta, possono essere nuovamente utilizzate per formare altre molecole (anabolismo, o costruzione), che sono alla base del funzionamento dell intero ciclo vitale. Queste serie di reazioni vengono dette vie metaboliche. Queste vie possono essere lineari, che partono cioè da un composto per giungere ad un prodotto finale diverso da quello di partenza, o cicliche, in cui il
14 14 Capitolo I prodotto finale è lo stesso di quello iniziale. In ogni caso, a differenza di quanto avviene nelle reazioni organiche o inorganiche in laboratorio, il prodotto di una reazione diventa il reagente della successiva. I- noltre, tutte le parti di un organismo vivente devono operare alla stessa temperatura e alla stessa pressione. Le cellule sono isotermiche, cioè sono sistemi che funzionano a temperatura costante. Anche in questo tipo di reazioni esistono catalizzatori, composti organici di cui parleremo per esteso in seguito, che hanno caratteristiche particolarissime e sono detti enzimi. Produzione e consumo di energia metabolica Le cellule e gli organismi, per funzionare, hanno bisogno di un continuo apporto di energia, senza la quale tenderebbero a decadere verso stati energetici sempre più bassi e disordinati. Tutti i processi di sintesi richiedono energia, sia nel mondo inorganico che negli organismi viventi: in questi ultimi le cellule hanno sviluppato efficientissimi meccanismi per catturare l energia della luce solare oppure per estrarla dai legami che tengono insieme gli atomi delle sostanze ossidabili. L energia così ottenuta potrà essere utilizzata per far avvenire processi non spontanei, cioè che richiedono energia. I principi fondamentali che governano le trasformazioni e gli scambi di energia negli organismi viventi costituiscono la bioenergetica. I pilastri fondamentali delle bioenergetica (di cui parleremo in modo dettagliato più avanti, nel capitolo dedicato) sono: Tutti gli organismi viventi creano e conservano le loro strutture complesse ed ordinate utilizzando l energia estratta da composti chimici o dalla luce solare. In ogni modificazione fisica o chimica la quantità totale di energia rimane costante anche se la forma di energia può cambiare. Le cellule sono motori chimici che operano a temperatura costante. Le richieste energetiche di quasi tutti gli organismi sono soddisfatte in modo diretto o indiretto dall energia solare. Il flusso di elettroni nelle reazioni di ossido-riduzione è alla base della formazione di energia cellulare.
15 Introduzione 15 Tutti gli organismi viventi dipendono gli uni dagli altri attraverso scambi di energia e materia mediati dall ambiente. Il punto centrale della bioenergetica è il modo in cui l energia, liberata dalla combustione di sostanze nutrienti o dalla cattura della luce solare, viene utilizzata dalle reazioni che richiedono energia. Come per la materia inorganica, anche per i sistemi biologici sono valide le leggi della chimica e della fisica. Quindi sarà valido il I Principio della termodinamica, che dice che, in ogni variazione chimica o fisica, la quantità totale di energia dell universo resta costante, anche se la forma dell energia può variare. La quantità di energia immediatamente disponibile per produrre lavoro si chiama energia libera e si indica con la lettera G. Questa energia non rappresenta tutta l energia messa in gioco nelle trasformazioni dette sopra perché una parte di essa viene dissipata sotto forma di entropia, che aumenterà il disordine del sistema (2 principio della termodinamica) Le reazioni chimiche che avvengono in un sistema chiuso procedono spontaneamente finché non raggiungono l equilibrio, stato in cui la velocità di formazione dei prodotti diventa uguale a quella in cui i prodotti si ritrasformano nei reagenti. La variazione di energia quando il sistema passa dallo stato iniziale a quello di equilibrio, a pressione e temperatura costanti, si chiama variazione di energia libera G. Il valore di G dipende dalla natura della reazione e da quanto prodotti e reagenti sono lontani dall equilibrio. Nelle reazioni in cui i prodotti hanno meno energia libera dei reagenti, cioè hanno maggiore stabilità, si avrà un eccesso di energia libera che può essere utilizzata per compiere un lavoro. Tali reazioni si dicono esoergoniche o spontanee e il G acquista valore negativo, G <0. Le reazioni invece in cui i prodotti hanno maggior energia libera dei reagenti e quindi per avvenire necessitano di un rifornimento di energia libera si dicono endoergoniche o non spontanee e il G acquista valore positivo, G >0. Gli organismi viventi hanno superato questo scoglio accoppiando reazioni endoergoniche, che quindi non potrebbero mai avvenire spontaneamente, con reazioni esoergoniche che le rendono possibili. L accoppiamento di questi due tipi di reazioni è un aspetto essenziale degli scambi energetici delle cellule. La reazione esoergonica che fa-
16 16 Capitolo I vorisce la maggior parte dei processi endoergonici delle cellule è l idrolisi di una molecola particolare, l Adenosin Tri Fosfato (ATP), che è il principale trasportatore di energia nelle cellule ed è il punto di unione fra i processi endo- ed eso-ergonici. L ATP si scinde in ADP (Adenosin Di Fosfato) e Pi, fosfato inorganico. Il gruppo fosforico terminale dell ATP viene trasferito ad un gran numero di accettori che vengono così attivati e possono subire quindi una molteplicità di trasformazioni chimiche. Alla luce di queste considerazioni possiamo quindi enunciare altre regole fondamentali della bioenergetica: Le reazioni cellulari endoergoniche sono guidate dall accoppiamento con processi chimici o fotochimici esoergonici attraverso la formazione di intermedi chimici; L ATP è il trasportatore universale dell energia metabolica ed accoppia il catabolismo con l anabolismo; Le cellule sono motori chimici auto-regolati che procedono secondo il principio della massima economia.
17 GLI AMMINOACIDI Gli amminoacidi sono importanti costituenti delle cellule viventi, sono infatti le unità strutturali di base delle proteine. Sono paragonabili ai mattoni con cui viene costruita una casa: ne sono l elemento più semplice e fondamentale e le conferiscono le caratteristiche più utili alle esigenze di chi la costruisce. Come si può dedurre dal nome, nella molecola di ogni amminoacido è presente almeno un gruppo amminico ( NH 2 ) e un gruppo acido, in genere carbossilico ( COOH), legati allo stesso atomo di carbonio. Sono inoltre presenti un atomo di idrogeno e un gruppo funzionale di varia natura. L esistenza di almeno due gruppi fortemente polari e la possibilità di formazione di legami a idrogeno spiega le caratteristiche fisiche degli amminoacidi, che sono tutti solidi cristallini con punto di fusione elevato. Anche la loro solubilità in acqua è elevata, anche se è legata alla natura della catena laterale. Nel corso dell evoluzione gli esseri viventi hanno selezionato un ristretto gruppo di amminoacidi, costituito da venti elementi, che sono i costituenti delle proteine. Questi composti, definiti amminoacidi proteici, hanno alcune caratteristiche comuni: 1) sono α-amminoacidi, cioè hanno il gruppo amminico ed il gruppo carbossilico legati all atomo di carbonio in posizione α, cioè sul primo C della catena dopo il gruppo carbossilico. Fa eccezione la prolina perché la catena laterale è legata oltre che al carbonio α anche all atomo di azoto collegato a quest ultimo. La prolina è in realtà un imminoacido ( NH ) e non un amminoacido ( NH 2 ). 2) gli amminoacidi differiscono fra loro per la natura chimica del gruppo R, che è legato allo stesso atomo di carbonio α ed è detto catena laterale. Il gruppo R può essere costituito da una catena idrocarburica a cui può essere legato un altro gruppo carbossilico, un altro gruppo amminico, o un gruppo di altra natura. 3) tutti gli amminoacidi hanno quattro sostituenti diversi legati al carbonio α, che è quindi un carbonio asimmetrico o carbonio chirale. 17
18 18 Capitolo II La formula generale degli amminoacidi è riportata in sintesi in Figura 1 dove a ph 7,0 il gruppo amminico è protonato ( NH 3 + ) e il gruppo carbossilico ha perso l idrogeno ( COO - ). La carica netta è ancora zero, ma la molecola è in realtà uno ione dipolare o zwitterione. Figura 1. Struttura di un amminoacido generico. 4) tutti gli amminoacidi, tranne la glicina che ha due sostituenti u- guali (due atomi di H), sono molecole chirali (Figura 2). Cioè possono presentarsi in forme speculari non sovrapponibili, come non lo sono la mano destra e la sinistra. Vengono detti anche isomeri ottici o enantiomeri. Figura 2. Molecole chirali come immagini non sovrapponibili. L isomeria in chimica organica è il fenomeno per cui due o più composti presentano la stessa formula bruta, sono cioè costituiti dallo stesso tipo e numero di atomi, hanno uguali proprietà chimiche e fisiche, ma differiscono nelle formule di struttura, cioè nella disposizione spaziale degli atomi e dei relativi legami chimici. Gli isomeri ottici
19 Amminoacidi e peptidi 19 hanno inoltre la particolarità di ruotare in modo opposto il piano della luce polarizzata. Tutti i composti che ruotano il piano della luce polarizzata si definiscono otticamente attivi ed il senso di rotazione viene indicato con il segno più (+) o meno ( ). Rispetto alla configurazione nello spazio dei vari gruppi intorno al carbonio α, gli amminoacidi sono classificati come D o L (Figura 3). Per convenzione (secondo Fischer) il gruppo più ossidato ( COO - ) si scrive in alto con i legami verticali che si allontanano dall osservatore ed i legami orizzontali che si avvicinano all osservatore. Se il gruppo amminico si trova a sinistra l amminoacido è L, se si trova a destra l amminoacido è D. In realtà gli amminoacidi proteici appartengono sempre alla serie L e, con rare eccezioni, solo questi isomeri partecipano alle reazioni cellulari. Questa particolarità non è stata ancora spiegata in maniera soddisfacente. L ipotesi più probabile è che la selezione degli isomeri L piuttosto che i D sia avvenuta casualmente all inizio dell evoluzione e sia stata mantenuta. Figura 3. Isomeri D e L secondo la convenzione di Fisher. Nelle tabelle 1-3 sono riportate le strutture dei 20 amminoacidi presenti nelle proteine, raggruppati secondo uno dei possibili criteri di classificazione, in base alle diverse proprietà che il gruppo funzionale R apporta alla molecola:
20 20 Capitolo II gruppi R idrofobici (Tabella 1) gruppi R idrofili non carichi (Tabella 2) gruppi R idrofili carichi, acidi e basici (Tabella 3). Gli amminoacidi vengono spesso indicati con una abbreviazione a tre lettere o mediante il simbolo ad una lettera. Le abbreviazioni sono quasi sempre costituite dalle prime tre lettere del nome inglese (Cys per la cisteina, Ala per l alanina, Arg per l arginina e così via). Fanno eccezione l asparagina (Asn), la glutammina (Gln), la isoeucina (Ile) ed il triptofano (Trp). I simboli ad una lettera derivano per molti amminoacidi dalla prima lettera del loro nome, ma poiché alcuni hanno la stessa iniziale si è ricorsi a convenzioni. Comunque le abbreviazioni a tre lettere sono generalmente da preferirsi perché sono più pratiche e generano meno confusione. Nelle rappresentazioni 3D riportate nelle tabelle con il colore violetto si indica l atomo di azoto del gruppo amminico ( NH 3 + ), con il colore rosso gli atomi di ossigeno del gruppo carbossilico ( CO 2 - ) e con il giallo l atomo di zolfo dei gruppi R della cisteina e della metionina. Con il grigio scuro e grigio chiaro si indicano rispettivamente gli atomi di carbonio e di idrogeno.
21 Amminoacidi e peptidi 21 Tabella 1. Amminoacidi con gruppi R idrofobici. Nome Sigla Formula di struttura 3D Glicina Gly (G) Alanina Ala (A) Valina Val (V) Leucina Leu (L) Isoleucina Ile (I) Metionina Met (M) Prolina Pro (P) Fenilalanina Phe (F) Triptofano Trp (W)
22 22 Tabella 2. Amminoacidi con gruppi R idrofili non carichi. Nome Sigla Formula di struttura 3D Serina Ser (S) Treonina Thr (T) Asparagina Asn (N) Glutammina Gln (Q) Tirosina Tyr (Y) Cisteina Cys (C)
23 Amminoacidi e peptidi 23 Tabella 3. Amminoacidi con gruppi R idrofili carichi (acidi e basici). Nome Sigla Formula di struttura 3D Lisina Lys (K) Arginina Arg (R) Istidina His (H) Ac. Aspartico/ Aspartato Asp (D) Ac. Glutammico/ Glutammato Glu (E)
24 24 Capitolo II Particolarità di alcuni amminoacidi Amminoacidi con gruppi R idrofobici. La glicina è l amminoacido strutturalmente più semplice con il gruppo R costituito solamente da un atomo di idrogeno e avendo due sostituenti uguali (due atomi di H) legati al carbonio α, è il solo che non è chirale. Quattro amminoacidi (Ala, Val, Leu, Ile) hanno catene laterali costituite da idrocarburi saturi, cioè che non contengono doppi legami. Sono molecole poco reattive che rivestono un ruolo importante nel determinare e mantenere la struttura tridimensionale delle proteine. Il ripiegamento delle catene polipeptidiche in genere avviene in modo tale che gli amminoacidi idrofobici restino rivolti verso l'interno della molecola e che quelli idrofilici siano, invece, rivolti verso l'esterno, dove sono liberi di interagire con altri composti. L alanina è l amminoacido più abbondante nella maggior parte delle proteine. La metionina è uno dei due amminoacidi contenenti zolfo la cui catena laterale R contiene un gruppo metiltioetere: - R = CH 2 CH 2 S CH 3 Come ricordato sopra solo la prolina non possiede un gruppo amminico ed uno carbossilico legati al carbonio in α, poiché il gruppo amminico è sostituito da un gruppo NH imminico nella formula ciclica di questo composto. Spesso la sua presenza condiziona la geometria della proteina di cui fa parte, provocando bruschi cambiamenti di direzione del filamento polipeptidico o interruzioni della catena. La fenilalanina e il triptofano hanno catene laterali aromatiche altamente idrofobiche che spesso si posizionano nell interno delle proteine globulari. Amminoacidi con gruppi R idrofili non carichi. La catena laterale della serina contiene un gruppo R ossidrilico ( OH) che possiamo ritrovare nei siti catalitici di alcuni enzimi dove si mostra particolarmente reattivo.
25 Amminoacidi e peptidi 25 Anche la treonina ha un ossidrile nella catena laterale, ma non è reattivo come quello della serina. Asparagina e glutammina sono le ammidi di altri due amminoacidi, rispettivamente l acido aspartico e l acido glutammico. In questi il gruppo carbossilico ( COO - ) è sostituito da un gruppo ammidico terminale ( CO NH 2 ). La tirosina si forma dalla fenilalanina, per sostituzione di un H con un gruppo ossidrilico ( OH) in posizione para che trasforma la catena laterale R da idrofoba a idrofila. Figura 4. Formazione di un legame disolfuro tra due molecole di Cys. La cisteina è con la metionina il secondo amminoacido che contiene zolfo. Possiede un gruppo solfidrilico ( SH) chimicamente reattivo nella catena laterale. Il suo idrogeno può formare legami a H deboli con l ossigeno e con l azoto. Inoltre può anche formare con un altra molecola di cisteina un legame covalente disolfuro S S costituendo un nuovo amminoacido detto cistina, importante nella struttura primaria delle proteine perché in esse può indurre ripiegamenti o rotture nella catena di amminoacidi. Il legame o ponte disolfuro ha una grande importanza nella struttura delle proteine perché può mettere in connessione catene separate o formare legami crociati tra residui di cisteina della stessa catena (Figura 4).
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
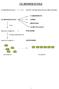 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
PROTEINE. Amminoacidi
 PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
Amminoacidi e Proteine
 Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
4x4x4=4 3 =64 codoni. 20 aminoacidi
 4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
Macromolecole Biologiche. I domini (I)
 I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Macromolecole Biologiche. I domini (III)
 I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
LE MOLECOLE INFORMAZIONALI. Lezioni d'autore Treccani
 LE MOLECOLE INFORMAZIONALI Lezioni d'autore Treccani Introduzione (I) I pionieri della biologia molecolare, scoperta la struttura degli acidi nucleici, pensarono di associare al DNA una sequenza di simboli,
LE MOLECOLE INFORMAZIONALI Lezioni d'autore Treccani Introduzione (I) I pionieri della biologia molecolare, scoperta la struttura degli acidi nucleici, pensarono di associare al DNA una sequenza di simboli,
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
«Macromolecole» Lipidi
 LIPIDI (1) «Macromolecole» Lipidi Biotecnologie Miscellanea di molecole biologiche che condividono la proprietà di non essere solubili in acqua. Molecole idrofobiche. Es: Grassi Oli (grasso liquido a temperatura
LIPIDI (1) «Macromolecole» Lipidi Biotecnologie Miscellanea di molecole biologiche che condividono la proprietà di non essere solubili in acqua. Molecole idrofobiche. Es: Grassi Oli (grasso liquido a temperatura
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
DNA - RNA. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi.
 DNA - RNA Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Esistono 4 basi azotate per il DNA e 4 per RNA Differenze
DNA - RNA Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Esistono 4 basi azotate per il DNA e 4 per RNA Differenze
Protocollo dei saperi imprescindibili
 Protocollo dei saperi imprescindibili Ordine di scuola:professionale DISCIPLINA: Scienze integrate( Scienze della Terra e Biologia) RESPONSABILE: Meri Teti CLASSI SECONDE SEZIONE B INDIRIZZO: Grafico CONOSCENZE/CONTENUTI:
Protocollo dei saperi imprescindibili Ordine di scuola:professionale DISCIPLINA: Scienze integrate( Scienze della Terra e Biologia) RESPONSABILE: Meri Teti CLASSI SECONDE SEZIONE B INDIRIZZO: Grafico CONOSCENZE/CONTENUTI:
BIOLOGIA GENERALE 22-24 ottobre 2007
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca
 INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
Metabolismo: Introduzione
 Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine.
 Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
Diversità tra i viventi
 Diversità tra i viventi PROPRIETÀ della VITA La CELLULA CLASSIFICAZIONE dei VIVENTI Presentazione sintetica Alunni OIRM Torino Tutti i viventi possiedono delle caratteristiche comuni Ciascun vivente nasce,
Diversità tra i viventi PROPRIETÀ della VITA La CELLULA CLASSIFICAZIONE dei VIVENTI Presentazione sintetica Alunni OIRM Torino Tutti i viventi possiedono delle caratteristiche comuni Ciascun vivente nasce,
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Scuola Media Piancavallo 2
 LA CELLULA Una caratteristica di quasi tutti gli esseri viventi è quella di possedere una struttura più o meno complessa in cui parti diverse, gli organi, sono adatte a svolgere funzioni specifiche. Il
LA CELLULA Una caratteristica di quasi tutti gli esseri viventi è quella di possedere una struttura più o meno complessa in cui parti diverse, gli organi, sono adatte a svolgere funzioni specifiche. Il
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas
 1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Nota dell editore Presentazione
 00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
Prof.ssa Gamba Sabrina. Lezione 7: IL DNA. Duplicazione e sintesi delle proteine
 Prof.ssa Gamba Sabrina Lezione 7: IL DNA Duplicazione e sintesi delle proteine concetti chiave della lezione Costituzione fisico-chimica del DNA Basi azotate Duplicazione Concetto di geni Rna Trascrizione
Prof.ssa Gamba Sabrina Lezione 7: IL DNA Duplicazione e sintesi delle proteine concetti chiave della lezione Costituzione fisico-chimica del DNA Basi azotate Duplicazione Concetto di geni Rna Trascrizione
Forza. Forza. Esempi di forze. Caratteristiche della forza. Forze fondamentali CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA
 Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 9
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 9 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 9 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
CELLULE EUCARIOTICHE
 CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
TEST BIOLOGIA 1 ANNO ABEI Da inviare a connesso@alice.it entro e non oltre il 6 novembre 2015
 1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
MACROSTRUTTURA DEL MUSCOLO STRIATO SCHELETRICO
 FUNZIONE DEL MUSCOLO SCHELETRICO Ultrastruttura della cellula muscolare. Miofilamenti. Meccanismo della contrazione. Trasmissione neuromuscolare. Scossa semplice e tetano muscolare. Unità motoria. PROPRIETA
FUNZIONE DEL MUSCOLO SCHELETRICO Ultrastruttura della cellula muscolare. Miofilamenti. Meccanismo della contrazione. Trasmissione neuromuscolare. Scossa semplice e tetano muscolare. Unità motoria. PROPRIETA
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
Livello di organizzazione degli esseri viventi
 Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Appunti sulla Macchina di Turing. Macchina di Turing
 Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Regione cerniera monomero regione cerniera
 Regione cerniera Tutte le Ig, sia quelle secrete che quelle presenti sulla membrana plasmatica dei linfociti B, sono costituite da quattro catene proteiche, due pesanti (H, da heavy, in rosso nel disegno)
Regione cerniera Tutte le Ig, sia quelle secrete che quelle presenti sulla membrana plasmatica dei linfociti B, sono costituite da quattro catene proteiche, due pesanti (H, da heavy, in rosso nel disegno)
PROGRAMMA DI BIOLOGIA. CLASSE 2^ F a. s. 2014 2015. Prof.ssa RUBINO ALESSANDRA
 ISTITUTO TECNICO INDUSTRIALE DI STATO "ENRICO FERMI" Via Luosi n. 23-41124 Modena Tel. 059211092 059236398 - (Fax): 059226478 E-mail: info@fermi.mo.it Pagina web: www.fermi.mo.it PROGRAMMA DI BIOLOGIA
ISTITUTO TECNICO INDUSTRIALE DI STATO "ENRICO FERMI" Via Luosi n. 23-41124 Modena Tel. 059211092 059236398 - (Fax): 059226478 E-mail: info@fermi.mo.it Pagina web: www.fermi.mo.it PROGRAMMA DI BIOLOGIA
aa 2013-14 Proteine Struttura delle Proteine α Amminoacidi
 Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Tesina di scienze. L Elettricità. Le forze elettriche
 Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
SINTESI DELL RNA. Replicazione. Trascrizione. Traduzione
 SINTESI DELL RNA Replicazione Trascrizione Traduzione L RNA ha origine da informazioni contenute nel DNA La TRASCRIZIONE permette la conversione di una porzione di DNA in una molecola di RNA con una sequenza
SINTESI DELL RNA Replicazione Trascrizione Traduzione L RNA ha origine da informazioni contenute nel DNA La TRASCRIZIONE permette la conversione di una porzione di DNA in una molecola di RNA con una sequenza
Le proteine. Le proteine sono i mattoncini che costituiscono gli organismi viventi.
 Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
Dalla Chimica Generale
 RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
Energia e Lavoro. In pratica, si determina la dipendenza dallo spazio invece che dal tempo
 Energia e Lavoro Finora abbiamo descritto il moto dei corpi (puntiformi) usando le leggi di Newton, tramite le forze; abbiamo scritto l equazione del moto, determinato spostamento e velocità in funzione
Energia e Lavoro Finora abbiamo descritto il moto dei corpi (puntiformi) usando le leggi di Newton, tramite le forze; abbiamo scritto l equazione del moto, determinato spostamento e velocità in funzione
La biochimica è anche definita la chimica del C :
 Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
Figura 1. Rappresentazione della doppia elica di DNA e struttura delle differenti basi.
 Sommario La molecola di DNA è deputata a conservare le informazioni genetiche necessarie per lo sviluppo ed il funzionamento degli organismi viventi. Poiché contiene le istruzioni per la costruzione delle
Sommario La molecola di DNA è deputata a conservare le informazioni genetiche necessarie per lo sviluppo ed il funzionamento degli organismi viventi. Poiché contiene le istruzioni per la costruzione delle
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Il flusso dell informazione genetica. DNA -->RNA-->Proteine
 Il flusso dell informazione genetica DNA -->RNA-->Proteine Abbiamo visto i principali esperimenti che hanno dimostrato che il DNA è la molecola depositaria dell informazione genetica nella maggior parte
Il flusso dell informazione genetica DNA -->RNA-->Proteine Abbiamo visto i principali esperimenti che hanno dimostrato che il DNA è la molecola depositaria dell informazione genetica nella maggior parte
Struttura e funzioni della cellula. Corso di Biofisica, Università di Cagliari 1
 Struttura e funzioni della cellula 1 Riferimenti Books and others Biological Physics (updated 1 st ed.), Philip Nelson, Chap. 2 Physical Biology of the Cell, Phillips et al., Chap. 2 Movies Exercise 2
Struttura e funzioni della cellula 1 Riferimenti Books and others Biological Physics (updated 1 st ed.), Philip Nelson, Chap. 2 Physical Biology of the Cell, Phillips et al., Chap. 2 Movies Exercise 2
NUCLEOTIDI e ACIDI NUCLEICI
 NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
Gli organismi viventi
 Gli organismi viventi Gli organismi viventi Quali caratteristiche contraddistinguono i viventi? È facile distinguere un organismo vivente da un oggetto non vivente? Gli organismi viventi Tutti gli organismi
Gli organismi viventi Gli organismi viventi Quali caratteristiche contraddistinguono i viventi? È facile distinguere un organismo vivente da un oggetto non vivente? Gli organismi viventi Tutti gli organismi
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di
 La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
LA CHERATINA. CORSO COSMETOLOGIA- DOTT.SSA B. SCARABELLI (www.cosmesinice.it) PROTEINA: unione di più aminoacidi
 PROTEINA: unione di più aminoacidi LA CHERATINA AMINOACIDO: molecola unità di base; ce ne sono 20 di cui 8 sono essenziali (da introdurre solo con i cibi) La struttura delle proteine vien suddivisa in
PROTEINA: unione di più aminoacidi LA CHERATINA AMINOACIDO: molecola unità di base; ce ne sono 20 di cui 8 sono essenziali (da introdurre solo con i cibi) La struttura delle proteine vien suddivisa in
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Modello del collasso idrofobico. Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60
 Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
I Composti Organici. Le Biomolecole
 I Composti Organici I composti organici sono molecole tutte contenenti carbonio. Essi comprendono. 1. composti di interesse energetico che sono gli Idrocarburi ( i derivati del petrolio), 2. composti a
I Composti Organici I composti organici sono molecole tutte contenenti carbonio. Essi comprendono. 1. composti di interesse energetico che sono gli Idrocarburi ( i derivati del petrolio), 2. composti a
SINTESI PROTEICA. Replicazione. Trascrizione. Traduzione
 Replicazione SINTESI PROTEICA Trascrizione Traduzione 61 codoni codificanti 3 triplette non senso (STOP) AUG codone di inizio codone per Met Caratteristiche del codice genetico Specificità Il codice genetico
Replicazione SINTESI PROTEICA Trascrizione Traduzione 61 codoni codificanti 3 triplette non senso (STOP) AUG codone di inizio codone per Met Caratteristiche del codice genetico Specificità Il codice genetico
Peptidi, proteine ed e nzim i i 1
 Peptidi, proteine ed enzimi 1 Gli amminoacidi possono formare catene Due amminoacidi possono unirsi tra loro attraverso il legame ammidico detto legame peptidico, tra il gruppo NH 2 di un amminoacido e
Peptidi, proteine ed enzimi 1 Gli amminoacidi possono formare catene Due amminoacidi possono unirsi tra loro attraverso il legame ammidico detto legame peptidico, tra il gruppo NH 2 di un amminoacido e
Macromolecole Biologiche. I domini (II)
 I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
LA GENETICA: DNA e RNA LA GENETICA. DNA e RNA. Prof. Daniele Verri
 LA GENETICA DNA e RNA Prof. Daniele Verri L'acido desossiribonucleico o deossiribonucleico (DNA) è un acido nucleico che contiene le informazioni necessarie per la formazione di RNA e proteine. LA GENETICA:
LA GENETICA DNA e RNA Prof. Daniele Verri L'acido desossiribonucleico o deossiribonucleico (DNA) è un acido nucleico che contiene le informazioni necessarie per la formazione di RNA e proteine. LA GENETICA:
Struttura delle proteine
 Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA)
 SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA) ORGANIZZAZIONE TERZIARIA DEL DNA Il DNA cellulare contiene porzioni geniche e intergeniche, entrambe necessarie per le funzioni vitali della
SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA) ORGANIZZAZIONE TERZIARIA DEL DNA Il DNA cellulare contiene porzioni geniche e intergeniche, entrambe necessarie per le funzioni vitali della
BIOMOLECOLE (IN ALIMENTAZIONE SONO CLASSIFICATE TRA I MACRONUTRIENTI)
 BIOMOLECOLE (IN ALIMENTAZIONE SONO CLASSIFICATE TRA I MACRONUTRIENTI) Sono i composti chimici dei viventi. Sono formate da Carbonio (C), Idrogeno (H), Ossigeno (O), Azoto (N), Fosforo (P) e Zolfo (S).
BIOMOLECOLE (IN ALIMENTAZIONE SONO CLASSIFICATE TRA I MACRONUTRIENTI) Sono i composti chimici dei viventi. Sono formate da Carbonio (C), Idrogeno (H), Ossigeno (O), Azoto (N), Fosforo (P) e Zolfo (S).
isomeria di struttura isomeria di posizione isomeria di catena stereoisomeria isomeria di conformazione isomeria di configurazione 'isomeria ottica
 ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
INTEGRALI DEFINITI. Tale superficie viene detta trapezoide e la misura della sua area si ottiene utilizzando il calcolo di un integrale definito.
 INTEGRALI DEFINITI Sia nel campo scientifico che in quello tecnico si presentano spesso situazioni per affrontare le quali è necessario ricorrere al calcolo dell integrale definito. Vi sono infatti svariati
INTEGRALI DEFINITI Sia nel campo scientifico che in quello tecnico si presentano spesso situazioni per affrontare le quali è necessario ricorrere al calcolo dell integrale definito. Vi sono infatti svariati
Il concetto di valore medio in generale
 Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
TIPI DI CELLULE : PROCARIOTE ED EUCARIOTE
 TIPI DI CELLULE : PROCARIOTE ED EUCARIOTE Tutti i tipi cellulari presenti sul nostro pianeta appartengono ad uno di due gruppi fondamentali: procarioti ed eucarioti. I termini procariota (dal greco pro
TIPI DI CELLULE : PROCARIOTE ED EUCARIOTE Tutti i tipi cellulari presenti sul nostro pianeta appartengono ad uno di due gruppi fondamentali: procarioti ed eucarioti. I termini procariota (dal greco pro
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
PROTEINA GREGGIA (P.G.)
 PROTEINA GREGGIA (P.G.) Il contenuto proteico di un alimento è valutato dal suo tenore in azoto, determinato con il metodo Kjeldahl modificato. Il metodo Kjeldahl valuta la maggior parte dell azoto presente
PROTEINA GREGGIA (P.G.) Il contenuto proteico di un alimento è valutato dal suo tenore in azoto, determinato con il metodo Kjeldahl modificato. Il metodo Kjeldahl valuta la maggior parte dell azoto presente
