Progetto Regione Emilia-Romagna. Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano
|
|
|
- Mauro Gigli
- 5 anni fa
- Visualizzazioni
Transcript
1 Progetto Regione Emilia-Romagna Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano Azione 3: Aspetti enzimatici legati alla stagionatura del Parmigiano-Reggiano Fase 1: Determinazione delle caratteristiche microbiologiche e chimiche dei campioni scelti
2 EVOLUZIONE DELLA FRAZIONE AMMINOACIDICA E OLIGOPEPTIDICANEL FORMAGGIO PARMIGIANO-REGGIANO NEI PRIMI MESI DI STAGIONATURA Dipartimento di Chimica Organica ed Industriale Facoltà di Agraria Università di Parma Rosangela Marchelli Arnaldo Dossena Stefano Sforza Gianni Galaverna Valeria Cavatorta Fausto Stefani
3 LA PROTEOLISI NEL PARMIGIANO-REGGIANO Enzimi responsabili del processo proteolitico e loro origine CASEINA Caglio Chimosina Proteasi associate alla parete cellulare Proteasi associate alla parete cellulare Proteasi intracellulari Endoproteasi Amminoproteasi Sieroinnesto Lactobacillus Plasmina Latte Ammino acidi Di- tripeptidi Oligopeptidi Tripeptidasi Dipeptidasi LISI FORMAGGIO Sistemi di trasporto
4 Il gruppo di ricerca si propone: L analisi quantitativa del contenuto amminoacidico dei campioni L analisi della frazione peptidica a basso peso molecolare (<1 kda) per l identificazione dei peptidi maggiormente presenti e la loro semi-quantificazione L utilizzo dei dati per ricavare informazioni sulle attività enzimatiche e la correlazione dei dati ottenuti con le attività enzimatiche determinate dal gruppo di Microbiologia degli Alimenti Biotecnologie Microbiche
5 ANALISI DEGLI AMMINOACIDI 5g formaggio + 5µl D-L Nor-Leucina+ 5 ml H 2 O bidistillata Neutralizzazione con NaOH 1 N derivatizzazione omogeneizzazione Purificazione mediante Scambio ionico Analisi HPLC-FLD Deproteneizzazione (7,5 ml TFA) 2 min Essiccazione Centrifugazione (4 C) Neutralizzazione con NaOH 1 N Filtrazione su carta Filtrazione (,45 µm) Estrazione fase lipidica Essiccazione e ridissoluzione in 1 ml di H 2 O bidistillata Essiccazione
6 Minutes mv Asp Gly Ser Glu His Arg Thr Ala Pro Tyr Val Met Lys Ile Leu N-Leu Phe
7 AMMINOACIDI TOTALI a.a. totali (mg/1g s.s.) esterno forma centro forma giorni di stagionatura Non emergono differenze significative nella quantità totale di amminoacidi tra parte esterna e parte centrale della forma fino al 2 mese. Una certa disomogeneità compare dal 3 mese per poi accentuarsi al 6, con prevalenza di amminoacidi nella parte esterna.
8 Distribuzione percentuale degli amminoacidi a 1 mese di stagionatura Ile 4% Leu 9% Phe 4% Asp 3% Ser 6% Glu 15% Ile 3% Leu 8% Phe 3% Asp 3% Ser 6% Glu 18% Lys 16% Met 2% Val 6% Tyr 3% Pro 9% Ala 5% Thr 3% Arg 7% Gly 2% His 6% Lys 16% Met 2% Val 6% Tyr 3% Pro 1% Ala 5% Thr 3% Arg 7% Gly 2% His 5% ESTERNO FORMA CENTRO FORMA Nessuna differenza significativa nella distribuzione percentuale tra le due zone
9 Distribuzione percentuale degli amminoacidi a 6 mese di stagionatura Leu 9% Phe 4% Asp 3% Ser 8% Leu 1% Phe 4% Asp 3% Ser 7% Ile 6% Glu 19% Ile 5% Glu 2% Lys 14% Lys 15% Met 2% Val 7% Tyr 1% Pro 1% Ala 2% Thr 5% Arg 3% His 5% Gly 2% Met 2% Val 7% Tyr 1% Pro 1% Ala 2% Thr 4% Arg 3% His 5% Gly 2% ESTERNO FORMA CENTRO FORMA Nessuna differenza significativa nella distribuzione percentuale tra le due zone
10 Distribuzione percentuale degli amminoacidi a diversi tempi di stagionatura Leu 9% Phe 4% Asp 3% Ser 6% Leu 9% Phe 4% Asp 3% Ser 8% Ile 4% Glu 15% Ile 6% Glu 19% Lys 16% Gly 2% Lys 14% Met 2% Val 6% Tyr 3% Pro 9% Ala 5% Thr 3% Arg 7% His 6% Met 2% Val 7% Tyr 1% Pro 1% Ala 2% Thr 5% Arg 3% His 5% Gly 2% 1 mese di stagionatura 6 mesi di stagionatura Dimnuisce la percentuale di arginina, alanina e tirosina Aumenta la percentuale di acido glutammico, serina, isoleucina
11 Arg Tyr Glu mg/1 g s.s giorni di stagionatura I dati indicano un cambiamento nella produzione di amminoacidi a partire dal 2-4 mese di stagionatura Questo cambiamento comporta un arresto nella produzione di Arg e Tyr (o una loro degradazione) ed un incremento nella produzione di Glu
12 ANALISI DEI PEPTIDI Ultrafiltrazione Estrazione 1 g di formaggio + 2,5 ml di Phe-Phe 1 mm + 45 ml di HCl,1 N (deproteinizzazione) Prelievo di un'aliquota di 3 ml di estratto Evaporazione totale del solvente Filtrazione su carta Recupero del campione con 9 µl di soluzione acquosa di ac. Formico,1 % Estrazione della frazione lipidica Filtrazione a 1 Da Filtrazione a,45 µm Filtrato 3 lavaggi di recupero Filtrato Essiccazione completa del filtrato sotto flusso di azoto
13 ANALISI HPLC/MS DEI PEPTIDI Separazione analitica Rivelazione HPLC a fase inversa Colonna C18 Eluente a gradiente H 2 O-CH 3 CN acidificati (ac. formico,1 %) Interfaccia ESI 1 TIC Zona di collisione in sorgente Phe-Phe Spettrometro di massa a singolo quadrupolo con interfaccia ESI % Time
14 IDENTIFICAZIONE DEI PEPTIDI Elaborazione dei dati: semiquantificazione % TIC Time % Spettro di massa m/z % Spettro di massa ricostruito % Picchi caratteristici mass m/z
15 SEMIQUANTIFICAZIONE DEI PEPTIDI , XIC % % Area del picco Time Time Calcolo del rapporto tra l'area generata dal peptide e l'area dello standard interno Correzione del dato ottenuto in base al contenuto di umidità
16 IDENTIFICAZIONE DELLA SEQUENZA ESATTA DEI PEPTIDI TRAMITE CONFRONTO CON LE SEQUENZE CASEINICHE E FRAMMENTAZIONE IN SORGENTE Individuazione, in base al peso molecolare del peptide, delle possibili sequenze caseiniche Calcolo dei frammenti teorici Peptide Frammentazione Confronto dei frammenti teorici con quelli presenti nello spettro 1 L E E L B (n-1) Attribuzione della sequenza caseinica, tra le diverse possibili. % B (n-2) B (n-4) B (n-3) m/z
17 CARATTERIZZAZIONE DELLA FRAZIONE PEPTIDICA TR PM Sequenza TR PM Sequenza TR PM Sequenza TR PM Sequenza αs1 CN(1-7) 25,3 416 β CN(1-3) 48,2 242 β CN(13-119) 1, , αs1 CN(1-17) 25,4 545 β CN(1-4) 51, β CN( ) 24,4 536 αs1 CN(1-4) 37,8 755 αs1 CN(1-16) 25,4 144 β CN(71-83) 55, β CN(99-16) 24,4 745 αs1s1 CN(1-6) 38, αs1 CN(1-16) 26,4 11 β CN(97-15) 55,5 754 β CN(99-159) 26,2 77 αs1 CN(3-35) 42,4 61 αs1 CN(16-2) 37,1 151 β CN(82-95) 57, β CN(199-29) 26, αs1 CN( ) 46, αs1 CN( ) 39,3 173 β CN(16-28) +3P 61, β CN(194-29) 27, αs1 CN(1-13) 49,9 95 αs1 CN(17-23) 39,4 787 β CN(1-6) 62, β CN(195-29) 28, αs1 CN(1-14) 49,9 791 αs1 CN(18-23) 4, β CN(14-28) +4P 62, β CN(193-29) 3,8 414 αs1 CN(1-13) 5, 3452 αs1 CN( ) 4,6 179 β CN(13-144) 74, β CN(51-93) 3,9 734 αs1 CN( ) 5,2 85 αs1 CN(24-3) 41,3 298 β CN(13-28) 74, β CN(53-93) 32, αs1 CN(24-36) 51, αs1 CN(1-23) 41, β CN(98-124) 74, β CN(55-93) 32,7 542 αs1 CN(1-14) 55, αs1 CN(14-23) 42, β CN( ) 74,8 424 β CN(57-93) 34, αs1 CN(25-36) 56, αs1 CN(24-34) 43, β CN( ) TR PM Frammenti 34, αs1 CN( ) 58,5 386 αs1 CN(83-114) 47,8 754 β CN(47-52) 6,2 114 αs1 CN(1-9) 36, αs1 CN(23-32) 58, αs1 CN(8-114) PM TR Sequenza 26 29, , ,9 γ-glu-ile γ-glu-leu γ-glu-phe
18 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO Andamento complessivo dei peptidi
19 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO Andamento complessivo dei peptidi I tre gruppi di peptidi: 25, 22,5 2, 17,5 15, 12,5 1, 7,5 5, 2,5 25, 22,5 2, 17,5 15, 12,5 1, 7,5 5, 2,5 con un massimo a tempo zero, 12 48,
20 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO Andamento complessivo dei peptidi I tre gruppi di peptidi: 25, 22,5 2, 17,5 15, 12,5 1, 7,5 5, 2,5 25, 22,5 2, 17,5 15, 12,5 1, 7,5 5, 2,5 con un massimo a tempo zero con andamento crescente, 12 48,
21 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO Andamento complessivo dei peptidi I tre gruppi di peptidi: 25, 22,5 2, 17,5 15, 12,5 1, 7,5 5, 2,5 25, 22,5 2, 17,5 15, 12,5 1, 7,5 5, 2,5 con un massimo a tempo zero con andamento crescente con massimo, 12 48,
22 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO: Peptidi con un massimo al tempo zero α S1 CN f (1-23) 25, 25, α S1 CN f (24-34) 22,5 2, 22,5 2, ß CN f (193-29) ß CN f (99-159) ß CN f (99-16) 17,5 15, 12,5 1, 7,5 5, 17,5 15, 12,5 1, 7,5 5, 2,5 2,5, 12 48, as1 ß... Leu Arg Phe Phe Val Ala Phe Leu Leu Tyr Gln Glu CHIMOSINA ß... Val Ser Lys Val Lys Glu
23 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO: Peptidi con un massimo al tempo zero α S1 CN f (1-23) 25, 25, α S1 CN f (24-34) 22,5 2, 22,5 2, ß CN f (193-29) ß CN f (99-159) ß CN f (99-16) 17,5 15, 12,5 1, 7,5 5, 17,5 15, 12,5 1, 7,5 5, 2,5 2,5, 12 48, as1 ß ß... Leu Arg Phe Phe Val Ala Phe Leu Leu Tyr Gln Glu Val Ser Lys Val Lys Glu CHIMOSINA ENZIMI ENDOGENI DEL LATTE
24 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO: Peptidi con un massimo tra il primo ed il secondo mese 2,5 2,5 2,25 2, 1,75 1,5 1,25 1,,75,5 2,25 2, 1,75 1,5 1,25 1,,75,5 Max a 3 Max a 6 Max a 9 Max a 12,25,25, 12 48,
25 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO: Peptidi con un massimo tra il primo ed il secondo mese 2,5 2,5 2,25 2, 1,75 1,5 1,25 1,,75,5 2,25 2, 1,75 1,5 1,25 1,,75,5 Max a 3 Max a 6 Max a 9 Max a 12,25,25,, Molti derivano dalla successiva degradazione di peptidi di origine chimosinica R P K H P I K H Q G L P Q E V L N E N L L R F
26 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO: Peptidi con un massimo tra il primo ed il secondo mese 2,5 2,5 2,25 2, 1,75 1,5 1,25 1,,75,5 2,25 2, 1,75 1,5 1,25 1,,75,5 Max a 3 Max a 6 Max a 9 Max a 12,25,25, 12 48, ESO- ed ENDO-PEPTIDASI BATTERICHE
27 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO: Peptidi con andamento crescente ß CN f (16-28)3P 25, 22,5 25, 22,5 ß CN f (14-28)4P ß CN f ( ) α S1 CN f (83-114) 2, 17,5 15, 12,5 1, 7,5 5, 2, 17,5 15, 12,5 1, 7,5 5, 2,5 2,5, 12 48, ß ß... Ile Asn Lys Lys Ile Glu Gln Ser Lys Val Leu Pro PLASMINA e AMMINOPEPTIDASI as1... Glu Gln Lys His Ile Gln
28 EVOLUZIONE NEL TEMPO DEL PATTERN PEPTIDICO: Peptidi con andamento crescente H 2 N COOH O N H COOH γ-glu-ile γ-glu-leu γ-glu-phe?-glu-phe Peptidi di neo-formazione (NON di derivazione proteolitica) probabilmente generati da un attività γ-glutamiltranspeptidasica
29 DISTRIBUZIONE DEL PATTERN PEPTIDICO NELLA FORMA 8, 7,5 7, 6,5 6, 5,5 5, 4,5 4, 8, 7,5 7, 6,5 6, 5,5 5, 4,5 4, 3,5 3, 2,5 2, 1,5 1,,5, , 7,5 7, 6,5 6, 5,5 5, 4,5 4, 3,5 3, 2,5 2, 1,5 1,,5, , 7,5 7, 6,5 6, 5,5 5, 4,5 4, 8, 7,5 7, 6,5 6, 5,5 5, 4,5 4, 3,5 3, 2,5 2, 1,5 1,,5, 8, 7,5 7, 6,5 6, 5,5 5, 4,5 4, 3,5 3, 2,5 2, 1,5 1,,5, Centro Esterno Centro Esterno 3,5 3,5 3, 3, 2,5 2,5 2, 2, 1,5 1,5 1, 1,,5,5,, Centro Esterno Fino a due mesi l esterno è più povero di peptidi derivati dalla chimosina, ad indicare un attività proteolitica più intensa nella parte esterna della forma Fino a due mesi i peptidi formati dai batteri lattici si formano e si degradano più rapidamente all esterno Nella parte esterna della forma vi è una maggior proliferazione batterica, ma la disomogeneità da essa provocata scompare a partire dal secondo-terzo mese Non si notano sostanziali differenze tre le zone di campionamento
30 PRIME CONCLUSIONI: L EVOLUZIONE NEL TEMPO DELLA FRAZIONE AMMINOACIDICA E PEPTIDICA Nel periodo che va dalla produzione al 1 mese di stagionatura i dati su amminoacidi e peptidi indicano due momenti ben distinti: Da a 2-4 mese: Da 2-4 mese al 1 mese: Dal 1 mese in poi: - tutti gli amminoacidi in crescita costante ed omogenea tra esterno ed interno - i peptidi presenti provengono essenzialmente dalla parte N- terminale dell αs1 caseina e dalla parte C-terminale della β-caseina - Disomogeneità nel contenuto peptidico tra esterno ed interno - Prevalenza dell azione enzimatica del caglio e dei batteri lattici - alcuni amminoacidi non aumentano più (Arg, Tyr, Ala), altri accelerano la loro crescita (Glu, Ser, Ile), con una certa disomogeneità tra esterno ed interno - I peptidi precedentemente presenti cominciano a scomparire e compaiono nuovi peptidi (parte centrale dell αs1 caseina, fosfopeptidi dalla β-caseina, γ-glutamilpeptidi) - Omogeneità del contenuto peptidico tra esterno ed interno della forma - Prevalenza di nuove azioni enzimatiche (plasmina, amminopeptidasi, γ-glutamiltranspeptidasi)..
Progetto Regione Emilia-Romagna. Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano
 Progetto Regione Emilia-Romagna Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano Azione 3: Aspetti enzimatici legati alla stagionatura del Parmigiano-Reggiano
Progetto Regione Emilia-Romagna Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano-Reggiano Azione 3: Aspetti enzimatici legati alla stagionatura del Parmigiano-Reggiano
Peptidi-1 Peptidi-2 1
 Peptidi-1 Peptidi-2 1 Peptidi-3 Peptidi-3 2 Peptidi-4 Peptidi-4 3 Peptidi-5 Peptidi-5 4 Peptidi-6 Peptidi-6 5 6 7 8 Spettrometria di massa di biomolecole: esempi ed esercizi Margherita Ruoppolo Dipartimento
Peptidi-1 Peptidi-2 1 Peptidi-3 Peptidi-3 2 Peptidi-4 Peptidi-4 3 Peptidi-5 Peptidi-5 4 Peptidi-6 Peptidi-6 5 6 7 8 Spettrometria di massa di biomolecole: esempi ed esercizi Margherita Ruoppolo Dipartimento
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano Reggiano
 Facoltà di Agraria Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano Reggiano Evoluzione della microflora lattica e dell attività enzimatica durante la stagionatura
Facoltà di Agraria Studio e modellazione degli aspetti enzimatici legati alla stagionatura del formaggio Parmigiano Reggiano Evoluzione della microflora lattica e dell attività enzimatica durante la stagionatura
Il comportamento tecnologico del latte: valutazione attraverso tecniche di microscopia
 Il comportamento tecnologico del latte: valutazione attraverso tecniche di microscopia D Incecco P., Limbo S., Hogenboom J.A., Rosi V., Pellegrino L. Dipartimento di Scienze per gli Alimenti, la Nutrizione
Il comportamento tecnologico del latte: valutazione attraverso tecniche di microscopia D Incecco P., Limbo S., Hogenboom J.A., Rosi V., Pellegrino L. Dipartimento di Scienze per gli Alimenti, la Nutrizione
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
mediante proteasi industriali
 Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Analisi della struttura primaria delle proteine
 Analisi della struttura primaria delle proteine Strumenti on-line La maggior parte degli strumenti per l analisi della struttura primaria si trovano on-line all indirizzo www.expasy.org Ottenere la sequenza
Analisi della struttura primaria delle proteine Strumenti on-line La maggior parte degli strumenti per l analisi della struttura primaria si trovano on-line all indirizzo www.expasy.org Ottenere la sequenza
AMMINO ACIDI. L equilibrio è regolato dal ph
 AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
3.3.2. ALIMENTI DI ORIGINE VEGETALE. 3.3.2.1. Verdure
 3.3.2. ALIMENTI DI ORIGINE VEGETALE 3.3.2.1. Verdure Nella Tabella 9 sono riportati i valori degli aminoacidi liberi presenti in alcune fra le più diffuse verdure in commercio. In un passato recente era
3.3.2. ALIMENTI DI ORIGINE VEGETALE 3.3.2.1. Verdure Nella Tabella 9 sono riportati i valori degli aminoacidi liberi presenti in alcune fra le più diffuse verdure in commercio. In un passato recente era
Rivelazione, identificazione, caratterizzazione strutturale
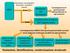 HPLC Separazione cromatografica di proteine e peptidi in miscela Eluato Rivelatore UV (fotodiodi) Cromatogramma UV (picchi generati dall assorbimento di ogni proteina) Eluato Spettrometro di massa ESI-Trappola
HPLC Separazione cromatografica di proteine e peptidi in miscela Eluato Rivelatore UV (fotodiodi) Cromatogramma UV (picchi generati dall assorbimento di ogni proteina) Eluato Spettrometro di massa ESI-Trappola
Federica Nigro Di Gregorio
 Foggia, 7-8 febbraio 2012 Aggiornamento di procedure di campionamento e test in situ, implementazione di sistemi analitici per la determinazione di tossine acquatiche e cianotossine Sviluppo e Ottimizzazione
Foggia, 7-8 febbraio 2012 Aggiornamento di procedure di campionamento e test in situ, implementazione di sistemi analitici per la determinazione di tossine acquatiche e cianotossine Sviluppo e Ottimizzazione
Cap. 1 Interazioni delle molecole con l acqua
 Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Come esprimere i risultati
 Centro MILC Dipartimento Produzioni Animali BVQSA Facoltà di Medicina Veterinaria Università degli Studi di Parma Andrea Summer Analisi del contenuto di k-caseina B in campioni di latte di massa del comprensorio
Centro MILC Dipartimento Produzioni Animali BVQSA Facoltà di Medicina Veterinaria Università degli Studi di Parma Andrea Summer Analisi del contenuto di k-caseina B in campioni di latte di massa del comprensorio
4.2. PRESENZA DI UMAMI NEGLI ALIMENTI ITTICI E DERIVATI
 4.2. PRESENZA DI UMAMI NEGLI ALIMENTI ITTICI E DERIVATI 4.2.1. PESCI, MOLLUSCHI E CROSTACEI Per la compilazione di questa parte, sono affiorati numerosi problemi di natura bibliografica che dimostrano
4.2. PRESENZA DI UMAMI NEGLI ALIMENTI ITTICI E DERIVATI 4.2.1. PESCI, MOLLUSCHI E CROSTACEI Per la compilazione di questa parte, sono affiorati numerosi problemi di natura bibliografica che dimostrano
LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOACIDI
 LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
3.3. UMAMI NEGLI ALIMENTI
 3.3. UMAMI NEGLI ALIMENTI In questo capitolo saranno esaminati i vari cibi, ad esclusione di quelli ittici che verranno presi in considerazione successivamente, allo scopo di scoprire se in essi è presente,
3.3. UMAMI NEGLI ALIMENTI In questo capitolo saranno esaminati i vari cibi, ad esclusione di quelli ittici che verranno presi in considerazione successivamente, allo scopo di scoprire se in essi è presente,
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
Ministero delle politiche agricole alimentari e forestali
 Decreto n._6890 Approvazione del metodo ufficiale di analisi per la determinazione del contenuto di amminoacidi liberi nei formaggi IL DIRETTORE GENERALE DI CONCERTO CON IL DIRETTORE GENERALE PER L'IGIENE
Decreto n._6890 Approvazione del metodo ufficiale di analisi per la determinazione del contenuto di amminoacidi liberi nei formaggi IL DIRETTORE GENERALE DI CONCERTO CON IL DIRETTORE GENERALE PER L'IGIENE
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
AMINOACIDI Struttura. Funzione. Classificazione. Proprietà
 AMINOACIDI Struttura Funzione Classificazione Proprietà 1 STRUTTURA Composti caratterizzati dalla presenza di un gruppo aminico (NH 2 ) e di un gruppo acido (COOH) legati al medesimo carbonio (C). In soluzione
AMINOACIDI Struttura Funzione Classificazione Proprietà 1 STRUTTURA Composti caratterizzati dalla presenza di un gruppo aminico (NH 2 ) e di un gruppo acido (COOH) legati al medesimo carbonio (C). In soluzione
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 5
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Ø Gel Elettroforesi (GE) Ø Spettrometria di Massa (MS)
 Tecniche di indagine nello studio delle PTMs Ø Gel Elettroforesi (GE) Ø Tecniche cromatografiche (LC, HPLC) Ø Spettrometria di Massa (MS) Possono essere utilizzate da sole o in combinazione, direttamente
Tecniche di indagine nello studio delle PTMs Ø Gel Elettroforesi (GE) Ø Tecniche cromatografiche (LC, HPLC) Ø Spettrometria di Massa (MS) Possono essere utilizzate da sole o in combinazione, direttamente
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
LA CARATTERIZZAZIONE ANALITICA
 CRRIZZZION NIIC N DFINIZION D IPICIÀ D IR tefano Cattaneo DeFN - UNII spetti trattati lcune considerazioni sul concetto di tipicità del formaggio a tipicità e il processo di maturazione del ilter dolo
CRRIZZZION NIIC N DFINIZION D IPICIÀ D IR tefano Cattaneo DeFN - UNII spetti trattati lcune considerazioni sul concetto di tipicità del formaggio a tipicità e il processo di maturazione del ilter dolo
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
MINISTERO DELLE POLITICHE AGRICOLE ALIMENTARI E FORESTALI
 MINISTERO DELLE POLITICHE AGRICOLE ALIMENTARI E FORESTALI DECRETO 28 aprile 2014 Approvazione del metodo ufficiale di analisi per la determinazione del contenuto di amminoacidi liberi nei formaggi. (14A03885)
MINISTERO DELLE POLITICHE AGRICOLE ALIMENTARI E FORESTALI DECRETO 28 aprile 2014 Approvazione del metodo ufficiale di analisi per la determinazione del contenuto di amminoacidi liberi nei formaggi. (14A03885)
Applicazione della tecnica ESI-MS/MS all identificazione e quantificazione di molecole complesse Carla Zannoni
 Applicazione della tecnica ESI-MS/MS all identificazione e quantificazione di molecole complesse Carla Zannoni Eni SpA Spettrometria di massa con campione in fase liquida: principi di funzionamento ed
Applicazione della tecnica ESI-MS/MS all identificazione e quantificazione di molecole complesse Carla Zannoni Eni SpA Spettrometria di massa con campione in fase liquida: principi di funzionamento ed
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
moli OH - /mole amminoacido
 ) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
SEMINARIO DI ZOOTECNIA E ALIMENTI FUNZIONALI
 SEMINARIO DI ZOOTECNIA E ALIMENTI FUNZIONALI IL CASO DEL PECORINO PROBIOTICO A. SANTILLO RICERCATORE IN ZOOTECNIA SPECIALE IL FORMAGGIO PECORINO PROBIOTICO La produzione di formaggio pecorino probiotico
SEMINARIO DI ZOOTECNIA E ALIMENTI FUNZIONALI IL CASO DEL PECORINO PROBIOTICO A. SANTILLO RICERCATORE IN ZOOTECNIA SPECIALE IL FORMAGGIO PECORINO PROBIOTICO La produzione di formaggio pecorino probiotico
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine. Solo per uso didattico, vietata la riproduzione, la diffusione o la vendita
 MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
Il metabolismo dell azoto
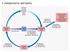 Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Esigenze nutrizionali dei BML
 Esigenze nutrizionali dei BML Esigenze nutrizionali di Oenococcus oeni Esigenze in azoto di Oenococcus oeni Nutrizione nei vini bianchi : Opti ML BLANC Esigenze nutrizionali di O.oeni Zuccheri Azoto É
Esigenze nutrizionali dei BML Esigenze nutrizionali di Oenococcus oeni Esigenze in azoto di Oenococcus oeni Nutrizione nei vini bianchi : Opti ML BLANC Esigenze nutrizionali di O.oeni Zuccheri Azoto É
Spettrometria di Massa applicata alla PROTEOMICA
 Spettrometria di Massa applicata alla PROTEOMICA 1. MALDI-TOF: Determinazione di mappe peptidiche mediante digestione in gel di spot separati su E-2D E da estratti proteici totali Identificazione rapida
Spettrometria di Massa applicata alla PROTEOMICA 1. MALDI-TOF: Determinazione di mappe peptidiche mediante digestione in gel di spot separati su E-2D E da estratti proteici totali Identificazione rapida
ESAME DI MATURITÀ. Opzione specifica biologia e chimica. giugno 2011
 ESAME DI MATURITÀ Opzione specifica biologia e chimica giugno 2011 UCORRELAZIONI Cognome:.......... Nome:.......... Gruppo:.......... Numero:.......... Tempo a disposizione: 60 minuti Punteggio correlazioni:
ESAME DI MATURITÀ Opzione specifica biologia e chimica giugno 2011 UCORRELAZIONI Cognome:.......... Nome:.......... Gruppo:.......... Numero:.......... Tempo a disposizione: 60 minuti Punteggio correlazioni:
06_citologia_SER_golgi 1
 1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
CARATTERIZZAZIONE CHIMICO-FISICA E MICROBIOLOGICA DEL PARMIGIANO-REGGIANO DI 12 MESI
 CARATTERIZZAZIONE CHIMICO-FISICA E MICROBIOLOGICA DEL PARMIGIANO-REGGIANO DI 12 MESI A. Pecorari, G. Gambini, M. Nocetti Consorzio Parmigiano-Reggiano L. Pellegrino, J.A. Hogenboom Distam - Milano Parma,
CARATTERIZZAZIONE CHIMICO-FISICA E MICROBIOLOGICA DEL PARMIGIANO-REGGIANO DI 12 MESI A. Pecorari, G. Gambini, M. Nocetti Consorzio Parmigiano-Reggiano L. Pellegrino, J.A. Hogenboom Distam - Milano Parma,
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, Padova. Tel.
 Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: fulvio.ursini@unipd.it Funzioni delle
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: fulvio.ursini@unipd.it Funzioni delle
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
E. Giordano 16/09/2010
 GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
Il metabolismo delle proteine nei batteri lattici
 Il metabolismo delle proteine nei batteri lattici (http://molgen.biol.rug.nl/molgen/research/lactis/proteolysis.php) La capacità di molte specie batteriche di crescere su un substrato complesso come il
Il metabolismo delle proteine nei batteri lattici (http://molgen.biol.rug.nl/molgen/research/lactis/proteolysis.php) La capacità di molte specie batteriche di crescere su un substrato complesso come il
FORMAGGIO - DETERMINAZIONE DEL CONTENUTO DI AMMINOACIDI LIBERI
 Decreto n. 6890 ALLEGATO : METODO DI ANALISI FORMAGGIO - DETERMINAZIONE DEL CONTENUTO DI AMMINOACIDI LIBERI 1. SCOPO E CAMPO DI APPLICAZIONE Questo standard descrive la determinazione del contenuto di
Decreto n. 6890 ALLEGATO : METODO DI ANALISI FORMAGGIO - DETERMINAZIONE DEL CONTENUTO DI AMMINOACIDI LIBERI 1. SCOPO E CAMPO DI APPLICAZIONE Questo standard descrive la determinazione del contenuto di
L approccio analitico
 L approccio analitico la sequenza analitica Estrazione della frazione aromatica Introduzione in un sistema cromatografico Separazione dei composti dell aroma Riconoscimento e quantificazione L approccio
L approccio analitico la sequenza analitica Estrazione della frazione aromatica Introduzione in un sistema cromatografico Separazione dei composti dell aroma Riconoscimento e quantificazione L approccio
Digestione delle proteine e assorbimento degli aminoacidi
 Digestione delle proteine e assorbimento degli aminoacidi Temperatura La cottura degli alimenti aumenta la digeribilità perché i legami peptidici sono piu accessibili agli enzimi proteolitici Digestione
Digestione delle proteine e assorbimento degli aminoacidi Temperatura La cottura degli alimenti aumenta la digeribilità perché i legami peptidici sono piu accessibili agli enzimi proteolitici Digestione
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Selezione per le Olimpiadi Internazionali della Chimica 2010 Fase nazionale Soluzione dei problemi a risposta aperta
 Selezione per le limpiadi Internazionali della himica 2010 Fase nazionale Soluzione dei problemi a risposta aperta 1. SALI DPPI Identificare il sale GL x (S 4 ) y z 2 1.1 Dato che G reagisce con Mn 4 in
Selezione per le limpiadi Internazionali della himica 2010 Fase nazionale Soluzione dei problemi a risposta aperta 1. SALI DPPI Identificare il sale GL x (S 4 ) y z 2 1.1 Dato che G reagisce con Mn 4 in
Strategie catalitiche
 Strategie catalitiche catalisi acido-base catalisi covalente catalisi da metalli Dati molecolari di alcune proteine Citocromo C (umano) Ribonucleasi A (pancreas di bue) Lisozima (bianco dell uovo) Mioglobina
Strategie catalitiche catalisi acido-base catalisi covalente catalisi da metalli Dati molecolari di alcune proteine Citocromo C (umano) Ribonucleasi A (pancreas di bue) Lisozima (bianco dell uovo) Mioglobina
LE PROTEINE: copolimeri di AMMINOACIDI
 LE PROTEINE: copolimeri di AMMINOACIDI Albumina Dr. Paola Rota e-mail: paola.rota@unimi.it Riassunto lipidi Classe eterogenea di composti (trigliceridi, fosfolipidi, alcune vitamine, alcuni ormoni, colesterolo,
LE PROTEINE: copolimeri di AMMINOACIDI Albumina Dr. Paola Rota e-mail: paola.rota@unimi.it Riassunto lipidi Classe eterogenea di composti (trigliceridi, fosfolipidi, alcune vitamine, alcuni ormoni, colesterolo,
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Indagine sul contenuto di ammine biogene nei vini
 Indagine sul contenuto di ammine biogene nei vini Giuseppe Arfelli * Nicoletta Belletti **, Claudia Corzani **, Alessandra Fabiani **, Rosalba Lanciotti **, Fausto Gardini ** * Dipartimento di Scienze
Indagine sul contenuto di ammine biogene nei vini Giuseppe Arfelli * Nicoletta Belletti **, Claudia Corzani **, Alessandra Fabiani **, Rosalba Lanciotti **, Fausto Gardini ** * Dipartimento di Scienze
Ionizzazione electrospray (ESI)
 Ionizzazione electrospray (ESI) Campione in fase liquida Analizzatore e - - Il potenziale applicato alla fine dell ago e e sufficientemente alto da nebulizzare la soluzione in una miriade di goccioline
Ionizzazione electrospray (ESI) Campione in fase liquida Analizzatore e - - Il potenziale applicato alla fine dell ago e e sufficientemente alto da nebulizzare la soluzione in una miriade di goccioline
DIAGNOSTICA CHIMICA PER LA AUTENTICITA ALIMENTARE. BIOTEC AGRO C.R. Enea - Trisaia
 DIAGNOSTICA CHIMICA PER LA AUTENTICITA ALIMENTARE Dott. ssa Mara Miglietta BIOTEC AGRO C.R. Enea - Trisaia La crescente domanda di qualità degli alimenti da parte dei consumatori corrisponde ad una maggiore
DIAGNOSTICA CHIMICA PER LA AUTENTICITA ALIMENTARE Dott. ssa Mara Miglietta BIOTEC AGRO C.R. Enea - Trisaia La crescente domanda di qualità degli alimenti da parte dei consumatori corrisponde ad una maggiore
Cellule somatiche del latte e resa casearia
 Cellule somatiche del latte e resa casearia 28 settembre Prodotti lattiero caseari: innovazione e tendenze verso il futuro.. Di cosa parleremo Definiremo le cellule somatiche Gli effetti sulla produzione
Cellule somatiche del latte e resa casearia 28 settembre Prodotti lattiero caseari: innovazione e tendenze verso il futuro.. Di cosa parleremo Definiremo le cellule somatiche Gli effetti sulla produzione
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Antimo Di Maro. Lezione 3. Corso di Laurea in Scienze Biologiche
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Esercitazione Esempi di domande del test intermedio
 Esercitazione Esempi di domande del test intermedio Materiale occorrente : Calcolatrice Penna Matita Righello Gomma Severamente vietato servirsi di libri, appunti, telefoni cellulari Quindi..!!!!! la legge
Esercitazione Esempi di domande del test intermedio Materiale occorrente : Calcolatrice Penna Matita Righello Gomma Severamente vietato servirsi di libri, appunti, telefoni cellulari Quindi..!!!!! la legge
Nuovi parametri di valutazione della qualità del latte
 Nuovi parametri di valutazione della qualità del latte Centro MILC Dipartimento Produzioni Animali BVQSA Facoltà di Medicina Veterinaria Università degli Studi di Parma Cos è la qualità del latte? Il concetto
Nuovi parametri di valutazione della qualità del latte Centro MILC Dipartimento Produzioni Animali BVQSA Facoltà di Medicina Veterinaria Università degli Studi di Parma Cos è la qualità del latte? Il concetto
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Struttura secondaria
 Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Purificazione e de novo sequencing di Pol1 e Pol2 due nuovi peptidi antibatterici isolati dalla saliva di larve di Polistes dominulus
 Purificazione e de novo sequencing di Pol1 e Pol2 due nuovi peptidi antibatterici isolati dalla saliva di larve di Polistes dominulus Interazione ospite-patogeno Gli insetti non hanno un sistema di difesa
Purificazione e de novo sequencing di Pol1 e Pol2 due nuovi peptidi antibatterici isolati dalla saliva di larve di Polistes dominulus Interazione ospite-patogeno Gli insetti non hanno un sistema di difesa
LA SPETTROMETRIA DI MASSA
 LA SPETTROMETRIA DI MASSA Tecnica che consente di caratterizzare e identificare composti sconosciuti e noti in base alla determinazione della loro massa molecolare e alla loro caratterizzazione strutturale
LA SPETTROMETRIA DI MASSA Tecnica che consente di caratterizzare e identificare composti sconosciuti e noti in base alla determinazione della loro massa molecolare e alla loro caratterizzazione strutturale
FABBISOGNO CALORICO kcal kcal
 FABBISOGNO CALORICO DONNA UOMO 1500-2000 kcal 2000-2500 kcal Al contrario di quanto accade per i carboidrati e i lipidi non esistono riserve di proteine. Le proteine, come tutti i componenti cellulari,
FABBISOGNO CALORICO DONNA UOMO 1500-2000 kcal 2000-2500 kcal Al contrario di quanto accade per i carboidrati e i lipidi non esistono riserve di proteine. Le proteine, come tutti i componenti cellulari,
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
CROMATOGRAFIA IONICA (IC)
 CROMATOGRAFIA IONICA (IC) CROMATOGRAFIA CROMATOGRAFIA IONICA RESINE A SCAMBIO IONICO Struttura Meccanismo di scambio STRUMENTAZIONE IC SOPPRESSORE A MEMBRANA PROTOCOLLO DI ANALISI CROMATOGRAFIA Analisi
CROMATOGRAFIA IONICA (IC) CROMATOGRAFIA CROMATOGRAFIA IONICA RESINE A SCAMBIO IONICO Struttura Meccanismo di scambio STRUMENTAZIONE IC SOPPRESSORE A MEMBRANA PROTOCOLLO DI ANALISI CROMATOGRAFIA Analisi
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Scaricato da 21/01/2011
 Al contrario di quanto accade per glucidi e lipidi non esistono riserve di proteine. 1 2 Gli aa in eccesso non vengono messi in riserva ma utilizzati come combustibili metabolici. Non più del 10-15% dell
Al contrario di quanto accade per glucidi e lipidi non esistono riserve di proteine. 1 2 Gli aa in eccesso non vengono messi in riserva ma utilizzati come combustibili metabolici. Non più del 10-15% dell
Università degli Studi G. d Annunzio. Chieti-Pescara. Dipartimento di FARMACIA INTERNATO DI LABORATORIO OFFERTA FORMATIVA A SCELTA A.A.
 Università degli Studi G. d Annunzio Chieti-Pescara Dipartimento di FARMACIA INTERNATO DI LABORATORIO OFFERTA FORMATIVA A SCELTA A.A. 2015/2016 PROGETTO FORMATIVO riservato a tutti i docenti afferenti
Università degli Studi G. d Annunzio Chieti-Pescara Dipartimento di FARMACIA INTERNATO DI LABORATORIO OFFERTA FORMATIVA A SCELTA A.A. 2015/2016 PROGETTO FORMATIVO riservato a tutti i docenti afferenti
Analisi di tossine algali tramite cromatografia liquida/spettrometria di massa
 Analisi di tossine algali tramite cromatografia liquida/spettrometria di massa Sara Bogialli, Antonio Di Corcia e-mail: sara.bogialli@uniroma1.it Università di Roma, La Sapienza Dipartimento di Chimica
Analisi di tossine algali tramite cromatografia liquida/spettrometria di massa Sara Bogialli, Antonio Di Corcia e-mail: sara.bogialli@uniroma1.it Università di Roma, La Sapienza Dipartimento di Chimica
Una procedura in HS-SPME GC-MS per lo screening delle principali droghe ricreazionali
 Una procedura in HS-SPME GC-MS per lo screening delle principali droghe ricreazionali (a cura di Stefano Gentili Dipartimento del Farmaco, ISS) Un numero crescente di droghe cosiddette ricreazionali (ecstasy
Una procedura in HS-SPME GC-MS per lo screening delle principali droghe ricreazionali (a cura di Stefano Gentili Dipartimento del Farmaco, ISS) Un numero crescente di droghe cosiddette ricreazionali (ecstasy
Amminoacidi e proteine Dagli amminoacidi come building-blocks alla struttura quaternaria
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Amminoacidi e proteine Dagli amminoacidi come building-blocks alla struttura quaternaria
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Amminoacidi e proteine Dagli amminoacidi come building-blocks alla struttura quaternaria
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Emivita delle proteine
 Emivita delle proteine Ornitina decarbossilasi: 30 min, HMGCoA red: ~ 2-4 h Possiedono alto turn over inoltre: Enzimi nella biosintesi dei nucleotidi timinici (Ribonucleotide red, timidilato sintetasi)
Emivita delle proteine Ornitina decarbossilasi: 30 min, HMGCoA red: ~ 2-4 h Possiedono alto turn over inoltre: Enzimi nella biosintesi dei nucleotidi timinici (Ribonucleotide red, timidilato sintetasi)
Aminoacidi. Struttura generale Sono 20 e formano le
 Aminoacidi Struttura generale Sono 20 e formano le proteine. Oltre a questi ne esistono altri meno comuni Alcuni subiscono modificazioni dopo essere stati inseriti nelle proteine Altri stanno nell organismo
Aminoacidi Struttura generale Sono 20 e formano le proteine. Oltre a questi ne esistono altri meno comuni Alcuni subiscono modificazioni dopo essere stati inseriti nelle proteine Altri stanno nell organismo
CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI
 DIPARTIMENTO DI SCIENZE CHIMICHE Corso di laurea magistrale in Chimica organica e bioorganica Anno accademico 2017/2018-1 anno CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI CHIM/06-6 CFU
DIPARTIMENTO DI SCIENZE CHIMICHE Corso di laurea magistrale in Chimica organica e bioorganica Anno accademico 2017/2018-1 anno CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI CHIM/06-6 CFU
cognome e nome turno banco data Indicare i CALCOLI per ESTESO Nei RIQUADRI TRATTEGGIATI riportare i dati con le CIFRE SIGNIFICATIVE appropriate
 PREPARAZIONE e STANDARDIZZAZIONE di una SOLUZIONE di ACIDO CLORIDRICO densità HCl (aq) conc. (g/ml) % peso prelievo HCl (aq) conc. (ml) mmoli HCl = volume matraccio (ml) titolo previsto HCl (aq) diluito
PREPARAZIONE e STANDARDIZZAZIONE di una SOLUZIONE di ACIDO CLORIDRICO densità HCl (aq) conc. (g/ml) % peso prelievo HCl (aq) conc. (ml) mmoli HCl = volume matraccio (ml) titolo previsto HCl (aq) diluito
Batteri lattici nella produzione di formaggi. Dr.ssa Marialuisa Callegari Università Cattolica del Sacro Cuore
 Batteri lattici nella produzione di formaggi FORMAGGIO... si può definire come il prodotto della maturazione della "cagliata" ottenuta con la coagulazione presamica o acida del latte intero o del latte
Batteri lattici nella produzione di formaggi FORMAGGIO... si può definire come il prodotto della maturazione della "cagliata" ottenuta con la coagulazione presamica o acida del latte intero o del latte
Luogo di consegna: Dipartimento di Scienze Chimiche, Complesso Universitario di Monte S. Angelo, Ed. 5B, locale 2Mc-20a, Via Cinthia, NAPOLI.
 ALLEGATO 22 (pag. 1/3) Nome attrezzatura: HPLC-MS/MS Lotto: 2 Luogo di consegna: Dipartimento di Scienze Chimiche, Complesso Universitario di Monte S. Angelo, Ed. 5B, locale 2Mc-20a, Via Cinthia, 80126
ALLEGATO 22 (pag. 1/3) Nome attrezzatura: HPLC-MS/MS Lotto: 2 Luogo di consegna: Dipartimento di Scienze Chimiche, Complesso Universitario di Monte S. Angelo, Ed. 5B, locale 2Mc-20a, Via Cinthia, 80126
Perché analizzare il contenuto di k-caseina B
 Perché analizzare il contenuto di k-caseina B Centro MILC Dipartimento Produzioni Animali BVQSA Facoltà di Medicina Veterinaria Università degli Studi di Parma Andrea Summer Le frazioni azotate del latte
Perché analizzare il contenuto di k-caseina B Centro MILC Dipartimento Produzioni Animali BVQSA Facoltà di Medicina Veterinaria Università degli Studi di Parma Andrea Summer Le frazioni azotate del latte
REGISTRO DELLE LEZIONI 2005/2006. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
M/z: Nozioni di Spettrometria di Massa e di Proteomica Applicata alla Biomedicina
 Laboratorio Proteomica M/z: Nozioni di Spettrometria di Massa e di Proteomica Applicata alla Biomedicina Marco Gaspari Argomenti Nozioni di analisi proteomica Gel elettroforesi bidimensionale Elementi
Laboratorio Proteomica M/z: Nozioni di Spettrometria di Massa e di Proteomica Applicata alla Biomedicina Marco Gaspari Argomenti Nozioni di analisi proteomica Gel elettroforesi bidimensionale Elementi
Biologia Molecolare. CDLM in CTF La riparazione del DNA
 Biologia Molecolare CDLM in CTF 2010-2011 La riparazione del DNA I tipi di mutazione e le conseguenze Le classi di danno al DNA Meccanismi di riparazione La necessità di codificare l informazione L informazione
Biologia Molecolare CDLM in CTF 2010-2011 La riparazione del DNA I tipi di mutazione e le conseguenze Le classi di danno al DNA Meccanismi di riparazione La necessità di codificare l informazione L informazione
METABOLISMO DEGLI AMMINOACIDI
 PRINCIPI NUTRITIVI METABOLISMO DEGLI AMMINOACIDI Nel corso della digestione le proteine vengono degradate in amminoacidi. Contrariamente ai carboidrati, gli amminoacidi non vengono immagazzinati, ma vengono
PRINCIPI NUTRITIVI METABOLISMO DEGLI AMMINOACIDI Nel corso della digestione le proteine vengono degradate in amminoacidi. Contrariamente ai carboidrati, gli amminoacidi non vengono immagazzinati, ma vengono
Modulo 3. Lavorare con le proteine
 Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
RISOLUZIONE ENO 8/2007 DOSAGGIO DEL LISOZIMA NEL VINO CON CROMATOGRAFIA LIQUIDA AD ALTA PRESTAZIONE
 RISOLUZION NO 8/2007 DOSAGGIO DL LISOZIMA NL VINO CON CROMATOGRAFIA LIQUIDA AD ALTA PRSTAZION L ASSMBLA GNRAL, Considerato l Articolo 2 paragrafo 2 iv dell accordo istitutivo dell Organizzazione Internazionale
RISOLUZION NO 8/2007 DOSAGGIO DL LISOZIMA NL VINO CON CROMATOGRAFIA LIQUIDA AD ALTA PRSTAZION L ASSMBLA GNRAL, Considerato l Articolo 2 paragrafo 2 iv dell accordo istitutivo dell Organizzazione Internazionale
2. SISTEMA DI PURIFICAZIONE CROMATOGRAFICA A MEDIA PRESSIONE (Biotage).
 1. APPARECCHIO PER REAZIONI A MICROONDE (Cem). Apparecchio per reazioni a microonde con sistema di sfiato automatico delle sovrappressioni, che consente di condurre reazioni che superano i 300 psi (20
1. APPARECCHIO PER REAZIONI A MICROONDE (Cem). Apparecchio per reazioni a microonde con sistema di sfiato automatico delle sovrappressioni, che consente di condurre reazioni che superano i 300 psi (20
