Struttura e meccanismo d azione degli enzimi
|
|
|
- Mariana Vacca
- 7 anni fa
- Visualizzazioni
Transcript
1 Macromolecole Biologiche Chimica Biologica A.A Struttura e meccanismo d azione degli enzimi
2 Catalisi chimica Catalisi chimica: teoria dello stato di transizione - descrizione microscopica del sistema: le molecole di reagenti per trasformarsi prodotti procedono lungo una traiettoria di reazione questo progresso viene descritto da una coordinata di reazione diagramma dello stato di transizione o diagramma della coordinata di reazione (correla l energia libera alla coordinata di reazione) il punto di massima G corrisponde allo stato di transizione (o complesso attivato)
3 Catalisi chimica Catalisi chimica: teoria dello stato di transizione A, B = reagenti P = prodotto A + B X P X = stato di transizione punto della reazione corrispondente al max di energia libera Coordinata di reazione: percorso di minima energia libera lungo il quale i reagenti si avvicinano l un l altro ΔG reazione < 0 reazione spontanea ΔG = energia libera di attivazione
4 Catalisi chimica Correlazione tra velocità di una reazione ed energia di attivazione K A + B X k P A, B = reagenti k P = prodotto A + B P velocità della reazione: d[p] = k [A][B] = k [X ] dt k = costante di velocità ordinaria della reazione elementare k = costante di velocità di decomposizione di X nei prodotti assunzione: anche se instabile, X è in rapido equilibrio con i reagenti [X K = ] costante di equilibrio [A][B] K può essere espressa come: -RT ln K = ΔG
5 Catalisi chimica Correlazione tra velocità di una reazione ed energia di attivazione d[p] = k [A][B] = k [X ] = k K [A][B] = k exp (-ΔG /RT) [A][B] dt la velocità di reazione non dipende solo dalla concentrazione dei reagenti ma diminuisce in modo esponenziale con ΔG (differenza tra l energia libera dello stato di transizione e quello dei reagenti) maggiore è ΔG meno stabile è lo stato di transizione più lenta è la reazione k = k exp (-ΔG /RT) = (K B T/h) exp (-ΔG /RT) K B = costante di Boltzmann = J K -1 h = costante di Plank = J s R = costante dei gas = 8.31 J mol -1 K -1
6 Catalisi chimica Correlazione tra velocità di una reazione ed energia di attivazione K A + B X k P k = costante di velocità di decomposizione di X nei prodotti lo stato di transizione è stabilizzato da un legame debole che può rompersi alla prima escursione vibrazionale k = κν ν = frequenza vibrazionale del legame che si spezza quando X si decompone κ = coeff. di trasmissione (0-1) (probabilità che la rottura di sia nella direzione della formazione del prodotto)
7 Catalisi chimica Correlazione tra velocità di una reazione ed energia di attivazione k = κν K A + B X k P ν = ε/h ε = energia media della vibrazione che porta alla decomposizione di X h = costante di Plank ad una temperatura T l energia classica di un oscillatore è K B = costante di Boltzmann ε = K B T (energia termica disponibile) k = κν = K B T/h k = k exp (-ΔG /RT) = (K B T/h) exp (-ΔG /RT) si assume κ = 1 all aumentare di T e quindi dell energia termica disponibile, aumenta la velocità della reazione
8 Catalisi chimica Correlazione tra velocità di una reazione ed energia di attivazione - passaggio attraverso lo stato di transizione: s - la decomposizione dello stato di transizione nei prodotti (o viceversa, nei reagenti) è il processo che determina la velocità di reazione totale A I P I = intermedio di reazione 2 stati di transizione 2 energie di attivazione - la tappa con lo stato di transizione a maggior energia libera determina la velocità di reazione
9 Catalisi chimica I catalizzatori riducono l energia libera di attivazione I catalizzatori si combinano temporaneamente con i reagenti promuovendo così il loro ingresso nella condizione reattiva dello stato di transizione abbassano il ΔG non alterano ΔG reazione (reazione spontanea diretta se ΔG reazione < 0, altrimenti inversa) accelerano allo stesso modo la reazione diretta e quella inversa (la reazione raggiunge l equilibrio più velocemente) ΔΔG cat = efficienza del catalizzatore = ΔG noncat -ΔG cat
10 Catalisi chimica I catalizzatori riducono l energia libera di attivazione d[p] = k exp (-ΔG /RT) [A][B] dt aumento di velocità: rapporto fra velocità di reazione catalizzata e non catalizzata exp(-δg cat /RT) / exp(-δg noncat /RT) = exp(δg noncat -ΔG cat)/rt = exp(δδg cat) dove ΔΔG cat = efficienza del catalizzatore Esempio: a T = 25 C (298 K) aumento di velocità di 10 volte ΔΔG ~ 5.71 kj/mol (meno della metà dell energia libera di un tipico legame a idrogeno) aumento di velocità di 10 6 volte ΔΔG ~ 34 kj/mol (piccola frazione dell energia libera della maggior parte dei legami covalenti)
11 Catalisi chimica I catalizzatori riducono l energia libera di attivazione si consideri la conversione di A in P: A P k F k R se in assenza di un catalizzatore la costante di velocità da A a P è, per esempio, k F 10-4 s -1 mentre la costante di velocità della reazione inversa è k R 10-6 s -1 la costante di equilibrio è K = k F / k R = [P]/[A] = 100 all equilibrio la concentrazione di P è 100 volte quella di A tale valore non cambia se la reazione è catalizzata, ma l equilibrio si raggiunge più in fretta
12 Proprietà generali degli enzimi Catalisi enzimatica - le diverse proteine svolgono funzioni biologiche cui si fa riferimento col termine di attività biologica: ogni specie proteica ha una propria attività biologica - gli enzimi sono i catalizzatori biologici - l attività biologica di un enzima è una specifica attività catalitica: capacità di accelerare una determinata reazione chimica - gli enzimi aumentano la velocità delle reazioni chimiche abbassando la barriera di energia libera che separa i reagenti dai prodotti - i reagenti di una reazione catalizzata da un enzima sono detti substrati di quell enzima
13 Proprietà generali degli enzimi Interazioni enzima-ligandi nella trasformazione del substrato in prodotto - gli enzimi agiscono legando transientemente substrati, intermedi, stati di transizione, e prodotti della reazione catalizzata - la reazione avviene con queste varie specie che si trasformano da reagenti in prodotti mantenendosi in complesso con l enzima - l enzima crea un ambiente in cui lo stato di transizione è stabilizzato e in cui la reazione procede quindi più velocemente di quando avviene quando le specie coinvolte sono in forma libera
14 Proprietà generali degli enzimi Interazioni enzima-ligandi nella trasformazione del substrato in prodotto una reazione catalizzata enzimaticamente procede con un meccanismo diverso da quella non catalizzata, con stati di transizione aventi una ΔG inferiore
15 Proprietà generali degli enzimi Catalisi chimica e catalisi enzimatica - gli enzimi catalizzano specifiche reazioni chimiche attraverso meccanismi di per sé molto simili a quelli operanti nella normale catalisi chimica - il meccanismo catalitico di un enzima è sempre una combinazione di più meccanismi elementari di catalisi chimica - il processo catalitico di un enzima interessa principalmente una porzione della molecola della proteina enzimatica, detta sito attivo - nel sito attivo sono presenti vari gruppi funzionali, detti gruppi catalitici, disposti e orientati in modo opportuno per legare i substrati e promuovere la loro trasformazione nei prodotti
16 Proprietà generali degli enzimi - le reazioni catalizzate dagli enzimi sono: volte più veloci delle reazioni non catalizzate queste reazioni di fatto non avvengono senza catalizzatore alcuni ordini di grandezza più veloci delle reazioni catalizzate chimicamente
17 Proprietà generali degli enzimi Differenze rispetto ai normali catalizzatori chimici (1) velocità di reazione più elevate (2) condizioni di reazione più blande: T < 100 C, P = P atm, ph ~ neutro (una catalisi chimica efficiente invece può richiedere T e P elevate e ph estremi) (3) capacità di regolazione: - controllo allosterico - modificazione covalente degli enzimi - variazione della quantità di enzima sintetizzato (4) elevata specificità di reazione: nel riconoscimento dei substrati e prodotti (raramente si hanno prodotti collaterali)
18 Proprietà generali degli enzimi (4) elevata specificità di reazione i substrati (ed altre molecole) si legano ai siti attivi (cavità interne o fessure superficiali) degli enzimi mediante interazioni non-covalenti - complementarità geometrica - complementarità elettronica - modelli per l interazione enzima-substrato: modello chiave-serratura modello dell adattamento indotto - in realtà il sito attivo più che essere complementare al substrato, è complementare allo stato di transizione
19 Proprietà generali degli enzimi Modello chiave-serratura siti di legame pre-strutturati, complementarità fra sito attivo enzima e substrato e nessun cambio conformazionale dovuto al legame del substrato Modello dell adattamento indotto siti di legame pre-strutturati, ma cambi conformazionali dovuti al legame del substrato
20 Proprietà generali degli enzimi (4) elevata specificità di reazione (4a) stereospecificità - specificità nel legare substrati chirali e nel catalizzare le loro reazioni - intrinseca asimmetria dei siti attivi (formati solo da L-AA) - quasi tutti gli enzimi che partecipano a reazioni chirali sono assolutamente stereospecifici Esempio: Aconitasi (ciclo dell acido citrico) Citrato = molecola prochirale diventa chirale per sostituzione di uno dei 2 gruppi carbossimetilici CH 2 COO - interazione asimmetrica (su 3 punti) fra citrato ed enzima
21 Proprietà generali degli enzimi (4) elevata specificità di reazione (4b) specificità geometrica - selettività nel riconoscimento dell identità dei gruppi chimici dei substrati - gli enzimi possono avere una specificità geometrica molto variabile - preferenza (più che specificità geometrica) quando i substrati accettati sono svariati (esempio: gli enzimi digestivi) Esempio: Chimotripsina mancanza di specificità anche per il tipo di reazione catalizzata (eccezione alla regola) idrolisi di legame peptidico ed estere
22 Proprietà generali degli enzimi Nomenclatura degli Enzimi IUBMB (International Union of Biochemistry and Molecular Biology): organismo internazionale che si occupa della classificazione funzionale e sistematica degli enzimi e della loro denominazione - classificazione e denominazione in base alla reazione catalizzata - ad ogni enzima sono assegnati 2 nomi e 1 numero: Nome d uso raccomandato (nome comunemente usato, spesso di origine storica ) Nome sistematico (nome dei substrati + termine con suffisso asi, che definisce il tipo di reazione) Numero di classificazione
23 Proprietà generali degli enzimi Numero di classificazione formato: (EC X.Y.Z.W) esempio: EC EC : Enzyme Commission X: Classe Y: Sottoclasse Z: Sotto-sottoclasse W: numero individuale Nomenclatura degli Enzimi - esistono 6 classi principali di reazioni enzimatiche
24 Proprietà generali degli enzimi Nomenclatura degli Enzimi Classe di enzimi Reazioni catalizzate 1. Ossidoriduttasi Reazioni di ossidoriduzione 2. Transferasi Trasferimento di gruppi funzionali 3. Idrolasi Reazioni di idrolisi 4. Liasi Reazioni di eliminazione con formazione di doppi legami 5. Isomerasi Isomerizzazioni 6. Ligasi Formazione di legami accoppiata all idrolisi di ATP
25 Nomenclatura degli Enzimi Proprietà generali degli enzimi
26 Proprietà generali degli enzimi Nomenclatura degli Enzimi Esempi: alcool deidrogenasi alcool:nad + ossidoriduttasi EC carbossipeptidasi A peptidil-l-amminoacido-idrolasi EC (nome raccomandato) (nome sistematico) (numero di classificazione) (nome raccomandato) (nome sistematico) (numero di classificazione)
27 Cofattori Cofattori e Coenzimi i gruppi funzionali delle proteine sono molto adatti per: - partecipare a reazioni acido-base -formare legami covalenti transitori - partecipare ad interazioni carica-carica meno adatti per: - catalizzare reazioni di ossidoriduzione - catalizzare processi con trasferimenti di gruppi Cofattori molti enzimi agiscono con l ausilio di specifiche sostanze non peptidiche: i cofattori
28 Cofattori Cofattori e Coenzimi Cofattori Ioni metallici (Cu 2+, Fe 3+, Zn 2+ ) Coenzimi (molecole organiche) Cosubstrati Gruppi prostetici Cosubstrati: sono associati transientemente all enzima e quindi funzionano da cosubstrati Gruppi prostetici: sono permanentemente associati all enzima, spesso anche con legami covalenti Oloenzima = complesso enzima-cofattore cataliticamente attivo Apoenzima = proteina inattiva a seguito della rimozione del cofattore
29 Cofattori Ioni metallici - effetti tossici di alcuni ioni metallici: Cd 2+ e Hg 2+ possono sostituire lo Zn 2+ (stesso gruppo della tavola periodica ) nel sito attivo di certi enzimi inattivandoli
30 Cofattori Coenzimi a) I coenzimi devono essere rigenerati - per completare un ciclo catalitico, i coenzimi che vengono modificati chimicamente devono tornare al loro stato originale cosubstrati la reazione può essere catalizzata da un enzima diverso gruppi prostetici la reazione avviene come fase (separata) della sequenza della reazione enzimatica
31 Cofattori Coenzimi Esempio: NAD + e NADP + trasportatori intracellulari di elettroni Riduzione: trasferimento di 2 atomi di idrogeno H o di uno ione idruro H: - e di un protone H + ADH = alcool deidrogenasi
32 Cofattori Coenzimi b) Molte vitamine sono precursori di coenzimi - molti organismi non sono in grado di sintetizzare alcuni coenzimi o parti di essi tali parti sono introdotti con la dieta attraverso le vitamine - negli organismi superiori i meccanismi di sintesi delle vitamine sono andati persi evolutivamente - solo le vitamine idrosolubili sono precursori di cofattori (non quelle liposolubili come la vitamina A e D)
33 Cofattori Coenzimi b) Molte vitamine sono precursori di coenzimi
34 Cofattori Coenzimi b) Molte vitamine sono precursori di coenzimi
35 Meccanismi di Catalisi Meccanismi di Catalisi i catalizzatori riducono l energia libera dello stato di transizione ΔG stabilizzando lo stato di transizione della reazione catalizzata l efficienza degli enzimi è dovuta alla loro specificità nel legare i substrati combinata alla disposizione dei gruppi catalitici classificazione meccanismi di catalisi 1) Catalisi acido-base 2) Catalisi covalente 3) Catalisi favorita da ioni metallici 4) Effetti di prossimità e orientamento 5) Legame preferenziale dello stato di transizione
36 Meccanismi di Catalisi Catalisi acida generale Catalisi acido-base l energia libera dello stato di transizione di una reazione viene abbassato a seguito del trasferimento temporaneo di un protone da un acido Esempio: tautomerizzazione cheto-enolica reazione non catalizzata reazione lenta: elevata energia libera dello stato di transizione, simile ad un carbanione catalisi acida generale donazione di un protone all atomo di O riduzione del carattere carbanionico dello stato di transizione aumento velocità reazione
37 Meccanismi di Catalisi Catalisi basica generale Catalisi acido-base l energia libera dello stato di transizione di una reazione viene abbassato a seguito della sottrazione temporanea di un protone da parte di una base Esempio: tautomerizzazione cheto-enolica reazione non catalizzata catalisi basica generale
38 Meccanismi di Catalisi Catalisi acido-base reazioni acido-basiche catalizzate in modo concertato reazioni soggette contemporaneamente a catalisi acida e basica generale le catene laterali di Asp, Glu, His, Cys, Tyr e Lys hanno un valore di pk nell ambito del ph fisiologico possono agire come catalizzatori acidi e/o basici l attività catalitica di questi enzimi è sensibile al ph (influenza sullo stato di protonazione delle catene laterali ) andamento a campana della velocità della reazione catalizzata in funzione del ph molti enzimi sono attivi nell ambito di un ristretto valore di ph (5-9)
39 Meccanismi di Catalisi Catalisi acido-base un gruppo ionizzabile sarà più efficiente nel trasferire protoni a ph prossimi al suo pk tuttavia il pk di un gruppo può variare di diverse unitàda quello atteso, a seconda del microambiente in cui si trova il ph, oltre che sullo stato di ionizzazione delle catene laterali, ha influenza anche su: - il legame del substrato all enzima - la ionizzazione del substrato - le variazioni strutturali dell enzima
40 Meccanismi di Catalisi Residui implicati nella catalisi acido-base pk a ~4 ~ ~8.3 ~6 ~10
41 Meccanismi di Catalisi Esempio di reazione acido-base concertata RNasi A (pancreas bovino) enzima digestivo (secreto dal pancreas nell intestino tenue) idrolisi di RNA nei nucleotidi componenti velocità di reazione ph-dipendente coinvolgimento di 2 residui ionizzabili con pk 5.54 e 6.4 (2 residui His) RNasi S (forma attiva, legame peptidico idrolizzato) + analogo del substrato non digeribile
42 Meccanismi di Catalisi Esempio di reazione acido-base concertata Reazione 1: His 12 (base generale) sottrae un protone dal gruppo ossidrile 2 dell RNA, promuovendo l attacco nucleofilico all atomo di fosforo His 119 (acido generale) promuove la scissione del legame protonando il gruppo uscente formazione di un intermedio poliribonuleotidico contenente un gruppo fosfodiestere 2,3 -ciclico all estremità 3 -terminale Reazione 2: dopo che il gruppo uscente si allontana entra H 2 O His 12 (acido generale), His 119 (base generale)
43 Meccanismi di Catalisi Catalisi covalente la reazione viene accelerata mediante la formazione transitoria di un legame covalente fra il catalizzatore (gruppo nucleofilico) ed il substrato (gruppo elettrofilico) catalisi nucleofilica 3 tappe concettuali: 1. formazione del legame covalente catalizzatore-substrato mediante reazione nucleofilica 2. perdita di elettroni dal centro di reazione ad opera del catalizzatore (ora elettrofilico) 3. eliminazione del catalizzatore (reazione inversa della 1.)
44 Meccanismi di Catalisi Catalisi covalente la nucleofilicità di una sostanza è correlata alla sua basicità la catalisi covalente assomiglia a quella basica salvo il fatto che si forma un legame covalente invece della privazione di un H + dal substrato più stabile è il legame covalente più sarà difficile romperlo e proseguire nella catalisi un buon catalizzatore covalente deve combinare 2 proprietà apparentemente contraddittorie: (a) alta nucleofilicità (b) capacità di formare un gruppo che abbandoni facilmente l enzima gli intermedi covalenti formano il prodotto desiderato reagendo in un secondo passaggio della reazione con: (a) una molecola di acqua (b) un secondo substrato
45 Meccanismi di Catalisi Gruppi nucleofilici: Catalisi covalente - carichi negativamente - contengono coppie di e - non condivisi in grado di formare facilmente legami covalenti con centri poveri di elettroni Esempi: Proteine gruppo amminico non protonato (Lys), gruppo carbossilico (Asp), gruppo imidazolico (His), gruppo tiolico (Cys), gruppo ossidrilico (Ser) Coenzimi tiamina pirofosfato (fermentazione alcolica) piridossal fosfato (deamminazione a.a.)
46 Meccanismi di Catalisi Centri elettrofilici dei substrati: Catalisi covalente - gruppi carichi positivamente - guscio elettronico di valenza non completo - atomi elettronegativi Esempi: gruppo fosforico, gruppo acilico, gruppo glicosilico
47 Meccanismi di Catalisi Catalisi favorita da ioni metallici ~ 1/3 degli enzimi richiede ioni metallici per l attività catalitica metalloenzimi: metalli di transizione (Fe 2+, Fe 3+, Cu 2+, Zn 2+, Mn 2+, Co 2+ ) legati saldamente all enzima ruolo catalitico enzimi attivati da metalli: metalli alcalini, alcalini-terrosi (Na +, K +, Mg 2+, Ca 2+ ) legati debolmente all enzima ruolo strutturale 3 diversi possibili ruoli catalitici: 1) si legano al substrato orientandolo correttamente per la reazione 2) partecipano a reazioni di ossido-riduzione mediante cambiamento reversibile del loro numero di ossidazione 3) stabilizzano elettrostaticamente o proteggono le cariche negative (o l aumento di densità elettronica) che possono svilupparsi durante la reazione
48 Meccanismi di Catalisi Catalisi favorita da ioni metallici - in molte reazioni si comportano come un protone che neutralizza una carica negativa, ma sono più efficienti perché possono essere più concentrati a ph neutro (dove [H + ] = 10-7 M) e con carica > rendono più acide le molecole d acqua ad essi legate, cioè le rendono fonte di ioni idrossido OH nucleofilici anche a valori di ph minori della neutralità Esempio: Anidrasi carbonica CO 2 + H 2 O HCO 3 + H +
49 Meccanismi di Catalisi Catalisi favorita da effetti di prossimità e orientamento I reagenti devono venire in contatto nella giusta relazione spaziale 1) gli enzimi portano i substrati in contatto con i gruppi catalitici e, in reazioni a più substrati, i substrati fra loro aumento velocità di un fattore ~5 2) gli enzimi legano i substrati nelle orientazioni più produttive affinché la reazione abbia luogo aumento velocità di un fattore ~100 (diversa reattività delle molecole a seconda della loro orientazione.
50 Meccanismi di Catalisi Catalisi favorita da effetti di prossimità e orientamento 3) gruppi carichi possono aiutare a stabilizzare lo stato di transizione della reazione ( catalisi elettrostatica ) e possono guidare substrati polari verso il sito attivo 4) gli enzimi stabilizzano/bloccano i movimenti (traslazionali e rotazionali) relativi tra i substrati ed i gruppi catalitici (nello stato di transizione) aumento di velocità di un fattore fino a ~10 7 ) Penalizzazione entropica: diminuzione di entropia dovuta all avvicinamento reciproco ordinato di substrati e gruppi catalitici con formazione di orientamento reattivo l energia libera necessaria per superare tale diminuzione di entropia è fornita dall energia di legame del(i) substrato(i) all enzima (valori negativi di ΔΗ)
51 Meccanismi di Catalisi Catalisi favorita dal legame preferenziale dello stato di transizione - un enzima può legare lo stato di transizione con una affinità maggiore rispetto a quella dei suoi substrati e prodotti ne aumenta la concentrazione e quindi proporzionalmente la velocità di reazione - gli enzimi forzano i substrati verso la geometria dello stato di transizione mediante siti di legame nei quali i substrati non distorti non si legano perfettamente ΔΔG cat = efficienza del catalizzatore = ΔG noncat -ΔG cat = ΔG N -ΔG E exp(δδg cat /RT) = aumento di velocità di reazione
52 Meccanismi di Catalisi Catalisi favorita dal legame preferenziale dello stato di transizione aumento di velocità di 10 6 volte a 25 C ΔΔG ~ 34 kj/mol se lo stato di transizione viene stabilizzato con soli 2 legami a H in più, non presenti fra enzima e substrato affinità di legame per lo stato di transizione 10 6 volte > che al substrato - un buon substrato non deve necessariamente legarsi con alta affinità al suo enzima, ma lo farà dopo essere stato attivato a stato di transizione - gli analoghi dello stato di transizione sono potenti inibitori dell enzima
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
Catalisi. Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A Modulo di Biologia Strutturale
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
CLASSIFICAZIONE ENZIMI
 CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cr Mn Fe Co Ni Cu Zn. Chimica Inorganica Biologica Vita ed Energia
 Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
 Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Conce& chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Conce& chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
 SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia.
 La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 12 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 12 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1
 REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Le reazioni chimiche
 Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
PROGRAMMA DISCIPLINARE SVOLTO a. s / N.B. il programma è pubblico ad uso degli studenti e delle famiglie.
 Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe.
 INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Il trasporto del glucosio
 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico
 Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico Dalla glicolisi alla fosforilazione ossidativa NAD + e NADP + Sono coinvolti nelle reazioni di trasferimento dell idruro H: -. Tutte le reazioni
Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico Dalla glicolisi alla fosforilazione ossidativa NAD + e NADP + Sono coinvolti nelle reazioni di trasferimento dell idruro H: -. Tutte le reazioni
Gerard Tortora, Brian Derrickson. Conosciamo
 1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Appunti di Stechiometria per Chimica Numero d ossidazione
 Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Reazioni di ossido-riduzione
 Reazioni di ossido-riduzione Secondo la teoria di Bronsted-Lowry le reazioni acido-base possono essere considerate processi di scambio protonico HCl + H 2 O Cl - + H 3 O + Cl H O H H Cl H O H H In questi
Reazioni di ossido-riduzione Secondo la teoria di Bronsted-Lowry le reazioni acido-base possono essere considerate processi di scambio protonico HCl + H 2 O Cl - + H 3 O + Cl H O H H Cl H O H H In questi
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
L acqua. Ci devono essere delle forze che tengono saldamente insieme le molecole d acqua
 L acqua Comparata a molecole con caratteristiche atomiche simili e di grandezza comparabile, l acqua presenta alcune caratteristiche peculiari Comparando l idruro dell ossigeno con gli idruri degli elementi
L acqua Comparata a molecole con caratteristiche atomiche simili e di grandezza comparabile, l acqua presenta alcune caratteristiche peculiari Comparando l idruro dell ossigeno con gli idruri degli elementi
Capitolo 4 Reazioni degli alcheni
 himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
La cinetica chimica. Velocità media di reazione
 La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Termodinamica dei sistemi biologici
 Bioenergetica Termodinamica dei sistemi biologici La bioenergetica è lo studio quantitativo delle trasduzioni energetiche, cioè dei cambiamenti di energia da una forma ad un altra Le trasformazioni biologiche
Bioenergetica Termodinamica dei sistemi biologici La bioenergetica è lo studio quantitativo delle trasduzioni energetiche, cioè dei cambiamenti di energia da una forma ad un altra Le trasformazioni biologiche
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Seminario. Ciclo di Krebs 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A
 Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Composti carbonilici Acidi carbossilici
 Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Tavola Periodica degli Elementi: Gruppi e Periodi
 La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
DESTINI DEL PIRUVATO
 DESTINI DEL PIRUVATO LA GLICOLISI RILASCIA SOLO UNA PICCOLA PARTE DELL ENERGIA TOTALE DISPONIBILE NELLA MOLECOLA DI GLUCOSIO Le due molecole di piruvato prodotte dalla glicolisi sono ancora relativamente
DESTINI DEL PIRUVATO LA GLICOLISI RILASCIA SOLO UNA PICCOLA PARTE DELL ENERGIA TOTALE DISPONIBILE NELLA MOLECOLA DI GLUCOSIO Le due molecole di piruvato prodotte dalla glicolisi sono ancora relativamente
Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine
 Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine Struttura di alcuni antibiotici -lattamici Meccanismo d azione della penicillina La penicillina inibisce la transpeptidasi,
Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine Struttura di alcuni antibiotici -lattamici Meccanismo d azione della penicillina La penicillina inibisce la transpeptidasi,
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
a. La Piruvato chinasi catalizza il trasferimento di un gruppo fosfato dal fosfoenolpiruvato all adenosina
 apitolo 18 Risposte a Domande interne al capitolo 18.1 (p. 548) a. La Piruvato chinasi catalizza il trasferimento di un gruppo fosfato dal fosfoenolpiruvato all adenosina difosfato. b. L alanina transaminasi
apitolo 18 Risposte a Domande interne al capitolo 18.1 (p. 548) a. La Piruvato chinasi catalizza il trasferimento di un gruppo fosfato dal fosfoenolpiruvato all adenosina difosfato. b. L alanina transaminasi
Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale
 Ciclo di Krebs 1 Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale 2 Complesso della piruvato deidrogenasi (2) FAD Diidrolipoil deidrogenasi Piruvato decarbossilasi E 3 Diidrolipoil
Ciclo di Krebs 1 Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale 2 Complesso della piruvato deidrogenasi (2) FAD Diidrolipoil deidrogenasi Piruvato decarbossilasi E 3 Diidrolipoil
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 16 Classificazione e nomenclatura dei composti 3 Sommario 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 16 Classificazione e nomenclatura dei composti 3 Sommario 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Le proteine che legano l ossigenol
 Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Fosforilazione ossidativa
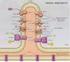 Chimica Biologica A.A. 2010-2011 Fosforilazione ossidativa Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Teoria Chemiosmotica ΔG = 2.3 RT (ph (matrice) -ph (spazio
Chimica Biologica A.A. 2010-2011 Fosforilazione ossidativa Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Teoria Chemiosmotica ΔG = 2.3 RT (ph (matrice) -ph (spazio
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
ENZIMI. A + B AB (100 Kcal= E. Attiv.) A + B AB (50 Kcal) SUBSTRATO ENZIMA E N E R G I A
 ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Energia di attivazione
 Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Composti organici del silicio
 Composti organici del silicio e B C N O F Ne P S Ar Br Kr : 1s 2 2s 2 2p 6 3s 2 3p 2 3d 0 Il silicio è un elemento della seconda riga della tavole periodica, è più grande, meno elettronegativo e più polarizzabile
Composti organici del silicio e B C N O F Ne P S Ar Br Kr : 1s 2 2s 2 2p 6 3s 2 3p 2 3d 0 Il silicio è un elemento della seconda riga della tavole periodica, è più grande, meno elettronegativo e più polarizzabile
Le interazioni deboli:
 Le interazioni deboli: sono legami non covalenti sono da 1 a 3 ordini di grandezza più deboli dei legami covalenti sono alcune volte maggiori della tendenza a dissociare dovuta all agitazione termica delle
Le interazioni deboli: sono legami non covalenti sono da 1 a 3 ordini di grandezza più deboli dei legami covalenti sono alcune volte maggiori della tendenza a dissociare dovuta all agitazione termica delle
Acidi carbossilici e derivati
 Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
DISSOLUZIONE DEI SALI IN ACQUA
 1 DISSLUZINE DEI SALI IN ACQUA 1. La dissoluzione di un sale è un equilibrio. 2. Diversi Sali hanno diverse solubilità (K ps ). 3. La solubilità dipende dall energia del reticolo ionico (U) e dall entalpia
1 DISSLUZINE DEI SALI IN ACQUA 1. La dissoluzione di un sale è un equilibrio. 2. Diversi Sali hanno diverse solubilità (K ps ). 3. La solubilità dipende dall energia del reticolo ionico (U) e dall entalpia
ENZIMI. Catalizzatori delle reazioni biologiche
 ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
Nomenclatura chimica
 Nomenclatura chimica Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione
Nomenclatura chimica Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione
Chimica Biologica A.A. 2010-2011. Bioenergetica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano e Metabolismo - nel metabolismo, reazioni in sé non spontanee (endoergoniche) possono
Chimica Biologica A.A. 2010-2011 Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano e Metabolismo - nel metabolismo, reazioni in sé non spontanee (endoergoniche) possono
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale.
 Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 22 Acidi e basi si scambiano protoni 3 Sommario 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. La forza
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 22 Acidi e basi si scambiano protoni 3 Sommario 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. La forza
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
B. Classificazione degli organismi 1. Autotrofi - si nutrono da soli a. ottengono il carbonio dalla CO 2 b. fonte di energia - fotosintetica: uso
 Outline Classificazione degli organismi Energia e metabolismo Energia libera Composti ad alta energia Ossidazione, riduzione e trasferimento energetico Ruolo degli enzimi Introduzione A. La vita è organica
Outline Classificazione degli organismi Energia e metabolismo Energia libera Composti ad alta energia Ossidazione, riduzione e trasferimento energetico Ruolo degli enzimi Introduzione A. La vita è organica
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Combustione. Energia chimica. Energia termica Calore. Combustibili fossili
 Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
LE MOLECOLE BIOLOGICHE
 LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
