STRUTTURA E FUNZIONE DELLE PROTEINE
|
|
|
- Uberto Gigli
- 5 anni fa
- Visualizzazioni
Transcript
1 STRUTTURA E FUNZIONE DELLE PROTEINE
2
3 PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica specifica
4 Le proteine di sostegno e alcune di quelle contrattili hanno una forma fibrosa Sono costituite da catene polipeptidiche allungate, disposte in fasci lungo uno stesso asse a costituire le fibre Sono insolubili in acqua Gli enzimi, gli anticorpi e le proteine di trasporto hanno invece una forma globulare Le catene sono strettamente avvolte in forma compatta, sferica o globulare, come un gomitolo Sono solubili in acqua
5 La struttura delle proteine ne determina la funzione Le proteine costituiscono il 40-70% del peso secco di una cellula Le proteine sono singole catene, non ramificate di monomeri amino acidici Nell organismo umano ne sono presenti centinaia ma solo 20 che compongono le proteine. Per la sintesi di una proteina devono essere presenti tutti contemporaneamente La sequenza degli amino acidi di una proteina ne determina la sua struttura tridimensionale (conformazione) A sua volta, la struttura di una proteina ne determina la funzione
6 Tutti gli amino acidi hanno la stessa struttura generale ma ciascuno differisce per il gruppo R
7
8 Quattro livelli di struttura determinano la forma di una proteina alfa Beta Primaria: la sequenza lineare degli amino acidi Secondaria: l organizzazione di parti di una catena polipeptidica (esempio: l α elica o il foglietto β) Terziaria: la struttura tridimensionale completa di una catena polipeptidica Quaternaria: l associazione di due o più polipeptidi in una struttura complessa multi-subunità
9 La caratteristica distintiva di ogni proteina è la particolare sequenza di aminoacidi Il dogma centrale della genetica
10 FORMAZIONE DEL LEGAME PEPTIDICO
11 I legami peptidici uniscono gli amino acidi in catene lineari
12 Delocalizzazione degli e - Le parziali caratteristiche di doppio legame impediscono la libera rotazione attorno al legame peptidico, C-N, che costituisce così un punto di rigidità della catena polipeptidica
13
14 LEGAME PEPTIDICO: C N = nm C N = nm C = N = nm
15 Ogni piano delle unità peptidiche ha due rotazioni possibili: una intorno al legame Cα-C' (angolo di rotazione Ψ, psi), ed una intorno al legame N-Cα (angolo di rotazione φ, phi). La configurazione preferenziale del gruppo peptidico è quella in cui i due Cα sono in posizione trans, in modo che i gruppi R consecutivi sono alla massima distanza l'uno dall'altro (minor ingombro sterico).
16
17 N-Carbonio α (Φ) (psi); Carbonio α Carbonio Carbonilico (ψ) (fi) Un'ulteriore conseguenza della risonanza che interessa il legame peptidico è che gli atomi che compongono il cosiddetto gruppo peptidico (i due atomi, C ed N, del legame stesso e i 4 atomi ad essi legati: O, H e i due carboni α) giacciono tutti su uno stesso piano (legame rigido e planare). Lo scheletro di una catena polipeptidica può essere rappresentato come una serie di piani rigidi
18 d
19 Peptidi e proteine Sono polimeri lineari di 20 tipi di monomeri Peptidi: polimeri più piccoli (5.000 Dalton) Di-, tripeptidi (2, 3 aa) Oligopeptidi (< 10 aa) Polipeptidi (> 10 aa) Proteine: polimeri più lunghi ( aa) con una struttura definita.
20
21
22 Legami caratterizzanti: ponte di H
23
24
25
26
27 Una comune struttura secondaria Proprietà dell alfa-elica: Resistenza e solubilità in acqua Proposta nel 1951 da Pauling e Corey
28 Ogni idrogeno ammidico è coinvolto in un legame idrogeno con il carbonile di un altro amminoacido
29 Le principali strutture secondarie di una catena polipetidica: α elica MODELLO A PALLE E BASTONCINI a) Elica destrorsa, b) Si evidenziano i legami idrogeno c) Il passo dell elica è 5.4 Å o 3.6 residui amminoacidici
30 Strutture secondarie: l α elica MODELLO A NASTRO
31 Nei foglietti pieghettati ci sono ancora dei legami ad idrogeno, ma stavolta sono tra fogli adiacenti (sheet) Legame a H Filamento β Filamento β
32 Ad esempio la seta. Le proteine della seta sono un esempio di foglietto pieghettato Sono composte principalmente da glicina e alanina
33 il foglietto β
34 Filamento β: conformazione ripetitiva, lo scheletro della proteina è disposto a zig-zag. Ogni filamento si dispone affianco all altro formando un foglietto pieghettato mantenuto da legami a H tra regioni adiacenti o molto lontane della stessa catena o di catene differenti. I gruppi R sporgono verso l esterno. I filamenti possono avere la stessa direzione (paralleli) o opposte (antiparalleli). La struttura è identica, solo il periodo è differente 6.5 rispetto a 7 A.
35
36
37
38
39
40 Come si orientano i legami negli amminoacidi? alfa elica Guardate i carbonili! Nell alfa elica sono alternati, mentre nei foglietti pieghettati puntano nella stessa direzione
41 Le strutture secondarie sono preferite Le strutture secondarie consentono, infatti, l'instaurarsi del maggior numero di legami a H tra i gruppi dello scheletro polipeptidico ed impediscono a quest'ultimo di interagire con l'ambiente acquoso
42 ORIGINE DELLA STRUTTURA TERZIARIA
43
44 L'effetto idrofobico è la forza motrice del ripiegamento di una proteina e ne
45 Le strutture terziarie sono sempre compatte La superficie delle proteine è polare mentre l'interno è prevalentemente apolare
46 L'avvolgimento della catena deve essere tale da esporre sempre al solvente acquoso le catene laterali idrofile. Catene laterali cariche possono trovarsi all interno di una proteina solo se la loro carica netta viene neutralizzata.
47 Legami responsabili della struttura terziaria Forze di Wan der Waals Legami a H Legami ionici Legami S-S 1-2 Kcal/mole 3-7 Kcal/mole 5 Kcal/mole 50 Kcal/mole
48
49
50
51
52
53 Catene polipeptidiche con più di 200 residui presentano 2 o più zone ( residui) a struttura globulare e compatta, congiunte da segmenti di catena relativamente flessibili. Queste strutture si definiscono
54 Un dominio può essere separato mediante idrolisi controllata, dal resto della catena polipeptidica. Il domino può riassumere nuovamente la struttura e spesso anche la funzione che aveva quando era unita al resto della catena polipeptidica.
55 Nel 1974 è stato scoperto il ripiegamento di Rosman, uno dei domini più ampiamente distribuito, formato da 70 residui con una super struttura secondaria del tipo βαβαβ. E presente in numerose proteine enzimatiche, anche a struttura molto diversa, ma che hanno in comune la funzione di legare un coenzima nucleotidico (NAD ).
56 ripiegamento di Rosman
57 ripiegamento di Rosman
58 E' stata avanzata l'ipotesi che questo dominio sia quello che resta di una primitiva proteina di epoche precellulari. Tutti gli organismi viventi discendono da pochi progenitori, così la grande maggioranza delle proteine deve essere derivata da un numero ristretto di archetipi
59 I genomi eucariotici sono costruiti in modo da facilitare la riorganizzazione occasionale di sequenze di DNA atte a creare un gene che codifichi per nuove combinazioni di domini proteici
60 La struttura terziaria di una proteina globulare costituita da più domini é la conseguenza della organizzazione dei vari domini e di tratti di struttura secondaria che li congiungono.
61 Proteine che possiedono piu' siti di legame per ligandi distinti spesso presentano questi siti di legame localizzati su diversi domini. Domini diversi in proteine multifunzionali possono svolgere funzioni diverse. I vari domini presenti su una proteina mostrano talvolta spostamenti reciproci relativi, collegati all'attività della proteina. (Es. Esochinasi)
62
63
64
65
66
67 Nelle cellule le proteine si sintetizzano ad una velocità molto elevata. Le cellule di E.Coli producono una molecola proteica biologicamente attiva contenente 100 residui aminoacidici in 5 sec a 37.
68 COME FANNO LE PROTEINE AD AVVOLGERSI NEL TEMPO DI POCHI SECONDI?
69 Supponiamo che ciascuno dei 2 angoli di torsione, φ ψ, di una proteina con n residui possa assumere 3 conformazioni stabili, le conformazioni possibili per questa proteina saranno 3 2n circa 10 n Se la proteina può esplorare una conformazione ogni secondi Il tempo in sec necessario per esplorare tutte le conformazioni possibili sarà t = 10 n / Per n= 100 t = ( 20 miliardi di anni!)
70 Le proteine non ricercano casualmente la conformazione nativa fra le molte possibili si ripiegano seguendo vie dirette
71 PICCOLI TRATTI DI STRUTTURA SECONDARIA SERVONO DA MEDIATORI DEL PROCESSO DI AVVOLGIMENTO.
72 LA FORMAZIONE DI CORTI SEGMENTI DI STRUTTURA SECONDARIA È MOLTO VELOCE.
73 Questi piccoli tratti (circa 15 residui) si stabilizzano formando dei complessi (es 2α, 2β, αβ) che si chiamano unità di avvolgimento. Intorno a questi centri si stabilizzano poi altri tratti di struttura secondaria
74
75 L'avvolgimento spontaneo delle catene polipeptidiche nella loro corretta struttura terziaria è un processo altamente cooperativo, in cui la formazione di piccoli elementi accelera la produzione di altri più grandi
76 Il processo di ripiegamento di una proteina procede da uno stato ad alta energia ed alta entropia ad uno a bassa energia e bassa entropia
77 Il processo di avvolgimento delle proteine può essere accelerato dall enzima proteina disolfuro isomerasi
78 PDI ossidata Proteina disolfuro isomerasi PDI ridotta Proteina ridotta Disolfuro misto Proteina ossidata (nativa)
79 PDI ridotta Ponti S-S non nativi Disolfuro misto Ponti S-S nativi
80 Per alcune proteine a tale processo partecipano gli chaperoni molecolari che : contribuiscono al corretto avvolgimento di una proteina nascente consentono alle proteine ripiegate in modo non corretto di raggiungere la conformazione nativa
81 Esistono due classi di chaperoni molecolari : la famiglia Hsp70 e le chaperonine (Hps60 o GroEL ed o Hsp10 GroES )
82
83
84 Le chaperonine sono costituite da due tipi di proteine HP60 (GroEL) e HP10 (GroES) GroEL 14 subunità identiche (549 aa) disposte in due anelli sovrapposti (7+7) GroES 7 subunità identiche (97aa) formano un anello eptamerico
85
86 Le proteine con peso molecolare superiore a sono OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ
87 Le proteine oligomeriche presentano un ulteriore livello di organizzazione srutturale la struttura quaternaria LA STRUTTURA QUATERNARIA descrive il modo in cui le singole catene polipeptidiche sono disposte l'una rispetto all'altra.
88
89 Vantaggi della struttura quaternaria Risparmio di DNA Minimizzazione degli errori casuali durante la biosintesi proteica Presenza di interazioni allosteriche
90 Per la sintesi di una catena polipeptidica di 4000 residui aminoacidici è necessario un gene che contenga almeno 4OOO x 3 = basi azotate. Per la sintesi di 2O copie di una stessa catena polipeptidica di 200 residui è sufficiente un gene che contenga solo 200 x 3 = 600 basi
91 LA GLICERALDEIDE-3-FOSFATO DEIDROGENASI È COSTITUITA DA 4 SUBUNITÀ IDENTICHE DI 330 RESIDUI (330 X 3 = 990 NUCLEOTIDI) SE LA PROTEINA CONSISTESSE IN 1 CATENA DI (330 X 4) 1320 RESIDUI OCCORREREBBE UN GENE DI 3 X 1320=3960 NUCLEOTIDI.
92 La Ferritina ha un peso molecolare di circa daltons. Non è costituita da una sola catena polipeptidica di 4000 a.a. ma di 20 catene identiche di circa 200 residui ciascuna.
93
94
95 Generalmente nella formazione delle proteine oligomeriche le subunità difettose sono scartate.
96 LA STRUTTURA QUATERNARIA DI UNA PROTEINA PUÒ SUBIRE MODIFICHE CONFORMAZIONALI REVERSIBILI AD OPERA DI LIGANDI, DEFINITI EFFETTORI ALLOSTERICI. LE MODIFICHE CONFORMAZIONALI POSSONO ALTERARE LA FUNZIONE DI UNA PROTEINA, REALIZZANDO IN TAL MODO UN IMPORTANTE MECCANISMO DI CONTROLLO DELLA SUA ATTIVITÀ BIOLOGICA.
97 La struttura quaternaria delle proteine La struttura quaternaria riguarda proteine costituite da 2 o più catene polipeptidiche o da più domini strutturali (es. proteine regolatrici). E possibile classificare le proteine in due gruppi: Proteine fibrose con catene disposte in lunghi fasci o foglietti e Proteine globulari con catene polipeptidiche ripiegate a formare forme globulari o sferiche Esempio: la emoglobina Le interazioni tra le subunità consentono grandi variazioni nell attività catalitica Biofisica
98 La struttura terziaria è generata dal ripiegamento e dalla conformazione della catena polipeptidica. La struttura quaternaria è l organizzazione di polipeptidi in un unica unità funzionale che consiste di più di una subunità polipeptidica.
99 L informazione per il folding della proteina è contenuta nella sequenza
100 Proteine denaturare al calore, con acidi, o chimici perdono la struttura terziaria e secondaria e la funzione biologica. Il processo è reversibile
101 Le chaperonine assistono le proteine nella fase di folding, prevenendo il legame con ligandi inappropriati.
102
103 Molte malattie sono dovute al difettoso ripiegamento di una proteina Alcune patologie derivano da proteine che non sono in grado di raggiungere la loro struttura funzionale e che tendono a formare grossi aggregati (fibrille o forme amiloidi): Alzheimer, Parkinson, encefalopatia spongiforme, diabete di tipo II. In altri casi mutazioni puntiformi generano proteine che non raggiungono la loro locazione finale o che non sono più in grado di svolgere la loro funzione perché incapaci di legare i loro substrati. La fibrosi cistica è un difetto nella proteina transmembrana che agisce come un canale degli ioni cloro nelle cellule epiteliali (CFTR: 1480 amminoacidi). La mutazione più comune è la delezione di un amminoacido (Phe 508) e la proteina mutata non si avvolge correttamente.
104 Proteine conformate in modo aberrante sono implicate nello sviluppo di patologie Una placca amiloide nella malattia di Alzheimer è un agglomerato di filamenti proteici
105 Comparazione sequenze Hum αglobina: Bovis: Pig: mvlspadktn vkaawgkvga hageygaeal mvlsaadkgn vkaawgkvgg haaeygaeal vlsaadkan vkaawgkvgg qagahgaeal ermflsfptt ktyfphfdls hgsaqvkghg kkvadaltna vahvddmpna ermflsfptt ktyfphfdls hgsaqvkghg akvaaaltka vehlddlpga ermflgfptt ktyfphfnls hgsdqvkahg kvadaltka vghlddlpga lsalsdlhah klrvdpvnfk llshcllvtl aahlpaeftp avhasldkfl lselsdlhah klrvdpvnfk llshsllvtl ashlpsdftp avhasldkfl lsalsdlhah klrvdpvnfk llshcllvtl aahhpddfnp svhasldkfl asvstvltsk yr anvstvltsk yr anvstvltsk yr
106 L omologia delle sequenze suggerisce relazioni funzionali ed evolutive tra le proteine
107 I peptidi ed i polipeptidi biologicamente attivi hanno dimensioni molto variabili (diverso numero di aminoacidi, diversa composizione, diversa sequenza) es. - Insulina con le sue due catene: alfa (21aa) e beta (30aa). - Glucagone (29 aa), - Somatostatina (14, 28aa) - Ossitocina (9 aa) - Vasopressina (9aa) - Glutatione (3aa)
108 L'insulina è costituita da due catene polipeptidiche (α più piccola di 21 aa e β più grande di 30 aa), tenute insieme da ponti disolfuro che si formano tra le cisteine 7 e 20 della catena α e le cisteine 7 e 19 della catena β. L'insulina viene prodotta a partire dalla proinsulina tramite taglio proteolitico di un peptide di congiunzione di 33 aa. Questo peptide è chiamato peptide C, mentre l'enzima responsabile del taglio proteolitico è detto endopeptidasi 33aa 21aa * * * * 30aa
109 Alcuni ricercatori notarono che nell'insulina umana sono presenti delle regioni variabili, in particolare la sequenza degli aminoacidi n 28 e 29 (P ro-lys) della catena β; successivamente si scoprì che invertendo tali aa. l'insulina passava direttamente allo stato monomerico, saltando quello dimerico. Nacque così la "Lys Pro" o "insulina rapida", un farmaco particolarmente utile se iniettato in prossimità di un pasto abbondante.
110 Il GLUCAGONE secreto dalle cellule β del pancreas regola il metabolismo nella fase di digiuno. Viene prodotto come pro-ormone (PM18000), e convertito in Glucagone a 29aa (PM 3500) dopo tagli proteolitici. Scoperto nel 1923, due anni dopo l insulina, la sua sequenza fu definita nel 56. La sua sequenza è mantenuta tra le specie, questo lo rende poco immunogeno. Non ha cisteine e ponti disolfuro, perciò è più resistente alla denaturazione alcalina. Mobilizza le riserve energetiche in risposta all ipoglicemia e al digiuno prolungato.
111 La somatostatina viene prodotta: a livello ipotalamico, dal sistema nervoso periferico, pancreatico e nel tratto gastrointestinale. Influenza principalmente quattro processi: la neurotrasmissione, la secrezione ghiandolare, la contrazione della muscolatura liscia e la proliferazione cellulare. Nei mammiferi è codificata da un unico gene Pre-pro pro-somatostatina 116 aa.(24aa N-terminali, peptide segnale). Pro-somatostatina 92 aa. Nei mammiferi il proormone processato ad entrambe le estremità N- e C-terminale Somatostatina-14 (SS-14) Somatostatina-28 (SS-28)
112 ossitocina,: nonapeptide secreto dalla neuroipofisi, implicato nella contrattilità della muscolatura uterina nel parto e nella eiezione del latte durante l allattamento, è implicato anche nei comportamenti sociali, sessuali e materni. Gly-Leu-Pro-Cys-Cys-Asn-Gln-Ile-Tyr
113 La vasopressina, ormone antidiuretico (ADH) o diuretina, di natura peptidica secreta dall'ipofisi posteriore, ma prodotta a livello ipotalamico. La vasopressina gioca un ruolo importante nella regolazione del volume plasmatico, contribuisce a mantenere costante la parte liquida del sangue, plasma. Favorisce, infatti, il riassorbimento di acqua a livello renale (più precisamente nei tubuli distali e nei dotti collettori dei nefroni), opponendosi alla produzione di urina (o diuresi); da qui il nome antidiuretico. Più il suo livello è alto e minore sarà la produzione di urina e viceversa. In assenza di vasopressina, malattia nota come diabete insipido, il soggetto elimina 18 litri di urina al giorno e, di conseguenza, è costretto ad assumere almeno 20 litri di liquidi con la dieta. Se l'aggettivo "antidiuretico" esprime in modo chiaro l'azione fisiologica di questo ormone, altrettanto si può dire del sinonimo "vasopressina". L'ADH, infatti, possiede una seconda, importante, azione, legata alla sua capacità vasocostrittrice. Diminuendo il calibro delle arteriole, la vasopressina è infatti capace di aumentare la pressione arteriosa, anche in maniera sensibile quando è secreta in quantità elevate. Cys-Tyr-Phe-Gln-Asn-Cys-Pro-Arg-Gly S-S
114 Il glutatione è una combinazione dei tre aminoacidi (tripeptide) cisteina, acido glutammico e glicina. γ-l-glutammil-l-cisteinil-glicina AGISCE: Contro i radicali liberi o molecole come perossido di idrogeno, nitriti, nitrati, benzoati e altre. Svolge un'importante azione nel globulo rosso, proteggendo tali cellule da pericoli ossidativi che causerebbero l emolisi. Elemento importante per il suo funzionamento è il NADPH,(derivato dalla vitamina PP ac. Nicotinico e coenzima della Glutatione reduttasi). L E. rigenera il Glutatione ossidato (GSSG) mediante gli e- ceduti dal NADPH con produzione di Glutatione ridotto (GSH) e NADP Nei soggetti favici l'assenza dell enzima glucosio-6-p-deidrogenasi (G6PD) porta ad una minor produzione di NADPH; le fave contengono sostanze ossidanti che portano in queste persone all'emolisi, in quanto il glutatione non possiede abbastanza potere riducente da poter contrastare il danno ossidativo di tali sostanze.
115
116 I peptidi ed i polipeptidi biologicamente attivi hanno dimensioni molto variabili (diverso numero di aminoacidi, diversa composizione, diversa sequenza es. - Ossitocina (9 aa) - Glucagone (29 aa) - Titina (~27000 aa)
117
118 La somatostatina viene prodotta: a livello ipotalamico, dal sistema nervoso periferico, pancreatico e nel tratto gastrointestinale. Influenza principalmente quattro processi: la neurotrasmissione, la secrezione ghiandolare, la contrazione della muscolatura liscia e la proliferazione cellulare. Nei mammiferi è codificata da un unico gene e sintetizzata come parte di un precursore più grande, la pre-pro pro-somatostatina, lungo 116 amminoacidi, caratterizzato all'estremità N-terminale da un peptide segnale di 24 residui. Il precursore è rapidamente trasformato in un peptide lungo 92 amminoacidi, la pro-somatostatina. Nei mammiferi il proormone processato ad entrambe le estremità N- e C-terminale dà due prodotti biologicamente attivi, la somatostatina-14 (SS-14) e la somatostatina-28 (SS-28)
119
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
dominio strutturale dominio modulo
 Riepilogo 2^lezione DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali
Riepilogo 2^lezione DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Modello del collasso idrofobico. Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60
 Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
PROTEINE. Amminoacidi
 PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE
 Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
Peptidi, proteine ed e nzim i i 1
 Peptidi, proteine ed enzimi 1 Gli amminoacidi possono formare catene Due amminoacidi possono unirsi tra loro attraverso il legame ammidico detto legame peptidico, tra il gruppo NH 2 di un amminoacido e
Peptidi, proteine ed enzimi 1 Gli amminoacidi possono formare catene Due amminoacidi possono unirsi tra loro attraverso il legame ammidico detto legame peptidico, tra il gruppo NH 2 di un amminoacido e
corta catena (meno di 20 ammino acidi) mancanza di una struttura spaziale organizzata lunga catena di ammino acidi struttura spaziale organizzata
 STRUTTURA DELLE PROTEINE Peptide: corta catena (meno di 20 ammino acidi) mancanza di una struttura spaziale organizzata Polipeptide (proteina): lunga catena di ammino acidi struttura spaziale organizzata
STRUTTURA DELLE PROTEINE Peptide: corta catena (meno di 20 ammino acidi) mancanza di una struttura spaziale organizzata Polipeptide (proteina): lunga catena di ammino acidi struttura spaziale organizzata
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
la struttura tridimensionale può essere ottenuta solo per Un intero dominio in genere da 50 a 300 residui
 Durante la traduzione l informazione di ripiegamento codificata nella sequenza aminoacidica diventa disponibile in maniera vettoriale la struttura tridimensionale può essere ottenuta solo per Un intero
Durante la traduzione l informazione di ripiegamento codificata nella sequenza aminoacidica diventa disponibile in maniera vettoriale la struttura tridimensionale può essere ottenuta solo per Un intero
Il dogma centrale della biologia. molecolare
 Il dogma centrale della biologia Cell molecolare Transcription Translation Ribosome DNA mrna Polypeptide (protein) L informazione per la sintesi delle proteine è contenuta nel DNA. La trascrizione e la
Il dogma centrale della biologia Cell molecolare Transcription Translation Ribosome DNA mrna Polypeptide (protein) L informazione per la sintesi delle proteine è contenuta nel DNA. La trascrizione e la
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine.
 Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
I LIPIDI (GRASSI) Cosa sono
 I LIPIDI (GRASSI) Cosa sono Comunemente chiamati "grassi", i lipidi comprendono una grande varietà di molecole, accomunate dalla caratteristica di essere insolubili in acqua. I lipidi più importanti dal
I LIPIDI (GRASSI) Cosa sono Comunemente chiamati "grassi", i lipidi comprendono una grande varietà di molecole, accomunate dalla caratteristica di essere insolubili in acqua. I lipidi più importanti dal
Traduzione dell informazione genetica (1)
 Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
aa 2013-14 Proteine Struttura delle Proteine α Amminoacidi
 Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale.
 Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa
 Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Amminoacidi e Proteine
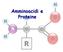 Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
MEMBRANE. struttura: fosfolipidi e proteine
 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
Struttura delle proteine
 Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
- lipidi strutturali, costituenti fondamentali delle membrane cellulari ed intracellulari (fosfolipidi, glicolipidi e colesterolo)
 I lipidi, o grassi, costituiscono un gruppo eterogeneo di sostanze accomunate dalla proprietà fisica della insolubilità nei solventi polari (es. acqua) (idrofobicità) e dalla solubilità nei soventi organici
I lipidi, o grassi, costituiscono un gruppo eterogeneo di sostanze accomunate dalla proprietà fisica della insolubilità nei solventi polari (es. acqua) (idrofobicità) e dalla solubilità nei soventi organici
TRASCRIZIONE DEL DNA, TRADUZIONE DELL RNA
 TRASCRIZIONE DEL DNA, TRADUZIONE DELL RNA TRADUZIONE La traduzione e il processo con cui viene sintetizzata un data proteina, attraverso reazioni chimiche di polimerizzazione di amminoacidi, in una
TRASCRIZIONE DEL DNA, TRADUZIONE DELL RNA TRADUZIONE La traduzione e il processo con cui viene sintetizzata un data proteina, attraverso reazioni chimiche di polimerizzazione di amminoacidi, in una
Rappresentazione dei Dati Biologici
 Rappresentazione dei Dati Biologici CORSO DI BIOINFORMATICA C.d.L. Ingegneria Informatica e Biomedica Outline Proteine ed Amminoacidi Rappresentazione di Amminoacidi Rappresentazione delle strutture Proteiche
Rappresentazione dei Dati Biologici CORSO DI BIOINFORMATICA C.d.L. Ingegneria Informatica e Biomedica Outline Proteine ed Amminoacidi Rappresentazione di Amminoacidi Rappresentazione delle strutture Proteiche
BIOMOLECOLE STRUTTURA E FUNZIONE
 BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
È stimato che oggi sulla terra sono presenti da 10*10 6 a 100*10 6 specie viventi
 È stimato che oggi sulla terra sono presenti da 10*10 6 a 100*10 6 specie viventi Enorme diversità di forme Costanza di struttura interna La cellula è l unità fondamentale di tutti gli organismi viventi
È stimato che oggi sulla terra sono presenti da 10*10 6 a 100*10 6 specie viventi Enorme diversità di forme Costanza di struttura interna La cellula è l unità fondamentale di tutti gli organismi viventi
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Macromolecole Biologiche. I domini (I)
 I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
NUCLEOTIDI e ACIDI NUCLEICI
 NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 7
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 7 La struttura delle proteine Concetti chiave: La struttura terziaria di una proteina descrive il ripiegamentodei suoi elementi
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 7 La struttura delle proteine Concetti chiave: La struttura terziaria di una proteina descrive il ripiegamentodei suoi elementi
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 9
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 9 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 9 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
LA TRADUZIONE E IL CODICE GENETICO
 LA TRADUZIONE E IL CODICE GENETICO La traduzione La traduzione è il processo di sintesi di una catena polipeptidica, un polimero costituito da amminoacidi legati insieme da legami peptidici Le molecole
LA TRADUZIONE E IL CODICE GENETICO La traduzione La traduzione è il processo di sintesi di una catena polipeptidica, un polimero costituito da amminoacidi legati insieme da legami peptidici Le molecole
L integrazione proteica nelle diverse fisiopatologie
 Università degli Studi di Napoli Federico II Corso di Laurea in Scienze della Nutrizione Umana Corso di: Chimica degli Alimenti L integrazione proteica nelle diverse fisiopatologie Prof. Gian Carlo Tenore
Università degli Studi di Napoli Federico II Corso di Laurea in Scienze della Nutrizione Umana Corso di: Chimica degli Alimenti L integrazione proteica nelle diverse fisiopatologie Prof. Gian Carlo Tenore
Università di Roma Tor Vergata - Corso di Laurea in Scienze Biologiche - Immunologia Molecolare - dott. Claudio PIOLI - a.a.
 Anticorpi generalità Riconoscimento antigene Anticorpi Molecole MHC Recettore per l Ag dei linfociti T (TCR) Anticorpi riconoscono diversi tipi di strutture antigeniche macromolecole proteine, lipidi,
Anticorpi generalità Riconoscimento antigene Anticorpi Molecole MHC Recettore per l Ag dei linfociti T (TCR) Anticorpi riconoscono diversi tipi di strutture antigeniche macromolecole proteine, lipidi,
Strutture molecolari della cellula: Bio-macromolecole. Prof. C. Guarino
 Strutture molecolari della cellula: Bio-macromolecole Prof. C. Guarino INTRO Ogni cellula vivente racchiude una pluralità di molecole diverse L acqua è l elemento dominante, nelle cellule vegetali e nei
Strutture molecolari della cellula: Bio-macromolecole Prof. C. Guarino INTRO Ogni cellula vivente racchiude una pluralità di molecole diverse L acqua è l elemento dominante, nelle cellule vegetali e nei
Macromolecole Biologiche. Chimica Biologica A.A. 2010-2011. Struttura Terziaria
 Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Struttura Terziaria Domini e struttura terziaria Struttura terziaria L arrangiamento spaziale degli amminoacidi di una singola catena polipeptidica
Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Struttura Terziaria Domini e struttura terziaria Struttura terziaria L arrangiamento spaziale degli amminoacidi di una singola catena polipeptidica
Macromolecole Biologiche. I domini (III)
 I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
NH 2 CHCOOH AMINOACIDI PRESENTI NELLE PROTEINE. Abbreviazione internazionale. Nome. acido aspartico acido glutammico. CXasparagina.
 Le proteine sono composti organici quaternari; esse sono costituite infatti da C,H,N e O. Pertanto rappresentano l'unica fonte di azoto del nostro organismo. Le proteine si formano per polimerizzazione
Le proteine sono composti organici quaternari; esse sono costituite infatti da C,H,N e O. Pertanto rappresentano l'unica fonte di azoto del nostro organismo. Le proteine si formano per polimerizzazione
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
Laurea Magistrale in Biologia
 Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Costituzione dei viventi
 Costituzione dei viventi La materia e costituita da elementi chimici in forma pura o in combinazioni dette composti 25 dei 92 elementi naturali sono costituenti essenziali dei viventi 4 (C, O,, N) costituiscono
Costituzione dei viventi La materia e costituita da elementi chimici in forma pura o in combinazioni dette composti 25 dei 92 elementi naturali sono costituenti essenziali dei viventi 4 (C, O,, N) costituiscono
Macromolecole Biologiche. I domini (II)
 I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
La biochimica è anche definita la chimica del C :
 Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
Tutte le cellule viventi sono composte da macromolecole simili, costituite dalle stesse piccole molecole di base. La grande diversità è data dalle diverse combinazioni di 4 principali elementi C H O N
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
IL TESSUTO ADIPOSO La funzione del tessuto adiposo, che è costituito da adipociti, è quella di garantire all organismo animale una riserva di
 IL TESSUTO ADIPOSO La funzione del tessuto adiposo, che è costituito da adipociti, è quella di garantire all organismo animale una riserva di energia, prontamente disponibile quando l organismo ne ha bisogno.
IL TESSUTO ADIPOSO La funzione del tessuto adiposo, che è costituito da adipociti, è quella di garantire all organismo animale una riserva di energia, prontamente disponibile quando l organismo ne ha bisogno.
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini.
 I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
I Composti Organici. Le Biomolecole
 I Composti Organici I composti organici sono molecole tutte contenenti carbonio. Essi comprendono. 1. composti di interesse energetico che sono gli Idrocarburi ( i derivati del petrolio), 2. composti a
I Composti Organici I composti organici sono molecole tutte contenenti carbonio. Essi comprendono. 1. composti di interesse energetico che sono gli Idrocarburi ( i derivati del petrolio), 2. composti a
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
Le proteine. Le proteine sono macromolecole che presentano differenze funzionali e strutturali
 Le proteine Le proteine sono macromolecole che presentano differenze funzionali e strutturali LE PROTEINE HANNO FUNZIONI BIOLOGICHE DIVERSE enzimi proteine di trasporto proteine strutturali proteine di
Le proteine Le proteine sono macromolecole che presentano differenze funzionali e strutturali LE PROTEINE HANNO FUNZIONI BIOLOGICHE DIVERSE enzimi proteine di trasporto proteine strutturali proteine di
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Meccanismi molecolari di trasduzione del segnale. Le vie di trasduzione del segnale sono molto specifiche ed estremamente sensibili.
 Meccanismi molecolari di trasduzione del segnale. Le vie di trasduzione del segnale sono molto specifiche ed estremamente sensibili. La sensibilita delle vie di trasduzione dipende da 3 fattori: -l affinita
Meccanismi molecolari di trasduzione del segnale. Le vie di trasduzione del segnale sono molto specifiche ed estremamente sensibili. La sensibilita delle vie di trasduzione dipende da 3 fattori: -l affinita
LAB-NEWS Anno 1 n 4 Aprile 2006
 1 FAVISMO (DEFICIT G6PD) Cos è il deficit di G6PD? Il deficit di G6PD o favismo è una condizione determinata dalla carenza dell enzima glucosio-6-fosfatodeidrogenasi (G6PD), importante in una via metabolica
1 FAVISMO (DEFICIT G6PD) Cos è il deficit di G6PD? Il deficit di G6PD o favismo è una condizione determinata dalla carenza dell enzima glucosio-6-fosfatodeidrogenasi (G6PD), importante in una via metabolica
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE
 MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
mediante proteasi industriali
 Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
Valitutti, Taddei, Kreuzer, Massey, Sadava, Hills, Heller, Berenbaum
 Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
Digestione e assorbimento delle proteine
 Digestione e assorbimento delle proteine Metabolismo delle proteine Le proteine sono formate da catene di α- aminoacidi della serie L uniti tra loro dal legame peptidico Le proteine sono composte da 20
Digestione e assorbimento delle proteine Metabolismo delle proteine Le proteine sono formate da catene di α- aminoacidi della serie L uniti tra loro dal legame peptidico Le proteine sono composte da 20
scaricato da www.sunhope.it
 Recettori a tirosina chinasi I recettori a tirosina chinasi presentano vari domini Una regione di legame (extracellulare) Una regione transmembrana Una coda intracellulare con numerose tirosine scaricato
Recettori a tirosina chinasi I recettori a tirosina chinasi presentano vari domini Una regione di legame (extracellulare) Una regione transmembrana Una coda intracellulare con numerose tirosine scaricato
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in Scienze Biologiche. Insegnamento di. Anno Accademico 2014-15
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2014-15 Lezione 16 Degradazione dei lipidi
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2014-15 Lezione 16 Degradazione dei lipidi
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Dall RNA alle proteine. La traduzione nei procarioti e negli eucarioti
 Dall RNA alle proteine La traduzione nei procarioti e negli eucarioti Codice genetico La sequenza dell mrna viene decodificata a gruppi di tre nucleotidi, e tradotta in una sequenza di amminoacidi 4 x
Dall RNA alle proteine La traduzione nei procarioti e negli eucarioti Codice genetico La sequenza dell mrna viene decodificata a gruppi di tre nucleotidi, e tradotta in una sequenza di amminoacidi 4 x
Mutagenesi: introduzione di alterazioni in una sequenza nucleotidica. Mutagenesi random: le mutazioni avvengono a caso su un tratto di DNA.
 Mutagenesi: introduzione di alterazioni in una sequenza nucleotidica Mutagenesi random: le mutazioni avvengono a caso su un tratto di DNA. In genere si ottengono trattando il DNA con agenti chimici (es.
Mutagenesi: introduzione di alterazioni in una sequenza nucleotidica Mutagenesi random: le mutazioni avvengono a caso su un tratto di DNA. In genere si ottengono trattando il DNA con agenti chimici (es.
Lezione del 24 Ottobre 2014
 MECCANISMI MOLECOLARI DEGLI STATI PATOLOGICI MECCANISMI MOLECOLARI DELLE MALATTIE METABOLICHE Lezione del 24 Ottobre 2014 EZIOLOGIA Studia le cause che inducono un turbamento persistente dell omeostasi
MECCANISMI MOLECOLARI DEGLI STATI PATOLOGICI MECCANISMI MOLECOLARI DELLE MALATTIE METABOLICHE Lezione del 24 Ottobre 2014 EZIOLOGIA Studia le cause che inducono un turbamento persistente dell omeostasi
 TRASDUZIONE DEL SEGNALE LE PRINCIPALI MOLECOLE CHE PROVVEDONO ALLO SCAMBIO DI INFORMAZIONI TRA LE CELLULE SONO FATTORI SOLUBILI QUALI NEUROTRASMETTITORI, ORMONI, FATTORI DI CRESCITA, CITOCHINE. UN CASO
TRASDUZIONE DEL SEGNALE LE PRINCIPALI MOLECOLE CHE PROVVEDONO ALLO SCAMBIO DI INFORMAZIONI TRA LE CELLULE SONO FATTORI SOLUBILI QUALI NEUROTRASMETTITORI, ORMONI, FATTORI DI CRESCITA, CITOCHINE. UN CASO
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE
 MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita i da unoo più domini.
 Idomini(I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita i da unoo più domini. I domini sono definiti come parte
Idomini(I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita i da unoo più domini. I domini sono definiti come parte
Farmaci del sistema nervoso autonomo
 Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
Capitolo 17. Risposte alle domande interne al capitolo. 17.1 (p. 501) a. glicina. b. prolina. c. treonina. d. aspartato
 apitolo 17 Risposte alle domande interne al capitolo 17.1 (p. 501) a. glicina b. prolina c. treonina d. aspartato e. 17.2 (p. 501) a. La glicina è un aminoacido idrofobico. b. La prolina è un aminoacido
apitolo 17 Risposte alle domande interne al capitolo 17.1 (p. 501) a. glicina b. prolina c. treonina d. aspartato e. 17.2 (p. 501) a. La glicina è un aminoacido idrofobico. b. La prolina è un aminoacido
Cellula. Benessere LIPIDOMICA. la Risposta nella. con il. Il profilo lipidomico della membrana cellulare. della
 Benessere Cellula della la Risposta nella LIPIDOMICA con il Il profilo lipidomico della membrana cellulare Spin-off del CNR Consiglio Nazionale delle Ricerche Benessere della Cellula La LIPIDOMICA della
Benessere Cellula della la Risposta nella LIPIDOMICA con il Il profilo lipidomico della membrana cellulare Spin-off del CNR Consiglio Nazionale delle Ricerche Benessere della Cellula La LIPIDOMICA della
GLUCONEOGENESI. Sintesi (GENESI) di nuove (NEO) molecole di glucosio
 GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
Niccolò Taddei Biochimica
 Niccolò Taddei Biochimica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono
Niccolò Taddei Biochimica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono
Nota dell editore Presentazione
 00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
Domini nelle Proteine
 Struttura secondaria, Motivi e Domini nelle Proteine Proprietà generali Le forme ioniche degli aminoacidi, senza considerare alcuna ionizzazione delle catene laterali. Proprietà generali Tutti gli aminoacidi
Struttura secondaria, Motivi e Domini nelle Proteine Proprietà generali Le forme ioniche degli aminoacidi, senza considerare alcuna ionizzazione delle catene laterali. Proprietà generali Tutti gli aminoacidi
Livello di organizzazione degli esseri viventi
 Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
Relazione struttura-funzione
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Relazione struttura-funzione Marco Nardini Dipartimento di Scienze
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Relazione struttura-funzione Marco Nardini Dipartimento di Scienze
Aspetti nutrizionali
 Aspetti nutrizionali Qualità tangibile: Caratteristiche organolettiche: - consistenza (caratt. meccaniche, geometriche, chimiche) - aspetto (forma, dimensione, colore) - aroma (sapore, odore) Caratteristiche
Aspetti nutrizionali Qualità tangibile: Caratteristiche organolettiche: - consistenza (caratt. meccaniche, geometriche, chimiche) - aspetto (forma, dimensione, colore) - aroma (sapore, odore) Caratteristiche
Le Ig sono glicoproteine costituite da 4 catene polipeptidiche:
 Struttura delle Ig Le Ig sono glicoproteine costituite da 4 catene polipeptidiche: 2 catene pesanti H (heavy( heavy) di P.M. 50.000 D, formate da c/a 450 amminoacidi 2 catene leggere L (light) Di P.M.
Struttura delle Ig Le Ig sono glicoproteine costituite da 4 catene polipeptidiche: 2 catene pesanti H (heavy( heavy) di P.M. 50.000 D, formate da c/a 450 amminoacidi 2 catene leggere L (light) Di P.M.
Aggiungendo zinco a questa formula si stabilizza la molecola, che si unisce in esameri e diventa idrofila, Farmacocinetica e legame alle proteine
 Le differenze dell'insulina detemir rispetto all'insulina naturale sono la scomparsa del residuo aminoacido Aggiungendo zinco a questa formula si stabilizza la molecola, che si unisce in esameri e diventa
Le differenze dell'insulina detemir rispetto all'insulina naturale sono la scomparsa del residuo aminoacido Aggiungendo zinco a questa formula si stabilizza la molecola, che si unisce in esameri e diventa
Seminario. Domini modulari delle proteine 1
 Seminario Proteine della matrice DOMINI E MODULI Domini modulari delle proteine 1 La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette
Seminario Proteine della matrice DOMINI E MODULI Domini modulari delle proteine 1 La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette
che è caratteristico degli alcoli (es CH 3 -CH 2 -OH etanolo) gruppo carbonilico che si trova in composti detti chetoni;
 LE BIOMOLECOLE 1. IL CARBONIO E I SUOI COMPOSTI Il carbonio è l'elemento base del mondo vivente. Ciò si deve alla sua particolare capacità di formare 4 legami covalenti, in genere molto forti, o con altri
LE BIOMOLECOLE 1. IL CARBONIO E I SUOI COMPOSTI Il carbonio è l'elemento base del mondo vivente. Ciò si deve alla sua particolare capacità di formare 4 legami covalenti, in genere molto forti, o con altri
 Gruppo EME α β δ ϒ ζ ε A A2 α2β2 97-98 α2δ2 2-3 F Gower1 Gower2 Portland α2 ϒ2 < 1 ζ2ε2 0 α2ε2 0 ζ2ϒ2 0 Periodo fetale Periodo postnatale Varianti strutturali dell emoglobina Emoglobina anomala HbS
Gruppo EME α β δ ϒ ζ ε A A2 α2β2 97-98 α2δ2 2-3 F Gower1 Gower2 Portland α2 ϒ2 < 1 ζ2ε2 0 α2ε2 0 ζ2ϒ2 0 Periodo fetale Periodo postnatale Varianti strutturali dell emoglobina Emoglobina anomala HbS
Lezione 2. Sommario. Bioinformatica. Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi e proteine. Mauro Ceccanti e Alberto Paoluzzi
 Lezione 2 Bioinformatica Mauro Ceccanti e Alberto Paoluzzi Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi e proteine Dip. Informatica e Automazione Università Roma Tre Dip. Medicina Clinica Università
Lezione 2 Bioinformatica Mauro Ceccanti e Alberto Paoluzzi Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi e proteine Dip. Informatica e Automazione Università Roma Tre Dip. Medicina Clinica Università
Chaperon molecolari e ripiegamento delle proteine
 UNIVERSITA DEGLI STUDI DI CAGLIARI Facoltà di Scienze Matematiche, Fisiche e Naturali Dipartimento di Scienze Applicate ai Biosistemi Biochimica e Biologia Molecolare Chaperon molecolari e ripiegamento
UNIVERSITA DEGLI STUDI DI CAGLIARI Facoltà di Scienze Matematiche, Fisiche e Naturali Dipartimento di Scienze Applicate ai Biosistemi Biochimica e Biologia Molecolare Chaperon molecolari e ripiegamento
Gerarchia della struttura delle proteine
 Si indica con CONFORMAZIONE la disposizione tridimensionale degli atomi di una molecola, cioè la loro organizzazione spaziale. Gerarchia della struttura delle proteine struttura primaria: sequenza degli
Si indica con CONFORMAZIONE la disposizione tridimensionale degli atomi di una molecola, cioè la loro organizzazione spaziale. Gerarchia della struttura delle proteine struttura primaria: sequenza degli
Esempio di domande possibili alla prova orale di Biochimica Generale ed Applicata AA 2009-10 Farmacia - FERIOTTO
 Esempio di domande possibili alla prova orale di Biochimica Generale ed Applicata AA 2009-10 Farmacia - FERIOTTO Lo studente spieghi: - Geometria dei legami del carbonio. - Principali gruppi funzionali
Esempio di domande possibili alla prova orale di Biochimica Generale ed Applicata AA 2009-10 Farmacia - FERIOTTO Lo studente spieghi: - Geometria dei legami del carbonio. - Principali gruppi funzionali
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
