CORSO DI FISICA TECNICA. Termodinamica. Prof. Ing. Giulio Vannucci
|
|
|
- Ladislao Ricciardi
- 4 anni fa
- Visualizzazioni
Transcript
1 CORSO DI FISICA ECNICA ermoinamica Prof. Ing. Giulio annucci
2 LA CONSERAZIONE DELL ENERGIA Si efinisce SISEMA una arte ell'universo searata a una suerficie, reale o immaginaria, all'universo circostante, il quale viene enominato AMBIENE. AMBIENE SISEMA Suerficie i searazione AMBIENE
3 A secona elle caratteristiche fisiche ella suerficie i searazione, il sistema è: - ISOLAO: non scambia nè materia nè energia con l'ambiente - CHISO : scambia solo energia, ma non materia, con l'ambiente - APERO : scambia sia materia che energia con l'ambiente - L'AMBIENE CONDIZIONA IL SISEMA (chiuso o aerto) - IL SISEMA NON CONDIZIONA MAI L'AMBIENE
4 Princiio Zero DE SISEMI CHISI, IN CONAO ERMICO RA LORO, cioè in grao i scambiare calore attraverso una arte in comune ella risettiva suerficie i searazione, ENDONO A PORARSI ALLA SESSA EMPERARA. Questo ostulato costituisce il resuosto er tutti gli altri rincii ella ermoinamica e viene talora enominato. tra ue cori in contatto termico il calore fluisce semre a quello a temeratura sueriore a quello a temeratura inferiore (ciò è conseguenza el secono rinciio ella ermoinamica).
5 Primo Princiio ella ermoinamica Energia otale = Energia Cinetica + Energia Potenziale L'energia cinetica è quella el baricentro el sistema. La ermoinamica consiera sistemi con baricentro fisso, cioè one E cinetica = 0. L'energia otenziale,, etta anche ENERGIA INERNA DEL SISEMA, è la somma elle energie relative al moto caotico ei costituenti elementari el sistema (nuclei, elettroni, baricentri molecolari, ecc.), che non moificano la osizione el baricentro el sistema, e ei contributi i tutte le interazioni che ienono alla osizione reciroca istantanea ei costituenti.
6 RASFORMAZIONI DEL SISEMA i. RASFORMAZIONI ALL'INERNO DI N SISEMA ISOLAO, = 0. ii. RASFORMAZIONI ALL'INERNO DI N SISEMA CHISO e/o APERO, # 0. Nel caso (ii) la variazione i energia è ovuta a scambi con l'ambiente, che ossono avvenire secono ue moalità rinciali: FLSSO DI CALORE, cioè trasmissione i energia "isorganizzata". PRODZIONE DI LAORO (meccanico, elettrico, ecc.), cioè trasmissione i energia "organizzata". Per semlicità consiereremo solo i casi in cui il lavoro è i tio meccanico.
7 Il lavoro meccanico è quello che accomagna la comressione o l'esansione el sistema. Il lavoro i comressione è comiuto sul sistema alle forze esterne ell'ambiente, F ex, alicate sulla suerficie i searazione. Il lavoro i esansione viene invece comiuto al sistema contro le forze esterne alicate alla suerficie i searazione. ex in x P ex = P in ± ove x inica lo sostamento infinitesimo ella osizione ella suerficie i searazione e è la conseguente variazione i volume el sistema.
8 Se A è l area ella suerficie i searazione e ex è la ressione che l ambiente esercita sulla suerficie i searazione, F ex = A ex w = F ex x = ex A x = ex = lavoro infinitesimo Se il sistema si esane, > 0, il sistema CEDE energia all'ambiente sotto forma i lavoro, quini w < 0 Analogamente, er < 0, w > 0. Si conviene quini i orre:
9 w = - ex Il rimo rinciio ella ermoinamica sancisce semlicemente che qualunque variazione i energia el sistema eve corrisonere al bilancio comlessivo i calore e lavoro scambiati con l'ambiente. = q q è la quantità infinitesima i calore scambiata con l'ambiente e = ex.
10 è un ifferenziale esatto (infatti la variazione finita i iene solo all'energia ello stato iniziale e a quella ello stato finale el rocesso consierato), w e q non sono semre ifferenziali esatti, ma solamente er rocessi articolari, cioè: ISOCORO (a volume costante, = 0), ISOBARO (a ressione costante, = 0), ISOERMICO (a temeratura costante, = 0), ADIABAICO (senza scambio i calore q = 0), CICLICO (senza variazione comlessiva i energia, D = 0).
11 PROCESSO ISOCORO: = 0 NON C'È LAORO MECCANICO: w = - = 0 = q v Il calore scambiato a volume costante coincie col ifferenziale esatto e è integrabile. Poichè = (,), il ifferenziale esatto i è: Q D q C C è il calore (secifico) molare a volume costante
12 PROCESSO ISOBARO: = 0 q = + = ifferenziale esatto W Q Si efinisce ENALPIA la funzione termoinamica H = + = H(,)
13 H ) ( q H H H H Q ) ( D NEI PROCESSI A PRESSIONE COSANE LA ARIAZIONE DI ENALPIA COINCIDE CON IL CALORE SCAMBIAO RA SISEMA E AMBIENE. H q C Calore (secifico) molare a ressione costante
14 Riscalamento (raffreamento) i un sistema a un solo comonente in conizioni i ressione costante Nel caso in cui il sistema vaa incontro a variazioni i stato fisico nell intervallo i temeratura consierato, la quantità i calore necessaria al riscalamento, Q = DH, eve essere scomosta : DH H ( ) H ( ) fus C 0, s D fus H eb C fus, l D eb H C eb, g ariazione i entalia alla fusione ariazione i entalia alla ebollizione Gli integrali riguarano intervalli i temeratura ove è stabile risettivamente lo stato solio, quello liquio e quello gassoso.
15 H H H ) ( ) ( ) ( Eslicitano l'esressione er il ifferenziale esatto ella funzione H, si ottiene: Per una mole i gas ieale: = R = (); = = C 0 quini H = + () = +R = C ovvero C C = R
16 PROCESSO ISOERMO: = 0 = q + w = q - La conizione = 0 ha conseguenze immeiate er il caso i un sistema costituito a GAS IDEALE: = 0 q = = - w (ifferenziale esatto) Q R q = R / R ln W utto il lavoro comiuto al sistema (nel caso i esansione) equivale esattamente al calore Q assorbito al sistema e fornito all'ambiente: quest'ultimo ha agito a ERMOSAO.
17 PROCESSO ADIABAICO: q = 0 = w = - (ifferenziale esatto) Nel caso i un GAS IDEALE: = Cv = - = - R / R C R C ln ln aveno osto (C C ) = R e g = C / C, si ottiene: C C C )ln ( ln ln g g costante g g g
18 GAS IDEALE isoterma aiabatica m
19 PROCESSO CICLICO: D = 0 = Q + W = 0 Q = - W Il lavoro corrisone all'area el iano i Claeyron (, m ) racchiusa al tracciato che raresenta il rocesso ciclico. m
20 RENDIMENO DI NA MACCHINA ERMICA Macchina termica è un sistema che rouce lavoro assorbeno calore a un serbatoio a temeratura elevata e ceeno calore a un serbatoio a temeratura inferiore. Il tio i rocesso a cui fare riferimento è quello ciclico: W = - Q = - [Q assorbito - Q ceuto ] Il lavoro comiuto equivale alla ifferenza tra calore assorbito e calore ceuto al sistema, cioè W < Q assorbito Il renimento el rocesso ciclico è ato al raorto : W Q assorbito
21 ESPERIMENO DI JOLE-HOMPSON > Stato iniziale Q = 0 = w = -. Stato finale cilinro isolato termicamente e iviso in ue arti a un setto otato i valvola. Areno la valvola e sostano comletamente entrambi i istoni verso estra, il gas assa tutto nel comartimento a ressione inferiore. La riuzione el volume ello scomarto a sinistra e l'esansione el volume i quello i estra avvengono in conizioni i costante, risettivamente, = e =, e con Q = 0. L'intero rocesso viene conotto in conizioni i reversibilità.
22 W W W 0 tot 0 [ + ] = [ + ] H = H IL PROCESSO AIENE SENZA ARIAZIONI DI ENALPIA. È ARIAA LA EMPERARA DEL GAS.
23 Il comortamento el gas nel corso i questo eserimento uò essere comletamente efinito al segno, ositivo o negativo, el COEFFICIENE DI JOLE - HOMPSON: J ( ) H esresso in K MPa -. Per esansione contro una ressione inferiore a quella interna, cioè er < 0, si ossono verificare ue situazioni: J > 0 : il gas si raffrea; J < 0 : il gas si riscala. er un gas ieale J = 0
24 Per un ato valore ell'entalia, temeratura e ressione el gas sono correlate a una funzione = (), che resenta un massimo. COEFFICIENE DI JOLE HOMPSON J = 0 Curva i inversione J < 0 J > 0 Il gas si riscala Il gas si raffrea
25 H C H ( ) H = 0 H ( ) C J GAS J /K MPa - B / K I / K N O CO Per = 0. MPa ( atm), la temeratura, I, alla quale J = 0 è etta EMPERARA DI INERSIONE.
26 LA LEGGE DI HESS Poichè la funzione entalia, H, ammette un ifferenziale esatto, la sua variazione finita iene solo allo stato finale e allo stato iniziale el sistema, ma non el cammino ercorso. Ciò vale anche quano si consieri una reazione chimica, che infatti equivale a un rocesso a uno stato (reagenti) a uno stato (rootti). Abitualmente le reazioni chimiche si osservano e si stuiano in conizioni i ressione costante: il calore scambiato tra sistema, nel quale avviene la reazione, e ambiente circostante equivale al H i reazione. (no stuio corretto ella reazione chimica richiee che anche la temeratura el sistema resti costante).quano, a artire allo stesso stato i reagenti, è ossibile raggiungere lo stato ei rootti secono iù vie, la legge i Hess reice che il H i reazione non cambia.
27 C +O CO DH La reazione uò essere vista come risultante i ue contributi istinti: C + O CO + ½ O DH CO + ½ O CO DH 3 ove DH = DH + DH 3 Analogamente CH 4 + O CO + H O DH C + O CO DH H + O H O DH 3 (C + O ) + ( H + O ) (CH 4 + O ) (CO + H O) (CO + H O) = 0 D f H ovvero C + H CH 4 D f H ove D f H = DH + DH 3 - DH che ermette i ricavare l entalia i formazione el metano nella iotetica reazione tra carbonio e irogeno.
28 L'ENALPIA DI FORMAZIONE DI N COMPOSO È LA ARIAZIONE DI ENALPIA CHE ACCOMPAGNA LA REAZIONE DI FORMAZIONE DEL COMPOSO A PARIRE DAGLI ELEMENI CHIMICI COSIII PRESI NELLA FORMA MOLECOLARE E NELLO SAO FISICO SABILI ALLA EMPERARA CONSIDERAA. SE LO SAO FISICO È QELLO SANDARD (vei oltre) L'ENALPIA DEGLI ELEMENI IENE CONSIDERAA NLLA E SI PARLA DI ENALPIA DI FORMAZIONE SANDARD, O SEMPLICEMENE ENALPIA SANDARD, DEL COMPOSO.
29 Data una reazione chimica (le stesse consierazioni valgono tuttavia er un qualsiasi rocesso che orti a uno stato i equilibrio all'altro) el tio: n A A + n B B +... n C C + n D D +... i cui si conosce il H alla temeratura e alla ressione, si vuole reveere il H alla temeratura >, alla stessa ressione. Per efinizione, DH = H rootti H reagenti = Σ i n i H i (i = A, B, C, D) ove i coefficienti stechiometrici n i vanno resi col segno ositivo se si riferiscono ai rootti e col segno negativo se riguarano i reagenti. Da questa efinizione iscene che:
30 Equazione i Kirchhoff DH n i i Hi n i i C, i DC DH ( ) DH ( ) DC Se l'intervallo i temeratura (, ) è tale a non comortare significative variazioni i C, l'integrazione è ossibile quano si conoscano i calori secifici molari i reagenti e rootti a.
31 CORSO DI FISICA ECNICA ermoinamica Grazie er l attenzione Prof. Ing. Giulio annucci
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica Mod. 2 CHIMICA FISICA. Lezione 3 TRASFORMAZIONI DEL SISTEMA
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. CHIMICA FISICA Lezione 3 Anno Accademico 00-0 Docente: Dimitrios Fessas RASFORMAZIONI DEL SISEMA i. RASFORMAZIONI
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. CHIMICA FISICA Lezione 3 Anno Accademico 00-0 Docente: Dimitrios Fessas RASFORMAZIONI DEL SISEMA i. RASFORMAZIONI
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica Mod. 2 CHIMICA FISICA. Lezione 7
 Università egli stui i MILANO Facoltà i AGRARIA El. i Chimica e Chimica Fisica Mo. CHIMICA FIICA Lezione 7 Anno Accaemico 000-0 Docente: Dimitrios Fessas Prorietà i equilibrio ei sistemi a iù comonenti
Università egli stui i MILANO Facoltà i AGRARIA El. i Chimica e Chimica Fisica Mo. CHIMICA FIICA Lezione 7 Anno Accaemico 000-0 Docente: Dimitrios Fessas Prorietà i equilibrio ei sistemi a iù comonenti
Lezione Trasformazioni termodinamiche
 Lezione rasformazioni termodinamiche Adiabatica; Isocora; Isobara; Isoterma; Energia interna costante; Adiabatica Consideriamo una trasformazione che orti il sistema dallo stato di equilibrio 1 allo stato
Lezione rasformazioni termodinamiche Adiabatica; Isocora; Isobara; Isoterma; Energia interna costante; Adiabatica Consideriamo una trasformazione che orti il sistema dallo stato di equilibrio 1 allo stato
Esercizi svolti di termodinamica applicata
 0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
Fisica Generale A estensione principio di conservazione dell energia energia termica teoria cinetica dei gas 14. I Principio della Termodinamica
 Fisica Generale A 4. I Princiio della ermodinamica htt://camus.cib.unibo.it/2434/ December 3, 2 Primo Princiio e Moti Molecolari Il rimo rinciio della termodinamica è l estensione del rinciio di conservazione
Fisica Generale A 4. I Princiio della ermodinamica htt://camus.cib.unibo.it/2434/ December 3, 2 Primo Princiio e Moti Molecolari Il rimo rinciio della termodinamica è l estensione del rinciio di conservazione
2) Primo principio della Termodinamica
 2) Primo rinciio della Termodinamica Anteatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica delle
2) Primo rinciio della Termodinamica Anteatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica delle
Calcolare in quanto tempo uno scaldabagno da 60 litri porta il suo contenuto
 lcuni esemi. Un coro di massa m1kg assorbe una quantità di calore 30cal aumentando la sua temeratura di 10 C. uale sarà il suo calore secifico? uale sarà la sua caacità termica? Calcolare in quanto temo
lcuni esemi. Un coro di massa m1kg assorbe una quantità di calore 30cal aumentando la sua temeratura di 10 C. uale sarà il suo calore secifico? uale sarà la sua caacità termica? Calcolare in quanto temo
Lezione 10 Termodinamica
 rgomenti della lezione: relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot Lezione 0 ermodinamica secondo riiio della termodinamica Gas ideali Un gas
rgomenti della lezione: relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot Lezione 0 ermodinamica secondo riiio della termodinamica Gas ideali Un gas
Lezione 10 Termodinamica
 rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
Tre tipi di Sistema Un richiamo
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: dv dp. dv dt. nrt dt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
Complementi di Termologia. III parte
 Prof. Michele Giugliano (Dicembre 00) Comlementi di Termologia. III arte N. 3. - Lavoro nelle trasformazioni. In generale se un gas, soggetto ad una variazione della ressione, varia il volume, esso comie
Prof. Michele Giugliano (Dicembre 00) Comlementi di Termologia. III arte N. 3. - Lavoro nelle trasformazioni. In generale se un gas, soggetto ad una variazione della ressione, varia il volume, esso comie
Prova scritta del 27 novembre 2018
 Prova scritta del 27 novembre 2018 1 Un reciiente della caacità di 1.00 L e contenente un gas A alla ressione di 10.0 kpa viene connesso ad un altro reciiente avente il volume di 3.00 L con all interno
Prova scritta del 27 novembre 2018 1 Un reciiente della caacità di 1.00 L e contenente un gas A alla ressione di 10.0 kpa viene connesso ad un altro reciiente avente il volume di 3.00 L con all interno
Enunciato di Kelvin-Plank
 ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
La funzione energia interna nei gas ideali. dv =( V p ) dp+( V. T ) p
 La funzione energia interna nei gas ideali Si vuole dimostrare che er quei gas i cui stati sono descritti dall'equazione =nr l' energia interna è funzione solo della temeratura. In altri termini si verificherà
La funzione energia interna nei gas ideali Si vuole dimostrare che er quei gas i cui stati sono descritti dall'equazione =nr l' energia interna è funzione solo della temeratura. In altri termini si verificherà
Introduzione alle macchine termiche
 1 Introduzione alle macchine termiche In questa nota 1 introduciamo il concetto di macchina termica che oera con trasformazioni cicliche er trasformare calore in lavoro. In generale questo argomento viene
1 Introduzione alle macchine termiche In questa nota 1 introduciamo il concetto di macchina termica che oera con trasformazioni cicliche er trasformare calore in lavoro. In generale questo argomento viene
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: nrt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du δ δl () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du δ δl () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che
TEORIA CINETICA DEI GAS
 TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
Si considera un corpo solido a forma di parallelepipedo, di spessore d [m] e facce maggiori con superficie S [m 2 ], tale che sia T 1
![Si considera un corpo solido a forma di parallelepipedo, di spessore d [m] e facce maggiori con superficie S [m 2 ], tale che sia T 1 Si considera un corpo solido a forma di parallelepipedo, di spessore d [m] e facce maggiori con superficie S [m 2 ], tale che sia T 1](/thumbs/54/34072796.jpg) I sistemi termici La resistenza termica Se ue corpi aventi temperature iverse vengono messi a contatto, si ha un passaggio i quantità i calore al corpo a temperatura maggiore verso quello a temperatura
I sistemi termici La resistenza termica Se ue corpi aventi temperature iverse vengono messi a contatto, si ha un passaggio i quantità i calore al corpo a temperatura maggiore verso quello a temperatura
Deduzione della legge dell azione di massa per via cinetica
 L equilibrio chimico Reazioni reversibili o di equilibrio: reazioni che ossono avvenire sia in senso diretto che in senso inverso Deduzione della legge dell azione di massa er via cinetica A + B C + D
L equilibrio chimico Reazioni reversibili o di equilibrio: reazioni che ossono avvenire sia in senso diretto che in senso inverso Deduzione della legge dell azione di massa er via cinetica A + B C + D
SCIENZA DEI MATERIALI. Chimica Fisica. VII Lezione. Dr. Fabio Mavelli. Dipartimento di Chimica Università degli Studi di Bari
 SCENZA DE MAEAL Chimica Fisica V Lezione Dr. Fabio Mavelli Diartimento di Chimica Università degli Studi di Bari Equazione Fondamentale 2 l rimo ed il secondo rinciio ermettono di esrimere la variazione
SCENZA DE MAEAL Chimica Fisica V Lezione Dr. Fabio Mavelli Diartimento di Chimica Università degli Studi di Bari Equazione Fondamentale 2 l rimo ed il secondo rinciio ermettono di esrimere la variazione
Parte II. I Principio della TERMODINAMICA a.a
 Parte II I Princiio della TERMODINAMICA a.a. 04-5 Equazioni di bilancio Mentre un sistema aerto consente flussi di massa e di energia attraerso le sezioni di ingresso e di uscita e flussi di energia attraerso
Parte II I Princiio della TERMODINAMICA a.a. 04-5 Equazioni di bilancio Mentre un sistema aerto consente flussi di massa e di energia attraerso le sezioni di ingresso e di uscita e flussi di energia attraerso
Calorimetria. Principio zero Trasformazioni termodinamiche Lavoro termodinamico
 Calorimetria Princiio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una articella è definito quando siano note, in un certo istante, la osizione
Calorimetria Princiio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una articella è definito quando siano note, in un certo istante, la osizione
Il primo principio della termodinamica
 Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
LAVORO DI UN GAS. Espansione di un gas a pressione costante V A V B
 LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
Termodinamica chimica
 I processi naturali hanno un verso spontaneo di evoluzione (es. gas si espandono, caduta dei gravi nell aria, una palla che rotola su di un piano inclinato) E possibile condurre i processi opposti solo
I processi naturali hanno un verso spontaneo di evoluzione (es. gas si espandono, caduta dei gravi nell aria, una palla che rotola su di un piano inclinato) E possibile condurre i processi opposti solo
Tonzig La fisica del calore
 4 onzig La fisica del calore batiche si trova 2 / = / 4, il che vuol dire che la [F] si riduce alla [E]. Ne deriva che, nello secifico caso di un gas erfetto, il rendimento di un ciclo di Carnot è [G]
4 onzig La fisica del calore batiche si trova 2 / = / 4, il che vuol dire che la [F] si riduce alla [E]. Ne deriva che, nello secifico caso di un gas erfetto, il rendimento di un ciclo di Carnot è [G]
Fisica dell Atmosfera e del Clima
 Università degli studi di rento Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile, Ambientale e Meccanica Fisica dell Atmosfera e del
Università degli studi di rento Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile, Ambientale e Meccanica Fisica dell Atmosfera e del
Sistemi termodinamici. I sistemi aperti e chiusi possono essere adiabatici quando non è consentito lo scambio di calore
 Sistemi termodinamici Sistema: regione dello spazio oggetto delle nostre indagini. Ambiente: tutto ciò che circonda un sistema. Universo: sistema + ambiente Sistema aperto: sistema che consente scambi
Sistemi termodinamici Sistema: regione dello spazio oggetto delle nostre indagini. Ambiente: tutto ciò che circonda un sistema. Universo: sistema + ambiente Sistema aperto: sistema che consente scambi
La Pressione (1) La Pressione è una grandezza scalare ed in un fluido rappresenta una proprietà meccanica dello stesso.
 La Pressione (1) Trasformazioni termodamiche del Gas Ideale - 1 ds La Pressione è una grandezza scalare ed un fluido raresenta una rorietà meccanica dello stesso. d n F df ds = 1 = mg h (1) = ds ds n π
La Pressione (1) Trasformazioni termodamiche del Gas Ideale - 1 ds La Pressione è una grandezza scalare ed un fluido raresenta una rorietà meccanica dello stesso. d n F df ds = 1 = mg h (1) = ds ds n π
= 20 C, dopo aver rappresentato il ciclo nel diagramma di Clapeyron, il lavoro L
 Partendo dallo stato iniziale, un gas erfetto monoatomico comie il ciclo raggiungendo successivamente gli stati intermedi, e e tornando oi dallo stato nello stato iniziale. Il ciclo è costituito da: un
Partendo dallo stato iniziale, un gas erfetto monoatomico comie il ciclo raggiungendo successivamente gli stati intermedi, e e tornando oi dallo stato nello stato iniziale. Il ciclo è costituito da: un
Sia dato un corpo su cui agisce una forza. Supponiamo che inizialmente il corpo sia fermo, dalla relazione
 Lavoro ed energia Sia dato un coro su cui agisce una forza. Suoniamo che inizialmente il coro sia fermo, dalla relazione F = ma doo un certo intervallo di temo in cui la forza agisce sull oggetto, il coro
Lavoro ed energia Sia dato un coro su cui agisce una forza. Suoniamo che inizialmente il coro sia fermo, dalla relazione F = ma doo un certo intervallo di temo in cui la forza agisce sull oggetto, il coro
Fisica dell Atmosfera e del Clima
 Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
Lezione XII Analisi Formale
 SCENZA DE MATERAL Chimica Fisica Lezione X Analisi Formale Dr. Fabio Mavelli Dipartimento i Chimica Università egli Stui i Bari Analisi Cinetica Fenomenologica Analisi Cinetica Fenomenologica Meccanismo
SCENZA DE MATERAL Chimica Fisica Lezione X Analisi Formale Dr. Fabio Mavelli Dipartimento i Chimica Università egli Stui i Bari Analisi Cinetica Fenomenologica Analisi Cinetica Fenomenologica Meccanismo
SCIENZA DEI MATERIALI. Chimica Fisica. V Lezione. Dr. Fabio Mavelli. Dipartimento di Chimica Università degli Studi di Bari
 SCIENZA DEI MAERIALI Chimica Fisica V Lezione Dr. Fabio Mavelli Dipartimento di Chimica Università degli Studi di Bari Sommario 2 Rapporto d rev / Funzione di stato Entropia Processi spontanei variazione
SCIENZA DEI MAERIALI Chimica Fisica V Lezione Dr. Fabio Mavelli Dipartimento di Chimica Università degli Studi di Bari Sommario 2 Rapporto d rev / Funzione di stato Entropia Processi spontanei variazione
È quella parte della termologia che studia le trasformazioni di calore in lavoro e viceversa.
 EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
Differenze fra Solido e Fluido
 Differenze fra Solido e Fluido Stati della materia: Solido o Fluido (liquido o gassoso) Il solido non cambia facilmente la sua forma, al contrario di un fluido Fra i fluidi abbiamo che il liquido cambia
Differenze fra Solido e Fluido Stati della materia: Solido o Fluido (liquido o gassoso) Il solido non cambia facilmente la sua forma, al contrario di un fluido Fra i fluidi abbiamo che il liquido cambia
Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante.
 All origine di tutto c è il teorema di conservazione dell energia totale meccanica: Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante. Il teorema è tipicamente
All origine di tutto c è il teorema di conservazione dell energia totale meccanica: Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante. Il teorema è tipicamente
e la forza di Archimede è uguale al peso del fluido occupato: A = M b)il corpo scende di h, cui corrisponde una variazione di energia potenziale
 ) Meccanica Un sistema è comosto da un coro omogeneo di massa M e densità ρ e da una data quantità di luido (di densità minore ρ ) in cui il coro è immerso. Inizialmente (stato i) il coro è ermo, quindi
) Meccanica Un sistema è comosto da un coro omogeneo di massa M e densità ρ e da una data quantità di luido (di densità minore ρ ) in cui il coro è immerso. Inizialmente (stato i) il coro è ermo, quindi
Applicazione del principio di conservazione dell energia a sistemi aventi un gran numero di particelle.
 PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
Termodinamica e Termochimica
 Termodinamica e Termochimica Mattia Natali 25 luglio 2011 Indice 1 Termochimica 1 1.1 Energia, sistemi, calore.................................... 1 1.2 Misure del calore.......................................
Termodinamica e Termochimica Mattia Natali 25 luglio 2011 Indice 1 Termochimica 1 1.1 Energia, sistemi, calore.................................... 1 1.2 Misure del calore.......................................
IL PRIMO PRINCIPIO DELLA TERMODINAMICA
 IL PRIMO PRINCIPIO DELLA TERMODINAMICA T R AT TO DA: I P ro b l e m i D e l l a F i s i c a - C u t n e l l, J o h n s o n, Yo u n g, S t a d l e r Z a n i c h e l l i e d i t o r e Fo n d a m e n t i
IL PRIMO PRINCIPIO DELLA TERMODINAMICA T R AT TO DA: I P ro b l e m i D e l l a F i s i c a - C u t n e l l, J o h n s o n, Yo u n g, S t a d l e r Z a n i c h e l l i e d i t o r e Fo n d a m e n t i
Il I principio della termodinamica. Calore, lavoro ed energia interna
 Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Dotto Formazione a tutto tondo Rapid Training 2018 Corso di Fisica. Argomento 11 Termodinamica
 Dotto Formazione a tutto tondo Rapid Training 2018 Corso di Fisica Argomento 11 Termodinamica 2 L energia interna dei gas L energia totale di tutte le molecole del sistema: e. cinetica traslazionale e.
Dotto Formazione a tutto tondo Rapid Training 2018 Corso di Fisica Argomento 11 Termodinamica 2 L energia interna dei gas L energia totale di tutte le molecole del sistema: e. cinetica traslazionale e.
TERMODINAMICA. Studia le trasformazioni dei sistemi in relazione agli scambi di calore e lavoro. GENERALITÀ SUI SISTEMI TERMODINAMICI
 TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
La termochimica. Energia in movimento
 La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
Peso atomico (meglio massa atomica)
 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
EQUILIBRIO CHIMICO. Alcune reazioni chimiche decorrono fino a completezza, con un consumo completo dei reagenti (reazioni quantitative)
 EQUILIBRIO CHIMICO Alcune reazioni chimiche ecorrono fino a completezza, con un consumo completo ei reagenti (reazioni quantitative) NaOH (aq) + HCl (aq) NaCl (aq) + H 2 O (l) Molte reazioni chimiche effettuate
EQUILIBRIO CHIMICO Alcune reazioni chimiche ecorrono fino a completezza, con un consumo completo ei reagenti (reazioni quantitative) NaOH (aq) + HCl (aq) NaCl (aq) + H 2 O (l) Molte reazioni chimiche effettuate
La termochimica. Energia in movimento
 La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
Appunti di Meccanica dei Fluidi M. Tregnaghi
 Aunti di Meccanica dei Fluidi 3. STATICA: PRESSIONE E LEE IDROSTATICA PRESSIONE IN UN PUNTO La ressione è il modulo della forza esercitata da un fluido er unità di suerficie che agisce in direzione normale
Aunti di Meccanica dei Fluidi 3. STATICA: PRESSIONE E LEE IDROSTATICA PRESSIONE IN UN PUNTO La ressione è il modulo della forza esercitata da un fluido er unità di suerficie che agisce in direzione normale
MOTI QUASI UNIDIMENSIONALI MOTI QUASI UNIDIMENSIONALI
 MOTI QUASI UNIDIMENSIONALI Nei moti quasi unidimensionali si iotizza la costanza del valore di tutte le grandezze termofluidodinamiche su ciascuna suerficie ermeabile aartenente alla suerficie esterna
MOTI QUASI UNIDIMENSIONALI Nei moti quasi unidimensionali si iotizza la costanza del valore di tutte le grandezze termofluidodinamiche su ciascuna suerficie ermeabile aartenente alla suerficie esterna
Termodinamica: studio dei trasferimenti di energia
 Termodinamica: studio dei trasferimenti di energia Termodinamica chimica: 1. variazione di energia associata ad una trasformazione 2. spontaneità di una trasformazione Si basa su tre principi (leggi) e
Termodinamica: studio dei trasferimenti di energia Termodinamica chimica: 1. variazione di energia associata ad una trasformazione 2. spontaneità di una trasformazione Si basa su tre principi (leggi) e
TERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la
 ERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la circonda e può influenzarne il comportamento ( ambiente
ERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la circonda e può influenzarne il comportamento ( ambiente
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
Energia e reazioni chimiche. Cap , 19-21, 27-30, 47-48, 50, 59-62
 2016-2017 CCS Biologia CCS Scienze Geologiche 1 Energia e reazioni chimiche Cap 5. 7-13, 19-21, 27-30, 47-48, 50, 59-62 2009 Brooks/Cole - Cengage Energia & Chimica 2 ENERGIA è la capacità di compiere
2016-2017 CCS Biologia CCS Scienze Geologiche 1 Energia e reazioni chimiche Cap 5. 7-13, 19-21, 27-30, 47-48, 50, 59-62 2009 Brooks/Cole - Cengage Energia & Chimica 2 ENERGIA è la capacità di compiere
Termometria e calorimetria
 Termometria e alorimetria Priniio zero della termodinamia: 2 ori, A e B, a temerature differenti (T A < T B ) osti a ontatto raggiungono l equilibrio termio. Se A e B sono in equilibrio termio on un terzo
Termometria e alorimetria Priniio zero della termodinamia: 2 ori, A e B, a temerature differenti (T A < T B ) osti a ontatto raggiungono l equilibrio termio. Se A e B sono in equilibrio termio on un terzo
UNIVERSITÀ DEGLI STUDI DI TERAMO
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di : FISICA MEDICA A.A. 015 /016 Docente: Dott. Chiucchi Riccardo mail:rchiucchi@unite.it Medicina Veterinaria: CFU
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di : FISICA MEDICA A.A. 015 /016 Docente: Dott. Chiucchi Riccardo mail:rchiucchi@unite.it Medicina Veterinaria: CFU
A1. Soluzione. Ilcalore Q per unita di massa e negativo (ceduto all esterno) e vale:
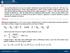 A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
dz dx + dy y x x y se z e una funzione di due generiche variabili x ed y ossia se z= a prescindere dal fatto che le variabili x ed y
 Richiami matematici se z e una funzione di due generiche variabili x ed y ossia se z= zxy (, ) a rescindere dal fatto che le variabili x ed y siamo indiendenti o siano diendenti da altre variabili il differenziale
Richiami matematici se z e una funzione di due generiche variabili x ed y ossia se z= zxy (, ) a rescindere dal fatto che le variabili x ed y siamo indiendenti o siano diendenti da altre variabili il differenziale
Fondamenti di Meteorologia e Climatologia
 Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Termologia. Paolo Bagnaia - CTF Esercizi di termologia e termodinamica 1
 ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
Tonzig La fisica del calore
 0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
FISICA. V [10 3 m 3 ]
![FISICA. V [10 3 m 3 ] FISICA. V [10 3 m 3 ]](/thumbs/24/2838543.jpg) Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
FISICA GENERALE (A) I Prova A.A Cognome Nome n. matricola
 FISICA GENERALE (A) I Prova A.A. 8-9 3.4.9 Cognome Nome n. matricola Corso di Studi Docente Voto 5 Crediti Crediti Esercizio n. Un anello di massa m uò scorrere senza attrito su una guida circolare orizzontale
FISICA GENERALE (A) I Prova A.A. 8-9 3.4.9 Cognome Nome n. matricola Corso di Studi Docente Voto 5 Crediti Crediti Esercizio n. Un anello di massa m uò scorrere senza attrito su una guida circolare orizzontale
Temperatura e Calore.
 emeratura e Calore www.fisicaxscuola.altervista.org emeratura e Calore Stati di Aggregazione emeratura Scale ermometriche Dilatazione ermica Leggi dei gas: La rima legge di Gay-Lussac ( costante) La seconda
emeratura e Calore www.fisicaxscuola.altervista.org emeratura e Calore Stati di Aggregazione emeratura Scale ermometriche Dilatazione ermica Leggi dei gas: La rima legge di Gay-Lussac ( costante) La seconda
Energia e trasformazioni spontanee
 Energia e trasformazioni spontanee Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede energia. La termodinamica è quella scienza che studia le variazioni di energia in una
Energia e trasformazioni spontanee Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede energia. La termodinamica è quella scienza che studia le variazioni di energia in una
BIOLOGIA A. A CHIMICA
 Laurea triennale in BIOLOGIA A. A. 03-4 4 CHIMICA Lezioni di Chimica Fisica rof. Antonio Toffoletti Conversione di una grandezza tra unità di misura differenti Uno scienziato ha misurato la pressione atmosferica
Laurea triennale in BIOLOGIA A. A. 03-4 4 CHIMICA Lezioni di Chimica Fisica rof. Antonio Toffoletti Conversione di una grandezza tra unità di misura differenti Uno scienziato ha misurato la pressione atmosferica
Termodinamica. Ireneo Kikic. DICAMP - SFLAB - University of Trieste
 ermodinamica Ireneo Kikic DIAM - FLAB - University of rieste IRENEO.KIKI@DIAM.UNI.I rimo principio della termodinamica alore e lavoro solo quando sono trasferiti tra i corpi Energia uò essere convertita
ermodinamica Ireneo Kikic DIAM - FLAB - University of rieste IRENEO.KIKI@DIAM.UNI.I rimo principio della termodinamica alore e lavoro solo quando sono trasferiti tra i corpi Energia uò essere convertita
Lezione VII - 11/03/2003 ora 14:30-16:30 - Entropia, trasformazione isoentropica, pompe di calore - Originale di Unetti Matteo
 Lezione VII - /03/003 ora 4:30-6:30 - Entroia, trasformazione isoentroica, ome di calore - Originale di Unetti Matteo Entroia Si uò introdurre una nuoa funzione di stato, l Entroia, definita così come
Lezione VII - /03/003 ora 4:30-6:30 - Entroia, trasformazione isoentroica, ome di calore - Originale di Unetti Matteo Entroia Si uò introdurre una nuoa funzione di stato, l Entroia, definita così come
Dispensa del corso di FLUIDODINAMICA DELLE MACCHINE
 Disensa del corso di FLUIDODINAICA DELLE ACCHINE Argomento: Onde di ach e onde d'urto (flusso stazionario, non viscoso di un gas erfetto) Prof. Pier Ruggero Sina Diartimento di Ingegneria Prof. P. R. Sina
Disensa del corso di FLUIDODINAICA DELLE ACCHINE Argomento: Onde di ach e onde d'urto (flusso stazionario, non viscoso di un gas erfetto) Prof. Pier Ruggero Sina Diartimento di Ingegneria Prof. P. R. Sina
ESERCITAZIONE DELL 11 DICEMBRE 2008 SOLUZIONI Corso di Matematica I per Geologia. dx dx dx sin x = (sin x)2 + (cos x) 2. (1)
 ESERCITAZIONE DELL DICEMBRE 008 SOLUZIONI Corso i Matematica I per Geologia A. Calcolare le erivate elle seguenti funzioni:. sin cos, sin 3, e sin 3 4 cos 3; +. log, log, arctan. Soluzioni.. Prima erivata.
ESERCITAZIONE DELL DICEMBRE 008 SOLUZIONI Corso i Matematica I per Geologia A. Calcolare le erivate elle seguenti funzioni:. sin cos, sin 3, e sin 3 4 cos 3; +. log, log, arctan. Soluzioni.. Prima erivata.
L ENERGIA CINETICA DELLE MOLECOLE DI UN GAS E LA TEMPERATURA Ogni molecola ha in media un'energia cinetica
 Primo principio- 1 - TERMODINAMICA ENERGIA INTERNA DI UN SISTEMA Ad ogni sistema fisico possiamo associare varie forme di energia, l energia cinetica delle molecole di cui è formato, energia potenziale,
Primo principio- 1 - TERMODINAMICA ENERGIA INTERNA DI UN SISTEMA Ad ogni sistema fisico possiamo associare varie forme di energia, l energia cinetica delle molecole di cui è formato, energia potenziale,
 La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
L'EQUILIBRIO CHIMICO NELLE REAZIONI
 L'EQUILIBRIO CHIMICO NELLE REAZIONI Abbiamo visto dall analisi termodinamica che l avvenire di una trasformazione e quindi anche di una reazione chimica dienda dalla variazione di energia libera del sistema
L'EQUILIBRIO CHIMICO NELLE REAZIONI Abbiamo visto dall analisi termodinamica che l avvenire di una trasformazione e quindi anche di una reazione chimica dienda dalla variazione di energia libera del sistema
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
5 DERIVATA. 5.1 Continuità
 5 DERIVATA 5. Continuità Definizione 5. Sia < a < b < +, f : (a, b) R e c (a, b). Diciamo che f è continua in c se sono verificate le ue conizioni: (i) c esiste (ii) = f(c) c Si osservi che nella efinizione
5 DERIVATA 5. Continuità Definizione 5. Sia < a < b < +, f : (a, b) R e c (a, b). Diciamo che f è continua in c se sono verificate le ue conizioni: (i) c esiste (ii) = f(c) c Si osservi che nella efinizione
Legge del gas perfetto e termodinamica
 Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
TERMOLOGIA & TERMODINAMICA III
 TERMOLOGIA & TERMODINAMICA III 1 I GAS PERFETTI gas perfetto microscopicamente Le interazioni fra le molecole costituenti sono trascurabili. Le grandezze macroscopiche che possono rappresentare lo stato
TERMOLOGIA & TERMODINAMICA III 1 I GAS PERFETTI gas perfetto microscopicamente Le interazioni fra le molecole costituenti sono trascurabili. Le grandezze macroscopiche che possono rappresentare lo stato
ESERCIZI DI TERMODINAMICA
 ESERCIZI DI TERMODINAMICA Un otore a cobustione eroga una otenza effettiva di k con un rendiento totale del 8% Il cobustibile utilizzato ha un otere calorifico inferiore di 000 k Calcolare la assa di cobustibile
ESERCIZI DI TERMODINAMICA Un otore a cobustione eroga una otenza effettiva di k con un rendiento totale del 8% Il cobustibile utilizzato ha un otere calorifico inferiore di 000 k Calcolare la assa di cobustibile
IL TRASPORTO DEGLI INQUINANTI
 La iffusione molecolare La ispersione avviene principalmente in irezione longituinale rispetto al flusso meio, e le variazioni i velocità non spiegano l aumento l i ampiezza in irezione normale al moto
La iffusione molecolare La ispersione avviene principalmente in irezione longituinale rispetto al flusso meio, e le variazioni i velocità non spiegano l aumento l i ampiezza in irezione normale al moto
1 TERMODINAMICA DELLE TURBINE A GAS 1.1 INTRODUZIONE
 TERMODINAMICA DELLE TURBINE A GAS. INTRODUZIONE Il ciclo termodinamico su cui è imostato il funzionamento delle turbine a gas è il ciclo Bryton, la cui analisi orta alla determinazione di due arametri
TERMODINAMICA DELLE TURBINE A GAS. INTRODUZIONE Il ciclo termodinamico su cui è imostato il funzionamento delle turbine a gas è il ciclo Bryton, la cui analisi orta alla determinazione di due arametri
VOLUME 2 - MODULO C UNITÀ DIDATTICA C1 SOLUZIONE DEL PROBLEMA INIZIALE
 Vol_C.doc VOLUME - MODULO C UNITÀ DIDATTICA C SOLUZIONI DELLE VERIFICHE DEI PREREQUISITI. Il eso volumico o eso secifico è ari al rodotto della massa volumica er l accelerazione di gravità. Pertanto si
Vol_C.doc VOLUME - MODULO C UNITÀ DIDATTICA C SOLUZIONI DELLE VERIFICHE DEI PREREQUISITI. Il eso volumico o eso secifico è ari al rodotto della massa volumica er l accelerazione di gravità. Pertanto si
Moto Monodimensionale in Condotti
 Diartimento di Ingegneria Industriale Moto Monodimensionale in Condotti Fluido Comrimibile - eoria Fig a Fig B Fig. A Moti D Comrimibili- ermodinamica Scuola di Ingegneria Corso di e Macchine A.A. 3 4
Diartimento di Ingegneria Industriale Moto Monodimensionale in Condotti Fluido Comrimibile - eoria Fig a Fig B Fig. A Moti D Comrimibili- ermodinamica Scuola di Ingegneria Corso di e Macchine A.A. 3 4
Progetto di travi in c.a.p isostatiche Il fuso del cavo risultante e il fuso di Guyon
 Università degli Studi di Roma Tre - Facoltà di Ingegneria Laurea magistrale in Ingegneria Civile in Protezione Corso di Cemento rmato Precomresso / 2015-16 Progetto di travi in c.a. isostatiche Il fuso
Università degli Studi di Roma Tre - Facoltà di Ingegneria Laurea magistrale in Ingegneria Civile in Protezione Corso di Cemento rmato Precomresso / 2015-16 Progetto di travi in c.a. isostatiche Il fuso
Lavoro di una forza. Si definisce lavoro elementare della forza F agente sul punto materiale P che si sposta di dr la quantità scalare:
 Laoro i una forza Consieriao un punto ateriale P in oto lungo una cura L per effetto i una forza F, sia r il ettore posizione el punto in un sistea i riferiento inerziale: in un interallo i tepo t il punto
Laoro i una forza Consieriao un punto ateriale P in oto lungo una cura L per effetto i una forza F, sia r il ettore posizione el punto in un sistea i riferiento inerziale: in un interallo i tepo t il punto
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
IL PRIMO PRINCIPIO DELLA TERMODINAMICA
 IL PRIMO PRINCIPIO DELLA TERMODINAMICA TRATTO DA: I Problemi Della Fisica - Cutnell, Johnson, Young, Stadler Zanichelli editore Fondamenti di fisica 1 Halliday, Resnic, Walker Zanichelli editore Integrazioni
IL PRIMO PRINCIPIO DELLA TERMODINAMICA TRATTO DA: I Problemi Della Fisica - Cutnell, Johnson, Young, Stadler Zanichelli editore Fondamenti di fisica 1 Halliday, Resnic, Walker Zanichelli editore Integrazioni
Introduzione. Trasmissione del calore Prof. Ing. Marina Mistretta
 Introduzione Trasmissione del calore Prof. Ing. Marina Mistretta Cos è la Fisica Tecnica Studio degli scambi di energia e di materia tra i sistemi e l ambiente circostante. Il calore si disperde nel verso
Introduzione Trasmissione del calore Prof. Ing. Marina Mistretta Cos è la Fisica Tecnica Studio degli scambi di energia e di materia tra i sistemi e l ambiente circostante. Il calore si disperde nel verso
9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI
 9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI 9. Introduzione I rocessi termodinamici che vengono realizzati nella ratica devono consentire la realizzazione di uno scambio di energia termica o di energia
9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI 9. Introduzione I rocessi termodinamici che vengono realizzati nella ratica devono consentire la realizzazione di uno scambio di energia termica o di energia
relazioni tra il calore e le altre forme di energia.
 Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Introduzione al primo principio della termodinamica. Liceo scientifico M. Curie Savignano s R.
 Introduzione al primo principio della termodinamica Liceo scientifico M. Curie Savignano s R. La termodinamica si basa sul concetto di sistema macroscopico (o sistema termodinamico). Lo stato di un sistema
Introduzione al primo principio della termodinamica Liceo scientifico M. Curie Savignano s R. La termodinamica si basa sul concetto di sistema macroscopico (o sistema termodinamico). Lo stato di un sistema
Termodinamica. by R. Pizzoferrato
 ermodinamica Comletiamo il quadro dei fenomeni fisici: cambiamenti di stato? dove finisce l energia ersa in meccanica? nuove grandezze fisiche: emeratura, Calore, ecc Definiamo Sistema ermodinamico: arte
ermodinamica Comletiamo il quadro dei fenomeni fisici: cambiamenti di stato? dove finisce l energia ersa in meccanica? nuove grandezze fisiche: emeratura, Calore, ecc Definiamo Sistema ermodinamico: arte
Per quanto detto prima il fenomeno di svuotamento termina quando la pressione di ristagno è pari a:
 Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Sulla propagazione delle onde sonore nell'atmosfera. C = du dt. C V =( du dt ) V T +W. du +dl=dq
 Sulla roagazione delle onde sonore nell'atmosfera Si definisce caacità termica di un coro il raorto C = du Tra energia assorbita dal coro e conseguente variazione della sua temeratura. Dalla relazione
Sulla roagazione delle onde sonore nell'atmosfera Si definisce caacità termica di un coro il raorto C = du Tra energia assorbita dal coro e conseguente variazione della sua temeratura. Dalla relazione
TERMODINAMICA E TERMOCHIMICA
 TERMODINAMICA E TERMOCHIMICA Termodinamica E la scienza delle relazioni tra calore ed altre forme di energia; determina quali processi chimici e fisici sono spontanei; non prende in considerazione la variabile
TERMODINAMICA E TERMOCHIMICA Termodinamica E la scienza delle relazioni tra calore ed altre forme di energia; determina quali processi chimici e fisici sono spontanei; non prende in considerazione la variabile
D.E.TE.C. Corso di Termofluidodinamica Prof. Luigi de Luca CICLI TERMODINAMICI. Figura 16
 D.E.E.C. Corso di ermofluidodamica Prof. Luigi de Luca CICLI ERMODINAMICI CICLO OO Iniziamo ora lo studio di cicli di teresse iù ratico. Sul ciclo Otto si basa il funzionamento dei motori ad accensione
D.E.E.C. Corso di ermofluidodamica Prof. Luigi de Luca CICLI ERMODINAMICI CICLO OO Iniziamo ora lo studio di cicli di teresse iù ratico. Sul ciclo Otto si basa il funzionamento dei motori ad accensione
ESERCIZIO 1 Q = 6991, kj
 ESERCIZIO 1 A 25 C, l entalpia standard di idrogenazione del cicloesene a cicloesano: C 6 H 10 (l) + H 2 (g) C 6 H 12 (l) vale -93,83 kj mol -1, mentre l entalpia standard di combustione del cicloesene
ESERCIZIO 1 A 25 C, l entalpia standard di idrogenazione del cicloesene a cicloesano: C 6 H 10 (l) + H 2 (g) C 6 H 12 (l) vale -93,83 kj mol -1, mentre l entalpia standard di combustione del cicloesene
Termodinamica. studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro.
 Termodinamica studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro. La termodinamica parte da osservazioni sperimentali e quindi si esprime
Termodinamica studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro. La termodinamica parte da osservazioni sperimentali e quindi si esprime
Progetto di travi in c.a.p isostatiche Il fuso del cavo risultante e il fuso di Guyon
 Università degli Studi di Roma Tre - Facoltà di Ingegneria Laurea magistrale in Ingegneria Civile in Protezione Corso di Cemento Armato Precomresso A/A 218-19 Progetto di travi in c.a. isostatiche Il fuso
Università degli Studi di Roma Tre - Facoltà di Ingegneria Laurea magistrale in Ingegneria Civile in Protezione Corso di Cemento Armato Precomresso A/A 218-19 Progetto di travi in c.a. isostatiche Il fuso
