Metodi per il sequenziamento di proteine
|
|
|
- Berto Rossi
- 6 anni fa
- Visualizzazioni
Transcript
1 Metodi per il sequenziamento di proteine
2 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione
3 Elettroforesi macromolecole cariche migrano in un campo elettrico in solvente non conducente con velocità u= ZeE η Z: numero di cariche per molecola e: 1.6x10-19 C E: campo elettrico (volt/cm) η: coefficiente di attrito
4 Mobilità elettroforetica µ = E u Elettroforesi su gel LogM = a bx M: peso molecolare x: distanza percorsa nel gel Log M x gel sopprime le correnti convettive provocate da gradienti di temperatura funziona da setaccio molecolare
5 Condizioni denaturanti La miscela di proteine viene disciolta in: Sodio Dodecil Solfato (SDS) * + mercaptoetanolo [HS-CH 2 -CH 2 -OH]** 1 SDS / 2 residui amino acidici si legano alla catena principale carica negativa netta massa della proteina carica proteina-sds>>carica proteina nativa *Detergente anionico che spezza i legami non covalenti ** Riduce i ponti disolfuro
6 Figure 8-17 Molecular Biology of the Cell ( Garland Science 2008)
7 Figure 8-18a Molecular Biology of the Cell ( Garland Science 2008)
8 Elettroforesi su gel di poliacrilamide i gel di poliacrilamide sono chimicamente inerti varie dimensioni dei pori setaccio molecolare migliora l efficienza dell elettroforesi
9 Figure 8-18b Molecular Biology of the Cell ( Garland Science 2008)
10 Figure 8-19 Molecular Biology of the Cell ( Garland Science 2008)
11 colorazione con argento o con blu Coomassie 1 dalton = 1/12 massa del 12 C = Kg amu : unità di massa atomica = massa del protone 1 amu = Kg
12 Sensibilità del metodo Blu Coomassie bande contenenti 0.1 µg di proteina argento bande contenenti 0.02 µg di proteina Si possono distinguere proteine che differiscono in massa di circa il 2% A: 40 kd circa 10 residui di differenza B: 41 kd
13 Focalizzazione isoelettrica pi = punto Isolelettrico = ph a cui la carica netta è zero citocromo C pi = 10.6 albumina pi = 4.8 elettroforesi in gradiente di ph (senza SDS) si possono separare proteine che differiscono tra loro di una sola carica
14 Massa pi focalizzazione isoelettrica + elettroforesi su gel con SDS gel da focalizzazione isoelettrica 1. orizzontalmente elettroforesi 2. verticalmente su gel con SDS macchie su 2 dimensioni Proteine di E.coli sono state separate > 1000 proteine in un singolo esperimento
15 Figure 8-23 Molecular Biology of the Cell ( Garland Science 2008)
16 Purificazione di proteine nella loro forma nativa (struttura 3D intatta) si sfruttano 1. dimensioni 2. solubilità 3. carica 4. affinità con molecole specifiche test per l attività catalitica test per la purezza (SDS)
17 1. Separazione mediante dialisi separazione delle proteine da molecole molto più piccole
18 1. Gel-cromatografia = cromatografia per filtrazione su gel insolubile, ma altamente idratato le molecole più piccole entrano nei granuli e le grandi no le grandi passano più velocemente
19 raccogliendo in tempi diversi all uscita della colonna si possono separare proteine di dimensioni diverse e con diversa solubilità
20 3. Cromatografia a scambio ionico ph=7 carica netta positiva attacco a COO - carica netta negativa nessuna interazione
21 4. Cromatografia di affinità esempio: Concanavalina A alta affinità per il glucosio colonna con glucosio la proteina si attacca il resto scorre aggiunta di glucosio liberazione della proteina colonna G G proteina aggiunta glucosio colonna G G proteina G G
22 Ultra-centrifugazione refrigerazione campione sedimentato vuoto motore
23 F 2 ( ) 2 c = m ω r = m 1 v ρ ω r v : volume specifico della proteina ρ : densità della soluzione v = f = Fc f : velocità = coeff. m di ( 1 v ρ ) f frizionale sedimen. ω 2 r della = costante proteina = fattore di galleggiamento s = v coeff. di sediment. = 2 ω r = m ( 1 v ρ ) f [s] = Svedberg (S) 1S = sec
24 Velocità di sedimentazione massa (a parità di forma e densità) (densità della molecola) -1 funzione (complicata) della forma (f ) funzione della densità della soluzione (ρ) vρ < 1 vρ = 1 vρ > 1 galleggiamento immobilità affondamento
25 Ribonucleasi A (12.4 kd) Emoglobina (68 kd) Fibrinogeno (330 kd) RNA ribosomale (1100 kd) Ribosoma E.coli (2500 kd) Virus mosaico tabacco (4x10 4 kd) Batteri Lisosomi La centrifugazione può essere usata per separare molecole con diversi coefficienti di sedimentazione S
26 Esempio Molecola anticorpale: Ultracentrifuga: Accelerazione centrifuga: PM = 150 kd r = 8 cm, rivoluzioni/ min (rpm) 4.9 x 10 8 cm/s 2 5 x 10 5 g se v (proteina) = 3.4 x 10-4 cm/s allora s = 7S
27 Sedimentazione all equilibrio Peso Molecolare (PM) centrifugazione a bassa velocità gradiente di concentrazione (sedimentazione bilanciata dalla diffusione) m = (1 v 2kT ρ ) ω 2 ln c 1 ( r c r ) m: massa proteina c i : concentrazioni a distanza r i dall asse di rotazione k: costante di Boltzmann T: temperatura
28 concentrazione aa Sequenziamento per mezzo della degradazione di Edman i. composizione in a.a. Ala-Gly-Asp-Phe-Arg-Gly scaldando a 110ºC in HCl 6N per 24 ore Asp: atena laterale acida: primo aa ad uscire si può individuare fino a 1 µg di un aa (=quantità presente in un impronta digitale) cromatografia a scambio ionico eluzione in funzione del ph
29 ii. identificazione del residuo amino terminale (a) marcatura con cloruro di dansile idrolisi può essere usato 1 sola volta (degradazione completa del peptide) (b) degradazione di Edman: rimozione di un a.a. alla volta dall estremità amino-terminale
30 Passi del sequenziamento a. composizione in a.a. 1Ala, 2Gly, 1Asp, 1Phe, 1Arg b. rimozione alla Edman c. composizione in a.a. 2Gly, 1Asp, 1Phe, 1Arg d. rimozione alla Edman e. composizione in a.a. 1Gly, 1Asp, 1Phe, 1Arg f. e così via a-c Ala c-e Gly e così via
31 Metodo di Edman Lunghezza massima 50 resisui perdita di attendibilità Tagli specifici con metodi chimici o enzimatici Reagente Taglio chimico Bromuro di cianogeno O-iodobenzoato Idrossilamina 2-Nitro-5-tiocianobenzoato Taglio enzimatico Tripsina Clostripaina Proteasi dello Stafilococco Sito di taglio Lato carbossilico di residui Met Lato carbossilico di residui Trp Legami Asp-Gly Lato aminico di residui di Cis Lato carbossilico di residui Lys e Arg Lato carbossilico di residui Arg Lato carbossilico di residui Asn e Gln
32 Prima proteina sequenziata Sanger F., Tuppy H. (1951) The amino-acid sequence in the phenylalanyl chain of insulin 2. The investigation of peptides from enzymic hydrolysates. Biochem. J. 49: Si dimostró che la sequenza era costituita solo da L-aminoacidi uniti tra loro da legami peptidici fra i gruppi α-aminici e i gruppi α-carbossilici metodo costoso ed inefficiente DNA ricombinante
33 Metodi per l allineamento di proteine
34 Data una nuova sequenza proteica primo passo ricerca (veloce) di una sequenza omologa nota Dot-Plot, Fasta, Blast secondo passo allineamento (DP: Needleman-Wunsch con matrici di somiglianza
35 Nuova sequenza possibili risultati della ricerca di omologia nelle Banche Dati Il peggiore: si trova una esatta corrispondenza con una sequenza giá depositata Il migliore: la nuova sequenza é simile a qualcosa di molto interessante (per esempio una proteina oncogena) Buono: la nuova sequenza é simile a qualche proteina nota prosaica (per esempio una ribonucleasi) Pericoloso: la nuova sequenza é marginalmente simile a qualcos altro (ma forse non c ha niente a che fare)
36 Il piú frequente: la nuova sequenza non assomiglia a nessuna delle sequenze presenti nelle Banche Dati 1. una nuova proteina? 2. l URF non è di una proteina? R.F Doolittle Of URF s and ORF s Questo caso era il piú frequente ai tempi (~1985) in cui scriveva Doolittle, ma probabilmente non oggi. release 09/1986 3,939 sequenze 900,163 a.a. release 10/ ,602 sequenze 37,315,215 a.a. release 11/ ,975 sequenze 89,639,744 a.a. release 11/ ,473 sequenze 106,613,078 a.a. release 11/ sequenze 144,646,353 a.a.
37 Release 54.5 of 13-Nov-07 of UniProtKB/Swiss-Prot contains sequence entries
38 2. AMINO ACID COMPOSITION (in percent for the complete database) Ala (A) 7.86 Met (M) 2.39 Gln (Q) 3.98 Trp (W) 1.13 Leu (L) 9.67 Asp (D) 5.33 Ser (S) 6.90 His (H) 2.30 Arg (R) 5.44 Phe (F) 3.94 Glu (E) 6.66 Tyr (Y) 3.00 Lys (K) 5.91 Cys (C) 1.50 Thr (T) 5.39 Ile (I) 5.86 Asn (N) 4.11 Pro (P) 4.86 Gly (G) 6.93 Val (V) 6.72 Asx (B) Glx (Z) Xaa (X) 0.00 Classification by frequency Leu, Ala, Gly, Ser, Val, Glu, Lys, Ile, Arg, Thr, Asp, Pro, Asn, Gln, Phe, Tyr, Met, His, Cys, Trp
39 gray = aliphatic, red = acidic, green = small hydroxy, blue = basic, black = aromatic,yellow = sulfur, white = amide
40
41
42
43 Taxonomic distribution of the sequences Kingdom sequences (% of the database): Archaea (4%) Bacteria ( 48%) Eukaryota ( 44%) Viruses ( 4%)
44 Within Eukaryota: Category sequences (% of Eukaryota) (% of the complete database) Human (14%) (6%) Other Mammalia (31%) ( 14%) Other Vertebrata (10%) (4%) Viridiplantae (17%) ( 7%) Fungi (15%) ( 7%) Insecta 5211 ( 4%) ( 2%) Nematoda 3617 ( 3%) ( 1%) Other 7402 ( 6%) ( 3%)
45 Average sequence length : 368 aa. Shortest sequence is GWA_SEPOF (P83570): 2 aa Longest sequence is TITIN_MOUSE (A2ASS6): aa
46 SEQUENCE SIZE Repartition of the sequences by size (excluding fragments) > last release
47 Tra due sequenze possono esserci vari tipi di relazioni stesso antenato provenienti da duplicazione genica provenienti da convergenza evolutiva 1 provenienti da trasferimento orizzontale di geni (trasposoni) 2 ortologhe paraloghe analoghe xenologhe 1 Es: Stesso sito attivo 2 Nei batteri é comune come, e piú, delle mutazioni
48 Con la tecnica dell allineamento si possono ottenere informazioni o funzionali sequenze molto simili svolgono probabilmente funzioni analoghe o strutturali o evolutive sequenze molto simili possono avere un antenato comune sequenza A sequenza B x passi y passi Antenato comune (normalmente non noto) Distanza evolutiva = x + y = # di mismatches nell allineamento (gaps esclusi)
49 Allineamento Confronto fra due (allineamento a coppie) o piú (allineamento multiplo) sequenze con lo scopo di cercare analogie e similaritá Allineamento globale su sequenze simili alla ricerca del maggior numero di corrispondenze (utilizzo di gaps) Allineamento locale tra pezzi di sequenze per il resto dissimili
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
PURIFICAZIONE DELLE PROTEINE
 PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Struttura secondaria
 Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Metodi di studio delle proteine :
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Centrifugazione. Alle sospensioni viene applicato un campo gravitazionale artificiale attraverso la rotazione ad alta velocità (campo centrifugo).
 Centrifugazione Alle sospensioni viene applicato un campo gravitazionale artificiale attraverso la rotazione ad alta velocità (campo centrifugo). Viene sfruttata la differenza di densità tra le particelle
Centrifugazione Alle sospensioni viene applicato un campo gravitazionale artificiale attraverso la rotazione ad alta velocità (campo centrifugo). Viene sfruttata la differenza di densità tra le particelle
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Acidi nucleici come materiale di studio. DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna
 Acidi nucleici come materiale di studio DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna Isolamento DNA da cellule eucariotiche Isolamento acidi nucleici 1. lisi cellulare 2. purificazione 2a.
Acidi nucleici come materiale di studio DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna Isolamento DNA da cellule eucariotiche Isolamento acidi nucleici 1. lisi cellulare 2. purificazione 2a.
TECNICHE CENTRIFUGATIVE
 TECNICHE CENTRIFUGATIVE Le tecniche di separazione mediante centrifugazione sfruttano il comportamento delle particelle all interno di un campo centrifugo applicato Lo scopo di tali metodiche e quello
TECNICHE CENTRIFUGATIVE Le tecniche di separazione mediante centrifugazione sfruttano il comportamento delle particelle all interno di un campo centrifugo applicato Lo scopo di tali metodiche e quello
TECNICHE CENTRIFUGATIVE PRINCIPI DI BASE DELLA SEDIMENTAZIONE TIPI DI CENTRIFUGHE ULTRACENTRIFUGA ANALITICA
 TECNICHE CENTRIFUGATIVE PRINCIPI DI BASE DELLA SEDIMENTAZIONE TIPI DI CENTRIFUGHE ULTRACENTRIFUGA ANALITICA TIPI DI CENTRIFUGHE CENTRIFUGHE PREPARATIVE Consentono la separazione, isolamento e purificazione
TECNICHE CENTRIFUGATIVE PRINCIPI DI BASE DELLA SEDIMENTAZIONE TIPI DI CENTRIFUGHE ULTRACENTRIFUGA ANALITICA TIPI DI CENTRIFUGHE CENTRIFUGHE PREPARATIVE Consentono la separazione, isolamento e purificazione
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
06_citologia_SER_golgi 1
 1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
La struttura covalente delle proteine (la sequenza amminoacidica)
 La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine. Solo per uso didattico, vietata la riproduzione, la diffusione o la vendita
 MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
FOCALIZZAZIONE ISOELETTRICA (IEF)
 FOCALIZZAZIONE ISOELETTRICA (IEF) ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico
FOCALIZZAZIONE ISOELETTRICA (IEF) ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
Modulo 3. Lavorare con le proteine
 Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
mediante proteasi industriali
 Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea
 la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea Analisi delle sue proprietà fisiche e biologiche Come viene modulata la sua espressione
la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea Analisi delle sue proprietà fisiche e biologiche Come viene modulata la sua espressione
Le molecole di RNA possono assumere particolari strutture che conferiscono loro particolari funzioni.
 Traduzione: t-rna Le molecole di RNA possono assumere particolari strutture che conferiscono loro particolari funzioni. Singola catena alta flessibilità ripiegamento su stessa legami deboli con se stessa
Traduzione: t-rna Le molecole di RNA possono assumere particolari strutture che conferiscono loro particolari funzioni. Singola catena alta flessibilità ripiegamento su stessa legami deboli con se stessa
Genomica e Proteomica
 Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
Traduzione dell informazione genetica (1)
 Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
TIPI di CROMATOGRAFIA
 Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
Distribuzione AA in banca dati
 Aminoacidi Distribuzione AA in banca dati Distribuzione AA in banca dati Aminoacidi Aminoacidi Aminoacidi Aminoacidi Aminoacidi (rappresenta l'assorbanza provocata da una soluzione a concentrazione molare
Aminoacidi Distribuzione AA in banca dati Distribuzione AA in banca dati Aminoacidi Aminoacidi Aminoacidi Aminoacidi Aminoacidi (rappresenta l'assorbanza provocata da una soluzione a concentrazione molare
Elettroforesi di Tamara Benincasa
 Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa
 WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
METODI BIOCHIMICI ESERCIZI D ESAME (by NewSgrunt)
 METODI BIOCHIMICI ESERCIZI D ESAME 2002 2006 (by NewSgrunt) A) SPETTROSCOPIA UV/vis, LAMBERT-BEER, STUDIO DELLE PROTEINE 1A) Il Citocromo c è caratterizzato dai seguenti coefficienti di estinzione molare:
METODI BIOCHIMICI ESERCIZI D ESAME 2002 2006 (by NewSgrunt) A) SPETTROSCOPIA UV/vis, LAMBERT-BEER, STUDIO DELLE PROTEINE 1A) Il Citocromo c è caratterizzato dai seguenti coefficienti di estinzione molare:
Never impure protein PURIFICAZIONE DI PROTEINE
 Never waste pure thoughts on an impure protein PURIFICAZIONE DI PROTEINE PURIFICARE Purificare significa ottenere solamente la nostra molecola di interesse. Purificare una proteina per: Determinarne la
Never waste pure thoughts on an impure protein PURIFICAZIONE DI PROTEINE PURIFICARE Purificare significa ottenere solamente la nostra molecola di interesse. Purificare una proteina per: Determinarne la
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
TECNICHE ELETTROFORETICHE
 TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
COMPORTAMENTO ANFOTERO DEGLI AA
 Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Metodi di studio delle proteine (o altre macromolecole)
 Metodi di studio delle proteine (o altre macromolecole) Purificazione Separazione da altri componenti cellulari; determinazione del grado di purezza Studio Determinazione della struttura funzione regolazione
Metodi di studio delle proteine (o altre macromolecole) Purificazione Separazione da altri componenti cellulari; determinazione del grado di purezza Studio Determinazione della struttura funzione regolazione
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo
 Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE
 MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
MODIFICAZIONI POST-TRADUZIONALI DELLE PROTEINE Nell ultima fase della sintesi proteica la catena polipeptidica neosintetizzata assume spontaneamente la sua conformazione nativa (massimo numero di legami
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Antimo Di Maro. Lezione 3. Corso di Laurea in Scienze Biologiche
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Cap. 1 Interazioni delle molecole con l acqua
 Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Il metabolismo dell azoto
 Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
GENERALITA SULLA CROMATOGRAFIA
 GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
3.3.2. ALIMENTI DI ORIGINE VEGETALE. 3.3.2.1. Verdure
 3.3.2. ALIMENTI DI ORIGINE VEGETALE 3.3.2.1. Verdure Nella Tabella 9 sono riportati i valori degli aminoacidi liberi presenti in alcune fra le più diffuse verdure in commercio. In un passato recente era
3.3.2. ALIMENTI DI ORIGINE VEGETALE 3.3.2.1. Verdure Nella Tabella 9 sono riportati i valori degli aminoacidi liberi presenti in alcune fra le più diffuse verdure in commercio. In un passato recente era
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Strategia generale per la purificazione: metodi di frazionamento.
 Strategia generale per la purificazione: metodi di frazionamento. - Il fatto che le proteine fossero sostanze chimiche ben definite non venne accettato per intero finché James Sumner nel 1926 cristallizzò
Strategia generale per la purificazione: metodi di frazionamento. - Il fatto che le proteine fossero sostanze chimiche ben definite non venne accettato per intero finché James Sumner nel 1926 cristallizzò
Elettroforesi proteine ed acidi nucleici
 Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
WESTERN BLOT o IMMUNOFISSAZIONE
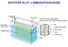 WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina 3500 V catod o
 La prima e : Isoelectric focusing (IEF) v=e z f 1 step1 v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina Tot 76 kvh f = coefficiente
La prima e : Isoelectric focusing (IEF) v=e z f 1 step1 v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina Tot 76 kvh f = coefficiente
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, Padova. Tel.
 Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: fulvio.ursini@unipd.it Funzioni delle
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: fulvio.ursini@unipd.it Funzioni delle
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 5
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Biologia Molecolare. CDLM in CTF La riparazione del DNA
 Biologia Molecolare CDLM in CTF 2010-2011 La riparazione del DNA I tipi di mutazione e le conseguenze Le classi di danno al DNA Meccanismi di riparazione La necessità di codificare l informazione L informazione
Biologia Molecolare CDLM in CTF 2010-2011 La riparazione del DNA I tipi di mutazione e le conseguenze Le classi di danno al DNA Meccanismi di riparazione La necessità di codificare l informazione L informazione
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
5- Estrazione ed analisi di DNA
 5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
3. ELETTROFORESI DI PROTEINE
 3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
Spettrometria di Massa applicata alla PROTEOMICA
 Spettrometria di Massa applicata alla PROTEOMICA 1. MALDI-TOF: Determinazione di mappe peptidiche mediante digestione in gel di spot separati su E-2D E da estratti proteici totali Identificazione rapida
Spettrometria di Massa applicata alla PROTEOMICA 1. MALDI-TOF: Determinazione di mappe peptidiche mediante digestione in gel di spot separati su E-2D E da estratti proteici totali Identificazione rapida
STRUTTURAZIONE DELLE PROTEINE
 STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
I meccanismi di catalisi della sintesi di DNA e RNA sono identici
 I meccanismi di catalisi della sintesi di DNA e RNA sono identici U U OH Ribo-nucleotide trifosfato TRASCRIZIONE Non ha bisogno di innesco Inizia a livello di un promotore La RNA polimerasi è totalmente
I meccanismi di catalisi della sintesi di DNA e RNA sono identici U U OH Ribo-nucleotide trifosfato TRASCRIZIONE Non ha bisogno di innesco Inizia a livello di un promotore La RNA polimerasi è totalmente
Dal Genotipo al Fenotipo
 Dal Genotipo al Fenotipo Dal Fenotipo normale al Fenotipo patologico Regolazione dell espressione genica Figure 7-1 Molecular Biology of the Cell ( Garland Science 2008) Una cellula differenziata contiene
Dal Genotipo al Fenotipo Dal Fenotipo normale al Fenotipo patologico Regolazione dell espressione genica Figure 7-1 Molecular Biology of the Cell ( Garland Science 2008) Una cellula differenziata contiene
Biologia Molecolare. CDLM in CTF La trascrizione negli eucarioti
 Biologia Molecolare CDLM in CTF 2010-2011 La trascrizione negli eucarioti I meccanismi della trascrizione Organizzazione generale delle sequenze regolative Il macchinario generale della trascrizione Si
Biologia Molecolare CDLM in CTF 2010-2011 La trascrizione negli eucarioti I meccanismi della trascrizione Organizzazione generale delle sequenze regolative Il macchinario generale della trascrizione Si
Spettrofotometria e analisi di amminoacidi. Quantizzazione di proteine e di miscele di amminoacidi
 Spettrofotometria e analisi di amminoacidi Quantizzazione di proteine e di miscele di amminoacidi Assorbimento della luce ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è, dal punto di vista dell'elettromagnetismo
Spettrofotometria e analisi di amminoacidi Quantizzazione di proteine e di miscele di amminoacidi Assorbimento della luce ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è, dal punto di vista dell'elettromagnetismo
Analisi quantitativa dell interazione proteina-proteina
 Analisi quantitativa dell interazione proteina-proteina Legame recettore-ligando (proteina-proteina) Il legame per il ligando deve essere: reversibile ad alta affinità saturabile deve portare ad una risposta
Analisi quantitativa dell interazione proteina-proteina Legame recettore-ligando (proteina-proteina) Il legame per il ligando deve essere: reversibile ad alta affinità saturabile deve portare ad una risposta
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Mutagenesi: introduzione di alterazioni in una sequenza nucleotidica. Mutagenesi random: le mutazioni avvengono a caso su un tratto di DNA.
 Mutagenesi: introduzione di alterazioni in una sequenza nucleotidica Mutagenesi random: le mutazioni avvengono a caso su un tratto di DNA. In genere si ottengono trattando il DNA con agenti chimici (es.
Mutagenesi: introduzione di alterazioni in una sequenza nucleotidica Mutagenesi random: le mutazioni avvengono a caso su un tratto di DNA. In genere si ottengono trattando il DNA con agenti chimici (es.
all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA
 Il Codice Genetico The genetic code consists of 64 triplet codons (A, G, C, U) 4 3 = 64 all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA AUG (methionine)
Il Codice Genetico The genetic code consists of 64 triplet codons (A, G, C, U) 4 3 = 64 all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA AUG (methionine)
E. Giordano 16/09/2010
 GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
TRADUZIONE. 2. Transfer (legato agli aminoacidi) 3. Ribosomale (associato a proteine nei ribosomi)
 enhancer promotore regione trascritta TATA trascrizione 5 3 splicing mrna 5 3 traduzione Proteina NH2 COOH Funzione biologica TRADUZIONE I tre ruoli svolti dall RNA: 1. Messaggero 2. Transfer (legato agli
enhancer promotore regione trascritta TATA trascrizione 5 3 splicing mrna 5 3 traduzione Proteina NH2 COOH Funzione biologica TRADUZIONE I tre ruoli svolti dall RNA: 1. Messaggero 2. Transfer (legato agli
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
