La microcalorimetria differenziale a scansione (DSC). Applicazioni nello studio della termostabilità delle proteine
|
|
|
- Lorenza Puglisi
- 6 anni fa
- Visualizzazioni
Transcript
1 La microcalorimetria differenziale a scansione (DSC). Applicazioni nello studio della termostabilità delle proteine
2 Applicazioni della DSC allo studio di macromolecole biologiche Analisi dei parametri termodinamici del processo (ΔH cal, ΔH vh, ΔG, ΔS, T m ) Effetto delle condizioni sperimentali (ph, forza ionica, presenza di ligandi/cofattori) Cinetica e reversibilità di processi temperaturadipendenti Interazioni tra macromolecole Lipidi: transizione di fase DNA/RNA: melting della doppia elica Proteine: denaturazione
3 Applicazioni della DSC allo studio delle proteine Effetto sui parametri termodinamici dell unfolding di una proteina di: Natura del processo di denaturazione (a due stati o multistato) Presenza e interazioni tra domini o subunità Condizioni sperimentali (ph, forza ionica) Presenza di substrati, effettori o cofattori Reazioni di oligomerizzazione e/o dissociazione Interazioni proteina-proteina Cinetica della denaturazione Ruolo di specifici residui amminoacidici
4 Schema del calorimetro Curva calorimetrica Curva calorimetrica di una proteina che subisce denaturazione termica: variazione del calore specifico (C p ) del campione in funzione della temperatura (T). ΔC p è la differenza di calore specifico pre- e post-transizione in corrispondenza di T 1/2. ΔH è l area del picco e corrisponde all entalpia della transizione.
5 Parametri sperimentali che si ottengono dalle curve DSC Tm indice della stabilità termica di una proteina ΔCp indice della compattezza della struttura di una proteina, rapporti S/V contributo delle interazioni idrofobiche ΔH cal caratteristica strutturale di una proteina, che dipende soprattutto dal contributo dei legami H (ed in minor misura dalle altre interazioni deboli). Il ΔH cal aumenta all'aumentare della T di denaturazione fino a raggiungere un valore di circa 13 cal/g a 110 C per numerose proteine globulari l'intensità dell'endoterma è proporzionale alla massa della proteina (o del dominio).
6 Dipendenza dalla temperatura dell entalpia (ΔH) di unfolding
7 Analisi DSC di proteine globulari in funzione del ph
8 Analisi termodinamica delle curve DSC L'area della curva calorimetrica di capacità termica (Cp) in funzione della temperatura corrisponde all'entalpia della transizione tra lo stato nativo e lo stato denaturato. H cal T T b e C p dt cal/g xm r cal/mole se stiamo osservando un equilibrio tra lo stato nativo e lo stato denaturato: d ln K HvH N D è possibile definire un'entalpia di Van't Hoff (ΔH vh ) per la transizione, che è in relazione con l'entalpia calorimetrica (ΔH cal ) attraverso l'equazione: H vh ART 2 C dt p T h m cal RT 2
9 Analisi delle curve DSC A = 4 per transizioni a due stati (N D) ΔH cal = ΔH vh transizioni a due stati ΔH cal > ΔH vh esistono stati intermedi (cooperatività intramolecolare) ΔH cal < ΔH vh cooperatività intermolecolare Parametri termodinamici ΔG = ΔH TΔS all'equilibrio ΔG = 0 ΔS D = ΔH D a T D [D] = [N] T D = T ½ ~ T m T D
10 Analisi delle curve DSC L'analisi termodinamica è applicabile se la transizione è reversibile. Transizioni irreversibili sono analizzabili solo se N k k 1 2 D k I 3 con k 3 < k 2 Sperimentalmente T m e forma della curva non dipendono dalla velocità di scansione (la denaturazione non è sotto controllo cinetico) e dalla concentrazione della proteina (non cambia lo stato di 'aggregazione' della proteina).
11 Analisi termodinamica di curve DSC complesse con ΔH cal > ΔH vh Deconvoluzione in transizioni a due stati (ΔH cal = ΔH vh ) possibilità di attribuire ciascuna transizione a due stati alla denaturazione di un dominio della poteina possibilità di valutare l'influenza di diversi fattori (es. ph, presenza di cofattori, effetto di sostituzioni aminoacidiche) sulla stabilità della proteina (o di un singolo dominio) Equazione di Gibbs-Helmholtz ΔG = ΔH cal [1-(T/Tm)] -ΔCp [(Tm T) + T ln(t/tm)]
12 DSC plasminogeno Il plasminogeno è il precursore della plasmina, una proteasi che scinde i coaguli di fibrina. La struttura multidominio del Lys79-plasminogeno (790 aa) è stata studiata utilizzando DSC e proteolisi limitata. È possibile assegnare le transizioni a due stati ai diversi domini della proteina 50 mm glicina ph
13 Ruolo dei metalli nella stabilità delle proteine: stabilità termica dell azzurrina
14 Perché la denaturazione di una proteina è irreversibile? Aggregazione Perdita del coenzima o del cofattore dal sito attivo Dissociazione di proteine oligomeriche in monomeri Cambiamenti nella struttura primaria Ossidazione di Cys, Met e Trp Riduzione di ponti disolfuro Modificazione di gruppi SH da parte di metalli Idrolisi di legami peptidici a basso ph in corrispondenza di residui di Asp Deammidazione di Asn e Gln
15 DSC Cu,Zn superossido dismutasi (SOD) La Cu,ZnSOD è una proteina dimerica che fa parte dei meccanismi cellulari di difesa contro lo stress ossidativo. L'enzima catalizza la reazione di dismutazione del superossido (O 2- ) ad ossigeno (O 2 ) ed acqua ossigenata (H 2 O 2 ). La Cu,ZnSOD è altamente termostabile (Tm superiore a 80 C) però la sua denaturazione è irreversibile. Identificazione di residui amminoacidici responsabili dell'irreversibilità della denaturazione. Residui di cisteina liberi Cu,ZnSOD bovina Cys6 Cu,ZnSOD umana Cys6 e Cys111 Mutagenesi sito-specifica e analisi DSC valutazione termostabilità globale (Tm) valutazione reversibilità (scaldamento parziale e analisi ΔH cal residuo)
16 Struttura della Cu,Zn superossido dismutasi (SOD) La Cys6 si trova all interfaccia del dimero La Cys111 è esposta al solvente
17 DSC Cu,Zn superossido dismutasi (SOD) bovina La mutazione Cys6Ala destabilizza leggermente la proteina: la Tm è più bassa
18 DSC Cu,Zn superossido dismutasi (SOD) umana dt df H T C t T f e dt t T df vt T t T e T k t f T k dt t df D cal p D vt T R E A D RT E A D D A A ) ( ) ) ( (1 ) ( ) ( ) ( ) ( ) 1 ( ) ( ) ( / 0 / 0 Denaturazione irreversibile descritta dalla relazione N D con una costante cinetica che segue l equazione di Arrhenius.
19 Analisi DSC dei mutanti Cys della Cu,ZnSOD umana C6S111 A6C111 A6S111
20 DSC Cu,Zn superossido dismutasi (SOD) umana Per ottenere i parametri termodinamici è stata effettuata una deconvoluzione della curva DSC assumendo una denaturazione reversibile. La parte della curva al di sopra di 87 C viene esclusa dal fit per minimizzare l effetto di distorsione dovuto all irreversibilità.
21 DSC Cu,Zn superossido dismutasi (SOD) La Cys6 è il residuo che contribuisce maggiormente alla irreversibilità della denaturazione della Cu,ZnSOD.
22 DSC tossina difterica La tossina è costituita da due frammenti associati mediante un ponte disolfuro frammento A 21 kda frammento B 37 kda Il frammento A catalizza la ADP-ribosilazione del fattore di allungamento EFII e blocca la sintesi proteica. La liberazione del frammento A mediante riduzione del ponte disolfuro avverrebbe nel citosol dopo internalizzazione recettore-mediata della tossina. Analisi DSC Tossina A + B A Tm 54.5 C ΔH cal 115 kcal/mol B Tm 58.4 C ΔH cal 164 kcal/mol Frammento A Tm 44.2 C ΔH cal 89 kcal/mol Frammento B idrofobico insolubile Tossina A + B Frammento A irreversibile reversibile
23 DSC tossina difterica
24 DSC tossina difterica La dipendenza dal ph del Tm della tossina A + B fornisce informazioni sul possibile meccanismo termodinamico alla base della traslocazione dall'endosoma nel citosol.
25 Ruolo della Pro31 nel determinare il potere riducente della tioredossina La tioredossina è una proteina di 12 kda conservata dai batteri all uomo che riduce ponti disolfuro nelle proteine. La Cys29 ha pk a 7 e agisce da nucleofilo Motivo Cys-Gly-Pro-Cys nel sito attivo Sito attivo WT e P31T-C32S
26 DSC tioredossina ossidata e ridotta La differenza di stabilità tra TRX ossidata e ridotta è molto ampia nel WT e diminuisce nel mutante P31T
27 La Pro31 è importante nel mantenere la differenza di stabilità tra la forma ossidata di TRX e quella ridotta. Poiché la forma ossidata di TRX è più stabile, è favorita la reazione di riduzione dei ponti disolfuro (o del glutatione, GSH).
28
29
2) La presenza di gruppi funzionali specifici che partecipano alla catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o quelli
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
Il paradosso (termodinamico) degli organismi viventi e la soluzione bioenergetica
 Università di Modena & Reggio Emilia DIPARTIMENTO di BIOLOGIA ANIMALE Laboratorio di Biochimica Il paradosso (termodinamico) degli organismi viventi e la soluzione bioenergetica Nicola Volpi, Prof. Associato
Università di Modena & Reggio Emilia DIPARTIMENTO di BIOLOGIA ANIMALE Laboratorio di Biochimica Il paradosso (termodinamico) degli organismi viventi e la soluzione bioenergetica Nicola Volpi, Prof. Associato
Limiti del criterio della variazione entropia
 Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Cr Mn Fe Co Ni Cu Zn. Chimica Inorganica Biologica Vita ed Energia
 Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
CALORIMETRIA. Il calore è una forma di energia che fluisce da o verso il sistema in presenza di un gradiente di temperatura T. T y.
 Cenni su DSC e CD CALORIMETRIA Il calore è una forma di energia che fluisce da o verso il sistema in presenza di un gradiente di temperatura T Q f ( T ) dove T T x y, z i T y x, z j T z x, y k La maggior
Cenni su DSC e CD CALORIMETRIA Il calore è una forma di energia che fluisce da o verso il sistema in presenza di un gradiente di temperatura T Q f ( T ) dove T T x y, z i T y x, z j T z x, y k La maggior
Macromolecole Biologiche Interazioni non covalenti
 Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine. Solo per uso didattico, vietata la riproduzione, la diffusione o la vendita
 MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
H = entalpia, contenuto termico di un sistema che sta reagendo; dipende dal numero e dal tipo di legami chimici dei reagenti e dei prodotti
 ΔG = ΔH - TΔS H = entalpia, contenuto termico di un sistema che sta reagendo; dipende dal numero e dal tipo di legami chimici dei reagenti e dei prodotti Reazione esotermica = rilascia colore, ΔH è negativo,
ΔG = ΔH - TΔS H = entalpia, contenuto termico di un sistema che sta reagendo; dipende dal numero e dal tipo di legami chimici dei reagenti e dei prodotti Reazione esotermica = rilascia colore, ΔH è negativo,
L ANALISI TERMICA determina l effetto prodotto da un aumento di temperatura su alcune proprietà fisiche del campione. (TG, DTA, TMA, EA, DSC, etc)
 La CALORIMETRIA determina le quantità di calore prodotte dalle trasformazioni fisiche e chimiche di un campione. (Calorimetria adiabatica ed isoterma) L ANALISI TERMICA determina l effetto prodotto da
La CALORIMETRIA determina le quantità di calore prodotte dalle trasformazioni fisiche e chimiche di un campione. (Calorimetria adiabatica ed isoterma) L ANALISI TERMICA determina l effetto prodotto da
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento più o meno elevata 4 classi sulla
Applicazioni biotecnologiche degli enzimi: le proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento più o meno elevata 4 classi sulla
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Termodinamica dei sistemi biologici
 Bioenergetica Termodinamica dei sistemi biologici La bioenergetica è lo studio quantitativo delle trasduzioni energetiche, cioè dei cambiamenti di energia da una forma ad un altra Le trasformazioni biologiche
Bioenergetica Termodinamica dei sistemi biologici La bioenergetica è lo studio quantitativo delle trasduzioni energetiche, cioè dei cambiamenti di energia da una forma ad un altra Le trasformazioni biologiche
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
L'analisi termica come metodo utile per l'identificazione delle plastiche ed il controllo qualità di materiali riciclati
 L'analisi termica come metodo utile per l'identificazione delle plastiche ed il controllo qualità di materiali riciclati Desenzano del Garda Food Contact Expert 25 Giugno 2015 Temperature T Cos è l Analisi
L'analisi termica come metodo utile per l'identificazione delle plastiche ed il controllo qualità di materiali riciclati Desenzano del Garda Food Contact Expert 25 Giugno 2015 Temperature T Cos è l Analisi
Composizione della sostanza azotata del latte vaccino (% rel)
 Composizione della sostanza azotata del latte vaccino (% rel) s1 29-35 Caseine s2 8-10 35-40 78 10-15 Materia Azotata Proteica ( ) lattoglobulina 4-8 8-9 94-95 Materia Azotata Totale (N*6,38) Proteine
Composizione della sostanza azotata del latte vaccino (% rel) s1 29-35 Caseine s2 8-10 35-40 78 10-15 Materia Azotata Proteica ( ) lattoglobulina 4-8 8-9 94-95 Materia Azotata Totale (N*6,38) Proteine
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
STRUTTURAZIONE DELLE PROTEINE
 STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
STRUTTURAZIONE DELLE PROTEINE Molti diversi tipi di struttura non avvolta (unfolded states) Un solo tipo di struttura avvolta (folded state) Proteina NATIVA Principi della strutturazione proteica: 1) La
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Termodinamica ENTALPIA...6
 Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Entropia, energia libera ed equilibrio. Capitolo 17
 Entropia, energia libera ed equilibrio Capitolo 17 Processi chimici e fisici spontanei Una cascata cade verso il basso Una zolletta di zucchero si scioglie in una tazza di caffé Ad 1 atm, l acqua ghiaccia
Entropia, energia libera ed equilibrio Capitolo 17 Processi chimici e fisici spontanei Una cascata cade verso il basso Una zolletta di zucchero si scioglie in una tazza di caffé Ad 1 atm, l acqua ghiaccia
Cinetica Chimica. Cinetica chimica
 Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
COMPORTAMENTO ANFOTERO DEGLI AA
 Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Applicazioni biotecnologiche degli enzimi: le lipasi
 Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Le tre funzioni termodinamiche che descrivono le variazioni di energia che avvengono in una reazione sono:
 Le tre funzioni termodinamiche che descrivono le variazioni di energia che avvengono in una reazione sono: G= energia libera di Gibbs H= entalpia S= entropia ΔG = ΔH TΔS ΔH < 0 ΔS > 0 Condizione tipica
Le tre funzioni termodinamiche che descrivono le variazioni di energia che avvengono in una reazione sono: G= energia libera di Gibbs H= entalpia S= entropia ΔG = ΔH TΔS ΔH < 0 ΔS > 0 Condizione tipica
Malattie a carattere. Familiare (causa genetica, più casi nella stessa famiglia)
 I meccanismi biochimici che sottintendono alle malattie neurodegenerative sono (sorprendentemente) pochi, inter-connessi e (sorprendentemente) comuni alle diverse malattie Malattie a carattere Familiare
I meccanismi biochimici che sottintendono alle malattie neurodegenerative sono (sorprendentemente) pochi, inter-connessi e (sorprendentemente) comuni alle diverse malattie Malattie a carattere Familiare
Corso di Macromolecole LO STATO VETROSO
 LO STATO VETROSO er studiare lo stato fisico del sistema ed introdurre quindi la discussione sullo stato vetroso si può descrivere come esso varia al variare della temperatura. Ø partendo dal cristallo
LO STATO VETROSO er studiare lo stato fisico del sistema ed introdurre quindi la discussione sullo stato vetroso si può descrivere come esso varia al variare della temperatura. Ø partendo dal cristallo
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
PROGRAMMA DISCIPLINARE SVOLTO a. s / N.B. il programma è pubblico ad uso degli studenti e delle famiglie.
 Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
FARMACODINAMICA. La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci.
 FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Laurea Magistrale in Biologia
 Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti:
 Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti: 1) Legami elettrostatici 2) Legami idrogeno 3) Forze di van der Waals Le interazioni deboli tra biomolecole
Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti: 1) Legami elettrostatici 2) Legami idrogeno 3) Forze di van der Waals Le interazioni deboli tra biomolecole
BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA
 Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
INTERAZIONI INTERMOLECOLARI NELLE PROTEINE
 INTERAZIONI INTERMOLECOLARI NELLE PROTEINE 1 RICHIAMI DI TERMODINAMICA 2 Entalpia Entropia Energia Libera di Gibbs ENERGIA INTERNA (U) L energia interna riassume tutti i contributi cinetici e potenziali
INTERAZIONI INTERMOLECOLARI NELLE PROTEINE 1 RICHIAMI DI TERMODINAMICA 2 Entalpia Entropia Energia Libera di Gibbs ENERGIA INTERNA (U) L energia interna riassume tutti i contributi cinetici e potenziali
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe. Substrato
 Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
INTRODUZIONE ALLA BIOCHIMICA
 INTRODUZIONE ALLA BIOCHIMICA Sistema vivente sistema complesso ed altamente organizzato dotato di una composizione chimica determinata e unica grazie a tale composizione chimica al suo interno si formano
INTRODUZIONE ALLA BIOCHIMICA Sistema vivente sistema complesso ed altamente organizzato dotato di una composizione chimica determinata e unica grazie a tale composizione chimica al suo interno si formano
moli OH - /mole amminoacido
 ) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
Fosforilazione ossidativa
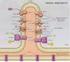 Chimica Biologica A.A. 2010-2011 Fosforilazione ossidativa Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Teoria Chemiosmotica ΔG = 2.3 RT (ph (matrice) -ph (spazio
Chimica Biologica A.A. 2010-2011 Fosforilazione ossidativa Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Teoria Chemiosmotica ΔG = 2.3 RT (ph (matrice) -ph (spazio
Reazione di Briggs Rauscher
 Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine
 Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine Struttura di alcuni antibiotici -lattamici Meccanismo d azione della penicillina La penicillina inibisce la transpeptidasi,
Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine Struttura di alcuni antibiotici -lattamici Meccanismo d azione della penicillina La penicillina inibisce la transpeptidasi,
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
06_citologia_SER_golgi 1
 1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
Le reazioni chimiche
 Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Combustione 2H 2 CO 2. Entalpie standard di combustione
 La combustione è una reazione di ossidoriduzione esotermica in cui si ha l'ossidazione di un combustibile da parte di un comburente (ossigeno presente nell aria), con sviluppo di calore e radiazioni luminose.
La combustione è una reazione di ossidoriduzione esotermica in cui si ha l'ossidazione di un combustibile da parte di un comburente (ossigeno presente nell aria), con sviluppo di calore e radiazioni luminose.
Applicazioni biotecnologiche degli enzimi: le lipasi
 Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
La cinetica chimica. Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento)
 La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
Reazioni opposte. Reazioni opposte o reversibili A + B 2C (k 1 e k -1 )
 Reazioni complesse Reazioni opposte o reversibili A B ( e - ) Reazioni consecutive A B C ( e ) Reazioni competitive o parallele A B ( ) A C ( ) Reazioni opposte Reazioni opposte o reversibili A + B C (
Reazioni complesse Reazioni opposte o reversibili A B ( e - ) Reazioni consecutive A B C ( e ) Reazioni competitive o parallele A B ( ) A C ( ) Reazioni opposte Reazioni opposte o reversibili A + B C (
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
Acquisizione e Stabilità della struttura terziaria delle proteine
 Acquisizione e Stabilità della struttura terziaria delle proteine FORZE CHE STABILIZZANO LA STRUTTURA TERZIARIA DELLE PROTEINE 1. Legame covalente S-S (forte): non è presente in tutte le proteine che,
Acquisizione e Stabilità della struttura terziaria delle proteine FORZE CHE STABILIZZANO LA STRUTTURA TERZIARIA DELLE PROTEINE 1. Legame covalente S-S (forte): non è presente in tutte le proteine che,
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Lo scopo della biochimica è la comprensione della vita in termini molecolari.
 Lo scopo della biochimica è la comprensione della vita in termini molecolari. Sebbene la biochimica venga spesso descritta come una scienza della vita e il suo sviluppo venga messo in relazione con la
Lo scopo della biochimica è la comprensione della vita in termini molecolari. Sebbene la biochimica venga spesso descritta come una scienza della vita e il suo sviluppo venga messo in relazione con la
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
CHIMICA GENERALE MODULO
 Corso di Scienze Naturali CHIMICA GENERALE MODULO 6 Termodinamica Entalpia Entropia Energia libera - Spontaneità Relatore: Prof. Finelli Mario Scienza che studia i flussi energetici tra un sistema e l
Corso di Scienze Naturali CHIMICA GENERALE MODULO 6 Termodinamica Entalpia Entropia Energia libera - Spontaneità Relatore: Prof. Finelli Mario Scienza che studia i flussi energetici tra un sistema e l
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE 1) Il collagene è una proteina (globulare / fibrosa). È formata da tre (catene alfa/alfa eliche) con andamento (destrorso/sinistrorso) che vanno
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE 1) Il collagene è una proteina (globulare / fibrosa). È formata da tre (catene alfa/alfa eliche) con andamento (destrorso/sinistrorso) che vanno
Esistono reazioni energeticamente favorite (ΔH<0) che non avvengono.es. C(diamante) à C(grafite)
 CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
CINETICA CHIMICA. Ogni reazione chimica però impiega un certo tempo per raggiungere le condizioni di equilibrio.
 Facendo reagire delle sostanze si arriva ad uno stato di equilibrio in cui le concentrazioni di reagenti e prodotto rispettano la legge di equilibrio chimico, definita da una costante di equilibrio. Ogni
Facendo reagire delle sostanze si arriva ad uno stato di equilibrio in cui le concentrazioni di reagenti e prodotto rispettano la legge di equilibrio chimico, definita da una costante di equilibrio. Ogni
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
30/10/2015 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE
 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
TERMODINAMICA. CONVENZIONE STORICA Q > 0 assorbito dal sistema W>0 fatto dal sistema Q < 0 ceduto dal sistema W<0 fatto sul sistema
 TERMODINAMICA Scambi di CALORE e LAVORO tra: SISTEMA AMBIENTE UNIVERSO kaperto SCAMBIA ENERGIA E MATERIA SISTEMA CHIUSO SCAMBIA ENERGIA, NON MATERIA m ISOLATO NON SCAMBIA ENERGIA NE MATERIA ENERGIA INTERNA
TERMODINAMICA Scambi di CALORE e LAVORO tra: SISTEMA AMBIENTE UNIVERSO kaperto SCAMBIA ENERGIA E MATERIA SISTEMA CHIUSO SCAMBIA ENERGIA, NON MATERIA m ISOLATO NON SCAMBIA ENERGIA NE MATERIA ENERGIA INTERNA
DETERMINAZIONE DELLA TEMPERATURA ED ENTALPIA DI FUSIONE DELLO STAGNO MEDIANTE CALORIMETRIA A SCANSIONE DIFFERENZIALE
 DETERMINAZIONE DELLA TEMPERATURA ED ENTALPIA DI FUSIONE DELLO STAGNO MEDIANTE CALORIMETRIA A SCANSIONE DIFFERENZIALE La tecnica della calorimetria a scansione differenziale (DSC) permette di effettuare
DETERMINAZIONE DELLA TEMPERATURA ED ENTALPIA DI FUSIONE DELLO STAGNO MEDIANTE CALORIMETRIA A SCANSIONE DIFFERENZIALE La tecnica della calorimetria a scansione differenziale (DSC) permette di effettuare
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine:
 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Modellistica dei Sistemi Biologici. Lezione 1 Introduzione alla Cinetica Chimica Fabio Mavelli
 Modellistica dei Sistemi Biologici Lezione 1 Introduzione alla Cinetica Chimica Fabio Mavelli 14 marzo 2012 Cinetica Chimica Branca della Chimica-Fisica che studia l evoluzione temporale dei Sistemi Chimici
Modellistica dei Sistemi Biologici Lezione 1 Introduzione alla Cinetica Chimica Fabio Mavelli 14 marzo 2012 Cinetica Chimica Branca della Chimica-Fisica che studia l evoluzione temporale dei Sistemi Chimici
Termodinamica II. Secondo Principio della Termodinamica
 Termodinamica II Secondo Principio della Termodinamica Dal primo al secondo principio della termodinamica Dal primo principio sappiamo che l energia non può essere né creata, né distru;a. Da questo deriva
Termodinamica II Secondo Principio della Termodinamica Dal primo al secondo principio della termodinamica Dal primo principio sappiamo che l energia non può essere né creata, né distru;a. Da questo deriva
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
