Chimica Fisica - Esercizi AA Rev. 2
|
|
|
- Rossana Cipriani
- 6 anni fa
- Visualizzazioni
Transcript
1 Chimica Fisica - Esercizi AA Rev. 2 Mirco Zerbetto, Antonino Polimeno htt:// Diartimento di Scienze Chimiche Università degli Studi di Padova
2 2
3 Indice 1 Nozioni di analisi matematica - I rinciio Derivate arziali e differenziali totali Esercizi risolti Esercizi non risolti Differenziali Esercizi risolti Esercizi non risolti I Princiio Esercizi risolti Esercizi non risolti II rinciio, grandezze standard e relazioni differenziali II Princiio Esercizi risolti Esercizi non risolti Grandezze standard Esercizi risolti Esercizi non risolti Relazioni differenziali Esercizi risolti Esercizi non risolti Sostanze ure e soluzioni Sostanze Esercizi risolti Esercizi non risolti Diagrammi di fase e soluzioni Esercizi risolti Esercizi non risolti
4 4 INDICE 4 Equilibrio chimico ed elettrochimico - cinetica chimica Equilibrio chimico ed elettrochimico Esercizi risolti Esercizi non risolti Cinetica chimica Esercizi risolti Esercizi non risolti
5 INDICE 5 Modifiche risetto alla Rev 1 Migliorata siegazione soluzione esercizio 1.27 Corretta soluzione esercizio 1.32 Corretto il valore del C dell acqua nel testo dell esercizio 1.36 Corretta la soluzione numerica, e migliorato il testo dell indizio nelle soluzioni, dell esercizio 1.38 Corretta la soluzione dell esercizio 1.46 Corretto refuso nel testo dell esercizio 2.15 Migliorata la discussione della soluzione dell esercizio 2.15 Corretti testo e soluzione numerica dell esercizio 2.25 Corretti testo e soluzione numerica dell esercizio 2.26 Corretto il segno nell esercizio 2.34 Migliorati testo e discussione della soluzione dell esercizio 3.16
6 6 INDICE
7 Caitolo 1 Nozioni di analisi matematica - I rinciio 7
8 8 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO 1.1 Derivate arziali e differenziali totali È data una funzione generica reale f(x 1, x 2,..., x m ) di m variabili indiendenti reali, che er ora assumiamo definita in R m. Nel seguito, assumiamo che la funzione f abbia un buon comortamento (derivabile ovunque, invertibile risetto a tutte le coordinate etc., salvo al iù che in un numero finito di unti). La derivata arziale di f risetto a x i è il limite del raorto tra la variazione della funzione e la variazione di x i mantenendo tutte le altre m 1 coordinate costanti ( ) f f(x 1,..., x i + δx i,..., x m ) f(x 1,..., x i,..., x m ) = lim x i x δx i 0 j i δx i L ordine di differenziazione è ininfluente sul risultato ( 2 ) ( f 2 ) f x i x j x k i,j = x j x i x k i,j Il differenziale totale df di una funzione f(x 1,..., x m ) è df = m ( f i=1 x i ) dx i dove dx i è una variazione infinitesimale e arbitraria della i-esima variabile indiendente x i Esercizi risolti Esercizio 1.1 Data la relazione (n, V, ) = nr/v, con R una costante, calcolate le derivate rime di. Soluzione ( ) Le derivate sono = R n V, V ( ) = nr V 2 V ( ) n, n,v = nr V Esercizio 1.2 Calcolate il differenziale totale di, definita dalla relazione recedente. Soluzione Si trova subito che ( ) ( ) d = dn + n V V, n, dv + ( ) d = R n,v V ( dn n ) dv + nd V Esercizio 1.3 Data la funzione Z = Z(X, Y ) dimostrate che ( ) Y 1 = ( ) Z X Z Y X
9 1.1. DERIVAE PARZIALI E DIFFERENZIALI OALI 9 e la cosiddetta regola ciclica ( ) X Y ( ) Y Z ( ) Z X Z X Y = 1 Soluzione Partiamo dal differenziale totale di Z ( ) ( ) Z Z dz = dx + dy X Y Y X Dato che abbiamo assunto un buon comortamento, ossiamo ricavare in rinciio Y = Y (X, Z) e calcolare il differenziale totale ( ) ( ) Y Y dy = dx + X Z Z X dz Sostituendo la rima nella seconda er dz ( ) ( ) [( ) Y Y Z dy = dx + X Z X vale a dire [( ) Y ( ) Z Z X X Y Z X Y dx + ( ) ] [( ) Y Y + dx + X Z Z X ( ) ] Z dy Y X ( ) ] Z 1 dy = 0 (1.1) Y X oiché le variazioni di X e Y sono arbitrarie, affinchè la relazione recedente sia vera, i contenuti delle arentesi quadre devono essere nulli. Quindi, onendo a zero il coefficiente di dy ( ) ( ) ( ) Y Z Y 1 = 1 = ) Z Y Z X X X ( Z Y X Naturalmente si otevano scegliere come variabili indiendenti una coia qualunque tra X, Y e Z quindi vale anche che ( ) ( ) X 1 X 1 = ( ) = ( ) Z Y Z Y Z Y X Y X Z Se ora nell equazione 1.1 mandiamo a zero il coefficiente di dx otteniamo ( ) ( ) ( ) ( ) ( ) ( ) Y Z Y X Y Z = = 1 Z X X Y Z X X Y Z Z X Y Esercizio 1.4 Date le grandezze α = V 1 ( V ) (coefficiente di esansione termica) e κ = V 1 ( ) (coefficiente di comressibilità), dimostrate che = α V κ Soluzione Dalla regola ciclica abbiamo che ( ) V = 1 ( ) V ( V ) = ( ) ( V ) ( V ) V ( ( V ) V = V α V κ = α κ ) = 1, quindi ( V )
10 10 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO Esercizio 1.5 Date due funzioni F = F (X, Y ) e G = G(X, Y ), dimostrate la regola della catena (chain rule) ( ) ( ) ( ) F F Y = G X Y X G X e che ( ) ( ) F F = X G X Y ( ) ( ) F Y + Y X X G Soluzione Consideriamo ( ) i differenziali ( ) totali di F = F (X, Y ) e Y = Y (X, G) F F df = dx + dy X Y Y X ( ) ( ) Y Y dy = dx + dg X G G X Sostituendo la seconda nella rima otteniamo df = [( ) F X Y ( ) ( ) ] ( ) ( ) F Y F Y + dx + dg Y X X G Y X G X ma F uò anche essere considerata funzione di X e G, F = F (X, G) ( ) ( ) F F df = dx + dg X G G X Le ultime due esressioni er df devono essere identiche, er dx, dg arbitrarie. Quindi devono essere vere le due regole enunciate inizialmente Esercizio 1.6 Calcolate il raorto tra il coefficiente di esansione termica α e quello di comressibilità κ er un gas erfetto avente volume molare ari ad dm 3 mol 1. Soluzione I fattori di esansione termica e di comressibilità sono stati in recedenza definiti come α = 1 ( ) Vm V m κ = 1 ( ) Vm V m oiché il volume molare di una gas erfetto è semlicemente V m = R/, dal calcolo diretto delle derivate arziali del volume molare si ha che α = 1 R V m = 1 κ = 1 R V m 2 = 1 da cui segue che er un gas erfetto α κ = = R V m Se V m = m 3 mol 1, con R = Pa m 3 K 1 mol 1, il raorto vale Pa K 1.
11 1.1. DERIVAE PARZIALI E DIFFERENZIALI OALI 11 Esercizio 1.7 Calcolate il raorto tra il coefficiente di esansione termica α e quello di comressibilità κ er il metano, descritto come un gas di van der Waals, con volume molare ari ad L mol 1. Soluzione Il roblema è analogo al recedente, ma il calcolo diretto delle derivate arziali del volume molare è reso difficile dal fatto che V m è ottenibile in modo eslicito solo come soluzione di una equazione cubica. Possiamo erò imiegare un utile identità algebrica, che sarà discussa in un uno dei Caitoli successivi: er una funzione generica F di tre coordinate X, Y, Z, se F (X, Y, Z) = 0 allora ( ) Y X Z ( ) F X = Y,Z ( F Y )X,Z Nel nostro caso osto F R/(V m b) + a/vm, 2 otteniamo facilmente α = 1 R V m b V R m (V m b) 2a 2 Vm 3 κ = 1 1 V R m (V m b) 2a 2 Vm 3 da cui deriva che α κ = R V m b Se V m = L mol 1 e b = L mol 1, con R = L atm K 1 mol 1, il raorto vale atm K 1 = Pa K 1. Esercizio 1.8 Calcolate le esressioni er il volume molare critico, la temeratura critica e la ressione critica di un gas descritto dall equazione di stato di van der Waals. Soluzione Nel diagramma V m costruito er l equazione vdw, ossiamo distinguere due regioni: nella rima, er < c, le isoterme resentano un massimo ed un minimo; nella seconda, er > c, le isoterme decadono in modo monotòno. L isoterma a = c seara le due regioni (quella inferiore è associata ad un sistema che assa da un fase condensata ad una fase gas, quella sueriore corrisonde ad un sistema in condizioni suercritiche, senza transizioni di fase) ed è dotata di un flesso a tangente orizzontale, che è identificato con il unto critico. Per calcolare c, V c e c dobbiamo solo valutare le derivate rima e seconda di in funzione di V m e orle ari a zero ( V m ) ( ) 2 2 V m = R (V m b) 2 + 2a Vm 3 = 0 2R = (V m b) 3 6a Vm 4 = 0 risolvendo troviamo V c = 3b, c = 8a/27Rb e sostituendo nell equazione di vdw troviamo c = a/27b 2.
12 12 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO Esercizio 1.9 Elaborate una rocedura sistematica er mettere in relazione i coefficienti del viriale nelle due formulazioni (ressione e volume) che descrivono il comortamento di un gas reale Z = n=1 A n n 1 B n Z = V n 1 n=1 m con A 1 = B 1 = 1 e dove Z = V m /R è il fattore di comressibilità Soluzione Poiché Z = V m /R, dalla seconda equazione del viriale otteniamo = R n=1 B n V n m e sostituendo nella rima esressione del viriale abbiamo la seguente relazione er Z Z = ( A n R ) n 1 B k V k = n=1 k=1 m ( = 1 + A 2 R ) ( B k V k + A 3 R ) 2 B k k=1 m V k +... = k=1 m = 1 + A 2R B 1 + A 2R B 2 + A 3 (R ) 2 B 1 V m Vm da cui segue che B 2 = R A 2, B 3 = (R ) 2 (A A 3) e così via. Esercizio 1.10 Calcolate il volume occuato da 1 mole di CO 2, descritta dall equazione vdw, ad 1 atm e 300 K. Soluzione Il roblema è risolvibile analiticamente, ma richiede la soluzione di un equazione cubica. Infatti, artendo dall equazione di stato otteniamo che il volume molare di un gas vdw verifica la relazione V 3 m R + b Vm 2 + a V m ab = 0 che ammette tre soluzioni (comlesse). Conviene risolvere l equazione numericamente, er esemio con il metodo di Netwon (si veda er esemio W.H. Press, S.A. eukolsky, W.. Vetterling e B.P. Flannery Numerical Recies: the art of scientific comuting (III ed.), New York: Cambridge University Press, ISBN ). Si verifica che delle tre soluzioni, una sola è reale e coincide con il volume molare. Per la CO 2, con a = atm L 2 mol 2 e b = L mol 1, si ottiene V m = L mol 1. Il rogramma in linguaggio Matlab che segue, risolve numericamente il roblema: function [Vm] = vdw(a, b,, ) %%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%% % Questa funzione calcola il volume molare er un gas
13 1.1. DERIVAE PARZIALI E DIFFERENZIALI OALI 13 % di van der Waals dati i arametri a, b, la ressione () % e la temeratura (). Le unita di misura sono: % % a : atm L^2 mol^-2 % b : L mol^-1 % : atm % : K % Vm : L mol^-1 %%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%% % % Costante dei gas in unita aroriate R = e-2; % L atm K^-1 mol^-1 % % real_gas imlementa l equazione di stato dei gas reali % di van der Waals fun real_gas(vm, a, b,,, R); % % Cerca la soluzione rossima a quella del gas ideale Vm = fzero(fun, R*/); return; function [f] = real_gas(vm, a, b,,, R) f = Vm^3 - Vm^2 * (b + R * / ) + a * Vm / - a * b / ; return; Potete scaricare la routine vdw.m dal sito web del Corso. Per il Matlab, invece, è a disosizione di tutti gli studenti una licenza di Ateneo al sito del CSIA Esercizi non risolti Esercizio 1.11 Il modello di van der Waals descrive in modo arossimato il comortamento di un gas mediante le due equazioni = nr V nb n2 a V 2 U = 3 2 nr n2 a V ( dove a, b sono costanti. rovate un esressione er U )n, in funzione di n, V e Esercizio 1.12 La caacità termica a volume costante di un sistema è C V = ( U ) V. Dimostrate
14 14 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO che ( ) U = C V + αv ( ) U V Esercizio 1.13 Stimate le costanti critiche secondo l equazione di van der Waals er l anidride carbonica. 1.2 Differenziali Una quantità infinitesimale m dz = M i (x 1,..., x m )dx i i=1 è detta differenziale lineare. In due variabili: dz = M(x, y)dx + N(x, y)dy (1.2) Un differenziale si dice esatto se esiste una funzione F tale che df = dz. In due variabili, la condizione necessaria e sufficiente erchè il differenziale sia esatto è che ( ) ( ) M N = y x x ( ) mentre in generale dovrà essere Mi x j y ( ) Mj x i = Considerate ora una curva C nel iano xy, x k j x k i che connetta due unti P in (x in, y in ) e P fin (x fin, y fin ) Dato il differenziale 1.2, definiamo l integrale di linea I sulla curva come n I = lim [M(x i, y i ) x i + N(x i, y i ) y i ] n i=1 dove i unti (x i, y i ) sono i vertici di una sezzata che arte da P in e arriva a P fin. Si dicono integrali ciclici I = C dz gli integrali di linea di un differenziale dz con un cammino di integrazione raresentato da una curva chiusa (P in = P fin ). Valgono le seguenti imortanti rorietà 1. se dz è esatto I = C dz = 0 er ogni curva chiusa C 2. se dz è esatto I = C dz = I = C dz se C e C hanno lo stesso unto iniziale e finale (l integrale è indiendente dal cammino) Se il differenziale è esatto, infatti, esiste una funzione F tale che dz = df, e quindi C df = F (x fin, y fin ) F (x in, y in ), indiendentemente dalla forma del cammino C. Le rorietà dei differenziali lineari sono di fondamentale interesse er al termodinamica. Per ogni trasformazione infinitesimale (cioè cambiamento di stato di un sistema termodinamico), le variazioni C dz
15 1.2. DIFFERENZIALI 15 Figura 1.1: Integrale di linea infinitesimale delle varie funzioni di stato d, dv, du, dh, ds, dg, da e così via sono differenziali esatti; il lavoro dw ed il calore dq scambiati dal sistema invece non lo sono. Per una trasformazione finita dallo stato 1 allo stato 2, la variazione finita F di una funzione di stato F è ottenuta come F = F 2 F 1 ; il lavoro ed il calore totali scambiati si devono invece calcolare dagli integrali di linea relativi al cammino secifico della trasformazione (se esiste un cammino, cioè una successione continua di unti di equilibrio del sistema!) Esercizi risolti Esercizio 1.14 dz = xy 2 dx + x 2 ydy, dv = xy 2 dxdy + xydx e dw = x 2 ydx + xy 2 dy sono differenziali lineari? Esatti o non esatti? Soluzione dz e dw sono differenziali lineari. Il rimo esatto, il secondo no. Infatti: xy 2 = 2xy = x2 y y x x 2 y y = x 2 xy2 x = y2 Esercizio 1.15 Calcolate l integrale di linea del differenziale (inesatto) dw = x 2 dx + xydy lungo la curva y = x da (0, 0) a (1, 1).
16 16 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO Soluzione Poiché y = x I = C dw = C x 2 dx + xydy = 2 C 1 0 x 2 dx = 2 3 x3 1 0 = 2 3 Esercizio 1.16 Calcolate l integrale di linea del differenziale (inesatto) dw = x 2 dx + xydy lungo la curva y = x 2 da (0, 0) a (1, 1). Soluzione Poiché y = x 2, dy = 2xdx I = C dw = C x 2 dx + xydy = C 1 0 (x 2 + 2x 4 )dx = x x5 0 0 = Esercizi non risolti Esercizio 1.17 Determinate il differenziale totale delle seguenti funzioni: z = e xy, z = 1/(x + y), z = ln xy e z = x sin y + y sin x Esercizio 1.18 A basse temerature e ressioni, l equazione di stato di un gas uò essere utilmente definita come (V m, ) = R V m a V 2 m dove a è una costante. Derivate esressioni er le seguenti quantità: ( ) Vm ( ) ( ) ( ), V m V, Vm, m Esercizio 1.19 Date le funzioni f(x, y) = x 2 y + xy 2 e g(x, y) = e (x2 +y 2) calcolate ( ) f e g x ( ) f x g Esercizio 1.20 Quali tra i seguenti differenziali sono esatti? dx x 2 y + dy xy 2 dx xy 2 + dy x 2 y 3. 2x 2 ydx + x 3 dy 4. ln ydx + x y dy Esercizio 1.21 Valutate l integrali di linea: C (x3 ydx + x 2 y 2 dy) dove C è il triangolo formato nell ordine da tre unti A(0, 0), B(0, 1) e C(1, 1).
17 1.3. I PRINCIPIO I Princiio Esercizi risolti Esercizio 1.22 I sistemi 1, 2 e 3 sono gas descritti dalle coordinate termodinamiche 1, V m,1, 2, V m,2, 3, V m,3 dove i, V m,i sono la ressione ed il volume molare del sistema i-esimo. serimentalmente che quando 1 e 3 sono in equilibrio termico, è soddisfatta la relazione Si trova 1 V m,1 ab 1 3 V m,3 = 0 mentre quando 2 e 3 sono in equilibrio termico vale la relazione 2 V m,2 3 V m,3 + ac 3V m,3 V m,2 = 0 dove a, b e c sono costanti. Definite una funzione er la temeratura emirica. Soluzione In condizioni di equilibrio termico devono valere entrambe le relazioni recedenti. Possiamo quindi scrivere dalla rima equazione: 1 V m,1 ab 1 = 3 V m,3 e dalla seconda 2 V m,2 1 ac V m,2 = 3 V m,3 da cui segue che le tre funzioni definibili come temeratura emirica sono θ = 1 V m,1 ab 1 = 2V m,2 1 ac V m,2 = 3 V m,3 Esercizio 1.23 Una reazione chimica sta avvenendo in un contenitore cilindrico, la cui area è A = 50 cm 2. A causa della reazione, un istone viene sinto er una distanza l = 15 cm contro una ressione costante ext = 121 kpa. Si calcoli il lavoro comiuto dal sistema. Soluzione Il lavoro comiuto dal sistema è di volume ed essendo l esansione contro una ressione esterna costante, si calcola w = ext V = ext A l = Pa m m = 91 J Esercizio 1.24 Si vuole determinare la caacità termica a ressione costante di un camione di una sostanza A, C A. Si rocede onendo il camione in un calorimetro a ressione costante, ed effettuando una quantità nota di lavoro sul sistema, w A, misurando nel contemo l aumento di temeratura del
18 18 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO sistema calorimetro + camione, A. Si rocede oi nello stesso modo er un camione di una sostanza, B, di cui è nota la caacità termica, C B, esercitando il lavoro w B e misurando B. Si suone che le caacità termiche siano costanti negli intervalli di temeratura considerati. Soluzione Per il rimo rinciio, in un calorimetro adiabatico a ressione costante, il lavoro fatto sul sistema coincide con la variazione di entalia. Se chiamiamo C la caacità termica del calorimetro, abbiamo (er semlice integrazione dell equazione che definisce la caacità termica, se si suone che sia costante con la temeratura) w A = H A = (C + C A ) A w B = H B = (C + C B ) B da cui, eliminando C, segue che C A = C B + H A A H B B Esercizio 1.25 Qual è la temeratura finale di una massa di acqua ari a m = kg, inizialmente a 25.6 C, osta in un calorimetro a ressione costante di caacità termica trascurabile, se si fa assare attraverso un resistore immerso nel camione una corrente elettrica i di 1.94 A, alla differenza di otenziale elettrico V di V, er un temo t di s? Soluzione Per effetto Joule, il lavoro elettrico effettuato sul sistema si trasforma in calore, ari alla variazione di entalia. Il lavoro elettrico è w = V it = J. Assumendo che la caacità termica secifica dell acqua sia ari a C = J kg 1 K 1, otteniamo una variazione di temeratura = w mc = 8.23 K da cui segue che la temeratura finale è 33.8 C o K Esercizio 1.26 Qual è la caacità termica secifica dello stirene, saendo che un camione di massa m = kg subisce un aumento di temeratura ari a 3.36 K se riscaldato con una resistenza elettrica er 100 s con lo stesso aarato dell esercizio recedente? Soluzione La variazione di entalia è ari a w = V it = J e quindi la caacità termica secifica dello stirene (er unità di massa) è C (stirene) = w m = 10.5 kj kg 1 K 1 Esercizio 1.27 L alicazione delle rorietà delle funzioni di stato ai sistemi termochimici è di grande utilità e ritorneremo sulla loro alicazione alla fine dei caitoli sussessivi, doo avere introdotto
19 1.3. I PRINCIPIO 19 Figura 1.2: rasformazioni a ressione e volume costanti altre funzioni di stato (come l entroia, l energia libera etc.). Per ora ci limitiamo ad un esemio di natura chimica che riassume le rorietà dei sistemi gassosi ideali, il rimo rinciio e la definizione e rorietà dell entalia. È noto che quando 1 mole di acido malonico cristallino viene bruciata in atmosfera di ossigeno a volume costante vengono liberati kj a K. Qual è la variazione di entalia er la reazione di una mole di acido malonico alla stessa temeratura, a ressione costante? Chiarite le condizioni di misura e le arossimazioni necessarie er la risosta al quesito. Considerate come uniche secie che contribuiscono alle variazioni di volume le secie gassose, descritte come gas erfetti. Informazione aggiuntiva: l energia interna di un gas erfetto diende solo dalla temeratura. Soluzione Si tratta di un roblema semlice, ma che richiede una definizione attenta del sistema. Consideriamo la Figura 1.2. Il sistema è costituito dalle secie che subiscono la reazione chimica, ed è semre in contatto con un termostato che assorbe o cede calore er mantenerlo a temeratura uniforme. La reazione è raresentata dalla trasformazione verticale b. Essa, erò, uò essere comosta dalla combinazione della trasformazione orizzontale a (isobara), seguita dalla trasformazione isoterma c (la temeratura è tenuta costante dal termostato accoiato al sistema che sta reagendo). Nella trasformazione orizzontale a ressione costante 1 il sistema subisce una variazione di volume V = V 2 V 1 ; la corrisondente variazione di entalia, che è ari er definizione al calore liberato
20 20 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO od assorbito dal sistema a ressione costante deve valere H a = U a + 1 V, dove H a e U a si riferiscono alla trasformazione a dallo stato ( 1, V 1 ) allo stato ( 1, V 2 ). Nella trasformazione verticale b a volume V 1 costante il sistema non comie lavoro e secondo il rimo rinciio, deve obbedire alla relazione U b = q, dove q è il calore di combustione (il segno meno deriva dal fatto che il dato nel testo è riferito al calore misurato dal unto di vista dell ambiente esterno; quando si arla di calore di combustione, si intende solitamente il calore che l ambiente ha ricevuto dal sistema, e si tratta quindi di una erdita di energia er il sistema), er giungere allo stato finale ( 2, V 1 ) caratterizzato da una ressione 2 e dallo stesso volume iniziale. La misura serimentale fornisce q, ovvero U b, ed il roblema richiede di calcolare H a. Per conoscere H a dobbiamo conoscere U a e V. Il valore di U a si determina tenendo conto della natura di funzione di stato di U, ossiamo assare dallo stato ( 2, V 1 ) allo stato ( 1, V 2 ) mediante una trasformazione isoterma: tenendo conto dell informazione aggiuntiva (che sarà discussa meglio nei caitoli successivi), segue che lo stato ( 2, V 1 ) e ( 1, V 2 ) hanno lo stessa energia interna, cioè che U a = U b. Si ha erciò che H a è uguale a q iù una correzione 1 V, che uò essere calcolata considerando che solo le secie resenti in forma gassosa contribuiscono significativamente al volume totale del sistema e che le secie gassose si comortino da gas erfetti: 1 (V 2 V 1 ) = 1 V = R (n gas,2 n gas,1 ) = R n gas Nel nostro caso la reazione è CH 2 (COOH) 2(s) + 2O 2(g) = 3CO 2(g) + 2H 2 O (l) quindi n gas = 3 2; U b = kj; segue che H a = kj. Si noti che nelle reazioni in cui il numero di moli di secie gassose è invariato, la variazione di entalia coincide con quella di energia interna (ad esemio in C(s) + O 2 (g) = CO 2 (g)). Esercizio 1.28 Un camione di azoto di massa m = 3.12 g a = 23.0 C si esande in maniera reversibile e adiabatica da V 1 = 400 ml a V 2 = 2.00 L. Qual è il lavoro comiuto dal gas? Si consideri il gas ideale. Soluzione Il lavoro di volume er una trasformazione reversibile (ressione interna ed esterna sono semre tra loro uguali) è dato in forma differenziale come δw = dv Inoltre, essendo la trasformazione adiabatica non c è scambio di calore tra il sistema e l ambiente, er cui δw = du = C V d Unendo le relazioni sora scritte, er una trasformazione reversibile adiabatica si ha C V d = dv = nr V dv
21 1.3. I PRINCIPIO 21 Si tratta di una equazione differenziale a variabili searabili, che uò essere riscritta come C V d = nr V dv Per un gas ideale, il calore secifico a volume costante non diende dalla temeratura, er cui l equazione differenziale sora scritta uò essere facilmente risolta 2 1 V2 1 C V d = nr 1 V 1 V dv ovvero C V ln ( 2 1 ) = nr ln ( V2 V 1 ) Introducendo le caacità termiche molari c V = C V /n e c = C /n, risettivamente a volume e ressione costante, il raorto γ = c /c V e ricordando che er un gas ideale R = c c V, l equazione recedente uò essere riscritta come ( ) [ (2 ) 1 ] 1 γ 1 ln 2 γ 1 = ln = ln 1 1 ( V1 V 2 ) e usando la monotonicità della funzione logaritmo, l ultima eguaglianza uò essere esressa anche come eguaglianza tra gli argomenti dei logaritmi, ossia oure ( 2 1 ( 2 1 ) 1 γ 1 ) = ( ) V1 = V 2 ( ) γ 1 V1 V 2 Per calcolare γ occorre ricordare che er un gas ideale si ha c v = n d.o.f. R 2 dove n d.o.f. è il numero di gradi di libertà er una molecola di gas. In questo esercizio, il gas è comosto da molecole di N 2. Una molecola biatomica è lineare, er cui ossiede n d.o.f. = 5 gradi di libertà, di cui 3 traslazionali e solo 2 rotazionali considerando la molecola rigida, er cui: c v = 5 2 R; c = 7 2 R; γ = 7 5 ; (γ 1) = 2 5 La temeratura a fine trasformazione è quindi 2 = K ( ) L 5 = 156 K 2.00 L Usando le rime equazioni, il lavoro er la trasofrmazione adiabatica reversibile (ricordando che il C V di un gas ideale è indiendente dalla temeratura) è 2 w = C V d = C V ( 2 1 ) = nc V 1
22 22 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO Il numero di moli di gas è n = 3.12 g 28.0 g mol er cui il lavoro è = mol w = mol J ( ) K = 323 J K mol Come commento finale, si vuol far notare che durante una trasformazione adiabatica reversibile V γ 1 = cost. da cui deriva, ricavando in funzione di ressione e volume usando la legge dei gas ideali: V γ = cost. Esercizio 1.29 Sul elo dell acqua avviene una reazione che svilua ossigeno molecolare, a temeratura di 27.5 C. Con un tubo del volume di 27.8 cm 3 si raccoglie un camione di miscela gassosa sora il elo dell acqua, contenente vaore acqueo e ossigeno. Saendo che la tensione di vaore dell acqua alla temeratura data è 27.5 orr e che la ressione nel tubo è di orr, si calcoli il volume che occuerebbe l ossigeno secco a 25.0 C e 1.00 bar. Soluzione La ressione misurata nel tubo di vetro è la ressione totale, somma delle ressioni arziali di vaore acqueo ed ossigeno molecolare: = O2 + H2 O O2 = H2 O = orr 27.5 orr = orr = Pa Assumendo l ossigeno un gas ideale, si ossono trovarne le moli n = V R = Pa m J K mol K che, nelle condizioni date, occuano il volume = mol. V = nr = mol J K mol K 10 5 = m 3 = 26.6 cm 3 Pa Esercizio 1.30 I valori di ressione e temeratura critica er l etano sono: c = 48.2 atm e c = K. Si calcoli la ressione che esercitano 74.8 g di etano in un reciiente del volume di 200 cm 3 alla temeratura di 37.5 C usando come equazione di stato: a) la legge dei gas ideali; b) l equazione di Van der Waals.
23 1.3. I PRINCIPIO 23 Soluzione Innanzitutto è conveniente calcolare il numero di moli di etano, data la sua massa molare MM = g/mol: n = 74.8 g g mol a) Gas ideale: = 2.49 mol = nr V = 2.49 mol J K mol K m 3 = Pa = 317 atm b) Gas di Van der Waals: la ressione e la temeratura critiche sono legate alle costanti a e b del modello attraverso le relazioni c = dalle quali si ricava: a e 27b 2 c = 8a 27Rb a = 27R2 c J = K 2 mol 2 K c Pa b = R c = J K mol K 8 c Pa È ora ossibile calcolare la ressione del gas = nr V nb an2 V 2 = = m3 = mol 2.49 mol J = K mol K m mol m 3 mol = Pa = 811 atm Pa m6 mol 2 Pa m6 mol mol m 6 = Esercizio 1.31 Le entalie di combustione a 18 C e 1 atm di glucosio ed etanolo sono, risettivamente, kj e kj. Quanto calore si libera nella formazione di 1 mole di etanolo dalla fermentazione del glucosio a 18 C e 1 atm (si trascurino i calori di diluizione, ecc.)? Soluzione La reazione di fermentazione è la seguente: C 6 H 12 O 6 2 C 2 H 6 O + 2 CO 2 mentre le due reazioni di combustione sono: R 1 : R 2 : C 6 H 12 O O 2 6 H 2 O + 6 CO 2 C 2 H 6 O + 3 O 2 3 H 2 O + 2 CO 2 H 1 = kj/mol H 2 = kj/mol La reazione di fermentazione si uò ottenere combinando le due reazioni di combustione: R 1 2R 2. In altre arole la reazione di fermentazione uò, in maniera concettuale, avvenire rima er una comleta combustione del glucosio e i rodotti che se ne formano si ricombinano er dare etanolo e ossigeno. Indiendentemente dalla realizzabilità di un simile ercorso, la variazione di entalia er la fermentazione del glucosio, essendo quest ultima una funzione di stato, è scomonibile nel contributo
24 24 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO della combustione del glucosio e in quello della formazione di etanolo a artire dai rodotti della sua combustione, er cui H = H 1 2 H 2 = kj kj kj = mol mol mol Esercizio 1.32 Un calorimetro a ghiaccio è costituito da un reciiente aerto a areti sottili, A, saldato all interno di un reciiente chiuso, K. Quest ultimo è comletamente riemito con una miscela di ghiaccio, acqua e mercurio. Se avviene un trasorto di calore da A a K, fonde un oco di ghiaccio e, attraverso un caillare, dell altro mercurio viene asirato in K. In tre distinti eserimenti, A conteneva inizialmente 10 ml di una soluzione S contenente I 2, ICl 3 e HCl. Sciogliendo in A (a) 98.6 mg di Au, (b) 60.9 mg di Cl 2 e (c) mg di AuCl, vennero asirati in K, (a) 143.6, (b) e (c) mg di Hg. Si trovi il H della reazione Au Cl 2 AuCl. È lecito assumere nei calcoli che iodio e oro siano resenti in soluzione solo nelle forme I 2, ICl 4 e AuCl 4. I volumi secifici del ghiaccio e dell acqua a 0 C sono risettivamente e cm 3 /g, il calore di fusione del ghiaccio è L = cal/g e la densità del mercurio a 0 C e 1 atm è ρ Hg = g/cm 3. Soluzione Le tre reazioni chimiche che avvengono nei tre diversi eserimenti, scritte in maniera tale che le variazioni di entalia siano esresse risetto ad 1 mol di (a) Au, (b) Cl 2 e (c) AuCl,sono R a : ICl 4 + Au AuCl I 2 R b : 2 3 HCl + Cl I ICl H+ R c : AuCl ICl HCl AuCl I H+ La formazione di AuCl a artire dagli elementi si ottiene combinando le tre reazioni sora scritte nel seguente modo: R a + R b /2 R c ); di conseguenza l entalia di formazione er una mole di cloruro di oro sarà: H a H b H c H = H a H b H c Per ogni rocesso, dobbiamo calcolare la variazione di entalia dalla massa di mercurio asirata. Siano V G e V L, m G e m L, ρ G e ρ L il volume, la massa e la densità (cioè l inverso del volume secifico) di ghiaccio e acqua liquida rima della reazione. Il volume di acqua totale è V G + V L = m G /ρ G + m L /ρ L ; se doo la reazione si ha una variazione m della massa di ghiaccio, la variazione del volume totale di acqua è V = m G + m ρ G + m L m ρ L m G ρ G m L ρ L ( 1 = m 1 ) = m (V G,s V L,s ) ρ G ρ L La variazione di volume è anche ari alla massa di mercurio asirata divisa er la densità del mercurio. Quindi m = m Hg ρ Hg (V G,s V L,s )
25 1.3. I PRINCIPIO 25 Risulta infine che la variazione di entalia er il rocesso è legata alla massa di mercurio asirata secondo la relazione m Hg H = L m = L ρ Hg (V G,s V L,s ) = cal 0 g m Hg(g) La variazione di entalia molare si ottiene er ciascun rocesso dividendo H er il numero di moli della secie dissolta. Per il rocesso di solubilizzazione dell oro abbiamo H a = = cal e er mole di oro /( /196.97) = kcal/mol. Per la seconda reazione, la variazione di entalia er mole di Cl 2 vale H b = kcal/mol. Infine, er la terza reazione, la variazione di entalia er mole di AuCl vale H c = kcal/mol. Segue che l entalia di reazione è kcal/mol. Esercizio 1.33 Considerate le seguenti reazioni a 20 C ed 1 atm R 1 R 2 C + O 2 CO 2 CO O 2 CO 2 Dove er la rima reazione H 1 = kcal/mol e er al seconda H 2 = kcal/mol. rovate H 3 er la reazione C O 2 CO Soluzione La reazione di formazione dell anidride dal carbonio è la somma della reazione di sintesi dell anidride dal monossido e di sintesi del monossido da carbonio; quindi, er la legge di Hess H 1 + H 3 = H 2, cioè H 3 = kcal/mol, e quindi H 3 = kcal/mol Esercizio 1.34 Saendo che il calore di fusione del ghiaccio a 0 C è cal er un grammo trovare il calore di fusione di 1 kg di ghiaccio a -10 C. Assumete che i calori medi secifici di ghiaccio e acqua siano e cal K 1 g 1 (i dati sono riferiti ad 1 atm di ressione). Soluzione Possiamo scrivere le seguenti reazioni, relativamente ad 1 g di sostanza H 2 O(l, 0 C) H 2 O(s, 0 C) H 1 = 79.69cal H 2 O(s, 0 C) H 2 O(s, 10 C) H 2 O(l, 0 C) H 2 O(l, 10 C) H 2 = = 4.94cal H 3 = = 10.10cal H 2 O(l, 10 C) H 2 O(s, 10 C) H 4 =... La somma delle rime due reazioni o delle ultime due è ari alla reazione H 2 O(l, 0 C) H 2 O(s, 10 C) Quindi er la legge di Hess = H 4 cal/g da cui H 4 = cal e er 1 kg di sostanza kcal. Esercizio 1.35 Si consideri 1 mol di un gas ideale, la cui energia libera segua la legge U = A + B, con A e B costanti. Il sistema si trova inizialmente nelle condizioni 1, 1, V 1, e viene trasformato in quattro assaggi successivi: a) una comressione molto lenta isoterma fino allo stato 2, 1, V 2 ;
26 26 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO b) una comressione molto raida fino allo stato 3, 3, V 3 ; c) una esansione molto lenta isoterma, fino allo stato 4, 3, V 4 ; d) una esansione molto veloce fino allo stato iniziale. Le trasformazioni b e d sono così veloci che non si considera avvenga scambio di calore. Si calcoli la relazione tra il lavoro totale fatto dal sistema, il calore scambiato in a e il calore scambiato in d, esrimendo il risultato in termini di 1 e 3. Soluzione La variazione totale di energia interna nel ciclo è nulla: U ciclo = U a + U b + U c + U d = 0 = q a + q c + w a + w b + w c + w d Inoltre, essendo U funzione della sola temeratura, U a = U c = 0, da cui q a + w a = 0; q c + w c = 0 Per cui, w b + w d = 0, che significa che il lavoro netto comiuto sul sistema è w = w a + w c Essendo entrambe le trasformazioni a e c trasformazioni isoterme reversibili, il lavoro uò essere calcolato a artire dal differenziale δw = dv = nr V dv Essendo la temeratura costante, Vf 1 w = nr dv = nr ln V i V Quindi, er le strasformazioni ( ) a e c: V1 w a = R 1 ln V 2 ( ) V3 w c = R 3 ln V 4 ( Vi V f ) Ora, cerchiamo di ricavare la relazione tra i vari volumi. Notiamo che nelle trasformazioni c e d si ha du = dw, ovvero Bd = dv = nr V La soluzione della recedente equazione differenziale è ( ) ( ) f Vf B ln = R ln i V i dv Quindi, er ( le strasformazioni ) ( b e ) d: 3 V3 B ln = R ln 1 V 2 ( ) ( ) 1 V1 B ln = R ln 3 V 4
27 1.3. I PRINCIPIO 27 da cui si ricava che V 3 /V 2 = V 4 /V 1 ovvero V 1 /V 2 = V 4 /V 3 e, usando tale osservazione nelle esressioni dei lavori w a e w b, si ottiene w a 1 = w c 3 Il lavoro comiuto dal sistema, è quindi w = w a w c = w a + w a 3 1 = w a = w c = q a = q c Esercizi non risolti Esercizio 1.36 L acqua sulla cima delle cascate del Niagara ha una temeratura di C e reciita er una altezza di m. Se si assume the tutta l energia otenziale iniziale viene dissiata in calore, si calcoli la temeratura dell acqua ai iedi delle cascate, conoscendo C (H 2 O, K) = J/ g K. Esercizio 1.37 Una sfera del diametro di 50.0 cm contiene una miscela di Ne e Ar al 50.0% in volume. La temeratura è di 20.0 C e la ressione 2.0 bar. Quali sono le frazioni molari e le ercentuali in eso dei due gas? Esercizio 1.38 Una mole di CO 2, la cui equazione di stato è descritta dall equazione di Van der Waals con arametri a = L 2 atm/mol 2 e b = L/mol, alla temeratura di = K subisce una comressione isoterma reversibile da un volume iniziale V 1 = 1.00 L ad un volume finale V 2 = L. Si calcoli il lavoro da comiere sul sistema affinché avvenga tale comressione. Esercizio 1.39 Un camione di zinco metallico reagisce comletamente con un eccesso di acido cloridrico acquoso. L idrogeno rodotto è gorgogliato in acqua a 25.0 C. Il volume del gas è 7.80 L e la ressione atm. La ressione di vaore dell acqua a 25.0 C è 23.8 orr. Quale massa di zinco metallico è stata consumata nella reazione? Esercizio 1.40 Un camione di 6.0 mol di un gas ideale monoatomico viene riscaldato a volume costante da C a C. Si calcoli la variazione di entroia del gas. Esercizio 1.41 In una macchina di Carnot, contenente 1 mole di un gas erfetto, la temeratura della sorgente di calore è C mentre quella del refrigerante è C. Nell esansione isoterma il volume finale è il doio di quello iniziale. Si calcoli il lavoro comiuto da questa macchina in un ciclo e il suo rendimento.
28 28 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO Esercizio 1.42 Quando l acido benzoico viene bruciato in una bomba calorimetrica a 30 C vengono liberati J er ogni grammo di acido benzoico. Qual è il H er la combustione di una mole di acido benzoico a 30 C? Esercizio 1.43 A circa 18 C, il U er la combustione di una mole di acetilene è kj, mentre er una mole di benzene è kj. rovare U e H a 18 C er la formazione di una mole di benzene liquido dall acetilene. Esercizio 1.44 Quando 6.00 g di CaCl 2 sono dissolti in g d acqua, la temeratura assa da 18.0 C a 27.9 C. Quanto vale la variazione di entalia in kj? N.B. La soluzione corretta resuorrebbe la conoscenza delle caacità termiche a ressione costante arziali molari; si uò erò assumere, in modo arossimato, che la soluzione abbia la caacità secifica dell acqua ura... Esercizio 1.45 Calcolate l entalia molare della reazione seguente: FeO (s) + CO (g) Fe (s) + CO 2(g) date le reazioni, con le corrisondenti entalie di reazione Fe 2 O 3(s) + 3 CO (g) 2 Fe (s) + 3 CO 2(g) 3 Fe 2 O 3(s) + CO (g) 2 Fe 3 O 4(s) + CO 2(g) Fe 3 O 4(s) + CO (g) 3 FeO (s) + CO 2(g) 28 kj/mol 59 kj/mol +38 kj/mol Esercizio 1.46 Attraverso una soluzione di NaOH viene fatto gorgogliare del fluoro gassoso e come rodotto si ottiene una miscela di F 2 O e O 2. La miscela viene fatta gorgogliare attraverso una soluzione di KOH al 40 % in un calorimetro con una caacità termica di kcal C 1. Parte di F 2 O reagisce formando F e O 2. Il eso della soluzione aumenta di 52.8 mg e la temeratura aumenta di C. Si trascurino l evaorazione dell acqua ed il calore secifico dei gas. Sono noti i seguenti dati termochimici: i calori svolti quando una mole di (a) KF si forma dagli elementi (b) acqua liquida viene formata dagli elementi (c) KF viene disciolto in acqua (d) K reagisce con l acqua sono risettivamente 134.5, 68.5, 3.6, 46.5 kcal ad 1 atm e 18 C, che è la temeratura a cui si svolge l eserimento. Calcolate il H di formazione di F 2 O ad 1 atm e 18 C. Esercizio 1.47 Calcolate l entalia e l energia interna standard a 283 e 298 K della reazione CH 3 COOH (l) + H 2(g) CH 3 CHO (l) + H 2 O (l) saendo che le entalie standard di formazione dell acido acetico, dell aldeide acetica e dell acqua sono risettivamente , e kj mol 1 a 298 K. Considerate l idrogeno come una
29 1.3. I PRINCIPIO 29 gas erfetto, trascurate la caacità termica di tutti i comonenti meno l acqua. Assumete che l acqua liquida abbia una C,m costante tra 273 e 373 K ari a 77 JK 1 mol 1. Esercizio 1.48 Si dimostri che in una esansione o comressione isoterma di un gas ideale U = 0 e H = 0. Esercizio 1.49 Due barrette, una di Au e una di Ag, della stessa lunghezza ed area sono messe in contatto. L estremità libera della barretta di Au è tenuta a contatto con un termostato a Au = 80.0 C, mentre l estremità libera della barretta di Ag è a contatto con termostato a temeratura Ag = 30.0 C. Quale sarà, all equilibrio, la temeratura nel unto di contatto tra i due metalli?
30 30 CAPIOLO 1. NOZIONI DI ANALISI MAEMAICA - I PRINCIPIO Esercizio 1.50 Un gas ideale viene sottoosto al ciclo di trasformazioni schematizzato in Figura 2.1. Da A a B, il rocesso è adiabatico; da B a C è isobaro e durante la trasformazione 100 kj di energia sono assorbiti dal sistema sotto forma di calore. Da C a D, il rocesso è isotermo; infine da D ad A è isobaro con 150 kj di energia ceduti all ambiente sotto forma di calore. Si calcoli la differenza di energia interna U AB = U B U A. Figura 1.3: Ciclo di trasformazioni del gas descritto dall esercizio 1.50.
31 Caitolo 2 II rinciio, grandezze standard e relazioni differenziali 31
32 32 CAPIOLO 2. II PRINCIPIO, GRANDEZZE SANDARD E RELAZIONI DIFFERENZIALI 2.1 II Princiio Esercizi risolti Esercizio 2.1 Si consideri il seguente ciclo di trasformazioni di un gas ideale: Figura 2.1: Ciclo di Carnot. 1) Esansione reversibile isoterma, A = B = hot 2) Esansione reversibile adiabatica, C = cold < hot 3) Comressione reversibile isoterma, D = cold 4) Comressione reversibile adiabatica, A = hot Si dimostri che la variazione di entroia nel ciclo è nulla. Qual è l efficienza del ciclo di Carnot? Soluzione Le trasformazioni 1 e 3 (isoterme reversibili) avvengono con scambio di calore. Dato che er un gas ideale l energia interna diende esclusivamente dalla temeraura, si ha: U 1 = w hot + q hot = 0 w hot = q hot U 3 = w cold + q cold = 0 w cold = q cold In articolare, nella trasformazione 1 (esansione) il sistema comie lavoro (w hot < 0) e di conseguenza assorbe calore (q hot > 0). Viceversa, nella trasformazione 3 (comressione), viene comiuto lavoro sul sitema (w cold < 0) er cui quest ultimo cede calore (q cold < 0). Le variazioni di entroia nelle due trasformazioni saranno S 1 = q hot / hot e S 3 = q cold / cold. Nelle trasformazione 2 e 4 (adiabatiche reversibili), invece, non vi è scambio di calore e non comortano variazione di entroia. Quindi, la variazione comlessiva di entroia nel ciclo sarà S = q hot hot + q cold cold = w hot hot w cold cold
33 2.1. II PRINCIPIO 33 I lavori comiuti dal/sul gas ( nelle ) trasformazioni 1 e 3 sono, risettivamente VB w hot = nr hot ln V A ( ) VD w cold = nr cold ln V C È utile cercare una relazione tra i raorti tra i volumi che aaiono nelle due recedenti equazioni. A tale scoo, si ricorda che in una trasformazione adiabatica, V γ 1 = cost. Di conseguenza, er le trasformazioni 2 e 4 si uò scrivere V γ 1 B hot = V γ 1 V γ 1 A hot = V γ 1 D da cui si ricava che VB V A si ottiene ossia q hot q cold = hot cold q hot hot = q cold cold C cold cold = VC V D. Sostituendo tale risultato nelle esressioni dei lavori (e quindi dei calori), Sostituendo questo risultato nell esressione dell entroia S = q hot hot + q cold cold = q hot hot q hot hot = 0 come ci si doveva attendere dato che essendo l entroia una funzione di stato, la variazione lungo un ciclo deve risultare nulla: ds = 0. L efficienza del ciclo viene definita come il raorto tra il lavoro netto che fa il sistema (reso in valore assoluto er avere un numero ositivo) e il calore (energia) fornito al sistema. Quindi, ɛ = w = w hot + w cold = q hot + q cold q hot q hot q hot = 1 cold hot < 1 Sunto di riflessione: ossono esistere due macchine termiche di Carnot che funzioano tra le due medesime temerature con efficienza differente? Esercizio 2.2 Una mole di gas erfetto viene riscaldata in modo isobaro fino a V f = 2V i (dove con i e f si intende, risettivamente, iniziale e finale). Quindi, il gas viene esanso isotermicamente fino a f = i /2 e oi raffreddato in modo isocoro fino a che si ritorna alla temeratura iniziale. Qual è la variazione totale di entroia? Soluzione Nella trasformazione isobara: V 1 1 = V = 2 1 er cui, S isob. = c ln ( 2 1 ) = c ln (2). Nella trasformazione isoterma: 3 V 3 = 2 V 2 V 3 V 2 = 2 3 = 2.
34 34 CAPIOLO 2. II PRINCIPIO, GRANDEZZE SANDARD E RELAZIONI DIFFERENZIALI er cui, S isot. = R ln ( V3 V 2 ) = R ln (2). Nella trasformazione isocora: S isoc. = c V ln ( 1 3 ) = c V ln (2). La variazione comlessiva di entroia è quindi S = S isob. + S isot. + S isoc. = (c + R c V ) ln (2) = 2R ln (2) = J mol K Esercizio 2.3 Il calore secifico standard, c, dell O 2 nell intervallo di temerature K segue la legge c ( ) / J K 1 mol 1 = Si calcoli la variazione di entroia quando 1 mol di O 2 viene riscaldata a = da 400 a 1000 K. Soluzione S = = = f i d c ( )/ = d ( ) / = [25.72 ln ( ) = J mol K 2 ] J mol K = Esercizio 2.4 Si calcolino S, H, q e U quando mol di metano sono riscaldate e costante da 25 C a 1475 C saendo che il calore secifico del metano è c = J/mol K. Soluzione S = nc ln ( 2 1 ) = J K H = nc = J = q c c V = R c V = ( ) U = nc V = J J mol K = J mol K Esercizio 2.5 Si calcoli il S di 100 g di acqua riscaldati a costante da 20 a 37 C. Soluzione S = nc ln ( 2 1 )
35 2.1. II PRINCIPIO g Il numero di moli d acqua è n = g = 5.55 mol mol Inoltre, il calore secifico er l acqua è c = g J K = 75.3 J mol K Per cui, S = 5.55 mol 75.3 ( ) J mol K ln = J K Esercizio 2.6 Una mole di O 2 esegue un ciclo di Carnot (si veda l esercizio 2.1), artendo da = 373 K, seguendo lo schema a) esansione isoterma reversibile, V 2 = 2V 1 ; b) esansione adiabativa reversibile, V 3 = 3V 1 ; c) comressione isoterma reversibile, V 4 = V 3 /2; d) comressione adiabatica reversibile, V 5 = V 1. Saendo che er O 2 si ha γ = c /c V = 1.4, si calcoli il lavoro nelle quattro fasi del ciclo ed il rendimento di quest ultimo. Soluzione Saendo che c c V = R, con il dato (γ) fornito dal roblema si ossono ricavare c V = 21 J mol K e c = 29 J mol K. [N.B. er un gas ideale biatomico, c V = 5R/2] a) w a = R 1 ln ( V2 V 1 ) = 2.15 kj. b) Essendo la trasformazione adiabatica, si uò calcolare la temeratura finale dalla relazione ( ) γ 1 V2 2 = 1 V 3 er cui 2 = 317 K. Il lavoro è, quindi w b = U b = c V = 1.2 kj c) w c = R 2 ln ( V4 V 3 ) = 1.83 kj. d) w d = U d = c V = 1.2 kj Il rendimento del ciclo è ɛ = = 0.150, ossia il 15%, Esercizio 2.7 Un oggetto d oro a 25 C è immerso in un reciiente a isolato termicamente e contenente 12 g di acqua a 8.0 C. All equilibrio, la temeratura dell acqua raggiunge i 13 C. Si calcoli la massa d oro e la variazione totale di entroia. [La ressione rimane costante e, er l oro, c = J mol 1 K 1 ]
36 36 CAPIOLO 2. II PRINCIPIO, GRANDEZZE SANDARD E RELAZIONI DIFFERENZIALI Soluzione Sfruttando il I rinciio, si uò dire che H = 0 H Au = H H2 O, quindi n Au c (Au) Au = n H2 Oc (H 2 O) H2 O Il numero di moli d acqua è: n H2 O = 0.67 mol 75.3 J n Au = g g mol mol K 5.0 K J mol K ( 12) K = 0.67 mol, er cui si uò ricavare = 0.82 mol Da cui si ricava la massa d oro: m Au = 0.82 mol g mol = g. Le variazioni di entroia er acqua ( e oro sono ) f S H2 O = n H2 Oc (H 2 O) ln = 0.89 J K 1 i,h2 O ( ) f S Au = n Au c (Au) ln i,au = 0.86 J K 1 er cui, la variazione totale di entroia è: S = S H2 O + S Au = J K 1. Esercizio 2.8 rovate la variazione di U, H, S, A e G er (a) l esansione di 10 moli di ossigeno da 200 L a 2000 L a 25 C, (b) la comressione di 1.0 mole di ossigeno da 1.0 atm a 6.0 atm alla stessa temeratura. Soluzione Suoniamo che i gas siano erfetti; er una trasformazione isoterma di un gas erfetto valgono le semlici relazioni U = H = 0 A = G = nr ln f i = nr ln V f V i S = nr ln f = nr ln V f i V i Nel quesito (a) abbiamo che U= H=0, mentre A = G = 57 kj, S = 0.19 kj K 1 ; nel quesito (b) troviamo invece U= H=0, A = G = 4.4 kj e S = 15 J K 1. Esercizio 2.9 Il calore di fusione del ghiaccio a 0 C è 79.7 cal g 1 ed il calore di esansione dell acqua a 100 C è 539 cal g 1. Il calore secifico medio dell acqua nell intervallo di temeratura tra 0 e 100 C è 1.00 cal K 1 g 1. Valutate l aumento di entroia er la trasformazione di 1 g di ghiaccio a 0 a vaore acqueo a 100 C. Soluzione Più avanti studieremo le rorietà delle transizioni di fase delle sostanze ure e nei Caitoli successivi delle soluzioni. Per ora ci limitiamo a ricordare che quando un sistema assa da una fase (cioè uno stato caratterizzato da valori omogenei di determinate rorietà intensive) ad un altra, in condizioni di ressione costante, subisce una trasformazione che è er definizione reversibile ad una temeratura ben definita, detta temeratura di transizione, cioè le due fasi sono in equilibrio ed una quantità di calore H entra od esce dal sistema; la variazione di energia libera è nulla, G = 0,
37 2.1. II PRINCIPIO 37 da cui segue che la variazione di entroia è S = H/. Per il rocesso descritto dal roblema abbiamo erciò che la variazione di entroia totale è data dalla somma dell entroia di fusione a 0 C iù l entroia di riscaldamento dell acqua liquida fino a 100 C iù l entroia di ebollizione a 100 C. Dai dati del roblema abbiamo erciò che S = H eb fus + d C,s fus fus + H fus = fus d = 2.05 cal K Esercizio 2.10 rovate la variazione di U, H, S, A e G e la finale er la comressione adiabatica di 10 L di idrogeno a 0 C e 1 atm ad 1 L. Dati utili: S m = cal K 1 mol 1 (a 0 C e 1 atm), C,m = 6.90 cal K 1 mol 1. Soluzione Per un sistema idrostatico in condizioni adiabiatiche δq = 0, da cui segue che du = δw = dv, mentre ds = 0 da cui dh = V d, da = Sd dv, dg = Sd + V d. Per una trasformazione adiabatica reversibile una gas erfetto segue la legge V γ = cost con γ = C,m /C V,m, vale l uguaglianza C,m C V,m = R. Dai dati del roblema troviamo C V,m = = 4.91 cal K 1 mol 1 e dunque γ = 6.90/4.91 = 1.40; la ressione finale è data da f = iv γ i V γ f = = 25.4 atm La temeratura finale si ottiene tenendo conto che R/C,m / = cost. er una trasformazione adiabatica, da cui ( ) R/C,m f f = i = (25.4) = 693 K i Il lavoro totale è invece Vf w = V i γ i V i V γ dv = f V f i V i γ 1 = = 0.92 kcal da cui U = 0.92 kcal. La variazione di H è invece ottenuta come H = f i ( i V γ ) 1/γ i d = f V f i V i 1 1/γ = 53.5 l atm = 1.30 kcal Il numero di moli si uò calcolare dalla legge dei gas erfetti come 0.45, segue erciò che A = ( )/1000 = 4.88 kcal, mentre G = 4.50 kcal; infine ovviamente S = 0. Esercizio 2.11 Un sistema è formato da N liquidi incomressibili, ciascuno caratterizzato da una caacità termica molare C n (costante con la temeratura) ed alla temeratura assoluta n, con 1 n N; se al sistema viene fatta comiere la quantità massima di lavoro, in condizioni adiabatiche, quali sono la temeratura finale ed il lavoro eseguito?
38 38 CAPIOLO 2. II PRINCIPIO, GRANDEZZE SANDARD E RELAZIONI DIFFERENZIALI Soluzione Poichè il calore scambiato dal sistema con l ambiente è nullo, il lavoro totale è ari all oosto della variazione dell energia interna, w max = U i U f = n C n n f La variazione di entroia totale del sistema è nulla, S = 0, da cui S n = n n f n che si uò riarrangiare in C n ln n ln f = n n C n C n d = n n C n C n ln f n = 0 C n ln n f = ex n n C n Esercizio 2.12 Qual è la variazione di entroia quando m 1 = g di acqua a C e m 2 = g di acqua a C vengono mescolati fino a raggiungere una temeratura uniforme, saendo che il calore secifico C dell acqua è cal K 1 g 1 e che l entroia a 25 C è S m = cal K 1 mol 1? Suonete di oerare a ressione costante. Soluzione Siano q 1 e q 2 il calore scambiato dall acqua a temeratura minore e maggiore risettivamente; la temeratura finale è q 1 + q 2 = m 1 C( f 1 ) + m 2 C( f 2 ) = 0 f = m m 2 2 m 1 + m 2 = K Le variazioni infinitesimali di entroia er le due masse d acqua sono m 1,2 Cd/, quindi la variazione di entroia totale è S = m 1 C f 1 d f + m 2C 2 d = cal K 1 Esercizio 2.13 Il calore molare del disolfuro di carbonio è stato misurato a varie temerature. Saendo che il calore di fusione è cal mol 1 e che il unto di fusione è K, trovare l entroia molare del CS 2 a 25 C. Soluzione Il roblema resenta un classico esemio di misura serimentale dell entroia assoluta di una sostanza ura, basata sull alicazione diretta del II e III rinciio. Alla temeratura finale il disolfuro di carbonio è liquido. Possiamo calcolare l entroia assoluta come S m (298.15) = S m (0) C,m (s) d C,m (l) d L integrazione a artire da 0 fino alla temeratura di fusione è sostituita da una integrazione da a 0 alla rima temeratura misurata, in cui il calore molare viene stimato in base alla legge di Debye C (s) d = 1 0 C,m C (s) d
39 2.1. II PRINCIPIO 39 K 1 C,m cal 1 K mol abella 2.1: Calore molare a ressione costante a varie temerature er il CS 2.
40 40 CAPIOLO 2. II PRINCIPIO, GRANDEZZE SANDARD E RELAZIONI DIFFERENZIALI Il contributo iniziale viene stimato come 1 0 C,m 1 0 a 2 = a C,m( 1 ) = 1.65 = I contributi integrali restanti si ossono ottenere interolando i dati disonibili dei calori molari ed integrando numericamente. Infine in base la terzo rinciio si one S(0) = 0. Si ottiene S(298.15) = 36.0 cal K 1. Il rogramma Fortran entroia, richiede in inut dati relativi alle transizione di fase note di una sostanza, una serie di calori molari misurati a varie temerature e restituisce l entroia calcolata ad una qualunque temeratura Esercizi non risolti Esercizio 2.14 Si consideri un ciclo di Carnot in cui il gas non sia ideale e le quattro trasformazioni non siano reversibili. Qual è l efficienza di tale ciclo? Sarà maggiore o minore di quella calcolata nell esercizio 2.1? Esercizio 2.15 Un gas ideale subisce una esansione durante la quale raddoia il suo volume. Se tale oerazione venisse eseguita in maniera isobara, isoterma o adiabatica, quale sarebbe il lavoro maggiore eseguito dal gas? Quale il lavoro minore? Si dia anche una risosta grafica al roblema avvelendosi di un grafico - V. Esercizio 2.16 Un gas ideale monoatomico viene scaldato in due modi diversi: a ressione costante e a volume costante. Quale deve essere, nei due casi, il calore da fornire al gas er scaldarlo da 30 C a 50 C? Esercizio 2.17 Una macchina termica che funziona con il ciclo di Carnot trasferisce 3240 J di calore dentro una stanza alla temeratura di 19 C dall esterno della stanza. ale oerazione richiede che sul sistema venga comiuto un lavoro netto di 400 J. Qual è la temeratura esterna? Esercizio 2.18 Una massa di 100 g di acqua alla temeratura di 20.0 C vengono messi un un congelatore che ha una efficienza del 25%. Si calcoli il lavoro che deve comiere il congelatore er ortare la massa d acqua alla temeratura di C. [Calore latente di fusione del ghiaccio: L f = 335 kj/kg] Esercizio 2.19 Una massa di g di H 2 O (l) alla temeratura di 100 C viene fatta trasformare comletamente in vaore. Quanto calore deve essere fornito er far avvenire il comleto assaggio di stato? [Calore latente di vaorizzazione dell acqua: L v = 2260 kj/kg]
41 2.1. II PRINCIPIO 41 Esercizio 2.20 Il sole, la cui temeratura è 5500 C, emette energia termica con una otenza di W. ale calore viene assorbito dallo sazio circostante, la cui temeratura media è di 3.0 K. Qual è la variazione di entroia dell universo in un giorno? Esercizio 2.21 Un gas ideale biatomico inizialmente alla ressione di 1 = 600 kpa subisce questa trasformazione ciclica: a) una esansione isoterma reversibile da V 1 = L a V 2 = 4.50 L, b) una trasformazione isobara da V 2 a V 1, c) una trasformazione isocora da 2 a 1. Si calcolino il lavoro, il calore e la variazione di energia interna er ognuna delle tre trasformazioni. Qual è l efficienza del ciclo?
42 42 CAPIOLO 2. II PRINCIPIO, GRANDEZZE SANDARD E RELAZIONI DIFFERENZIALI 2.2 Grandezze standard Esercizi risolti Esercizio 2.22 Date le reazioni I e II, determinare r U er la reazione III oltre ai f H er HI (g) e H 2 O (g) a 298 K. Si assuma che i gas hanno comortamento ideale. (I) H 2(g) + I 2(g) 2 HI (g) (II) 2 H 2(g) + O 2(g) 2 H 2 O (g) r H = 52.9 kj/mol r H = kj/mol (III) 4 HI (g) + O 2(g) 2 I 2(s) + 2 H 2 O (g) Soluzione La variazione di energia libera standard er la reazione III è: r U = r H r V Dato che la reazione III uò essere scritta combinando le rime due reazioni, in articolare sottraendo, alla rima, due volte la seconda, la variazione di entalia standard è r H = r H (II) 2 r H (I) = kj/mol rattandosi di gas ideali, si uò inoltre scrivere r V = r nr = 7.43 kj/mol da cui, si calcola la variazione di energia interna: r U = kj/mol. Per quanto riguarda le entalie di formazione standard, si ha f H (HI (g) ) = 1 2 rh (I) = 26.5 kj/mol f H (H 2 O (g) ) = 1 2 rh (II) = kj/mol Esercizio 2.23 Si calcolino entroie, entalie ed energie libere standard a K delle seguenti reazioni: a) 2 CH 3 CHO (g) + O 2(g) 2 CH 3 COOH (l) b) 2 AgCl (s) + Br 2(l) 2 AgBr (s) + Cl 2(g) Soluzione Ricordando che: r S = i r H = i ν i S m,i ν i f,i H r G = r H r S dove ν i è il coefficiente stechiometrico della secie i-esima nella reazione, ositivo se la secie aare nei rodotti, negativo altrimenti.
43 2.2. GRANDEZZE SANDARD 43 Secie Sm / J K 1 mol 1 f H / kj mol 1 CH 3 CHO (g) O 2(g) CH 3 COOH (l) AgCl (s) Br 2(l) AgBr (s) Cl 2(g) abulati, a K, si trovano i seguenti dati Per cui, a) r S = 2S m(ch 3 COOH, l) 2S m(ch 3 COOH, g) S m(o 2, g) = J K mol r H = 2 f H (CH 3 COOH, l) 2 f H (CH 3 COOH, g) f H (O 2, g) = kj mol r G = kj mol b) r S = 2S m(agbr, s) + S m(cl 2, g) 2S m(agcl, s) S m(br 2, l) = 92.7 J K mol r H = 2 f H (AgBr, s) + f H (Cl 2, g) 2 f H (AgCl, s) f H (Br 2, l) = kj mol r G = 26.1 kj mol Esercizi non risolti Esercizio 2.24 Calcolate l entalia molare della reazione seguente: FeO (s) +CO (g) Fe (s) +CO 2(g), date le reazioni, con le corrisondenti entalie di reazione a) Fe 2 O 3(s) + 3 CO (g) 2 Fe (s) + 3 CO 2(g) ( -28 kj/mol) b) 3 Fe 2 O 3(s) + CO (g) 2 Fe 3 O 4(s) + CO 2(g) (-59 kj/mol) c) Fe 3 O 4(s) + CO (g) 3 FeO (s) + CO 2(g) (38 kj/mol) Esercizio 2.25 La riduzione dell ossido di ferro da arte dell idrogeno è descritta dalla reazione Fe 2 O 3(s) + 3 H 2(g) 2Fe (s) + 3H 2 O (l). Calcolate l entalia standard di reazione a 25 C saendo che le energie libere standard di formazione a artire dagli elementi dell ossido di ferro e dell acqua seguono le leggi, risettivamente, r G /Jmol 1 = (/K) e r G /Jmol 1 = (/K)
44 44 CAPIOLO 2. II PRINCIPIO, GRANDEZZE SANDARD E RELAZIONI DIFFERENZIALI Esercizio 2.26 In un contenitore, mantenuto alla ressione di 1 bar e alla temeratura di 100 C, viene osta una mole di CuSO 4 H 2 O (s) che si decomone interamente in solfato di rame solido e vaor acqueo. Saendo che il sistema assorbe una quantità di calore ari a kj, e utilizzando i dati forniti nella tabella seguente (a 25 C), si determini l entalia di formazione standard del solfato di rame monoidrato a 25 C. f H / kj mol 1 C,m/ J K 1 mol 1 CuSO 4 H 2 O (s)? 134 CuSO 4(s) H 2 O (g) abella 2.2: Dati termochimici relativi alla decomosizione del solfato di sodio monoidrato a a 25 C 2.3 Relazioni differenziali Esercizi risolti Esercizio 2.27 Ricavate le relazioni di Gibbs-Helmholtz, che correlano la variazione con la temeratura di ( A e G ) con i valori di U e H: A/ ( ) G/ V = U 2 = H 2 Soluzione Dalla relazione integrale che ( esrime ) A in funzione di U troviamo A A = U S = U + V ( ) 1 A = A V 2 U 2 e tenendo conto dell identità ( ) A/ = A V ( ) A V si ottiene la rima relazione di Gibbs-Helmholtz. Per la seconda si rocede analogamente, artendo da G = H S = H + ( ) 1 G = G 2 H 2 e, infine, tenendo conto dell identità ( ) G/ = G ( ) G ( ) G
45 2.3. RELAZIONI DIFFERENZIALI 45 Esercizio 2.28 Ricavate la relazioni esistente tra α, κ ed il coefficiente di ressione C = 1 ( ) V Soluzione Ricordiamo che α = 1 ( ) V κ = 1 V V ( ) V Dalla relazione ( ) ( ) ( ) V = 1 V V e dalle definizioni di C, κ e α ( ) V = C ( ) V = V κ ( ) = V da cui segue C ( V κ) (1/V α) = 1 e dunque 1 ( ) V = 1 V α C = α κ Esercizio 2.29 rovate la relazione che esiste tra le caacità termiche a ressione e volume costanti. Soluzione Ricordiamo ( ) che ( ) U S C V = = V V ( ) ( ) H S C = = Possiamo ( scrivere ) ( ) ( ) ( ) S S S V = + V V ( ) S = C ( ) S = C V V ( ) ( ) S = = C = α V V κ ( ) V = V α dove la enultima eguaglianza si ottiene utilizzando le relazioni di Maxwell. Quindi C = C V + α κ V α C C V = V α2 κ
46 46 CAPIOLO 2. II PRINCIPIO, GRANDEZZE SANDARD E RELAZIONI DIFFERENZIALI Esercizio 2.30 Ricavate la relazione tra le caacità termiche a ressione e volume costanti er un gas erfetto ed un gas di van der Waals. Soluzione Per un gas erfetto abbiamo verificato in recedenza che α = 1 ( ) R = R V m V m = 1 κ = R V m 2 = 1 da cui segue che C C V = V = nr er un gas vdw invece si ottiene R α = 1 V m b V m R (V m b) 2 2a Vm 3 κ = 1 1 V m R (V m b) 2 2a Vm 3 da cui segue, con qualche assaggio 1 C C V = nr 1 2n2 a(v nb) 2 nr V 3 La funzione (C C V )/nr tende a 1 con V, cioè si ritrova un comortamento ideale a ressioni tendenti a zero. Esercizio 2.31 Calcolate il coefficiente di Joule-homson ( ) µ J = H Soluzione Possiamo calcolare il coefficiente di Joule-homson, il cui significato fisico è discusso in seguito, usando la relazione ciclica ( ) ( ) ( ) H = 1 H H da cui si ottiene µ J = ( ) H 1 ( H ) ( ) H = ( ) H = 1 ( ) H C che uò essere facilmente messo in relazione con altre grandezze come α, κ etc. Alicando lo schema sistematico descritto in recedenza si ottiene er ( esemio ) H dh = d + [ ( S ) d + ( ) ] S d + V d = dh = ds + V d ( ) H d + ( ) H d ( ) H d
47 2.3. RELAZIONI DIFFERENZIALI 47 dove si è usata la definizione di ds con S = S(, ). Poiché otteniamo ( ) ( ) S S = C C d + e er d = 0 ( ) H da cui segue [ V = V ( ) ] V d = ( ) V = [Maxwell] ( ) H d + ( ) V = V (1 α) ( ) H d µ J = V C ( α 1) Esercizi non risolti Esercizio 2.32 Dimostrate che ( A )V = S k α Esercizio 2.33 Dimostrate che S = C ( G H ) Esercizio 2.34 Dimostrate che ( ) U = α k S α Esercizio 2.35 Dimostrate che Esercizio 2.36 Dimostrate che Esercizio 2.37 Dimostrate che ( H S ) = 1 α ( ) V = U C V k k α ( ) V = C S V C V Esercizio 2.38 Dimostrate che ( G )V = V Sk α Esercizio 2.39 Un gas obbedisce all equazione di stato = R V + a + b m Vm 2 il coefficiente di esansione termica in funzione di a, b,, V m con a, b costanti. Si esrima
48 48 CAPIOLO 2. II PRINCIPIO, GRANDEZZE SANDARD E RELAZIONI DIFFERENZIALI
49 Caitolo 3 Sostanze ure e soluzioni 49
50 50 CAPIOLO 3. SOSANZE PURE E SOLUZIONI 3.1 Sostanze Esercizi risolti Esercizio 3.1 La tensione di vaore di un liquido nel range di temerature tra 200 e 260 K segue la relazione emirica ln /torr = K/. Calcolate l entalia di evaorazione del liquido. Soluzione Dall equazione di Clausius-Claeyron, er integrazione, si trova che d ln = H H d ln = cost R 2 R quindi H = KR = K J K 1 mol 1 = kj mol 1 Esercizio 3.2 Calcolate il unto di fusione del ghiaccio er una ressione di 10 MPa. Assumete che le densità del ghiaccio e dell acqua siano costanti e ari a ρ s = e ρ l = g cm 3 risettivamente, e che l entalia di fusione sia H F = 6.01 kj mol 1. Soluzione Posto che F = K sia la temeratura di fusione a 1 atm, cioè Pa, assumiamo che il secondo membro dell equazione di Claeyron sia costante, cioè che d d = H F V F H F F V F da cui, con / H F / F V F, con = ( ) MPa = Pa si ottiene = =10 MPa F = ( F 1 M H2 O 1 ) H F ρ l ρ s = K Pa kg mol J mol 1 ( ) kg m kg m 3 = 0.74K quindi la temeratura di fusione a 10 MPa è ari a K = K. Esercizio 3.3 Calcolate la differenza tra le endenze delle curve µ vs. ai due lati a) del unto normale di congelamento e b) del unto normale di ebollizione dell acqua. Usate i seguenti dati: ρ s = e ρ l = g cm 3 a 0 C; ρ l = g cm 3 e ρ g = g L 1 a 100 C. N.B. Il unto normale di transizione è la temeratura di transizione di fase ad 1 atm di ressione; il unto standard di transizione è la temeratura di transizione di fase ad 1 bar = atm di ressione. Soluzione Nel caso a: ( ) ( ) µl µs = 1.63 cm 3 mol 1 ( 1 = V m,l V m,s = M H2 O 1 ) ρ l ρ s ( ) = g mol g cm g cm 3
51 3.1. SOSANZE 51 Nel caso b: ( ) µg ( ) µl = 30.1L mol 1 ( 1 = V m,g V m,l = M H2 O 1 ) ρ g ρ l ( ) = g mol g L g L 1 Esercizio 3.4 Calcolate la ressione necessaria er convertire la grafite in diamante a 25 C. Usate i seguenti dati: Grafite (G) Diamante (D) f G /kj mol v/cm 3 g κ /kpa abella 3.1: Dati termochimici costanti risetto a, dove v è un volume secifico, e tenendo conto che la differenza tra il otenziale chimico standard del diamante e della grafite alla ressione standard, cioè l energia libera di reazione standard della reazione C (G) C (D), è r G = µ D µ G = kj mol 1 a 25 C. Figura 3.1: Suerman risolve l esercizio 3.4 Soluzione All equilibrio, i otenziali chimici del diamante e della grafite devono essere uguali (come vedremo iù avanti, questo significa che l energia libera della reazione C(G) C(D), vale a dire r G = µ D µ G, deve essere zero). Possiamo calcolare rg come funzione della ressione: ( ) r G(, ) = r G(, r G )+ = Abbiamo che r G(, ) = r G, mentre ( )+ 1 2 ( ) r G ( 2 ) r rg 2 = ( ) 2 +O(( ) 3 ) = r V = = (v D v G ) M C = (0.284
52 52 CAPIOLO 3. SOSANZE PURE E SOLUZIONI 0.444) cm 3 g g mol 1 = 1.92 cm 3 mol 1. Inoltre, ( 2 ) ( ) [( ) ( ) r G r V r v D r v G 2 = = da cui ( 2 ) r G 2 = ) M C = (κ,d v D κ,g v G )M C cm 3 kpa 1 mol 1 Infine, riarrangiando e cambiando unità di misura si ottiene r G = [ ( ) ( ) ] cm 3 kpa mol 1 L equazione di secondo grado ha due soluzioni, che corrisondono a = kpa e = kpa; la rima corrisonde alla transizione grafite diamante, la seconda alla transizione (iotetica) diamante grafite. Esercizio 3.5 Data una generica transizione di fase di una sostanza ura tra le fasi α e β, α β, determinate la variazione dell entalia di transizione tr H = H α,m H β,m Soluzione Partiamo ( dal differenziale ) ( in (, ) ) di tr H: tr H tr H d tr H = d + d [ ( Hα,m ) ( ) ] [( ) Hβ,m Hα,m = d + [ ( ) Vα,m = (C α,m C β,m )d + V α,m V β,m + [ ( ) ] tr V = tr C,m d + tr V d ( ) ( dove abbiamo fatto uso delle identità H = C e H = ) artendo dal differenziale di H esresso nelle variabili canoniche...). ( Hβ,m ) ( Vβ,m ] d ) ] d ( ) V + V (dimostratele, Dato che siamo in resenza di una transizione di fase d e d non sono indiendenti, ma legati dalla legge di Claeyron, d = trh trv d. Dividendo la recedente esressione er d e usando la legge di Claeyron, otteniamo la seguente formula, dovuta a Planck: d tr H = tr C + ( ) trh ln tr V tr H d =( ) che è valida lungo la curva di coesistenza delle due fasi. Se consideriamo una transizione in cui la fase α sia un gas, ossiamo scrivere tr V R/ (trascurando il volume molare della fase condensata β e assumendo che la fase gas sia erfetta); sostituendo nell esressione di Planck otteniamo d tr H = tr C + ( ) trh ln R/ tr H = tr C + trh trh = tr C d
53 3.1. SOSANZE 53 Esercizio 3.6 Calcolate un esressione generale er l integrazione della relazione di Clausius-Claeyron Soluzione Date la relazione di Clausius-Claeyron e l ultima esressione del recedente esercizio dln d = trh R 2 d tr H d = tr C dalla seconda ricaviamo tr H e sostituiamo il risultato nella rima tr H( ) = tr H(0) + 0 d tr C ( ) dln = trh(0) d R R 2 d tr C ( ) 0 tr H(0) è detta entalia latente di transizione allo zero assoluto; dalla relazione recedente discende ln = cost trh(0) R + 0 d R 2 d tr C ( ) 0 se assumiamo che tr C sia circa costante, otteniamo ln = trh(0) R + trc R ln + cost La forma generale cercata è dunque ln = A + B ln + C. Esercizio 3.7 Calcolate la relazione ressione/temeratura er una fase condensata ura volatile in equilibrio con il suo vaore ed un gas inerte. Soluzione Sia α la fase gas, in cui la sostanza ura è resente con una frazione molare y; sia β la fase condensata; infine siano e v la ressione totale e la ressione arziale dovuta alla sola sostanza. Il otenziale chimico della sostanza nelle due fasi deve essere lo stesso µ α = µ β, e quindi dµ α (,, y) = dµ β (, ) ( ) ( ) ( ) ( ) ( ) µα µα µα µβ µβ d + d + dy = d + d,y,y y, ( ) µα S α d + V α d + dy = S β,m d + V β,m d y, dove sono state usate le consuete indentità tra grandezze termodinamiche molari, arziali molari etc.; assumendo che la miscela gassosa sia erfetta v = y (legge di Dalton) e µ α = µ α + R ln + R ln y quindi sostituendo nella enultima esressione otteniamo S α d + R riarrangiando d ln v = S α S β,m R d + R y dy = S αd + R d ln v = S β,md + V β,m d d + V β, m R d ln v d + ln v d
54 54 CAPIOLO 3. SOSANZE PURE E SOLUZIONI e quindi ln v ln v = S α S β,m R = V β, m R = trh R 2 La rima equazione è molto simile all equazione di Clausius-Claeyron, ma è ricavata con un arossimazione di meno, ossia che la fase condensata abbia volume molare trascurabile risetto al volume molare del vaore. Esercizio 3.8 L entalia di evaorazione del tetracloruro di carbonio è ari a kj mol 1 ; il unto di ebollizione normale si ha a 77 C. A quale ressione il tetracloruro bolle a 85 C? Soluzione Assumendo che l entalia di evaorazione sia costante, abbiamo che ln 2 = ( eh 1 1 ) 1 R 1 2 e ricavando 2 si ottiene [ ( e H 1 2 = 1 ex 1 )] = R 1 2 [ J mol 1 ( )] 1 = 760 torr ex J K 1 mol K 1 = 958 torr K Esercizio 3.9 Qual è il unto di fusione del ghiaccio a 100 atm? Assumete che l entalia di fusione sia costante e ari a J g 1 e che i volumi secifici di ghiaccio ed acqua siano ari a e cm 3 g 1 risettivamente (e costanti). Soluzione Dall equazione di Clausius-Claeyron otteniamo d d = F V F H ; arossimando a secondo membro F = K (unto di fusione normale), otteniamo F F V F H ; il volume di transizione secifico è F V = = cm 3 g 1. Sostituendo, otteniamo = K. Esercizio 3.10 In rossimità del unto trilo dell ammoniaca la ressione di vaore sora il liquido ed il solido varia con la temeratura secondo le esressioni 3063 K ln = atm 3754 K ln = atm Determinate la temeratura e la ressione del unto trilo e le entalie di evaorazione, sublimazione e fusione. Soluzione Le due curve si intercettano al unto trilo, quindi K 3 = K 3
55 3.1. SOSANZE 55 da cui 3 = K e quindi 3 = atm. Dalla relazione di Clausius-Claeyron, er esemio alicata alla sublimazione, abbiamo che er due generiche coie di valori 0, 0 e, che giacciono sulla curva di sublimazione ln 0 = SH R ( ) assumendo naturalmente S H costante; scegliendo 0 = 1 atm, sia ha che ln 1atm = cost SH 1 R da cui segue er confronto con la relazione emirica S H = 3754 K J K 1 mol 1 = kj mol 1. Analogamente troviamo che E H = kj mol 1. Infine F H = S H E H = 5.74 kj mol 1 Esercizio L di aria secca vengono fatti assare attraverso un bicchiere (isolato termicamente) contenente 250 g d acqua, inizialmente a 25.0 C. Calcolate la temeratura finale del sistema. Dati: tensione di vaore dell acqua 23.8 torr, caacità termica molare a ressione costante dell acqua 75.5 J K 1 mol 1. Suonete che l aria sia a temeratura costante e che il vaore acqueo sia un gas erfetto. Soluzione Parte dell acqua evaora, n g = vv R si abbassa = n l = q n l C,m e sottrae calore q = n g E H, quindi la temeratura (n g moli di acqua vaore, n l moli di acqua liquida, con n g n l ), con m M H2. Combinando le varie relazioni otteniamo O = vv E HM H2 O R mc,m = 1.56 K Esercizio 3.12 Un liquido bolle a h = 368 K sulla cima di una montagna ad altezza h dal livello del mare, dove invece bolle a 0 = 378 K. Saendo che va H = 45 kj mol 1, stimate l altezza della montagna. Assumete che la temeratura esterna media si mantenga costante lungo tutto il versante della montagna intorno a aria = 20 C. Soluzione Stimiamo la variazione della ressione in funzione dell altezza: d = ρ m ()gdz dove ρ m è la densità di massa, g l accelerazione di gravità, z è l altezza. Ma ρ m = Mρ, dove M è il eso molecolare dell azoto (assumiamo che si ossano trascurare gli altri gase dell aria), ρ è la densità molare; inoltre assumendo che l aria si comorti da gas erfetto = R aria ρ; aria è la temeratura dell aria. Quindi d = Mgρ()dz = Mg(/R aria v)dz, da cui h d = mg h ( dz h = 0 ex Mgh ) R aria R aria 0 0 Usiamo ora la relazione di Clausius-Claeyron (o meglio la relazione formalmente identica er la tensione di vaore di una fase condensata volatile in resenza di un gas esterno inerte): ln h = ( vah 1 1 ) 0 R 0 h
56 56 CAPIOLO 3. SOSANZE PURE E SOLUZIONI da cui segue che h = vah aria Mg ( 1 1 ) = 3.5 km h 0 Esercizio 3.13 Stimate un esressione er l entroia di transizione S = S α,m S β,m lungo la curva di coesistenza di due fasi α, β in funzione della temeratura. Soluzione Lungo la curva di coesistenza la ressione è funzione della temeratura, = ( ) e quindi S = S α,m [, ( )] S β,m [, ( )] Per la fase α abbiamo che ds α,m d = ( Sα,m che si uò scrivere come ) =( ) + ( Sα,m ) d d ds α,m d = C α,m V α,m α α d d dove α α è il coefficiente di esansione termica della fase α etc. Analoga esressione vale er la fase β, quindi: d S d = C,m (V m α) V Esercizi non risolti Esercizio 3.14 Nell esercizio 3.2, assumete che nel secondo membro dell equazione non si ossa arossimare con F. Esercizio 3.15 Partendo dai risultati dell esercizio 3.3, di quanto è maggiore la differenza tra i otenziali chimici del vaore acqueo e quello dell acqua liquida a 100 C e 1.2 atm risetto alla stessa differenza a 100 C e 1.0 atm? Esercizio 3.16 In una notte d inverno un viaggiatore misura la temeratura dell aria, che è 4.5 C. Se la ressione arziale dell acqua nell aria è ari a 1.95 torr a questa temeratura, otrebbe formarsi la brina? Dati: il unto trilo dell acqua è a bar e K; l entalia di sublimazione è ari a 51 kj mol 1.
57 3.2. DIAGRAMMI DI FASE E SOLUZIONI 57 Esercizio 3.17 Il toluene segue la seguente curva solido-liquido bar = ( x)x bar dove x = 3 1, e la curva liquido-vaore ln bar = y y y (1 y) 1.7 y dove y = c. Il unto trilo si ha a 3 = µbar, 3 = K, la temeratura critica è c = K; i volumi molari sono 30.4 L mol 1 er la fase gas e 0.12 L mol 1 er la fase liquida. Calcolate: il unto di fusione standard, il unto di ebollizione standard e l entalia standard di ebollizione del toluene. 3.2 Diagrammi di fase e soluzioni Esercizi risolti Esercizio 3.18 I volumi arziali molari dell acetone e del cloroformio in una miscela con una frazione molare di cloroformio ari a 0.47 sono 74.2 e 80.2 cm 3 mol 1. Qual è il volume di 500 gr di soluzione? Soluzione La massa della soluzione è m = n A M A + n C M C (A e C sono riferiti ad acetone e cloroformio); dividendo er le moli totali n = n A + n C, m/n = x A M A + x C M C, cioè n = m/[(1 x C )M A + x C M C ] (relazione diretta tra il numero di moli totali di soluzione, il suo eso m e la comosizione x C ). Sostituendo, si ottiene n = 5.7 mol, n A = 3.0 mol e n C = 2.7 mol. Quindi, V = n A V A + n C V C = 0.44 L. Esercizio 3.19 In una cantina enologica sono disonibili L di alcol etilico al 96 % in eso di etanolo. Si vuole aggiungere acqua er ottenere vodka al 56 % in eso di etanolo. Alla temeratura della cantina, C, sono noti i seguenti dati (W acqua ura, E etanolo, A soluzione di alcol concentrato iniziale, V vodka): ρ W = g ml 1, V A W = ml mol 1, V A E = ml mol 1, V V W = ml mol 1, V V E = ml mol 1. Quanti litri di acqua devono essere aggiunti e quanti litri di vodka si ottengono? Soluzione I volumi delle due soluzioni sono V A = n A W V A W + n A EV A E V V = n V W V V W + n V EV V E Inoltre si sa che n A E = n V E Dalla rima relazione si ottiene facilmente V A n A = x A W V A W + x A E V A E
58 58 CAPIOLO 3. SOSANZE PURE E SOLUZIONI dove n A è il numero di moli totali della soluzione A. Dalle ercentuali in eso ossiamo ricavare le frazione molari; in generale, er N soluti con esi molecolari M i si ha che x i = n i n = i M i N j M j=1 j Nelle due soluzioni troviamo erciò subito x A W = 0.096, xa E = 0.91 e xv W = 0.67, xv E = Ora ossiamo trovare n A = mol e quindi n A W = xa W na = mol, n A E = na n A W = mol. Le moli totali di vodka sono invece n V = n V E /xv E = na E /xv E = mol, con moli di acqua ari a n V W = xv W nv = mol; le moli di acqua aggiunte sono dunque n W = n V W na W = mol, ed il volume di acqua aggiunto è V W = n W M W /ρ W L. Il volume di vodka totale è V V = n V W V V W + n V E V V E L. N.B. Il volume ottenuto semlicemente sommando il volume iniziale con quello dell acqua aggiunta è L. Esercizio 3.20 In una soluzione binaria A + B i volumi arziali sono V A = V A + ax2 B 2 3 (a b)x3 B e V B = VB + bx2 A (a b)x3 A, dove V A, V B, a, b sono funzioni di,. Verificate la relazione di Gibbs-Duhem er i volumi arziali molari e calcolate il volume di mescolamento er una mole di soluzione. Soluzione A temeratura e ressione costante, la relazione di Gibbs-Duhem è x A dv A + x B dv B = 0; si ha che x A dv A = x A [2ax B 2(a b)x 2 B]dx B x B dv B = x B [2bx A + 2(a b)x 2 A]dx A Sommando si ottiene x A dv A + x B dv B = 2x A x B [ a + (a b)(1 x A ) + b + (a b)x A ]dx A = 0 Il volume di mescolamento molare è mix V = x A (V A V n A) + x B (V B VB) = x A(1 x A ) [(a b)x A + a + 2b] 3 Esercizio 3.21 Data una soluzione binaria A + B, saendo che la fase liquida è formata da 2.75 mol e la fase vaore da mol, consocendo la frazione molare totale della secie A, z A = e la frazione molare della stessa secie nella fase liquida, x A = 0.310, calcolate la comosizione della fase gassosa Soluzione Il numero di moli totali è n = n l + n g = 7.01 mol, da cui n A = nz A = 2.94 mol e n A,l = n l x A = mol; quindi n A,g = (n A n A,l ) = 2.09 mol e erciò y A = n A,g /n g = 0.491
59 3.2. DIAGRAMMI DI FASE E SOLUZIONI 59 Esercizio 3.22 Calcolate al differenza tra il otenziale chimico dell etanolo uro e dell etanolo che contenga il 10% in eso di acetone a 25 C. Soluzione Assumiamo che la soluzione sia ideale. Le frazioni molari sono x A = e x E = (vedi l esercizio 3.19), quindi: µ E = µ E + R ln x E µ E µ E = R ln x E = 210 J mol 1 Esercizio 3.23 A 50.0 C la tensione di vaore del benzene (B) è 271 torr, mentre quella del toluene ( ) è 92.6 torr. Assumendo che la soluzione formata dai due comosti sia erfetta, e che sia ottenibile in tutte le roorzioni, calcolate la tensione di vaore di una miscela formata dal % in eso di benzene; stimate anche la comosizione del vaore. Soluzione Le frazioni molari in soluzione sono x B = e x = (vedi l esercizio 3.19); dalla legge di Raoult B = x B B = torr e = x = torr, quindi = B + = 170 torr; la comosizione del vaore (che si suone erfetto) è data da y B = B / = 0.70, y = 1 y B = Esercizio 3.24 La ressione osmotica di una soluzione acquosa a 298 K è 99 kpa. A quale temeratura congela? Dati: K f = 1.86 K mol 1 kg, ρ H2 O = kg m 3. Soluzione La ressione osmotica si trova in funzione della legge di van t Hoff, la variazione del unto di fusione dalla relazione lineare er l abbassamento del unto crioscoico: Π = cr = n ΠV R n = V R n n = K F m = K F K F V H2 Oρ H2 O V ρ H2 O dove il volume di acqua è arossimato con il volume totale della soluzione; si trova erciò = K F Π R ρ H2 O = Quindi la temeratura di fusione è θ F = C. Esercizio 3.25 Calcolate l energia libera, l entroia e l entalia di mescolamento di una soluzione formata da 1.00 mol di esano e 1.00 mol di etano a 298 K Soluzione Assumendo che la soluzione sia ideale si ha in generale er N soluti mix H = 0, mix G = nr N i=1 x i ln x i, mix S = nr N i=1 x i ln x i. Con N = 2, n = 2 e x 1 = x 2 = 0.5 si trova mix G = 3.43 kj, mix S = 11.5 J K 1. Esercizio 3.26 In quali roorzioni di frazioni molari si ha la massima entroia di mescolamento tra benzene ed etilbenzene? Soluzione Poichè, assumendo la soluzione ideale: mix S = nr(x B ln x B + x E ln x E ) = nr[x B ln x B + (1 x B ) ln(1 x B )]
60 60 CAPIOLO 3. SOSANZE PURE E SOLUZIONI si deve orre d mix S dx B = nr ln x B 1 x B = 0 da cui x B = 1/2. Una soluzione binaria ideale ha la massima entroia di mescolamento quando è equimolare. Esercizio 3.27 Un soluto non volatile di eso molecolare ari a 241 g mol 1 è sciolto in acqua a = 293 K; saendo che la tensione di vaore dell acqua ura e della soluzione sono risettivamente = e = atm, che la concentrazione è kg di soluto in kg di acqua, calcolate il coefficiente di attività dell acqua nella soluzione Soluzione L attività a H2 O dell acqua è ottenuta dalla legge di Raoult = a H2 O, a H2 O = / = ; la frazione molare dell acqua è ottenibile saendo che le moli di soluto sono n S = 122 g/241 g mol 1 = mol e quelle dell acqua n H2 O = 920 g/18.02 g mol 1 = mol, da cui x H2 O = , quindi γ H2 O = a H2 O/x H2 O = Esercizio 3.28 Una soluzione A + B in equilibrio con il suo vaore a 30 C e 1 atm è tale che x A = e y A = B = 92.1 kpa Calcolate le attività dei due comonenti saendo che A = 73.0 kpa, Soluzione A = y A = = kpa, B = A = kpa, quindi a A = A / A = 0.436, a B = / B = Esercizio 3.29 Se una soluzione forma un azeotroo, nell iotesi che la miscela gassosa del vaore sia erfetta, note le ressioni di vaore dei comonenti uri e la tensione di vaore totale, quanto valgono i coefficienti di attività in soluzione dei vari comonenti? Soluzione Si ha che x i = y i = i /, quindi i /x i = = i /x i i = / i. Ma er definizione γ i = i /x i i dalla legge di Raoult, quindi γ i = / i. Esercizio 3.30 In uno studio sulle miscele di acido roionico (1) in ossano (2) si trova che il volume di eccesso molare segue l esressione Vm E = x 1 x 2 [a 0 + a 1 (x 1 x 2 )], con a 0 e a 1 costanti. Calcolate un esressione generale er i volumi arziali molari dei due comonenti Soluzione Si ha che: V ideale = n 1 V m,1 + n 2 V m,2 = V uri mix V ideale = 0 V E = mix V reale mix V ideale = mix V reale = V V uri = V n 1 V m,1 n 2 V m,2
61 3.2. DIAGRAMMI DI FASE E SOLUZIONI 61 quindi V = n 1 V m,1 + n 2 V m,2 + a 0n 1 n 2 + a 1n 1 n 2 (n 1 n 2 ) n 1 + n 2 (n 1 + n 2 ) 2 e si ottiene V 1 = V 2 = ( ) V = V m,1 + a 0 x a 1 (3x 1 x 2 )x 2 2 n 1,,n ( ) 2 V = V m,2 + a 0 x a 1 (x 1 3x 2 )x 2 1 n 2,,n 1 Esercizio 3.31 La naftalina (1) forma soluzioni ideali con il benzene (2); la nafatalina ura fonde a 90.0 C, ed ha un entalia di fusione di 4600 cal mol 1. Qual è la frazione molare di nafatalina in una soluzione con benzene che fonda a 60.0 C? Soluzione Poiché = F = K f x 2 = RF 2x 2/ H F sostituendo i dati numerici si trova x 2 = , da cui x 1 = Esercizio 3.32 Una soluzione binaria ha la seguente energia libera di eccesso G E = nr βx 1 x 2 dove β è una costante. rovate un esressione er i coefficienti di attività delle due sostanze in funzione della comosizione. Soluzione Dalla relazione (vedi aunti di lezione): ( ) G E = R ln γ i n i,,n i dove con n i si intende il numero di moli di tutte le comonenti tranne della i-esima, si trova che ( ) G E = βr n 1 n 2 = βr x 2 2 n 1 n 1 n 1 + n 2,,n 2 ed un analoga esressione er la derivata in n 2 ; quindi: γ 1 = ex(βx 2 2) γ 2 = ex(βx 2 1) Esercizio 3.33 È data una soluzione binaria, dove il comonente 1 è il benzene ed il comonente 2 è il cicloesano, a 40.0 C; 1 = e 2 = torr; i due comonenti formano un azeotroo quando le moli di benzene sono uguali a quelle di cicloesano, con una tensione di vaore = torr. Il sistema uò essere descritto dal modello della soluzione regolare, descritto nel recedente esercizio?
62 62 CAPIOLO 3. SOSANZE PURE E SOLUZIONI Soluzione Dall esercizio recedente otteniamo che er x 1 = x 2 i due coefficienti di attività dovrebbero essere uguali, γ 1 = γ 2. Ma nell esercizio 3.29 abbaimo imarato a valutare i coefficienti di attività date le tensioni di vaore dei comonenti uri e la tensione di vaore dell azeotroo; troviamo che γ 1 = e γ 2 = 1.117, che sono abbastanza vicini, giustificando così il modello adottato. Esercizio 3.34 Due sostanze, A e B, mostrano il seguente diagramma di fase solido-liquido. Si dia una descrizione di tutte le regioni del diagramma, indicando (se vengono formati) anche i comosti tra le due sostanze. Si indichi anche se le varie sostanze, nelle diverse regioni, si trovano nello stato liquido o gassoso. Soluzione Il diagamma di fase mostra la formazione di 2 comosti tra A e B in fase solida. Uno è A 2 B (er x B = 0.33), mentre l altro è AB 2 (er x B = 0.67). In fase solida non si formano soluzioni tra questi due comosti o tra uno dei due e una delle due sostanze A o B. Sulla base di queste osservazioni, vengono di seguito discusse le diverse regioni: Zona 1: i unti del diagramma, a comosizione fissata, si trovano ad una temeratura maggiore delle curve (x) che indicano l equilibrio solido-liquido. Non essendoci zone di immiscibilità indicate, si uò dire che nella zona 1 si hanno soluzioni liquide (in tutte le roorzioni), delle due sostanze, er cui: A (l) + B (l). Zona 2: una miscela rearata in questa regione vedrà in equilibrio A (s) (da un unto nella regione 2, sostandosi a sinistra si trova A uro sotto la sua temeratura di fusione) e la soluzione (A (l) + B (l) ), che è la fase che si incontra sostandosi, nella regione 2, verso destra, aumentando la frazione molare di B. Zone 3 e 4: in queste regioni co-esisteranno due fasi, una solida costituita da A 2 B (s) ed una liquida, costituta da (A (l) + B (l) ).
63 3.2. DIAGRAMMI DI FASE E SOLUZIONI 63 Zona 5: in questa regione co-esisteranno due fasi, una solida costituita da AB 2(s) ed una liquida, costituta da (A (l) + B (l) ). Zona 6: in questae regione co-esisteranno due fasi, una solida costituita da B (s) ed una liquida, costituta da (A (l) + B (l) ). Zona 7: i unti in questa regione descrivono una situazione in cui sono resenti due fasi solide distinte, una formata da A (s) uro e l altra dal comosto A 2 B (s). Zona 8: in questa regione coesistono due fasi solide distinte, una formata dal comosto A 2 B (s) e l altra dal comosto AB 2(s). Zona 8: i unti in questa regione descrivono una situazione in cui sono resenti due fasi solide distinte, una formata da B (s) uro e l altra dal comosto AB 2(s). Si aggiunge che la cuside iù a sinistra corrisonde all eutettico er questo sistema. utte le osservazioni sora scritte sono riassunte nel diagramma di fase riortato nella figura seguente. Esercizio 3.35 A 90 C, le ressioni di vaore di 1,2-dimetilbenzene è A = kpa, mentra quella di 1,3-dimetilbenzene è B = 18 kpa. Si disegni il diagramma di fase ressione vs. comosizione, saendo che in fase liquida i due comosti sono miscibili in tutte le roorzioni. Se una miscela liquida delle due sostanze, a = 90 C, mostra una tensione di vaore = 19 kpa, qual è la sua comosizione? Qual è la comosizione del vaore? Si considerino gas e misclela liquida ideali. Soluzione In quanto segue verranno etichettati A e B, risettivamente, 1,2-dimetilbenzene e 1,3- dimetilbenzene. Il diagramma di fase verrà costruito usando come variabile di comosizione la frazione molare di A (1,2-dimetilbenzene) in liquido o vaore (x A o y A ).
64 64 CAPIOLO 3. SOSANZE PURE E SOLUZIONI Per quanto riguarda la diendenza della ressione dalla comosizione del liquido, essendo la soluzione ideale si uò usare la legge di Raoult er scrivere la ressione arziale della miscela: = x A A + x B B = x A A + (1 x A ) B = B + ( A B)x A Si nota che la relazione tra la ressione e la comosizione di A in fase liquida è una retta, ed è raresentata in rosso nella figura 3.2. Per la diendenza tra ressione e comosizione in A nel vaore, ricordiamo che, durante la transizione di fase, la ressione arziale del comonente in fase gas equivale alla tensione di vaore del comonente in fase liquida. Per cui A = x A A = y A da cui si uò ricavare x A = y A A Sostituendo quest ultima relazione nella esressione di (x A ), si ottiene = A B A + ( B A )y A Da cui si vede che la relazione tra la ressione e la frazione molare di A nel vaore è un ierbole, raresentata in verde in figura 3.2. Saendo che la miscela a comosizione incognita ha una tensione di vaore di 19 kpa, si uò usare la legge di Raoult er calcolare x A = B A B = da cui x B = 1 x A = In fase vaore, = 0.50 y A = x A A = = 0.53 e y B = 1 y A = Esercizio 3.36 Un sistema viene rearato aggiungendo AlCl 3 in acqua, in due condizioni diverse: (a) l acqua è solo liquida e (b) l acqua è in equilibrio con vaore acqueo. Si calcoli la varianza del sistema nei due casi considerando che il tricloruro di alluminio (III) idrolizza e che nel sistema è resente l equilibrio di reciitazione di Al(OH) 3. Soluzione (a) C aso in cui l acqua è solo liquida Per stabilire la varianza del sistema occorre decidere quali variabili di stato ossono essere modificate indiendentemente, quante fasi esistono nel sistema e qual è il numero di secie indiendenti. Riguardo alle variabili di stato, dato che non sono imosti vincoli dal roblema, se ne ossono modificare
65 3.2. DIAGRAMMI DI FASE E SOLUZIONI 65 Figura 3.2: Diagramma di fase ressione contro comosizione er il sistema 1,2-dimetilbenzene - 1,3-dimetilbenzene. indiendentemente 2: e (oure e V, oure e V). Le fasi nel sistema sono F = 2: l acqua liquida e Al(OH) 3 solido. In totale ci sono 7 secie nel sistema: AlCl 3, H 2 O, Al 3+, Cl, H +, OH e Al(OH) 3. ra queste, erò esistono i seguenti vincoli: -Idrolisi di AlCl 3 : AlCl 3(aq) Al 3+ (aq) + 3 Cl (aq) -Idrolisi di H 2 O: H 2 O (l) H + (aq) + OH (aq) -Preciitazione di Al(OH) 3 : AlCl 3(aq) + 3 H 2 O (l) Al(OH) 3(s) + H + (aq) + Cl (aq) -Elettroneutralità della soluzione: [H + ] + 3[Al 3+ ] = [Cl ] + [OH ] Si noti come si consideri l equilibrio di idrolisi di HCl comletamente sostato verso la dissociazione, er cui, come arossimazione, non si sta considerando la resenza di HCl nel sistema (e quindi neure il vincolo tra l acido cloridico e i rodotti della sua idrolisi). Il numero di secie (o comonenti) libere è quindi C = 7 4 = 3. La varianza del sistema è, quindi, V = C F + 2 = = 3. (b) C aso in cui l acqua liquida è in equilibrio con il vaore Risetto al caso recedente, consideriamo due diverse secie d acqua: H 2 O (l) e H 2 O (g). Per cui il numero totale di secie sale a 8. L equilibrio vaore - liquido, erò aggiunge un nuovo vincolo risetto
66 66 CAPIOLO 3. SOSANZE PURE E SOLUZIONI a quelli sora indicati (ossia, le 3 reazioni chimiche e l elettroneutralità). Per cui, C = 8 5 = 3. Il numero di secie libere rimane invariato. Il numero di fasi, invece, cambia a F = 3: ci sono una fase gassosa (acqua vaore), una liquida (acqua liquida) ed una solida (il reciitato Al(OH) 3 ). Per quanto riguarda le variabili di stato, invece, esse rimangono 2. La varianza er il sistema è quindi: V = C F + 2 = = 2. Aggiungere l equilibrio dell acqua liquida con il rorio vaore ha l effetto netto di aggiungere un vincolo in iù nel sistema, risetto al caso (a), e quindi un minore numero di gradi di libertà. Esercizio 3.37 UF 4 e ZrF 4 fondono, risettivamente, a 1035 C e 912 C. Essi formano una serie continua di soluzioni solide, con una temeratura minima di fusione a 765 C; tale soluzione solida ha comosizione x ZrF4 x (s) ZrF 4 = A 850 C, invece, x (l) ZrF 4 = A 900 C, la soluzione liquida ha x (l) ZrF 4 = 0.28, mentre quella solida = 0.87 e x (s) ZrF 4 = Si disegni il diagramma di stato, descrivendo cosa accade se una soluzione liquida con x (l) ZrF 4 = 0.40 viene raffreddata lentamente da 900 C a 500 C. Soluzione Usando i dati forniti dal roblema, il diagramma di stato viene raresentato arossimativamente in figura 3.3. Seguendo la trasformazione data nel testo dell esercizio, nel unto di artenza, A, il sistema è liquido con x (l) ZrF 4 = Abbassando la temeratura, quando si arriva al unto B, a circa 860 C, comincia a staccarsi dalla soluzione una miscela solida con x (s) ZrF Man mano che si abbassa la temeratura tra B e C, la soluzione liquida si imoverisce in UF 4, che va a formare la miscela solida, 4 via via iù ricca in ZrF 4. Al unto C (circa 820 C), la miscela inizialmente liquida diventa solida, con x (s) ZrF 4 = Infine, rocedendo a D, e giù fino a 500 C, non succede iù nulla er quanto sia dato saere dalla informazioni fornite dal testo del roblema. Esercizio 3.38 In figura 3.4 è riortato il diagramma di fase er miscele Sn / Pb. Si calcoli la varianza del sistema nei unti del diagramma indicati con A, B e C considerando la ressione costante. Soluzione Punto A Il numero di comonenti indiendenti è C = 2 (non vi sono vincoli, come reazioni chimiche, tra i due metalli). La fase è unica (liquida), er cui F = 1; la temeratura (o il volume) è l unica variabile di stato liberamente modificabile, dato che il testo sottolinea che la ressione è costante. Per cui, V = C F + 1 = = 2. Punto B
67 3.2. DIAGRAMMI DI FASE E SOLUZIONI 67 Figura 3.3: Diagramma di fase temeratura contro comosizione er il sistema binario UF 4 - ZrF 4. Il numero di comonenti indiendenti è C = 2 (non vi sono vincoli, come reazioni chimiche, tra i due metalli). Sono resenti due fasi, una solida (iombo uro) ed una liquida (iombo e stagno), er cui F = 2. Come rima, considerando che la ressione è mantenuta costante, V = C F +1 = = 1. P unto C (eutettico) Il numero di comonenti indiendenti è C = 2 (non vi sono vincoli, come reazioni chimiche, tra i due metalli). Co-esistono F = 3 fasi: miscela liquida dei metalli, Sn solido e Pb solido. Considerando che la ressione è mantenuta costante, V = C F + 1 = = Esercizi non risolti Esercizio 3.39 Si derivi, er una sostanza ura, la derivata seconda delle linee di coesistenza di due fasi. Esercizio 3.40 Data la soluzione binaria dell esercizio 3.20, er quale valore della frazione molare x A si ha il massimo volume di mescolamento quando b = 0 e b = a/2?
68 68 CAPIOLO 3. SOSANZE PURE E SOLUZIONI Figura 3.4: Diagramma di fase temeratura contro comosizione er il sistema binario Sn - Pb. Esercizio 3.41 La tensione di vaore dell etere etilico è torr. A 10.0 C sciogliamo 4.16 g di acido salicilico in g di etere. La tensione di vaore si abbassa di 8.5 torr. Stimate da questi dati il eso molecolare dell acido salicilico. Esercizio 3.42 Calcolate l energia libera e l entroia di mescolamento di una miscela gassosa erfetta formata da N sostanze, nell iotesi (1) che il sistema sia formato inizialmente come una serie di comarti searati con areti mobili, che vengano oi eliminate er effetturare il mescolamento (cioè che la ressione finale sia uguale alle ressioni arziali dei comonenti iniziali) (2) che il sistema sia formato inizialmente come una serie di comarti searati con areti rigide. Esercizio 3.43 Calcolate l energia libera, l entroia e l entalia di mescolamento di una soluzione formata da mol di esano e 1.00 mole di etano a 298 K Esercizio 3.44 Dato l esercizio 3.26: qual è la roorzione in massa dei due comonenti er la quale si ha la massima entroia di mescolamento? Esercizio 3.45 Nell esercizio 3.30 saendo che a 0 = cm 3 mol 1, a 1 = cm 3 mol 1, le densità dei due comonenti uri sono ρ 1 = e ρ 2 = g cm 3 risettivamente e la temeratura è K, valutate i volumi arziali molari dei due comonenti er n 1 = n 2.
69 3.2. DIAGRAMMI DI FASE E SOLUZIONI 69 Esercizio 3.46 Nell esercizio 3.31 utilizzate la realzione che lega la frazione molare del solvente alla temeratura di fusione senza iotizzare che sia necessariamente molto maggiore delle frazioni molari dei soluti. Esercizio 3.47 La canfora è un solvente adatto alla determinazione del eso molecolare di molte sostanze organiche erchè basta sciogliere ochi milligrammi di sostanza er ottenere variazioni significative del unto di fusione, dato l alto valore della K f = 40 K mol/kg. Saendo che il unto di fusione normale della canfora è 172 C, se si sciolgono 7.9 mg di una sostanza incognita X in mg di canfora e si ottiene un di 8 K, è iù robabile che X sia fenoftaleina, naftalene o alcol roilico? Esercizio 3.48 La tensione di vaore del gas mostarda (vedi agina Wiki) a 30 C è atm. In miscele formate da questa sostanza (M) e dal difeniletere (D) si misurano coefficienti di attività di M ari a 1.179, er x M ari a e risettivamente. Stimate la ressione arziale di M a 30 C sora una miscela di M e D al % in eso di M. Esercizio 3.49 Una soluzione contenente mol di idrossido di sodio in moli di acqua ha una tensione di vaore di torr a C; la tensione di vaore dell acqua ura è Qual è l attività dell acqua nella soluzione e quanto vale la differenza tra i otenziali chimici dell acqua in soluzione e ura? Esercizio 3.50 Qual è l umidità relativa dell aria in equilibrio con una soluzione di saccarosio 2.00 M, assumendo che la soluzione abbia un comortamento ideale ed una densità di g cm 3?
70 70 CAPIOLO 3. SOSANZE PURE E SOLUZIONI
71 Caitolo 4 Equilibrio chimico ed elettrochimico - cinetica chimica 71
72 72 CAPIOLO 4. EQUILIBRIO CHIMICO ED ELEROCHIMICO - CINEICA CHIMICA 4.1 Equilibrio chimico ed elettrochimico Esercizi risolti Esercizio 4.1 Una miscela di gas contiene il 51.3 % di H 2 S ed il resto è CO L di questa miscela a C e 760 torr sono fatti assare attraverso un tubo a C e raffreddati raidamente. Il gas in uscita viene fatto assare attraverso un secondo tubo contenente cloruro di calcio, il cui eso aumenta di 34.7 mg. rovate la costante di equilibrio a C er la formazione del solfuro di carbonile COS da acido solfidrico e anidride carbonica. Soluzione La reazione è H 2 S + CO 2 COS + H 2 O; la costante di equilibrio è erciò (miscela erfetta): K = COS H2 O H2 S CO2. La ressione totale a 350 C iniziale (rima che il sistema raggiunga l equilibrio chimico) si ottiene semlicemente come in = 760torr K/294.15K = torr; inoltre H2 S in / in = da cui H2 S in = torr; analogamente si ricava che CO2 in = torr. Se chiamiamo x la ressione arziale dell acqua H2 O all equilibrio abbiamo H2 O = x COS = x H2 S = H2 S in x CO2 = CO2 in x x si ricava dalla variazione di eso del CaCl 2, che la assorbe comletamente: x = n H 2 OR V = g g mol torr L mol 1 K K L quindi la costante di equilibrio è K = /( ) = = torr Esercizio 4.2 La costante di equilibrio della reazione 1 2 N 2(g) O 2(g) NO (g) è a 2500 K. Quante moli in ercentuale di NO ci sarebbero all equilibrio in aria a questa temeratura? Si ammetta che l aria contenga ossigeno e azoto molecolari nel raorto 20.8:79.2. Soluzione Ammettiamo che la ressione totale sia un atmosfera e che i coefficienti di fugacità siano unitari; elenchiamo le relazioni note tra le ressioni arziali delle tre secie: NO 1/2 N 1/2 = O 2 NO + N2 + O2 = 1atm N2 O2 = = ossiamo ricavare dalle ultime due equazioni le ressioni arziali dell ossigeno e dell azoto in funzione della ressione del monossido, e sostituirle nella rima equazione, ottenendo NO 1 NO = da cui NO = atm, e quindi le moli in ercentuale sono 100 NO /1atm = 1.81%.
73 4.1. EQUILIBRIO CHIMICO ED ELEROCHIMICO 73 Esercizio 4.3 Una certa quantità di irite viene bruciata all aria e convertita in anidride solforosa e ossido ferrico. I gas ottenuti vengono fatti assare attraverso un forno contenente un catalizzatore, a 528 C. In uscita, si ottiene anidride solforica che viene convertita in acido solforico. Quanti metri cubi di aria a 12 C e 1 atm devono essere forniti er ogni tonnellata di irite, al fine di convertire il 90 % di tutto lo zolfo contenuto nella irite stessa in acido solforico? È nota la K c er la dissociazione di due moli di anidride solforica in anidride solforica e ossigeno, ari a M a 528 C. Considerate la comosizione dell aria come nell esercizio recedente. Soluzione La reazione investigata è 2 SO 3(g) 2SO 2(g) + O 2(g), di cui è nota la costante di equilibrio in termini di K c (cioè con l uso delle molarità). Cominciamo considerando una tonnellata di irite FeS 2, vale a dire 10 6 g/ g mol 1 = moli. Queste reagiscono bruciando all aria 2 FeS 2(s) O 2(g) Fe 2 O 3(s) + 4SO 2(g) quindi si formano = moli di anidride solforosa. Di queste il 90 % viene trasformata in anidride solforica, quindi La K c della reazione di conversione è K c = [SO 2 ]2 [O 2 ] [SO 3 ] 2 M notate che non è adimensionale (ha le dimensioni di una molarità) ed il suo uso non è iù consigliato. Ricaviamo la relazione tra K e K c, nella solita iotesi che la miscela sia erfetta K = SO 2 2 O2 2 SO = n SO 2 2 n O2 n = n SO 2 3 n 2 SO 3 n 2 SO 3 2 n O2 R V = K R c dove, n, V sono la ressione, il numero di moli ed il volume totali. Dalla recedente relazione otteniamo (sostituendo i valori = K e R = atm L mol 1 K 1 ) K = Si noti che il numero di moli totali della miscela comrende anche l azoto (inerte in questa reazione) quindi n = n SO2 + n SO3 + n O2 + n N2. Infine consideriamo che il raorto tra il numero di moli di azoto e la somma del numero di moli di ossigeno e la metà del numero di moli di anidride solforosa deve essere uguale al raorto iniziale tra azoto e ossigeno nell aria, cioè n N2 n O2 + n SO3 /2 = Riassumendo, abbiamo tre relazioni in n, n O2 e n N2. Risolvendo troaviamo n N2 = Il numero di moli di aria aggiunte è ari a ( /79.2)n N2 = 1.26n N2 = n N2 + n O2 + n SO3 /2 = ; da questo ossiamo risalire (legge di stato dei gas erfetti) al volume occuato a 12 C ed 1 atm, che è ari a /1 = L vale a dire 841 m 3. Esercizio 4.4 È data la reazione all equilibrio Zn (s) + H 2 O (g) ZnO (s) + H 2(g). L energia libera standard di reazione è 33 kj mol 1 a 1280 K. Scrivete l esressione della costante di equilibrio in funzione delle ressioni arziali dei comonenti gassosi e calcolatene il valore numerico alla temeratura data.
74 74 CAPIOLO 4. EQUILIBRIO CHIMICO ED ELEROCHIMICO - CINEICA CHIMICA Soluzione Assumendo che la miscela gassosa sia erfetta: K = H 2 H2 O = ex( f G /R ) = Esercizio 4.5 L acido cianidrico forma robabilmente un dimero se disciolto in benzene, mentre si resenta come monomero in acqua. Data una soluzione acquosa di HCN, questa viene sbattuta con benzene a 15 C fino al raggiungimento dell equilibrio; er titolazione con NaOH si determina la seguente relazione tra le concentrazioni (molalità totale) di HCN in benzene (m B ) ed in fase acquosa (m A ): m B /m A = (m A /m ). rovate la K di equilibrio della reazione 2HCN (HCN) 2 in benzene. Soluzione Dal testo, ricaviamo che: m A = m HCN,A, m B = m HCN,B + 2m (HCN)2,B. L equilibrio di riartizione del sistema è K r = a HCN,B a HCN,A = γ HCN,B γ HCN,A m HCN,B m HCN,A mentre l equilibrio di dimerizzazione è K = m a (HCN) 2,B (a HCN,B ) 2 = m γ (HCN) 2,B (γ HCN,B ) 2 m (HCN)2,B (m HCN,B ) 2 Assumendo le due soluzioni come ideali, arossimiamo tutti i coefficienti di attività ad uno; dalle due relazioni di equilibrio e dalle due relazioni in m A, m B otteniamo m B m A = K r + 2K 2 r K m A m che confrontata con la relazione emirica orge: K r = , K = Esercizio 4.6 Considerate la decomosizione del metano: CH 4(g) C (s) + 2H 2(g) a 298 K; l entalia e l entroia standard diformazione del metano a questa temeratura sono risettivamente f H = kj mol 1 e f S = 80 J K 1 mol 1. Calcolate la costante di equilibrio della reazione di decomosizione. Soluzione Si ha che d G = f G = ( f H f S ) = J mol 1 e erciò ln K = f G /R = , da cui K = Esercizio 4.7 Considerate la reazione: U (s) H 2(g) UH 3(s)
75 4.1. EQUILIBRIO CHIMICO ED ELEROCHIMICO 75 è noto che fra 400 e 715 K vale la relazione serimentale ln = ln(/k) (/K) Calcolate l entalia e la caacità termica a ressione costante standard di formazione er l idruro di uranio in funzione della temeratura. Soluzione La soluzione è triviale f H = R 2 dln K d = R 2 d d ( 3 2 ln = 3 ( R 2 3 K ) = ( K 8.48 )R e derivando ancora risetto alla temeratura ( f C,m f H ) = = 8.48R ) Esercizio 4.8 A 1 atm e 25 C le entalie di combustione della grafite è , dell idrogeno e del benzene liquido kcal mol 1. L entroia molare a 1 atm e 25 C della grafite è 1.36, dell idrogeno e del benzene cal K 1. A quale fugacità dell idrogeno sarebbero in equilibrio benzene liquido e grafite a 25 C in resenza di un catalizzatore caace di decomorre il benzene esclusivamente in grafite e idrogeno? Soluzione Assumiamo che la ressione standard sia 1 atm. Consideriamo la reazione di decomosizione del benzene in grafite ed idrogeno. L entalia di reazione si ottiene sommando le entalie di combustione f H = c H C 6 H 6 +6 c H C +3 ch H 2 mentre l entroia è f S = S mc 6 H 6 6S mc 3S mh 2 ; l energia libera si ottiene come f H f S ; sostituendo i valori numerici otteniamo f H = kcal mol 1, f S = cal K 1 mol 1 e f G = kcal mol 1. La costante di equilibrio ermette oi di trovare al fugacità ( ) 3 fh2 K = = ex( f G /R ) f = 4.3 H2 107 atm Esercizio 4.9 In figura 4.1 è data una ila con elettrodi a idrogeno e rame. Scrivete lo schema della ila, le reazioni agli elettrodi e la reazione comlessiva di cella. Soluzione Pila: Pt (s) H 2(g), 1 atm H + (aq), 1 M Cu 2+ (aq), 1 M Cu (s) Catodo: Cu 2+ (aq) + 2 e Cu (s)
76 76 CAPIOLO 4. EQUILIBRIO CHIMICO ED ELEROCHIMICO - CINEICA CHIMICA Figura 4.1: Pila: idrogeno + rame Anodo: H 2(g) 2 H + (aq) + 2 e Reazione di cella: H 2(g) + Cu 2+ (aq) 2 H + (aq) + Cu (s) Esercizio 4.10 È data la ila Daniell, illustrata in figura 4.2. Scrivete lo schema della ila, le reazioni agli elettrodi e la reazione comlessiva di cella. Soluzione Pila: Catodo: Zn (s) Zn 2+ (aq) Cu 2+ (aq) Cu (s) Anodo: Cu 2+ (aq) + 2 e Cu (s) Zn (s) Zn 2+ (aq) + 2 e Reazione di cella: Cu 2+ (aq) + Zn (s) Cu (s) + Zn 2+ (aq)
77 4.1. EQUILIBRIO CHIMICO ED ELEROCHIMICO 77 Esercizio 4.11 Considerate l equilibrio di solubilità generico: MX (s) M + (aq) + X (aq). Consideriamo la soluzione ideale e definiamo K S = m M +m X /m 2 ; sia S la solubilità del sale MX, cioè la molalità di MX disciolto. Ora aggiungiamo un elettrolita forte NX con molalità C. Ricavate una relazione tra S e C Soluzione La molalità del catione è m M + = S, quella dell anione è m X = S + C, quindi S(S + [ C)/m 2 = K S, da cui S = C 2 + 4m 2 K S C] /2. Se C 2m K S, allora esandendo in serie di aylor la radice e fermandosi al rimo ordine si ha S K S m 2 /C. Esercizio 4.12 Ora risolvete l esercizio recedente assumendo che la soluzione non sia ideale, quindi K S = a M +a X /m 2. Soluzione Possiamo assumere che valga la relazione di Debye-Huckel er il calcolo dei coefficienti di attività medi. Abbiamo quindi: K S = a M +a X m 2 = m M+m X m 2 γ 2 ± dove m M + = S, m X = S + C, log γ ± = A I, A = Kg 1/2 mol 1/2 ; I è la forza ionica, che ossiamo assumere tranquillamente come dovuta al solo elettrolita forte (S C), cioè I C/m. Segue che ln γ ± = 2.303A C, ovvero γ m 2 = ex( C/m ). Abbiamo quindi: S(S + C) m 2 = K S ex(2.344 C/m ) = K S Figura 4.2: Pila Daniell
Chimica Fisica - Esercizi AA
 Chimica Fisica - Esercizi AA 2017-18 Mirco Zerbetto, Antonino Polimeno htt://www.chimica.unid.it/antonino.olimeno Diartimento di Scienze Chimiche Università degli Studi di Padova 2 Indice 1 Nozioni di
Chimica Fisica - Esercizi AA 2017-18 Mirco Zerbetto, Antonino Polimeno htt://www.chimica.unid.it/antonino.olimeno Diartimento di Scienze Chimiche Università degli Studi di Padova 2 Indice 1 Nozioni di
Chimica Fisica - Esercizi AA
 Chimica Fisica - Esercizi AA 2014-15 Mirco Zerbetto, Antonino Polimeno htt://www.chimica.unid.it/antonino.olimeno Diartimento di Scienze Chimiche Università degli Studi di Padova 2 Indice 1 Nozioni di
Chimica Fisica - Esercizi AA 2014-15 Mirco Zerbetto, Antonino Polimeno htt://www.chimica.unid.it/antonino.olimeno Diartimento di Scienze Chimiche Università degli Studi di Padova 2 Indice 1 Nozioni di
Termologia. Paolo Bagnaia - CTF Esercizi di termologia e termodinamica 1
 ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
Lezione 10 Termodinamica
 rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
Esercizi svolti di termodinamica applicata
 0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
5. Energia libera e potenziale chimico
 5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: dv dp. dv dt. nrt dt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
Tre tipi di Sistema Un richiamo
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
Il primo principio della termodinamica
 Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
SCIENZA DEI MATERIALI. Chimica Fisica. VI Lezione. Dr. Fabio Mavelli. Dipartimento di Chimica Università degli Studi di Bari
 SCIENZA DEI MATERIALI Chimica Fisica VI Lezione Dr. Fabio Mavelli Dipartimento di Chimica Università degli Studi di Bari Energia Libera di Helmholtz F 2 Definiamo la funzione di stato Energia Libera di
SCIENZA DEI MATERIALI Chimica Fisica VI Lezione Dr. Fabio Mavelli Dipartimento di Chimica Università degli Studi di Bari Energia Libera di Helmholtz F 2 Definiamo la funzione di stato Energia Libera di
Tonzig La fisica del calore
 0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica. FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti. Esercitazione del 03/11/2010
 CorsI di aurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CIMICA Docente: Cristian Gambarotti Esercitazione del // Argomenti della lezione avoro, Calore, Energia Interna, Entalpia relativi
CorsI di aurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CIMICA Docente: Cristian Gambarotti Esercitazione del // Argomenti della lezione avoro, Calore, Energia Interna, Entalpia relativi
Fisica dell Atmosfera e del Clima
 Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
CALORE E TERMODI NAMI CA - PRI MO PRI NCI PI O
 CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
A1. Soluzione. Ilcalore Q per unita di massa e negativo (ceduto all esterno) e vale:
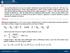 A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
Il I principio della termodinamica. Calore, lavoro ed energia interna
 Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
LAVORO DI UN GAS. Espansione di un gas a pressione costante V A V B
 LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
PROBLEMI E QUESITI DI TERMOLOGIA (SOLUZIONI)
 1 PROBLEMI E QUESITI DI TERMOLOGIA (SOLUZIONI) Qui di seguito viene riportata la risoluzione dei problemi presentati nel file Unità omonimo (enunciati). Si raccomanda di prestare molta attenzione ai ragionamenti
1 PROBLEMI E QUESITI DI TERMOLOGIA (SOLUZIONI) Qui di seguito viene riportata la risoluzione dei problemi presentati nel file Unità omonimo (enunciati). Si raccomanda di prestare molta attenzione ai ragionamenti
Corso di Chimica Fisica A. Prove d esame
 Università di orino Corso di Studi in Chimica - Laurea riennale A. A. 2004-2005 Corso di Chimica Fisica A rove d esame Roberto Dovesi Bartolomeo Civalleri /home/mimmo/testitex/tut cf-a 05/esami cfa 05.pdf
Università di orino Corso di Studi in Chimica - Laurea riennale A. A. 2004-2005 Corso di Chimica Fisica A rove d esame Roberto Dovesi Bartolomeo Civalleri /home/mimmo/testitex/tut cf-a 05/esami cfa 05.pdf
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Esercizi sugli stati ed il diagramma entalpico dell'aria umida
 Esercizi sugli stati ed il diagramma entalico dell'aria umida CESARE MARIA JOPPOLO, STEFANO DE ANTONELLIS, LUCA MOLINAROLI DIPARTIMENTO DI ENERGIA POLITECNICO DI MILANO C. M. Joolo, S. De Antonellis, L.
Esercizi sugli stati ed il diagramma entalico dell'aria umida CESARE MARIA JOPPOLO, STEFANO DE ANTONELLIS, LUCA MOLINAROLI DIPARTIMENTO DI ENERGIA POLITECNICO DI MILANO C. M. Joolo, S. De Antonellis, L.
1 TERMODINAMICA DELLE TURBINE A GAS 1.1 INTRODUZIONE
 TERMODINAMICA DELLE TURBINE A GAS. INTRODUZIONE Il ciclo termodinamico su cui è imostato il funzionamento delle turbine a gas è il ciclo Bryton, la cui analisi orta alla determinazione di due arametri
TERMODINAMICA DELLE TURBINE A GAS. INTRODUZIONE Il ciclo termodinamico su cui è imostato il funzionamento delle turbine a gas è il ciclo Bryton, la cui analisi orta alla determinazione di due arametri
Esercitazione 7. Soluzione. Il sistema è isolato, quindi l energia totale si conserva. Applicando il primo principio della termodinamica si ottiene:
 Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
Peso atomico (meglio massa atomica)
 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Per quanto detto prima il fenomeno di svuotamento termina quando la pressione di ristagno è pari a:
 Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
b) Essendo p A V A = p C V C ne risulta T C = T A = 300 K.
 2.00 moli di un gas perfetto di volume V 1 = 3.50 m 3 e T 1 = 300 K possono espandersi fino a V 2 = 7.00 m 3 e T 2 = 300 K. Il processo è compiuto isotermicamente. Determinare: a) Il lavoro fatto dal gas;
2.00 moli di un gas perfetto di volume V 1 = 3.50 m 3 e T 1 = 300 K possono espandersi fino a V 2 = 7.00 m 3 e T 2 = 300 K. Il processo è compiuto isotermicamente. Determinare: a) Il lavoro fatto dal gas;
ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA
 ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA Esercizio : Scelta ottimale di un monoolista e imoste Si consideri un monoolista con la seguente funzione di costo totale: C ( ) = 400 + + 0 0 La domanda
ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA Esercizio : Scelta ottimale di un monoolista e imoste Si consideri un monoolista con la seguente funzione di costo totale: C ( ) = 400 + + 0 0 La domanda
Appunti di Meccanica dei Fluidi M. Tregnaghi
 Aunti di Meccanica dei Fluidi 3. STATICA: PRESSIONE E LEE IDROSTATICA PRESSIONE IN UN PUNTO La ressione è il modulo della forza esercitata da un fluido er unità di suerficie che agisce in direzione normale
Aunti di Meccanica dei Fluidi 3. STATICA: PRESSIONE E LEE IDROSTATICA PRESSIONE IN UN PUNTO La ressione è il modulo della forza esercitata da un fluido er unità di suerficie che agisce in direzione normale
Lo stato gassoso e le sue proprietà
 Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Istituzione di Fisica Statistica
 Istituzione di Fisica Statistica Comito e rova arziale (December 9, 004) Mattia Donega 8 dicembre 006 Esercizio Un gas classico di N articelle di massa m in equilibrio alla temeratura T è riartito fra
Istituzione di Fisica Statistica Comito e rova arziale (December 9, 004) Mattia Donega 8 dicembre 006 Esercizio Un gas classico di N articelle di massa m in equilibrio alla temeratura T è riartito fra
Calore, lavoro e trasformazioni termodinamiche (1)
 Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
IIASS International Institute for Advanced Scientific Studies
 IIASS International Institute for Advanced Scientific Studies Eduardo R. Caianiello Circolo di Matematica e Fisica Diartimento di Fisica E.R. Caianiello Università di Salerno Premio Eduardo R. Caianiello
IIASS International Institute for Advanced Scientific Studies Eduardo R. Caianiello Circolo di Matematica e Fisica Diartimento di Fisica E.R. Caianiello Università di Salerno Premio Eduardo R. Caianiello
Idraulica e Idrologia: Lezione 12 Agenda del giorno
 Idraulica e Idrologia: Lezione genda del giorno Idrostatica: fluidi in quiete - Unità di misura er la ressione di un fluido - Pressione e rofondità - Princiio di rchimede: cori in un fluido Pg Fluido Cosa
Idraulica e Idrologia: Lezione genda del giorno Idrostatica: fluidi in quiete - Unità di misura er la ressione di un fluido - Pressione e rofondità - Princiio di rchimede: cori in un fluido Pg Fluido Cosa
Dalla legge dei gas perfetti si ha il rapporto tra il numero di moli dei due gas R T 1 V 2 P V 1. =n 1. RT 2 =V 2 qundi: n 1 = T 2. =n 2.
 Compito intercorso Fisica II ICI 1 giugno 2006 1 Due recipienti uguali, isolati termicamente dall'ambiente esterno, sono connessi da un condotto con un rubinetto, inizialmente chiuso. Uno dei recipienti
Compito intercorso Fisica II ICI 1 giugno 2006 1 Due recipienti uguali, isolati termicamente dall'ambiente esterno, sono connessi da un condotto con un rubinetto, inizialmente chiuso. Uno dei recipienti
Corso di Chimica Fisica A. Prove d esame
 Università di Torino Corso di Studi in Chimica - Laurea Triennale A. A. 2006-2007 Corso di Chimica Fisica A Prove d esame Roberto Dovesi Loredana Valenzano 1 CORSO DI LAUREA IN CHIMICA - ANNO ACCADEMICO
Università di Torino Corso di Studi in Chimica - Laurea Triennale A. A. 2006-2007 Corso di Chimica Fisica A Prove d esame Roberto Dovesi Loredana Valenzano 1 CORSO DI LAUREA IN CHIMICA - ANNO ACCADEMICO
 La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
Capitolo 2. Funzioni
 Caitolo 2 Funzioni 2.1. De nizioni Un concetto di fondamentale imortanza è quello di funzione. roosito la seguente de nizione: Vale a questo De nizione 10 Dati due insiemi (non vuoti) X e Y, si chiama
Caitolo 2 Funzioni 2.1. De nizioni Un concetto di fondamentale imortanza è quello di funzione. roosito la seguente de nizione: Vale a questo De nizione 10 Dati due insiemi (non vuoti) X e Y, si chiama
Riepilogo di calorimetria
 Riepilogo di calorimetria Applicate la conservazione dell energia: Calore assorbito = Calore ceduto Se non ci sono trasformazioni di fase: 1. Calore assorbito = massa x calore specifico x (T fin T iniz
Riepilogo di calorimetria Applicate la conservazione dell energia: Calore assorbito = Calore ceduto Se non ci sono trasformazioni di fase: 1. Calore assorbito = massa x calore specifico x (T fin T iniz
CORSO DI CHIMICA. Esercitazione del 7 Giugno 2016
 CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
Applicazione del principio di conservazione dell energia a sistemi aventi un gran numero di particelle.
 PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione
Tonzig La fisica del calore
 4 onzig La fisica del calore batiche si trova 2 / = / 4, il che vuol dire che la [F] si riduce alla [E]. Ne deriva che, nello secifico caso di un gas erfetto, il rendimento di un ciclo di Carnot è [G]
4 onzig La fisica del calore batiche si trova 2 / = / 4, il che vuol dire che la [F] si riduce alla [E]. Ne deriva che, nello secifico caso di un gas erfetto, il rendimento di un ciclo di Carnot è [G]
2 febbraio con 10 Pa, Pa, K, 1760 J mol e m mol. Con questi dati si ricava la temperatura finale. exp 422.
 febbraio 08. La temperatura di fusione dello zolfo monoclino alla pressione di un bar è 9.3 C. La variazione di volume molare durante la fusione è di.3 cm 3 mol -, mentre il calore latente di fusione è
febbraio 08. La temperatura di fusione dello zolfo monoclino alla pressione di un bar è 9.3 C. La variazione di volume molare durante la fusione è di.3 cm 3 mol -, mentre il calore latente di fusione è
Fisica 1 Anno Accademico 2011/2012
 Matteo Luca Ruggiero DISAT@Politecnico di Torino Anno Accademico 2011/2012 (4 Giugno - 8 Giugno 2012) Sintesi Abbiamo formulato il primo principio della termodinamica che regola gli scambi di calore, la
Matteo Luca Ruggiero DISAT@Politecnico di Torino Anno Accademico 2011/2012 (4 Giugno - 8 Giugno 2012) Sintesi Abbiamo formulato il primo principio della termodinamica che regola gli scambi di calore, la
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
UGELLO CONVERGENTE. Dai valori noti si ricava: = = e quindi il rapporto: p a
 UGELLO CONVERGENE. Si consideri un ugello convergente che scarica in ambiente ( a atm). Sono noti la temeratura di ristagno K, il diametro di uscita dell ugello D.m e la differenza di ressione tra monte
UGELLO CONVERGENE. Si consideri un ugello convergente che scarica in ambiente ( a atm). Sono noti la temeratura di ristagno K, il diametro di uscita dell ugello D.m e la differenza di ressione tra monte
TEORIA CINETICA DEI GAS
 TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
14 Gas reali. Potenziali termodinamici
 4 Gas reali. Potenziali termodinamici (9 problemi, difficoltà 62, soglia 43) Formulario Equazione di van der Waals per i gas reali per mol p + a v 2 (v b) RT, dove a e b sono due costanti diverse da gas
4 Gas reali. Potenziali termodinamici (9 problemi, difficoltà 62, soglia 43) Formulario Equazione di van der Waals per i gas reali per mol p + a v 2 (v b) RT, dove a e b sono due costanti diverse da gas
ESERCIZI SULLA DINAMICA DI CORPI RIGIDI.
 ESERCIZI SULL DINMIC DI CRPI RIIDI. Risoluzione mediante equazioni di Lagrange, equilibrio relativo (forze aarenti), stazionarietà del otenziale U; stabilità dell equilibrio e analisi delle iccole oscillazioni.
ESERCIZI SULL DINMIC DI CRPI RIIDI. Risoluzione mediante equazioni di Lagrange, equilibrio relativo (forze aarenti), stazionarietà del otenziale U; stabilità dell equilibrio e analisi delle iccole oscillazioni.
Esercizi proposti - Gruppo 7
 Argomenti di Matematica er l Ingegneria - Volume I - Esercizi roosti Esercizi roosti - Gruo 7 1) Verificare che ognuina delle seguenti coie di numeri razionali ( ) r + 1, r + 1, r Q {0} r ha la rorietà
Argomenti di Matematica er l Ingegneria - Volume I - Esercizi roosti Esercizi roosti - Gruo 7 1) Verificare che ognuina delle seguenti coie di numeri razionali ( ) r + 1, r + 1, r Q {0} r ha la rorietà
il ciclo di Ericsson (1853) caratterizzato da due isoterme e due isobare; il ciclo di Reitlinger (1873) con due isoterme e due politropiche.
 16 Il ciclo di Stirling Il coefficiente di effetto utile per il ciclo frigorifero di Carnot è, in base alla (2.9): T min ɛ =. (2.31) T max T min Il ciclo di Carnot è il ciclo termodinamico che dà il maggior
16 Il ciclo di Stirling Il coefficiente di effetto utile per il ciclo frigorifero di Carnot è, in base alla (2.9): T min ɛ =. (2.31) T max T min Il ciclo di Carnot è il ciclo termodinamico che dà il maggior
ESAME DI AMMISSIONE ALLA TERZA LICEO SCIENZE SPERIMENTALI: FISICA
 LICO CANTONAL DI LUGANO 2 SAM DI AMMISSION ALLA TRZA LICO SCINZ SRIMNTALI: FISICA COGNOM: NOM:...... RONINZA SCOLASTICA:. unti esercizi 1 2 3 TOT 18 4 3 25 unti fatti Nota SRCIZIO 1 Annerire o crociare
LICO CANTONAL DI LUGANO 2 SAM DI AMMISSION ALLA TRZA LICO SCINZ SRIMNTALI: FISICA COGNOM: NOM:...... RONINZA SCOLASTICA:. unti esercizi 1 2 3 TOT 18 4 3 25 unti fatti Nota SRCIZIO 1 Annerire o crociare
2) Primo principio della Termodinamica
 2) Primo principio della Termodinamica Antefatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica
2) Primo principio della Termodinamica Antefatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica
Opera rilasciata sotto licenza CC BY-NC-SA 3.0 Italia da Studio Bells (www.studiobells.it)
 Esercizio Argomenti: gas perfetti, trasformazioni adiabatiche, primo principio. Livello: scuola superiore. Un gas perfetto monoatomico si trova in un contenitore chiuso da un pistone mobile. Inizialmente
Esercizio Argomenti: gas perfetti, trasformazioni adiabatiche, primo principio. Livello: scuola superiore. Un gas perfetto monoatomico si trova in un contenitore chiuso da un pistone mobile. Inizialmente
Lezione n. 5. Entalpia. a volume costante a pressione costante Calorimetria differenziale Reazione esotermiche ed endotermiche Legge di Hess
 himica Fisica - himica e Tecnologia Farmaceutiche Lezione n. 5 Entalpia alorimetria a volume costante alorimetria a pressione costante alorimetria differenziale Reazione esotermiche ed endotermiche Legge
himica Fisica - himica e Tecnologia Farmaceutiche Lezione n. 5 Entalpia alorimetria a volume costante alorimetria a pressione costante alorimetria differenziale Reazione esotermiche ed endotermiche Legge
Enunciato di Kelvin-Plank
 ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
Lezione 5: Termodinamica. Seminario didattico
 Lezione 5: Termodinamica Seminario didattico Esercizio n 1 Ad una mole di gas monoatomico viene fatto percorrere il ciclo mostrato in figura il processo bc è una espansione adiabatica; p B =1.03 bar, V
Lezione 5: Termodinamica Seminario didattico Esercizio n 1 Ad una mole di gas monoatomico viene fatto percorrere il ciclo mostrato in figura il processo bc è una espansione adiabatica; p B =1.03 bar, V
UNIVERSITA DEGLI STUDI DI ROMA LA SAPIENZA FACOLTA DI INGEGNERIA. Esame di Fisica II (modulo unico) Ingegneria Automatica del
 UNIVERSIA DEGLI SUDI DI ROMA LA SAPIENZA FACOLA DI INGEGNERIA Esame di Fisica II (modulo unico) Ingegneria Automatica del 12.1.26 N.1 Una vaschetta contenente acqua scivola su un piano liscio inclinato
UNIVERSIA DEGLI SUDI DI ROMA LA SAPIENZA FACOLA DI INGEGNERIA Esame di Fisica II (modulo unico) Ingegneria Automatica del 12.1.26 N.1 Una vaschetta contenente acqua scivola su un piano liscio inclinato
Proprietà volumetriche delle sostanze pure. Termodinamica dell Ingegneria Chimica
 Proprietà volumetriche delle sostanze pure Termodinamica dell Ingegneria Chimica le fasi di una specie pura Una sostanza la cui composizione chimica non varia in tutta la massa presa in considerazione
Proprietà volumetriche delle sostanze pure Termodinamica dell Ingegneria Chimica le fasi di una specie pura Una sostanza la cui composizione chimica non varia in tutta la massa presa in considerazione
LA MATERIA ED I SUOI STATI
 LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
Sistemi termodinamici. I sistemi aperti e chiusi possono essere adiabatici quando non è consentito lo scambio di calore
 Sistemi termodinamici Sistema: regione dello spazio oggetto delle nostre indagini. Ambiente: tutto ciò che circonda un sistema. Universo: sistema + ambiente Sistema aperto: sistema che consente scambi
Sistemi termodinamici Sistema: regione dello spazio oggetto delle nostre indagini. Ambiente: tutto ciò che circonda un sistema. Universo: sistema + ambiente Sistema aperto: sistema che consente scambi
COMPITO A. 4) Primo principio della termodinamica per sistemi chiusi ed aperti. 5)Teoremi di Carnot: enunciati ed esempi
 COMPITO A 1)In un vaso di alluminio, di massa m1, è contenuta la massa m2 di acqua di cui non si conosce la temperatura. Nell acqua si immerge un pezzo di rame di massa m3, riscaldato a t1 C e con ciò
COMPITO A 1)In un vaso di alluminio, di massa m1, è contenuta la massa m2 di acqua di cui non si conosce la temperatura. Nell acqua si immerge un pezzo di rame di massa m3, riscaldato a t1 C e con ciò
Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire.
 Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire. Molte reazioni procedono in modo incompleto; è importante quindi determinare
Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire. Molte reazioni procedono in modo incompleto; è importante quindi determinare
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
Termodinamica. studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro.
 Termodinamica studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro. La termodinamica parte da osservazioni sperimentali e quindi si esprime
Termodinamica studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro. La termodinamica parte da osservazioni sperimentali e quindi si esprime
Gas ideale: velocità delle particelle e pressione (1)
 Gas ideale: velocità delle particelle e pressione (1) In un gas ideale le particelle sono considerate puntiformi e risentono di forze solo durante gli urti (perfettamente elastici) con le pareti del recipiente.
Gas ideale: velocità delle particelle e pressione (1) In un gas ideale le particelle sono considerate puntiformi e risentono di forze solo durante gli urti (perfettamente elastici) con le pareti del recipiente.
È quella parte della termologia che studia le trasformazioni di calore in lavoro e viceversa.
 EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
Esercitazione 13/5/2016
 Esercitazione 3/5/206 Esercizio Un anello di massa m e raggio r rotola senza strisciare su un piano orizzontale con velocità v CM costante. Ad un certo istante inizia a salire lungo un piano inclinato.
Esercitazione 3/5/206 Esercizio Un anello di massa m e raggio r rotola senza strisciare su un piano orizzontale con velocità v CM costante. Ad un certo istante inizia a salire lungo un piano inclinato.
QUESITI DI FISICA RISOLTI A LEZIONE TERMODINAMICA
 QUESITI DI FISICA RISOLTI A LEZIONE TERMODINAMICA Un recipiente contiene gas perfetto a 27 o C, che si espande raggiungendo il doppio del suo volume iniziale a pressione costante. La temperatura finale
QUESITI DI FISICA RISOLTI A LEZIONE TERMODINAMICA Un recipiente contiene gas perfetto a 27 o C, che si espande raggiungendo il doppio del suo volume iniziale a pressione costante. La temperatura finale
Lezione 4: Termodinamica. Seminario didattico
 Lezione 4: Termodinamica Seminario didattico Esercizio n 1 Un vaso di massa 150g in rame (calore specifico 0,0923 cal/g K) contiene 220g di acqua, entrambi alla temperatura di 20,0 C. Un cilindro di 300g
Lezione 4: Termodinamica Seminario didattico Esercizio n 1 Un vaso di massa 150g in rame (calore specifico 0,0923 cal/g K) contiene 220g di acqua, entrambi alla temperatura di 20,0 C. Un cilindro di 300g
FISICA. V [10 3 m 3 ]
![FISICA. V [10 3 m 3 ] FISICA. V [10 3 m 3 ]](/thumbs/24/2838543.jpg) Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Corso di Termofluidodinamica
 Corso di Termofluidodinamica Modulo di Termodinamica Tecnica A.A. 2014-2015 - Esercizi di preparazione alla prima prova intermedia Problema N. 1 Un serbatoio deve essere dimensionato per contenere 200
Corso di Termofluidodinamica Modulo di Termodinamica Tecnica A.A. 2014-2015 - Esercizi di preparazione alla prima prova intermedia Problema N. 1 Un serbatoio deve essere dimensionato per contenere 200
IL CICLO DI CARNOT. Scambi di energia durante il ciclo
 IL CICLO DI CNO Consideriamo un gas ideale, contenuto nel solito cilindro, che compie un ciclo di 4 trasformazioni reversibili (2 isoterme + 2 adiabatiche) rappresentate nel piano -p come in figura. cambi
IL CICLO DI CNO Consideriamo un gas ideale, contenuto nel solito cilindro, che compie un ciclo di 4 trasformazioni reversibili (2 isoterme + 2 adiabatiche) rappresentate nel piano -p come in figura. cambi
Corso di Chimica Fisica A. Prove d esame
 Università di orino Corso di Studi in Chimica - Laurea riennale A. A. 2005-2006 Corso di Chimica Fisica A rove d esame Roberto Dovesi Bartolomeo Civalleri /home/mimmo/testitex/tut cf-a 06/esami cfa 06.pdf
Università di orino Corso di Studi in Chimica - Laurea riennale A. A. 2005-2006 Corso di Chimica Fisica A rove d esame Roberto Dovesi Bartolomeo Civalleri /home/mimmo/testitex/tut cf-a 06/esami cfa 06.pdf
Legge del gas perfetto e termodinamica
 Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Probabilità e tempi medi di assorbimento
 Probabilità e temi medi di assorbimento 6.1 Probabilità di assorbimento Consideriamo una catena con un numero finito di stati che indichiamo con S = {1, 2,... r}. Sia C una classe chiusa di S. Se la catena
Probabilità e temi medi di assorbimento 6.1 Probabilità di assorbimento Consideriamo una catena con un numero finito di stati che indichiamo con S = {1, 2,... r}. Sia C una classe chiusa di S. Se la catena
FISICA. Un sistema formato da un gas ideale monoatomico(= sistema) alla pressione costante di 110kPa acquista 820J di energia nella modalità calore.
 Serie 5: Termodinamica V FISICA II liceo Esercizio 1 Primo principio Un cilindro contiene 4 mol di un gas(= sistema) monoatomico a temperatura iniziale di 27 C. Il gas viene compresso effettuano su di
Serie 5: Termodinamica V FISICA II liceo Esercizio 1 Primo principio Un cilindro contiene 4 mol di un gas(= sistema) monoatomico a temperatura iniziale di 27 C. Il gas viene compresso effettuano su di
TERMODINAMICA CHIMICA
 TERMODINAMICA CHIMICA Si definisce FUNZIONE DI STATO una variabile il cui valore dipende solo dallo stato iniziale e finale del sistema e non dal cammino percorso nella trasformazione effettuata Sono funzioni
TERMODINAMICA CHIMICA Si definisce FUNZIONE DI STATO una variabile il cui valore dipende solo dallo stato iniziale e finale del sistema e non dal cammino percorso nella trasformazione effettuata Sono funzioni
Termodinamica. Ireneo Kikic. DICAMP - SFLAB - University of Trieste
 ermodinamica Ireneo Kikic DIAM - FLAB - University of rieste IRENEO.KIKI@DIAM.UNI.I rimo principio della termodinamica alore e lavoro solo quando sono trasferiti tra i corpi Energia uò essere convertita
ermodinamica Ireneo Kikic DIAM - FLAB - University of rieste IRENEO.KIKI@DIAM.UNI.I rimo principio della termodinamica alore e lavoro solo quando sono trasferiti tra i corpi Energia uò essere convertita
Primo principio della Termodinamica
 rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
C e detta capacita termica
 Capacita termica la quantita di calore che occorre fornire o sottrarre ad un corpo per modificarne la temperatura e direttamente proporzionale alla sua variazione T T f T i di temperatura ( attenzione
Capacita termica la quantita di calore che occorre fornire o sottrarre ad un corpo per modificarne la temperatura e direttamente proporzionale alla sua variazione T T f T i di temperatura ( attenzione
ESERCITAZIONE 5: ESERCIZI DI RIPASSO
 Microeconomia CLEA A.A. 00-00 ESERCITAZIONE 5: ESERCIZI DI RIPASSO Esercizio 1: Scelte di consumo (beni comlementari) Un consumatore ha referenze raresentate dalla seguente funzione di utilità: U (, )
Microeconomia CLEA A.A. 00-00 ESERCITAZIONE 5: ESERCIZI DI RIPASSO Esercizio 1: Scelte di consumo (beni comlementari) Un consumatore ha referenze raresentate dalla seguente funzione di utilità: U (, )
1) Si deve progettare un auto reattore per un missile che vola a M 1 := 1.8. Supponendo che
 Esercizi di Esame 1.mcd (1/9) 1) Si deve rogettare un auto reattore er un missile che vola a M 1 : 1.8. Suonendo che T 1 : 73.15 K, 1 : 0.7 atm, A : 0.0347 m, A 3 /A 1.34 e che la combustione roduce 196.7kJ/kg.
Esercizi di Esame 1.mcd (1/9) 1) Si deve rogettare un auto reattore er un missile che vola a M 1 : 1.8. Suonendo che T 1 : 73.15 K, 1 : 0.7 atm, A : 0.0347 m, A 3 /A 1.34 e che la combustione roduce 196.7kJ/kg.
Macchine termiche: ciclo di Carnot
 Macchine termiche: ciclo di Carnot Una macchina termica (o motore termico) è un dispositivo che scambia calore con l ambiente (attraverso un fluido motore) producendo lavoro in modo continuo, tramite un
Macchine termiche: ciclo di Carnot Una macchina termica (o motore termico) è un dispositivo che scambia calore con l ambiente (attraverso un fluido motore) producendo lavoro in modo continuo, tramite un
Moto Monodimensionale in Condotti
 Diartimento di Ingegneria Industriale Moto Monodimensionale in Condotti Fluido Comrimibile - eoria Fig a Fig B Fig. A Moti D Comrimibili- ermodinamica Scuola di Ingegneria Corso di e Macchine A.A. 3 4
Diartimento di Ingegneria Industriale Moto Monodimensionale in Condotti Fluido Comrimibile - eoria Fig a Fig B Fig. A Moti D Comrimibili- ermodinamica Scuola di Ingegneria Corso di e Macchine A.A. 3 4
Capacità termica e calore specifico
 Calori specifici Capacità termica e calore specifico Il calore si trasferisce da un corpo ad un altro fintanto che i corpi sono a temperature differenti. Potremo scrivere quindi: Q = C ΔT = C (T f T i
Calori specifici Capacità termica e calore specifico Il calore si trasferisce da un corpo ad un altro fintanto che i corpi sono a temperature differenti. Potremo scrivere quindi: Q = C ΔT = C (T f T i
Entalpia. L'entalpia è una funzione di stato ed è una grandezza estensiva. dh=du+pdv+vdp --> du+pdv = dh - Vdp
 Entalpia Si definisce entalpia la grandezza H ( 1 H = U + pv L'entalpia è una funzione di stato ed è una grandezza estensiva. Differenziando la (1) si ha dh=du+pdv+vdp --> du+pdv = dh - Vdp In una generica
Entalpia Si definisce entalpia la grandezza H ( 1 H = U + pv L'entalpia è una funzione di stato ed è una grandezza estensiva. Differenziando la (1) si ha dh=du+pdv+vdp --> du+pdv = dh - Vdp In una generica
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
Temi di termodinamica
 Temi di termodinamica Prova scritta del 12/04/1995 Una mole di gas perfetto monoatomico alla temperatura T A =243 K e pressione p A = 2 atm, esegue un ciclo reversibile costituito dalle seguenti trasformazioni:
Temi di termodinamica Prova scritta del 12/04/1995 Una mole di gas perfetto monoatomico alla temperatura T A =243 K e pressione p A = 2 atm, esegue un ciclo reversibile costituito dalle seguenti trasformazioni:
Energia e trasformazioni spontanee
 Energia e trasformazioni spontanee Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede energia. La termodinamica è quella scienza che studia le variazioni di energia in una
Energia e trasformazioni spontanee Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede energia. La termodinamica è quella scienza che studia le variazioni di energia in una
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
PCl5 (g) <====> PCl3(g) + Cl2(g)
 ESERCITAZIONE 10 DISSOCIAZIONE TERMICA Alcuni gas si decompongono per effetto del riscaldamento in altre sostanze, che possono essere tutte o solo in parte gassose. Ad esempio: PCl5 (g) PCl3(g)
ESERCITAZIONE 10 DISSOCIAZIONE TERMICA Alcuni gas si decompongono per effetto del riscaldamento in altre sostanze, che possono essere tutte o solo in parte gassose. Ad esempio: PCl5 (g) PCl3(g)
Corso di Progetto di Strutture. POTENZA, a.a Serbatoi e tubi
 Corso di Progetto di Strutture POTENZA, a.a. 01 013 Serbatoi e tubi Dott. Marco VONA Scuola di Ingegneria, Università di Basilicata marco.vona@unibas.it htt://www.unibas.it/utenti/vona/ CONSIDEAZIONI INTODUTTIVE
Corso di Progetto di Strutture POTENZA, a.a. 01 013 Serbatoi e tubi Dott. Marco VONA Scuola di Ingegneria, Università di Basilicata marco.vona@unibas.it htt://www.unibas.it/utenti/vona/ CONSIDEAZIONI INTODUTTIVE
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
ESERCIZIO 1: Vincolo di bilancio lineare
 Microeconomia rof. Barigozzi ESERCIZIO 1: Vincolo di bilancio lineare Si immagini un individuo che ha a disosizione un budget di 500 euro e deve decidere come allocare tale budget tra un bene, che ha un
Microeconomia rof. Barigozzi ESERCIZIO 1: Vincolo di bilancio lineare Si immagini un individuo che ha a disosizione un budget di 500 euro e deve decidere come allocare tale budget tra un bene, che ha un
SECONDO PRINCIPIO TERMODINAMICA Problemi di Fisica secondo principio termodinamica
 SEONO PRINIPIO ERMOINMI Problemi di Fisica secondo principio termodinamica SEONO PRINIPIO ERMOINMI PROEM alcolare il rendimento di una macchina di arnot che lavora fra la temperatura di ebollizione dell'acqua
SEONO PRINIPIO ERMOINMI Problemi di Fisica secondo principio termodinamica SEONO PRINIPIO ERMOINMI PROEM alcolare il rendimento di una macchina di arnot che lavora fra la temperatura di ebollizione dell'acqua
Fondamenti di Meteorologia e Climatologia
 Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Uniersità degli studi di rento Facoltà di Ingegneria Corso di Laurea in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Ciile ed Ambientale Fondamenti di Meteorologia
Fondamenti di Meteorologia e Climatologia
 Università degli studi di Trento Facoltà di Ingegneria Corso di Laurea in Ingegneria per l Ambiente e il Territorio Prof. Dino Zardi Dipartimento di Ingegneria Civile ed Ambientale Fondamenti di Meteorologia
Università degli studi di Trento Facoltà di Ingegneria Corso di Laurea in Ingegneria per l Ambiente e il Territorio Prof. Dino Zardi Dipartimento di Ingegneria Civile ed Ambientale Fondamenti di Meteorologia
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Capitolo 16 L energia si trasferisce
 Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante.
 All origine di tutto c è il teorema di conservazione dell energia totale meccanica: Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante. Il teorema è tipicamente
All origine di tutto c è il teorema di conservazione dell energia totale meccanica: Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante. Il teorema è tipicamente
