Biopolimeri a Base Proteica
|
|
|
- Marcellina Olivia Bini
- 6 anni fa
- Visualizzazioni
Transcript
1 School of Industrial and Information Engineering ourse (095857) Introduction to Green and Sustainable hemistry Biopolimeri a Base Proteica Prof. Attilio itterio Dipartimento MI Giulio Natta
2 Elementi ostitutivi delle Proteine I monomeri delle proteine sono gli amminoacidi Gruppo ammino (gruppo ammonio) N 2 R Gruppo carbossilico (carbossile, carbossilato) R = RESIDU RGANI (ATENA LATERALE) A p 7, la maggior parte degli Amminoacidi sono Zwitterioni (dotati di cariche ma complessivamente elettricamente neutri) R + 3 N K a1 R + 3 N - K a2 + + N 2 R - Attilio itterio
3 Numerazione degli Amminoacidi Le proteine sono costruite assemblando amminoacidi tramite legami peptidici per formare una catena polipeptidica. Alfa-ammino configurazione L del carbonio α ε δ γ β 2 N N lisina gruppo ε-ammino Alfa-carbossile (attaccato al carbonio αlfa) arbonio alfa Un amminoacido ha molte componenti strutturali: un atomo di carbonio centrale (α) è attaccato a: un gruppo ammino (N 2 ), un gruppo carbossilico (), un atomo di idrogeno (), un residuo organico (R) in catena laterale. Attilio itterio
4 Amminoacidi in 3 Dimensioni arbonio asimmetrico (legato a 4 gruppi diversi) Stereoisomeri Ruotano la luce polarizzata Isomeri ottici Non-sovrapponibili Immagini speculari Atomo di carbonio asimmetrico Forme L e D Naturali: solo configurazione L Attilio itterio
5 La Sinistrosità" degli Amminoacidi. R R α forma L N N α forma D Guardando lungo il legame -α dall atomo di idrogeno, la forma L ha i sostituenti, R e N dal α disposti in direzione oraria. Per la forma L i gruppi letti, R, N sono posizionati in direzione antioraria. Tutti gli a.a. eccetto la Glicina (GLy, R = ) hanno un centro chirale Tutti gli a.a. incorporati nelle proteine dagli organismi sono in forma L. Attilio itterio
6 onfigurazione vs. onformazione onfigurazione = differenti geometrie dovute all orientazione nello spazio cis vs. trans (legame peptidico planare) D vs. L; R vs. S (amminoacidi chirali) Non si può passare da una configurazione all altra senza rompere legami 2 D-gliceraldeide 2 D-gliceraldeide Diagramma PE del butano in funzione dell angolo diedro 2 L-gliceraldeide 2 L-gliceraldeide onformazione = disposizione alternata che deriva dal moto molecolare onformazione a sedia vs. a barca nel cicloesano Si può convertire una conformazione in un altra (En.). Energia Potenziale Eclissato Eclissato Eclissato Eclissato Angolo diedro Attilio itterio
7 Amminoacidi Naturali N N N 2 Glycine (Gly) N 2 L-Alanine (Ala) N 2 L-Valine (Val) N 2 L-IsoLeuc (Ile) N L-Leucine (Leu) N 2 L-Proline (Pro) 2 N L-istidine (is) S S Se N 2 N 2 N 2 N 2 N 2 N 2 N 2 N 2 L-ysteine (ys) L-Methionine (Met) L-Serine (Ser) L-Threonine (Thr) L-Selcys (Sec) N L-Aspartic Acid (Asp) L-Asparagine (Asn N 2 N N 2 N N 2 N 2 N 2 N 2 N 2 N 2 N 2 N 2 L-Phenylal. (Phe) L-Tyrosine (Tyr) L-Triptoph. (Thr) L-Lysine (Lys) L-Arginine (Arg) L-Glutamic acid (Glu) L-Glutamine (Gln) Attilio itterio
8 I Venti Amminoacidi costituenti delle Proteine (1) 1) Amminoacidi con residui idrofili carichi positivi/negativi Positiva + Negativa - Arginina (Arg) (R) Istidina (is) () Lisina (Lys) (K) Acido aspartico (Asp) (D) Acido glutammico (Glu) (E) N + 3 N 3 N + N N N + N 2 - N N 2 N 2 2 N - Attilio itterio
9 I Venti Amminoacidi costituenti delle Proteine (2) 2) Amminoacidi con catene polari (idrofile) non cariche Serina (Ser) (S) + 3 N 2') asi speciali isteina (ys) () + 3 N - - S 2 2 Treonina (Thr) (T) + 3 N - Glicina (Gly) (G) + 3 N Asparagina (Asn) (N) + 3 N 2 N - Prolina (Pro) (P) 2 + N Glutammina (Gln) (Q) + 3 N - 2 N 2 2 Tirosina (Tyr) (Y) + 3 N - 2 Attilio itterio
10 I Venti Amminoacidi costituenti delle Proteine (3) 3) Amminoacidi con sostituenti non polari (idrofobici) Alanina (Ala) (A) + 3 N - Triptofano (Trpl) (W) + 3 N 3 N N Isoleucina (Ile) (I) N 3 Valina (Val) (V) Attilio itterio Leucina (Leu) (LN) + 3 N Metionina (Met) (M) + 3 N S 3 Fenilalanina (Phe) (F) + 3 N - 2
11 lassi di Amminoacidi Non polari (NP), non-interattivi ala, val, leu, ile, pro, trp, phe, met Non polari (nell insieme), gruppi interattivi (I) cys, tyr Polari (P) gly, ser, thr, asn, gln (gly è non-interattivo) Acidi (A) asp, glu Basici (B) lys, arg, his Attilio itterio
12 Valori di pk a degli Amminoacidi Naturali AMMINAID α arbossile α Ammino Unità atena Laterale Gly Ala Val Leu Ile Ser Thr Met Phe Trp Asn Gln Pro Asp Glu is Lys Arg ys Tyr Attilio itterio
13 Punto Isoelettrico La carica netta su un amminoacido o un peptide cambia al variare del p. Punto Isoelettrico (pi) - Il p a cui la carica netta su un amminoacido o peptide è zero. Elettroforesi - Un metodo di separazione di specie cariche che le forza a migrare verso elettrodi positivi o negativi. Gli ioni Positivi si muovono verso l elettrodo negativo Gli ioni Negativi si muovono verso l elettrodo positivo. u ep voltaggio V u + + ep - Particella carica lunghezza L u = µ ep ep V L V: voltaggio applicato / V µ ep : mobilità elettroforetica / m 2 /(s V) Attilio itterio
14 Peptidi, Polipeptidi e Proteine peptide = un prodotto della condensazione di amminoacidi dipeptide = 2 aa,.. ecc. oligopeptide = fino a 20 aa polipeptide = > 20 aa proteina = un polipeptide funzionale con un ruolo biologico talvolta contiene anche porzioni non-polipeptidiche. proteine molto piccole sono spesso ormoni Attilio itterio
15 I Quattro Livelli della Struttura Proteica Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Residui amminoacidici α-elica atena polipeptidica Sub-unità assemblate Attilio itterio
16 Livelli della Struttura delle Proteine - I struttura primaria (1 o ) la sequenza degli amminoacidi con modificazioni, inclusa le aggiunte di altre unità legate covalentemente struttura secondaria (2 o ) Legame a- strutturato su grande scala implicante i componenti dello scheletro della catena domini e motivi un tipo intermedio di termini destinati a descrivere una certa regione di una proteina avente certe specificità strutturali Attilio itterio
17 Struttura Tridimensionale delle Proteine atena laterale atena polipeptidica principale atena peptidica = struttura primaria arbonio alfa arbonio alfa arbonio alfa atena laterale atena laterale Struttura secondaria Alfa elica Strati beta antiparalleli arbonio alfa atena laterale Attilio itterio
18 Struttura Secondaria di una Proteina: ollagene Tripla elica Tre catene polipeptidiche intrecciate a formare un corda Struttura del collagene (tessuto connettivo) Il legane- è perpendicolare alle catene I legami- sono inter-molecolari Il legame- si instaura tra il donatore N- e l accettore = della prolina (idrossiprolina) Legami a idrogeno alternati tra le catene Un legame- per un'unità di tripla elica Rappresenta il 25-30% delle proteine umane. Attilio itterio
19 Livelli di Strutture Proteiche II struttura terziaria (3 o ) altre attrazioni (ioniche) e reazioni (legami S-S) all interno di una singola catena polipeptidica struttura quaternaria (4 o ) Associazioni di catene polipeptidiche con : a) altri polipeptidi b) altri biopolimeri c) con piccole molecole (organiche) d) con piccole unità (inorganiche) comunemente ioni metallici. Attilio itterio
20 Struttura Terziaria (III) di una Proteina inque classi di strutture terziarie: Legami ionici (a) Legami a idrogeno in catena (b) Forze idrofobiche (attrazione) (c) S e S 2 N + a N d Interazione dipolo-dipolo (d) Legami disolfuro (e) c Tutte implicano interazioni tra le catene laterali degli amminoacidi in catena. 3 c 3 I legami disolfuro sono legami covalenti; le interazioni b-d sono debolmente attrattive, ed il legame ionico è forte. N 2 b + a c Attilio itterio
21 Struttura Terziaria di Proteine legame a idrogeno legame ionico Mioglobina una struttura terziaria interazione idrofobica legame disolfuro Attilio itterio
22 Modi di rappresentazione delle proteine Nastri Linee α elica Foglietti β e connettori a filo Attilio itterio
23 Struttura Quaternaria delle Proteine La struttura quaternaria contiene due o più sub-unità terziarie (catene proteiche) atena atena Tenute assieme dalle stesse interazioni delle strutture terziarie L Emoglobina contiene quattro catene proteiche Il gruppo eme in ciascuna sub-unità acquisisce l ossigeno per trasportarlo nel sangue ai tessuti atena Gruppo eme atena Attilio itterio
24 Variabilità nell'rganizzazione Proteica dominio S 2 lisozima catalasi emoglobina mioglobina DNA desossiribonucleasi citocromo c porina collagene Attilio itterio
25 Riassunto dei Livelli Strutturali in Proteine STRUTTURA PRIMARIA La sequenza degli amminoacidi Presenti in una catena o catene Peptidiche di una proteina STRUTTURA SENDARIA La disposizione ripetitiva regolare ordinata spazialmente degli amminoacidi legati tra loro, che deriva dai legami ad idrogeno fra gli ossigeni carbonilici e l atomo di idrogeno ammidico Alfa Elica Legami a idrogeno tra ogni quattro amminoacidi Foglietti beta Legami a idrogeno tra due catene affacciate, o una singola catena avvolta su se stessa. STRUTTURA TERZIARIA La forma complessiva tridimensionale che deriva dalle forze attrattive tra le catene laterali degli amminoacidi (Gruppi R) che non sono vicini nella catena proteica Legami disolfuro Interazioni elettrostatiche Legami a idrogeno Interazioni idrofobiche STRUTTURA QUATERNARIA La forma tri-dimensionale di una proteina costituita da due o più catene peptidiche indipendenti, che deriva dalle interazioni non covalenti tra i gruppi R Interazioni elettrostatiche Legami a idrogeno Interazioni idrofobiche Attilio itterio
26 lassificazione delle Proteine lassificazione per forma globulari fibrose tripsina lassificazione per funzione collagene Strutturali Indicatori di direzione Metaboliche Trasporto lassificazione da quant altro è presente Proteine derivatizzate Attilio itterio
27 lassificazione delle Proteine per Funzioni lassificazione: Enzimi Proteine strutturali Proteine di difesa Proteine di trasporto Proteine di riserva Proteine di effetto ormoni, regolatori, tossine Ipotetico 3% Ribosomial e 4% Strutturali 9% Altro 30% anali 1% Fattori 4% Shock termico 4% Enzimi 45% Funzioni delle proteine Forniscono supporto strutturale e meccanico Mantengono i tessuti corporei Funzioni come enzimi e ormoni Aiutano a mantenere il bilancio acido-base Trasportano nutrienti Assistono il sistema immunitario Servono come fonte di energia quando necessario Attilio itterio
28 Proteine Derivate Glicoproteine Lipoproteine Nucleoproteine Proteine oniugate (oloproteine) porzione proteica = apoproteina attaccati piccoli gruppi = spezzoni organici/inorganici eme, flavina, metalli, fosfato catena laterale della serina PRTEINA KINASI PRTEINA FSFATASI kinasi fosfatasi kinasi fosfatasi Attilio itterio
29 Sintesi Proteica nella ellula Attilio itterio
30 PRTEINE Apoproteina solo amminoacidi ofattori piccole molecole organiche (quali, vitamine, ATP, NAD, FAD) o entità inorganiche (particolarmente ioni metallici) che sono richiesti per l attività; possono essere legate debolmente (coenzimi) o legate saldamente (gruppi prostetici) Gruppo Prostetico gruppo legato saldamente (es, eme) all apoproteina loproteina proteina attiva con attaccati cofattori e gruppi prostetici. Attilio itterio
31 FATTRI possono partecipare direttamente in processi catalitici o trasportano altre piccole molecole; il legame alle proteine è sia debole che forte sono indispensabili in piccole quantità, si devono poter fornire nella dieta e possono essere solubili sia in acqua che in grassi Funzioni gli ioni metallici mantengono la conformazione proteica tramite interazioni elettrostatiche (complessazione metallica) i gruppi prostetici come l eme possono legarsi al sito attivo e variare la conformazione per controllare il legame possono accettare un substrato nel corso della reazione omuni leganti a ponte 2-, -, - 2 S -, S 2-, , imidazolo leganti terminali esogeni sono molto spesso legati a metalli 2, -, 2-, S -, S 2- Attilio itterio
32 Le Migliori Fonti di Proteine per la Dieta Umana ereali Verdure Frutti Latte arne e Semi Grammi (g) di Proteine Attilio itterio
33 Biopolimeri a Base Proteica Proteine di Soia P-γ-GA Polipeptidi sintetici Semi di soia mopolimeri peptidi surplus agricolo batterici a sintesi specifica 40% di proteine: sintesi chimica: soprattutto globuline 1. Sintesi Merryfield 2. N-carbossianidridi sintesi biologica: espressione genica Attilio itterio
34 Proteine della Soia omposizione: (costituenti principali) acido aspartico + asparagina 11.3 % N N - acido glutammico + glutammina 17.2 % N - N - N 2 N N N 2 N N - Attilio itterio
35 Isolamento delle Proteine della Soia La soia è diventata sempre più popolare perché: È fonte di proteine di alta-qualità a basso contenuto di grassi saturi ontiene isoflavoni ontiene fitoestrogeni Il recupero di concentrati di proteine di soia si ha dopo estrazione dell olio : 1. Estrazione lio produzione margarina oncentrato di proteine di soia recuperato da: 2. Estrazione con basi 90% 3. Lavaggio con alcool acquoso > 65% 4. Lavaggio acido > 65% 5. Denaturazione a vapore > 65% oncentrato di proteine di soia: $/kg Attilio itterio
36 Proteine della Soia per Plastiche Le principali proteine nei semi di soia sono due proteine di riserva : 1. β-onglicinina (7s) e 2. Globuline Glicinine (11s) Struttura trimerica della β-onglicinina (7s) (180 kda) Attilio itterio Struttura dell esamero Glicinina (11s) (320 kda) arancio (A1), rosa (A2), rosso (A3), verde (B1), viola (B2), e blu scuro (B3)
37 Proteine di Soia per Plastiche Riempitivi in plastiche di origine petrolifera ne aumenta la biodegradabilità Lavorazione da fusi (estrusione, stampaggio per iniezione, stampaggio per soffiatura, stampaggio per compressione) le proteine di soia stampate per compressione: fragili uso di plastificanti (acqua, PVA, EG, PG, glicerina) potenziale aggiunta di riempitivi (cellulosa) Reticolazione con formaldeide o glutaraldeide I materiali più indagati (rinforzati con fibre), usati per parti interne di automobili. ompositi con materiali inorganici e nanoparticelle. Attilio itterio
38 Applicazione delle Proteine di Soia Storia: Anni 1940: forte interesse nell uso di plastiche da soia plastiche: parti di automobili fibre: applicazioni tessili Dopo 1945: Tendenza invertita da parte dei polimeri meno cari prodotti a partire dal petrolio Attualmente Solo lo 0.5 % delle proteine di soia usate in prodotti industriali - Rivestimento della carta Futuro soia mista ad amido plastiche stampabili film bloccanti 2 /UV, confezioni pacciamature agricole schiume isolamenti, sost. polistirene Rakesh Kumar et al. Industrial rops and Products 16, , Attilio itterio
39 ompositi di Inorganici con Matrice rganica: Proteine come Leganti Grafico della rigidità verso la resistenza Linea retta: Valore atteso del composito erchio: Reale posizionamento del composito resistenza (kj m -2 ) ,1 0,01 proteina osso dentina smalto calcite 0,001 0,01 0, rigidità (GPa) corno fosfato di calcio valva mollusco Effetto Sinergico: 1+1>2 P. Fratzl,.S. Gupta, E.P. Paschalis, P. Roschger, J. Mater. hem. 2004, 14, Attilio itterio
40 Struttura e Proprietà del omposito Madreperla Madreperla Acciaio Modulo E 80 GPa/m MPa/m 2 Resistenza a trazione 800 MPa/m MPa/m 2 Resistenza a compressione 450 MPa/m MPa/m 2 Matrice di β-chitina - proteine Piaste di aragonite esagonale Attilio itterio
41 Proteine da Pannelli di olza (al 10% di umidità) - Tipica omposizione himica 41 omponente Media Umidità (%) 10.0 Proteine grezze (N 6.25;%) 35.0 Proteine bypass Rumine (%) 35.0 lio (%) 3.5 Acido linoleico (%) 0.6 eneri 6.1 Fibre grezze (%) 12.0 Tannini (%) 1.5 Senapina (%) 1.0 Acido fitico (%) 4.0 Glucosinolati (μmol/g) 16 Amminoacidi Media % Alanina 1.53 Arginina 2.12 Aspartato 2.55 isteina 0.94 Glutammato 6.43 Glicina 1.75 Istidina 1.13 Isoleucina 1.41 Leucina 2.39 Lisina 2.02 Metionina 0.77 Metionina + cisteina 1.71 Fenilalanina 1.54 Prolina 2.23 Serina 1.64 Treonina 1.50 Triptofano 0.46 Tirosina 1.05 Valina 1.71 Attilio itterio
42 Proteine da Pannelli di olza 42 Pannelli di colza (T < 80 ) Fonte Pompa 88 1h Filtro a fibra Reattore con sospensione Pompa acqua Filtro a fibra Estratto 80 Pompa Defitinizzazione, oagulazione, Riduzione acqua F-Proteine (40-50%) I-Proteine (40% recupero) (65% contenuto proteico) Attilio itterio
43 Acido Poli-γ-glutammico N 2 N N n * N 2 2 * n Polimero extracellulare escreto da batteri Bacillus Estrazione Acida precipitazione del polimero in alcool M w = 300, ,000 Dalton } Tutti processi in acqua Attilio itterio
44 himica dell Acido Poli-γ-glutammico * N 2 2 * R n R = ( 2 ) 4 3 DS> 95% ( 2 ) 9 3 T m = 152 T g = - 49 Esterificazione riduce la solubilità in acqua induce fusibilità Per le sue proprietà di biodegradabilità, non-tossicità e non-immunogenicità, lo si è usato con successo in industrie alimentari, mediche e trattamento acque. Shah et al. Polym. Preprints 1992, 33(2) 488; US Patent 5,378,807; gunleye A, Bhat A, Irorere VU, ill D, Williams, Radecka I. Microbiology Jan;161(Pt 1):1-17 Attilio itterio
45 Applicazioni dell Acido Poli-γ-glutammico Solubilità in acqua modificatori reologici trattamento dell acqua super assorbenti emulsionanti polimerici detergenti } Sostituisce l acido p(acrilico), la p(acrilammide), PVA, PEG Applicazioni Biomediche riempitivo del plasma sanguigno smart polymers sensibili a stimoli idrogel Attualmente: Nessun fornitore commerciale Attilio itterio
46 Polipeptidi Sintetici e Proteine Biotecnologiche Proteine = macromolecole biologiche Materiali convenzionali : seta, lana Polipeptidi derivati chimicamente : poliammidi con un largo numero di unità ripetitive e una moltitudine di sequenze Proteine Biotecnologiche : naturali ma prodotte via organismi ingegnerizzati Adeguamento Necessita il controllo della sequenza Attilio itterio
47 lassificazione di Polipeptidi Sintetici Fibrosi Elastomeri Adesivi Tela di ragno: materiale di pareti di arterie: colla: forte resistenza > un miliardo di cicli di dalle ossa animali e allungamento estensione/rilassamento = collagene nella vita umana senza muscoli attaccati evidenza di fatica o isteresi Struttura di unità prim. ripetute (Val-Pro-Gly-Val-Gly) n n = 11 alla superficie via adesione a 3-proteine Attilio itterio
48 Polipeptidi Fibrosi Allungamento arico a rottura [%] [ 10 3 J/kg] Tela di ragno* Bx Acciaio 8 2 Kevlar 4 30 * Nephila clavipes, dragline Attilio itterio
49 Applicazioni ommerciali di Polipeptidi Sintetici Fibrose Elastomeri Adesivi Biomedicale Biomedicale Recupero metalli da reflui (Fe(II), Fe(III) Suture Bioerodibili Elastina artificiale la cost. di dissociaz. biocompatible per complesso con proteina cozza è M -1 Rigenerazione tessuti per applicazioni Alta robustezza Applicazioni ingegnerizzate in acqua Attilio itterio
50 Sintesi di Polipeptidi 1. himica 1.1 Policondensazione: Sintesi Merrifield 2 l + N ( 3 ) 3 Supporto PS R Gruppo Protettivo N-terminale bloccato se R =, occorre gruppo protettivo Per es. 2 - Deprotezione ( 3 ) 3 -= N 2 R Attilio itterio
51 Sintesi di Polipeptidi 2 R + N 2 ( 3 ) 3 N R 2 amminoacido D R N R N ( 3 ) 3 Attilio itterio
52 Sintesi di Polipeptidi 1.2 Polimerizzazione di N-carbossianidridi Esempio: sintesi dell acido poli(glutammico) N 2 ( 2 ) 2 R + l l o TF ( 2 ) N 2 R l 3 l 3 Reazione di fosgenazione prodotto di reazione: N-carbossianidride - NA Attilio itterio
53 Sintesi di Polipeptidi --N 2 ( 2 ) 2 R + ( 2 ) 2 R N DMF o TF N---N 2 ( 2 ) 2 ( 2 ) 2 R R Attacco a NA N N 2 idrolisi ( 2 ) 2 ( 2 ) 2 n Attilio itterio
54 Sintesi di Polipeptidi 2. Produzione Biosintetica ompleto controllo delle sequenze Piuttosto priva di errori Accertare le proprietà dei Materiali Progettare la sequenza aa Innumerevoli Variazioni nella Sequenza aa Sintetizzare il DNA Esprimere la proteina Isolare la proteina Progettazione Genetica : determina la sequenza degli aa ogni aa naturale codificato da 3 nucleotidi consecutivi la maggior parte degli aa espresso da più di un codone Attilio itterio
Biopolimeri a Base Proteica
 School of Industrial and Information Engineering Course 096125 (095857) Introduction to Green and Sustainable Chemistry A.A. 2015/2016 Biopolimeri a Base Proteica Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
School of Industrial and Information Engineering Course 096125 (095857) Introduction to Green and Sustainable Chemistry A.A. 2015/2016 Biopolimeri a Base Proteica Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 5
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
20/12/ tipi di amino acidi: parecchie combinazioni
 20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, Padova. Tel.
 Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: fulvio.ursini@unipd.it Funzioni delle
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: fulvio.ursini@unipd.it Funzioni delle
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Antimo Di Maro. Lezione 3. Corso di Laurea in Scienze Biologiche
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
aa 2013-14 Proteine Struttura delle Proteine α Amminoacidi
 Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Gli amminoacidi ( 20) hanno proprietà strutturali comuni
 Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Amminoacidi - Peptidi - Proteine. Emoglobina
 Amminoacidi - Peptidi - Proteine Emoglobina 1 Emoglobina Gli amminoacidi sono le sostanze di base che costituiscono le proteine. Ogni proteina è caratterizzata da una precisa sequenza di mattoni di amminoacidi.
Amminoacidi - Peptidi - Proteine Emoglobina 1 Emoglobina Gli amminoacidi sono le sostanze di base che costituiscono le proteine. Ogni proteina è caratterizzata da una precisa sequenza di mattoni di amminoacidi.
Le molecole biologiche. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
ACIDI GRASSI INSATURI
 LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
lezione Prof. Spina miliardi di anni fa l universo comparve sotto forma di eruzioni
 Biochimica Matricole dispari 1 1^ lezione Prof. Spina LA BIOCHIMICA 15 20 miliardi di anni fa l universo comparve sotto forma di eruzioni d l f d inimmaginabili di particele subatomiche ricche di energia
Biochimica Matricole dispari 1 1^ lezione Prof. Spina LA BIOCHIMICA 15 20 miliardi di anni fa l universo comparve sotto forma di eruzioni d l f d inimmaginabili di particele subatomiche ricche di energia
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
LE MACROMOLECOLE BIOLOGICHE Le cellule contengono 4 famiglie principali di molecole organiche:
 LEZIONE n 1 LE MACROMOLECOLE BIOLOGICHE Le cellule contengono 4 famiglie principali di molecole organiche: macromolecole Macromolecole macromolecole I componenti chimici di una cellula -Le macromolecole
LEZIONE n 1 LE MACROMOLECOLE BIOLOGICHE Le cellule contengono 4 famiglie principali di molecole organiche: macromolecole Macromolecole macromolecole I componenti chimici di una cellula -Le macromolecole
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine.
 Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
Lezione 2. Bioinformatica. Mauro Ceccanti e Alberto Paoluzzi
 Lezione 2 Bioinformatica Mauro Ceccanti e Alberto Paoluzzi Dip. Informatica e Automazione Università Roma Tre Dip. Medicina Clinica Università La Sapienza Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi
Lezione 2 Bioinformatica Mauro Ceccanti e Alberto Paoluzzi Dip. Informatica e Automazione Università Roma Tre Dip. Medicina Clinica Università La Sapienza Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi
LE BIOMOLECOLE LIPIDI, PROTEINE E ACIDI NUCLEICI GSCATULLO
 LE BIOMOLECOLE LIPIDI, PROTEINE E ACIDI NUCLEICI GSCATULLO ( Le Biomolecole I Lipidi Definizione e classificazione I lipidi rappresentano una vasta classe di composti chimicamente eterogenea per struttura
LE BIOMOLECOLE LIPIDI, PROTEINE E ACIDI NUCLEICI GSCATULLO ( Le Biomolecole I Lipidi Definizione e classificazione I lipidi rappresentano una vasta classe di composti chimicamente eterogenea per struttura
COMPORTAMENTO ANFOTERO DEGLI AA
 Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
30/10/2015 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE
 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
LEZIONE 2 COMPOSTI DEL CARBONIO: MACROMOLECOLE:
 LEZIONE 2 COMPONENTI CHIMICI DELLA CELLULA ACQUA COMPOSTI DEL CARBONIO: MACROMOLECOLE: ZUCCHERI ACIDI GRASSI PROTEINE NUCLEOTIDI percentuale di abbondanza relativa I componenti chimici di una cellula organismi
LEZIONE 2 COMPONENTI CHIMICI DELLA CELLULA ACQUA COMPOSTI DEL CARBONIO: MACROMOLECOLE: ZUCCHERI ACIDI GRASSI PROTEINE NUCLEOTIDI percentuale di abbondanza relativa I componenti chimici di una cellula organismi
E. Giordano 16/09/2010
 GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
BIOMOLECOLE LE BASI DELLA BIOCHIMICA. Capitolo 1 Dal Carbonio agli OGM PLUS
 BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
FUNZIONI DELLE PROTEINE
 FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
INTRODUZIONE ALLA PROTEINE BCP 1-2
 INTRODUZIONE ALLA BIOCHIMICA DELLE PROTEINE BCP 1-2 Pietre miliari Lehninger 1973 Biochemistry Proteine ricombinanti Protein engineering Cristallografia, NMR, EM, MS, spettroscopie... Computing Bioinformaticai
INTRODUZIONE ALLA BIOCHIMICA DELLE PROTEINE BCP 1-2 Pietre miliari Lehninger 1973 Biochemistry Proteine ricombinanti Protein engineering Cristallografia, NMR, EM, MS, spettroscopie... Computing Bioinformaticai
ARPAT Agenzia regionale per la protezione ambientale della Toscana
 ARPAT Agenzia regionale per la protezione ambientale della Toscana Dipartimento Provinciale di Livorno 114, Via Giovanni Marradi - 57126 LIVORNO Tel. 0586/263411 - Fax 0586/263477 E-mail: f.righini@arpat.toscana.it
ARPAT Agenzia regionale per la protezione ambientale della Toscana Dipartimento Provinciale di Livorno 114, Via Giovanni Marradi - 57126 LIVORNO Tel. 0586/263411 - Fax 0586/263477 E-mail: f.righini@arpat.toscana.it
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Somministrazione o assunzione di alimenti allo scopo di nutrire l organismo
 Definizioni Alimentazione Somministrazione o assunzione di alimenti allo scopo di nutrire l organismo Nutrizione complesso di processi biologici che consentono o condizionano la conservazione, l accrescimento,
Definizioni Alimentazione Somministrazione o assunzione di alimenti allo scopo di nutrire l organismo Nutrizione complesso di processi biologici che consentono o condizionano la conservazione, l accrescimento,
La struttura delle proteine viene suddivisa in quattro livelli di organizzazione:
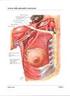 Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Cap. 1 Interazioni delle molecole con l acqua
 Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
BIOMOLECOLE. I mattoni delle cellule.
 BIMLECLE I mattoni delle cellule PRINCIPALI GRUPPI FUNZINALI I gruppi funzionali sono gruppi di atomi, uniti da legami covalenti, che conferiscono alla molecola di cui fanno parte un comportamento chimico
BIMLECLE I mattoni delle cellule PRINCIPALI GRUPPI FUNZINALI I gruppi funzionali sono gruppi di atomi, uniti da legami covalenti, che conferiscono alla molecola di cui fanno parte un comportamento chimico
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw-Hill Companies srl. c. d. HOOCCH 2 CH 2 N
 opyright 2009 The McGraw-ill ompanies srl Soluzioni ai problemi proposti nel libro apitolo 26 26.1 S S 2 3 S 3 2 2 3 S 2 3 2 3 L-isoleucine 2 3 2 3 2 3 26.2 a. b. 3 ( 3 ) 2 ( 3 ) 2 2 3 c. d. 2 2 3 26.3
opyright 2009 The McGraw-ill ompanies srl Soluzioni ai problemi proposti nel libro apitolo 26 26.1 S S 2 3 S 3 2 2 3 S 2 3 2 3 L-isoleucine 2 3 2 3 2 3 26.2 a. b. 3 ( 3 ) 2 ( 3 ) 2 2 3 c. d. 2 2 3 26.3
Proteine. Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana)
 Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
LE MOLECOLE BIOLOGICHE
 LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
Sequenze nucleotidiche del DNA definite loci costituiscono i geni. Ogni gene codifica per una specifica proteina
 sintesi proteica La sintesi proteica è il processo che porta alla formazione delle proteine da sequenze del DN definite geni. Si tratta di un processo a più fasi Nelle sue linee fondamentali questo processo
sintesi proteica La sintesi proteica è il processo che porta alla formazione delle proteine da sequenze del DN definite geni. Si tratta di un processo a più fasi Nelle sue linee fondamentali questo processo
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Le proteine. Sintetizzate nei ribosomi come una sequenza lineare di amminoacidi assumono in seguito una struttura tridimensionale
 Le proteine Elementi funzionali e strutturali di fondamentale importanza per lo svolgimento di funzioni metaboliche, di trasporto, di trasmissione nervosa o contrattile, ormonale o immunitaria Sintetizzate
Le proteine Elementi funzionali e strutturali di fondamentale importanza per lo svolgimento di funzioni metaboliche, di trasporto, di trasmissione nervosa o contrattile, ormonale o immunitaria Sintetizzate
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
H N H R N H R N R R N R H H H
 AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
Le molecole biologiche. Le proteine
 Le molecole biologiche Le proteine Le proteine sono macromolecole che costituiscono la maggior parte delle strutture cellulari ed extra-cellulari Così come nel caso di lipidi e carboidrati, anch esse
Le molecole biologiche Le proteine Le proteine sono macromolecole che costituiscono la maggior parte delle strutture cellulari ed extra-cellulari Così come nel caso di lipidi e carboidrati, anch esse
Struttura secondaria
 Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Amminoacidi e Proteine
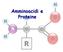 Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Le proteine. Le proteine sono macromolecole che presentano differenze funzionali e strutturali
 Le proteine Le proteine sono macromolecole che presentano differenze funzionali e strutturali LE PROTEINE HANNO FUNZIONI BIOLOGICHE DIVERSE enzimi proteine di trasporto proteine strutturali proteine di
Le proteine Le proteine sono macromolecole che presentano differenze funzionali e strutturali LE PROTEINE HANNO FUNZIONI BIOLOGICHE DIVERSE enzimi proteine di trasporto proteine strutturali proteine di
